Роль мультимодальної програми Fast Track Surgery у хірургічному лікуванні колоректального раку
Щепотін І.Б., Колеснік О.О., Лукашенко А.В., Махмудов Д.Е., Грандо С.О.
Авторами проведено оцінку впливу мультимодальної програми Fast Track Surgery на найближчі результати хірургічного лікування хворих на рак ободової кишки в порівнянні із традиційним лікуванням. У результаті проведення рандомізованого дослідження (150 хворих) встановлено: використання мультимодальної програми Fast Track Surgery у хворих на рак ободової кишки сприяє скороченню термінів реабілітації та зниженню витрат на лікування.

Вступ
Тривале та стійке виліковування хворих на рак ободової кишки (РОК) на сьогодні забезпечує радикальне хірургічне втручання. Теоретичні підходи до зменшення деструктивних впливів стресу, пов’язаного як із наявністю основного захворювання, так і викликаного хірургічною травмою, беруть свій початок від часу відкриття D. Cuthbertson у 20-х роках минулого століття синдрому гіперметаболізму-гіперкатаболізму та білково-енергетичної недостатності. Подальшими дослідженнями W. Cannon i H. Kehlet було встановлено вплив центральної нервової та ендокринної системи на розвиток цих синдромів, а також розроблено ефективні методи їх лікування та попередження [5,16]. Із досліджень Н. Kehlet розвинулася мультимодальна програма Fast track surgery (FTS — хірургія швидкого відновлення) або Enhanced Recovery After Surgery (ERAS — прискорення одужання після хірургії) [2, 16]. Програма FTS охоплює питання передопераційної підготовки, особливостей оперативної техніки, ведення післяопераційного періоду у хворих, що підлягають оперативним втручанням на органах черевної порожнини. Програма FTS заснована на патофізіологічних принципах і має за мету: понизити реакцію організму на стрес від хірургічної травми та болю; прискорити термін одужання за рахунок ранньої мобілізації і харчування; скоротити термін перебування хворого в лікарні, що є дуже важливим для пацієнтів. Застосування програми FTS у європейських хірургічних клініках значно прискорило реабілітацію та покращило якість життя хворих на РОК. Дослідження ефективності даної програми ведеться з 80-х років минулого століття. Зазначені результати (табл. 1) отримують своє підтвердження з позицій доказової медицини [9, 6].
| Призначення | Ефект | Ступінь доведеності |
|---|---|---|
| Відміна або зменшення об’єму підготовки кишечника | Відсутність бактеріальної транслокації кишкової мікрофлори | 1А (мультицентрове рандомізоване дослідження) |
| Завершення ентерального харчування за 3–4 год до операції | Запобігання інсулінорезистентності | 2А (когортне дослідження) |
| Епідуральна анестезія | Знеболення без парасимпатичної блокади | 1В (рандомізоване дослідження) |
| Обмеження інфузійної терапії | Запобігання набряку вісцеральних тканин | 2С |
| Мініінвазивний оперативний доступ, відмова від рутинної постановки дренажів | Зниження хірургічної травми | 1А (метааналіз) |
| Забезпечення нормотермії під час операції | Зниження післяопераційного стресу | 1В (рандомізоване дослідження) |
| Уникання або раннє видалення назогастрального зонда | Зниження дихальних розладів, профілактика післяопераційного парезу кишечника | 1А (метааналіз) |
| Раннє ентеральне харчування | Зменшення нудоти, відновлення пасажу по кишечнику | 1А (метааналіз) |
| Рання мобілізація | Відновлення серцево–легеневої діяльності, пасажу по кишечнику | 2А (когортне дослідження) |
| Зменшення нудоти, прискорення відновлення перистальтики | Раннє ентеральне харчування, відновлення якості життя | 1В (рандомізоване, подвійне сліпе дослідження) |
Підготовка ободової кишки. До недавнього часу механічне очищення ободової та прямої кишки перед оперативним втручанням вважалося незаперечним етапом передопераційної підготовки. Але на основі даних метааналізу 9 рандомізованих багатоцентрових досліджень, у яких брали участь більш ніж 1500 пацієнтів [10, 11 ], стало відомо, що механічне очищення ободової кишки підвищує рівень недостатності анастомозу, рівень септичних і гнійних ускладнень та подовжує час перебування пацієнта в стаціонарі. Проведені бактеріологічні дослідження продемонстрували, що середня кількість колоній бактерій на одиниці площі слизової оболонки ободової кишки до і після очисної клізми залишаються незмінними [10, 11]. Не встановлено переваг механічного очищення ободової кишки перед очищенням осмотичними проносними засобами.
Ентеральне харчування. Традиційно прийнятим вважається за необхідне голодування протягом доби до операції задля уникання таких ускладнень, як аспірація та інші. За даними рандомізованих досліджень встановлено, що призначення вуглеводних харчових сумішей за 3–4 год до операції прискорює відновлення перистальтики кишечника після операції [15]. У дослідженні R.Nelson і співавтори[19] встановлено, що пацієнти основної групи (n=36), яким призначалось ентеральне харчування у формі вуглеводних сумішей, мали значно менший рівень післяопераційних ускладнень та менше часу знаходились у стаціонарі, ніж пацієнти контрольної групи, які в той самий час отримували таку саму кількість води. У питанні щодо післяопераційного харчування досі виникають протиріччя. За даними К.М. Jeffrey і співавторів [13], різниці у швидкості відновлення післяопераційних пацієнтів, що отримували чисту рідину та харчові суміші, не відмічено. Але більш пізні рандомізовані дослідження В.Т. Stewart і співавторів [20] продемонстрували, що у пацієнтів із раннім післяопераційним харчуванням швидше відновлюється перистальтика, починається дефекація і значно менше часу триває післяопераційний парез кишечнику. Час госпіталізації у них достовірно менший. Відомо, що післяопераційний період супроводжується такими стресовими реакціями, як гіперметаболізм, протеоліз соматичних білків та інсулінорезистентність як прояв стресорних реакцій. Встановлено, що раннє післяопераційне ентеральне харчування та пізнє доопераційне харчування достовірно зменшують явища інсулінорезистентності [18, 21].
Епідуральна анестезія [16]. Доведено, що торакальна епідуральна анестезія при резекціях ободової кишки достовірно зменшує тривалість післяопераційного парезу кишечнику в порівнянні із тривалим призначенням опіоїдних анальгетиків. Механізм такої дії пов’язують із блокадою аферентних симпатичних інгібіторних рефлексів та із підвищенням рівня кровотоку в кишечнику завдяки блокаді еферентних симпатичних шляхів та за рахунок розчинення препарату і його протизапальній дії.
Відмова від рутинної постановки дренажів. В 2004 р. H. Petrowsky і співавтори [6, 8] провели метааналіз 8 рандомізованих досліджень, у яких брали участь пацієнти, що перенесли операції на ободовій кишці за різними показаннями (n=1390). 717 з них (1-ша група) було виконано дренування черевної порожнини, 673 (2-га група) — ні. У результаті досліджень виявлено, що суттєвої різниці у рівні післяопераційної летальності та ускладнень у цих групах немає. Встановлено також, що у пацієнтів 1-ї групи відмічались більш часті гнійні ускладнення зі сторони післяопераційної рани. У метааналізі De Jesus і співавторів [4] брали участь 1140 пацієнтів, що були оперовані з приводу раку прямої та ободової кишки. 573 виконувалась постановка дренажу черевної порожнини чи малого таза, 567 – ні. Частота летальності, клінічних та рентгенологічних проявів недостатності анастомозу, інфікування післяопераційної рани та релапаротомій в обох групах виявлялася рівною або із статистично несуттєвою різницею.
Обмеження інфузійної терапії. Питання щодо оптимізації призначення інфузійної терпії пацієнтам, які проходять лікування за мультимодальною програмою FTS на сьогодні залишається відкритим. D.H. Jacobsen і співавтори [12] проводили рандомізоване дослідження щодо впливу гіпергідратації на перебіг післяопераційного періоду пацієнтів та не знайшли статистично значимого взаємозв’язку між об’ємом інфузій та рівнем ускладнень зі сторони серцево-судинної та дихальної системи, а також між впливом на тривалість післяопераційного парезу кишечнику [14, 17]. Оптимізація інфузійної терапії у цієї категорії пацієнтів потребує подальшого вдосконалення.
Назогастральна інтубація. За даними метааналізу M.L. Cheatman і співавторів [3] встановлено, що рутинна назогастральна інтубація у багатьох пацієнтів має побічні ефекти у вигляді пневмонії, ателектазу, підвищення температури та інше. Безумовна користь від назогастральної декомпресії відмічалась лише у 5% пацієнтів. У великому метааналізі R. Nelson і співавторів [19] 2010 р., у якому брали участь 5711 пацієнтів, виявлено, що у хворих, яким не встановлювали назогастральний зонд, швидше відновлювалась перистальтика, а рівень неспроможності колоректальних анастомозів виявився рівним в обох групах.
Мета дослідження — покращення безпосередніх результатів хірургічного лікування хворих на РОК шляхом удосконалення програми FTS. Завданнями дослідження було оцінити ефективність програми FTS за показниками тривалості оперативного втручання, швидкості відновлення пасажу по шлунково -кишковому тракту, динаміки больового, анемічного та гіпопротеїнемічного синдрому, терміну перебування на лікарняному ліжку та економічного ефекту.
об’єкт і методи дослідження
З січня 2008 р. у відділенні пухлин черевної порожнини Національного інституту раку проводилось рандомізоване дослідження хворих на резектабельний РОК (T2-4N0-2M0-1) із застосуванням мультимодальної програми FTS в періопераційному періоді в порівнянні із стандартним оперативним лікуванням. Рандомізація 2:1. Для статистичної інтерпретації отриманих результатів було застосовано метод дисперсійного аналізу із використанням пакета програмного забезпечення Statistica 6.0. З метою оцінки інтенсивності гострого болю використовують цифрову рейтингову шкалу (Numerical Rating Scale, NRS).
Основні аспекти стратегії Fast Track Surgery [2].
1. Передопераційний період:
- відмова від механічної підготовки товстої кишки (очисні клізми перед операцією);
- відмова від голодування перед операцією (останній прийом їжі можливий за 2–3 год до операції харчовими сумішами із підвищеним вмістом вуглеводів);
- відмова від премедикації наркотичними анальгетиками.
2. Під час операції:
- епідуральна анестезія органів черевної порожнини розчином маркаїну 0,125% 8–9 мл/год, використання нестероїдних протизапальних діючих речовин;
- мініінвазивні оперативні доступи;
- мінімізація крововтрати (використання електро- чи УЗ-скальпеля);
- використання циркулярних зшиваючих апаратів та атравматичного шовного матеріалу для формування анастомозів;
- відмова від рутинної довготривалої постановки дренажів у черевну порожнину та порожнину малого тазу, назогастрального зонда, центральних венозних катетерів та сечових катетерів.
3. Післяопераційний період:
- раннє ентеральне харчуваня (в середньому через 6 год після операції);
- рання активізація пацієнта;
- раннє видалення сечових і венозних катетерів, дренажів та зондів, епідурального катетера (до 2–3 діб після операції).
- агресивна протибольова терапія з використанням подовженої епідуральної анальгезії з місцевими анестетиками, відмова від рутинного використання наркотичних анальгетиків.
Для лапаротомії у хворих на рак правої половини ободової кишки використовували: мінімальний поперековий доступ в мезогастрії справа; у хворих на рак попереково-ободової кишки — серединний поперековий доступ; у хворих на рак лівого вигину — поперековий доступ в мезогастрії зліва; у хворих на рак сигмоподібної кишки та ректосигмоїдного відділу — лівий поперековий доступ над лоном та у здухвинній області.
Результати
У січні 2011 р. проведено аналіз лікування 2 груп хворих на РОК: основної (n=102) — застосування програми FTS; та контрольної (n=48) – оперативне лікування із стандартною підготовкою.
Обрані групи хворих були репрезентовані за факторами клінічного прогнозу (стать, вік, стадія захворювання, локалізація пухлини). Середній вік хворих відповідно становив 62±6 та 61±6 років в основній та контрольній групах. В обох групах переважали особи жіночої статі (64–67 %). В основній групі в більшості випадків (78%) об’ємом операції була правобічна гемиколектомія. В контрольній групі виконано правобічних гемиколектомій — 72%. У 18% хворих основної групи виконано комбіновані оперативні втручання та у 16% — паліативне. У 19% хворих контрольної групи виконано комбіновані оперативні втручання та у 20% — паліативні операції. Інтраопераційних ускладнень не було. Післяопераційні ускладнення легкого ступеня спостерігали в обох групах. У контрольній групі було 2 випадки розвитку тромбофлебіту вен нижніх кінцівок та 2 випадки цистіту. В основній групі в 1 хворого був випадок загострення хронічного панкреатиту, у 2 — цистіту. Випадків післяопераційної летальності не було.
Фізикальний статус ECOG мав більш позитивну динаміку в групі хворих з FTS. Кількість хворих із статусом ECOG 1 на 5-ту добу після операції була у 2,1 раза більше в основної групі (відповідно 64 та 30%).
Фактори адаптації організму пацієнтів до перенесеного оперативного втручання оцінювали за лабораторними показниками гемоглобіну, гематокриту та еритроцитів. Зазначені параметри порівнювали у передопераційний період (день перед операцією), у день операції, на 1-шу та 2-гу добу після неї, а також у день виписки із стаціонару. На день операції середні значення рівня гемоглобіну були майже рівними (90,7±20,4 г/л та 90,6±20,5 г/л в основній та контрольній групах відповідно). Статистична значимість показників виявлена на 2-гу добу після операції: середній рівень в основній групі становив 91,5±17,4 г/л, в контрольній — 74,8±15,3 г/л (р<0,05). При порівнянні інших показників рівнів гемоглобіну, еритроцитів та гематокриту статистичної значимості не виявлено. Використання раннього ентерального харчування та відмова від передопераційного голодування відобразились на показниках рівня загального білка в ранній післяопераційний період: у пацієнтів з групи FTS рівень загального білка залишався нормальним (в середньому >65 г/л), у той час як пацієнти з контрольної групи мали тенденцію до гіпопротеїнемії (середній рівень становив 60±7,3 г/л). Статистичної значимості між отриманими показниками не виявлено, але можна стверджувати про тенденцію до гіпопротеїнемії і, як наслідок, до білково-енергетичної недостатності в ранній післяопераційний період у хворих контрольної групи.
Порівняльний аналіз ефективності використання програми FTS у хворих на РОК наведено в табл. 2.
Дискусія. Отримані результати дослідження не вступають у протиріччя із світовими тенденціями та результатами інших європейських та американських авторів [7, 8, 16] та свідчать про значні переваги програми FTS в контексті хірургічного лікування хворих на РОК. Але, незважаючи на значні успіхи та обнадійливі результати, зазначена концепція має багато невирішених та недостатньо розглянутих питань. Підкреслювалась неоднозначність відповідей авторів на такі питання, як дренування черевної порожнини, оптимізація та індивідуалізація інфузійної терапії, показання до назогастральної декомпресії після оперативного втручання, комбінація різних класів анальгетичних препаратів для досягнення оптимального больового контролю та інше. На нашу думку, досить неоднозначним та найменш висвітленим у науковій літературі залишається питання нутритивної підтримки та корекції нутритивного статусу пацієнтів, яким планується хірургічне лікування РОК за програмою FTS. На думку авторів, найбільшого успіху в цьому можна досягти лише за умови індивідуалізації корекції нутритивного статусу, зокрема білково-енергетичної недостатності. Запропонований підхід передбачає наступні заходи.
Об’єктивне обстеження має включати зважування, визначення зросту та індексу маси тіла. Індекс маси тіла визначається за формулою Кетле:
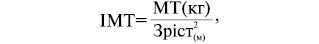
де ІМТ — індекс маси тіла в кг/м.
Кахексія І ст. — до 20 кг/м, ІІ ст. — 20–17 кг/м, ІІІ ст. — ?17 кг/м.
Усі отримані антропометричні та лабораторні показники для зручності заносяться у зведену таблицю із референтними значеннями (див. табл. 2), на основі чого вираховується ступінь нутритивної недостатності.
У випадку дефіциту маси тіла більш ніж за 3 тиж необхідне призначення харчових сумішей із підвищеним вмістом білків та пептидів за тиждень до операції. Можна також оцінювати ступінь нутритивного ризику за формулою Busby:
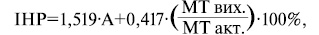
де:
ІНР — індекс нутритивного ризику;
А — сироватковий альбумін;
МТ вих. — вихідна маса тіла;
МТ акт. — актуальна маса тіла.
Результати: ІНР?97,5 — немає нутритивної недостатності; ІНР=97,5– 83,5 — середній ступінь нутритивної недостатності; ІНР?83,5 — тяжкий ступінь нутритивної недостатності.
Оцінка білкового метаболізму здійснюється наступним чином: визначення загального білка сироватки (норма — 65–85 г/л). У разі виявлення білкової недостатності задля подальшої її корекції необхідно визначити добову втрату азоту та підрахувати азотистий баланс:
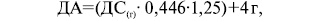
де: ДА — добовий азот;
ДС(г) — добова сечовина (у грамах).
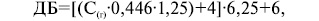
де:
ДБ — добовий білок;
ДС(г) — добова сечовина (у грамах).
Азотистий баланс — співвідношення азоту, отриманого з їжею, до азоту, виділеного із організму за добу. Для визначення кількості азоту в кількості білка необхідно масу білка, отриманого з їжею, розділити на коефіцієнт 6,25. Вміст білка у 100 г харчової суміші завжди зазначається виробником. Таким чином, формула для підрахунку азотистого балансу матиме такий вигляд:
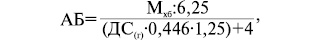
де:
АБ — азотистий баланс;
Мхб— маса харчового білка за добу.
У залежності від переважання катаболізму чи анаболізму азотистий баланс може бути: позитивний — у разі переважання анаболічних процесів (АБ>1), негативний —у разі переважання катаболічних процесів на фоні білково-енергетичної недостатності (АБ<1) та нульовий (АБ ~1). Суть нутритивної підтримки полягає у забезпеченні позитивного або нульового азотистого балансу до операції.
Для диференціювання катаболізму соматичних і вісцеральних білків можна використовувати формулу індексу креатиніну:
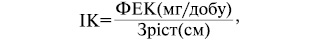
де:
ІК — індекс креатиніну;
ФЕК — фактична екскреція креатиніну за добу.
Нормальне значення показника становить 10,5–9,5. Легка нутритивна недостатність (НН) — 9,5–8,4; середня НН — 8,4–7,4; тяжка НН — <7,4.
На всіх етапах лікування для адекватного призначення харчових сумішей має бути вирахувана добова енергетична потреба. Для оцінки добової енергетичної потреби використовується формула визначення істинного споживання енергії (табл. 3).
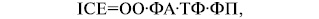
де:
ІСЕ — істинне споживання енергії (ккал);
ОО — основний обмін;
ФА — фактор активності;
ТФ — температурний фактор;
ФП — фактор пошкодження.
Основний обмін вираховується за формулою Харріса — Бенедикта:
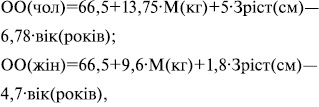
де:
М — маса тіла в кілограмах.
Для більш спрощеного, але менш точного підрахунку можливо скористатися формулою: ОО = 25ккал/кг/добу.
У лютому–березні 2011 р. в клініці пухлин органів черевної порожнини та заочеревинного простору в рамках протоколу дослідження мультимодальної програми FTS було проведено пілотне дослідження впливу оцінки та корекції нутритивного статусу пацієнта на перебіг післяопераційного періоду та кількість післяопераційних ускладнень. Отримані результати наводимо в якості клінічного спостереження (case – report):
Пацієнт Ю., 64 роки. Діагноз — С-а сигмоподібної кишки рT4 N0M0, стадія ІІВ, клінічна група 3. Виконана операція — передня резекція прямої кишки. Оперативний доступ — лівостороння поперечна лапаротомія. Післяопераційний період протікав без ускладнень, інтраопераційних ускладнень не було. Пацієнт готовий до виписки на 5-ту добу після операції. ПГЗ №75412/11 від 09.03.11: помірно диференційована аденокарцинома кишки, інфільтрує всі шари стінки органа. В реґіонарних лімфатичних вузлах та краях резекції елементів пухлини не виявлено. Пацієнту рекомендовано курс ад’ювантної ПХТ за схемою Mayo. Маса пацієнта — 83,6 кг, зріст — 176 см. ІМТ — 27кг/м (нормальне значення). Рівень загального білка крові — 78 г/л, альбуміну — 43 г/л, феритину — 182 мкг/л. Рівень добової сечовини сечі — 507 ммоль/добу, добового креатиніну сечі — 28843,5 мкмоль/добу. Індекс нутритивного ризику — 95,1 (середній ступінь); добова втрата білка (шляхом катаболізму) за даними добової сечовини становила 106 г/добу. Для підтримання позитивного азотистого балансу пацієнту було складено раціон на основі харчових сумішей із підвищеним вмістом білка. В день операції біохімічний аналіз не проводили. На 1-шу добу після операції відповідні показники та значення становили: маса — 79кг, ІМТ — 25,5 кг/м(нормальне значення); рівень загального білка — 46,6 г/л, альбумін — 22 г/л, феритин — 196 мкг/л. Рівень добової сечовини сечі — 600 ммоль/добу, добового креатиніну сечі — 24590 мкмоль/добу. Індекс нутритивного ризику — 48,9 (важка нутритивна недостатність). Добова втрата білка (шляхом катаболізму) — 125 г/л. Істинне споживання енергії — 3290 ккал/добу. Раціон підібраний із врахуванням кількості білка, необхідної для підтримки позитивного азотистого балансу та із врахуванням істинного споживання енергії за добу. Ентеральне харчування розпочато через 6 год після операції. На 5-ту добу відмічена нормалізація усіх зазначених показників, індекс нутритивного ризику — 98,2 (відсутність нутритивної недостатності), маса тіла пацієнта — 82,9 кг, ІМТ — 26,7кг/м (нормальне значення). Пацієнту надані рекомендації з приводу подальшого раціону харчування та спостереження.
У процесі виконання роботи було доведено зменшення використання медичних препаратів та реактивів та скорочення часу перебування на стаціонарному ліжку в групі хворих, що лікувались із застосуванням принципів FTS. У зв’язку з цим були підраховані витрати на лікування в обох групах і отримані результати показали суттєве зменшення витрат на лікування в досліджуваній групі. Розрахункова вартість лікування хворих на РОК на 1500 грн. менша за стандартне лікування. За 2008 р. з приводу РОК в Україні виконано 2680 операцій. За умови лікування цих хворих за принципами FTS це дозволило б заощадити 4 млн грн. бюджетних коштів.
Висновки
Мультимодальна програма FTS підвищує ефективність хірургічного лікування хворих на РОК. Тільки за рахунок комплексного підходу, в тому числі використання епідуральної анестезії, мінімізації хірургічного втручання, ранньої активізації і харчування, багатьох інших компонентів програми, FTS сприяє зниженню больового синдрому, швидкому відновленню функції шлунково-кишкового тракту та ранньої реабілітації хворих. Завдяки використанню програми FTS та більш ефективній реабілітації хворих на РОК IV стадії стало можливим розпочати в ранній термін паліативну хіміотерапію в необхідному обсязі. Використання програми FTS дає можливість вдвічі знизити витрати на лікування, що призведе до економії бюджетних коштів.
Література
- 2. Рак в Україні, 2007–2008. (2009) Бюл. національного канцер-реєстру України №10, Київ, 104 с.
- 5. Щепотін І.Б., Колеснік О.О., Махмудов Д.Е. (2010) Ефективність мультимодальної програми Fast Track Surgery у хворих на рак ободової кишки Онкологія: прил. к журналу «Онкология», 12(1) (спеціальне видання): 57–58.
- 7. Cheatham M.L., Chapman W.C., Key S.P. et al (2005) A meta-analysis of selective versus routine nasogastric decompression after elective laparotomy. Ann Surg., 221: 469–476.
- 13. de Jesus E.C., Karliczek A., Matos D. et al. (2010) Prophylactic anastomotic drainage for colorectal surgery. Cochrane Database of Systematic Reviews, Issue 2. Art. No.: CD002100. DOI: 10.1002/14651858.CD002100.pub2.
- 18. Douglas W., Wilmore M.D. (2002) From Cuthbertson to Fast-Track Surgery: 70 Years of Progress in Reducing Stress in Surgical Patients. Ann of Surg., 236(5): 643–648 © Lippincott Williams & Wilkins, Inc.
- 27. Gang Wang, Zhi-Wei Jiang, Jing Xu et al.(2011) Fast-track rehabilitation program vs conventional care after colorectal resection: A randomized clinical trial. World J Gastroenterol., 17(5): 671-676.
- 32. Garth A.K., Newsome C.M., Simmance N.et al. (2010) Nutritional status, nutrition practices and post-operative complications in patients with gastrointestinal cancer., J. Hum. Nutr. Diet, 23: 393–401.
- 38. Ghislaine A.P.G. van Mastrigt, Manuela A. Joore, Fred H.M. Nieman et al. (2010) Health-related quality of life after fast-track treatment results from a randomized controlled clinical equivalence trial. Qual. Life Res. (2010) 19: 631–642.
- 50. Grigoras I. (2007) Fast-track surgery — a new concept — the perioperative anesthetic management. J. Сhir., 3(2): 89–91.
- 59. Guenaga KKFG, Atallah В.N., Castro A.A., (2005) Mechanical bowel preparation for elective colorectal surgery. Cochrane Database Syst Rev;Issue article No. CD001544.
- 63. Henrik Kehlet.(2008) Fast-track colorectal surgery. Lancet, 371(8).
- 68. Jacobsen D.H., Sonne E., Andreasen J. et al. (2006) Convalescence after colonic surgery with fast-track vs. Conventional care. Colorectal Disease, 8: 683–687.
- 73. Jeffery K.M., Harkins B., Cresci G.A. et al. (1996) The clear liquid diet is no longer a necessity in the routine postoperative management of surgical patients. Am. Surg., 62: 167–170.
- 79. Jose Eduardo de Aguilar-Nascimento, Alberto Bicudo Salomao, Cervantes Caporossi and Breno Nadaf Diniz. CliInical benefits after the implementation of a multimodal perioperative protocol in elderly patients. Arq. Gastroenterol, 47(2).
- 103. Kaska M., Grosmanova T., Havel E. et al. (2010) The impact and safety of preoperative oral or intravenous carbohydrate administration versus fasting in colorectal surgery-a randomized controlled trial. Wien Klin Wochenschr., 122: 23–30.
- 110. Kehlet H., Wilmore D.W. (2008) Evidence-based surgical care and the evolution of fast-track surgery. Ann. Surg., 248(2): 189–98.
- 114. Knut Magne Augestad, Conor P. Delaney. (2010) Postoperative ileus: Impact of pharmacological treatment, laparoscopic surgery and enhanced recovery pathways. World J. Gastroenterology, 16(17): 2067–2074.
- 118. Ned Abraham, Sinan Albayati. (2011) Enhanced recovery after surgery programs hasten recovery after colorectal resections. World J. Gastrointest Surgery, 3(1): 6.
- 122. Nelson R., Edwards S., Tse B. (2010) Prophylactic nasogastric decompression after abdominal surgery. Cochrane Database Syst Rev; CD004929.
- 125. Stewart B.T., Woods R.J., Collopy B.T., et al. (1998) Early feeding after elective open colorectal resections: a prospective randomized trial. Aust. NZ J. Surg., 68:125–128.
- 130. Timothy C., Counihan M.D.,Joanne Favuzza, D.O. (2009) Fast Track Colorectal Surgery. Clin. Colon Rectal Surg., 22: 60–72.
Роль мультимодальной программы Fast Track Surgery в хирургическом лечении колоректального рака
Национальный институт рака, Киев
Резюме. Авторами проведено оценку влияния мультимодальной программы Fast Track Surgery на ближайшие результаты хирургического лечения пациентов с колоректальным раком по сравнению с традиционным лечением. В результате проведенного рандомизированного исследования (150 пациентов) установлено: использование мультимодальной программы Fast Track Surgery у пациентов с раком ободочной кишки способствует сокращению термина реабилитации, снижению затрат на лечение.
колоректальный рак, хирургия быстрого восстановления, хирургия, ускоренная реабилитация после хирургии.














Leave a comment