Мітотична активність і вміст нуклеїнових кислот у ядрах клітин нейробластомних пухлин
Грабовий О.М., Зарецький М.Б., Перепьолкіна І.В., Василишин О.І.
Резюме. Підвищення ступеня анаплазії у нейробластомних пухлинах супроводжується зменшенням середнього вмісту ДНК і зростанням проліферативної активності. Але великий діапазон коливань останньої у гангліоневромах і нейробластомах не дає можливості (крім крайніх випадків) використовувати її як самостійний критерій визначення злоякісного потенціалу конкретної окремо взятої пухлини. Серед гангліонейробластом і нейробластом можна виділити пухлини, які мають протилежні вектори формування їх клітинного спектра: за рахунок зменшенням чи, навпаки, зростання мітотичної активності в міру накопичення вмісту ДНК у пухлинних клітинах. З іншого боку, нейробластомні пухлини також можна розділити на такі, в яких збільшення середнього вмісту ДНК у ядрах клітин відбувається за рахунок високої проліферативної активності (велика частка клітин, у яких відбувається синтез ДНК), і такі, в яких цей показник зумовлений збільшенням частки в клітинному спектрі клітин з високим вмістом ДНК (поліплоїдних).

Сьогодні є загальновизнаним, що білок Ki-67 є високоінформативним маркером клітинної проліферації. У зв’язку з тим, що необмежена (неконтрольована) мітотична активність є типовою властивістю пухлин, визначення цього протеїну знайшло широке застосування в онкології, а частка Ki-67-позитивных пухлинних клітин (Ki-67 — індекс мічення) часто корелює з клінічним перебігом раку.
Нейробластомі пухлини (НБ) також є об’єктом дослідження для встановлення їх проліферативної активності за визначенням експресії білка Ki-67 [10–12]. Показана залежність між високим рівнем Кі-67 та несприятливим та проміжним МКІ (індексом Шимади), також високий рівень Кі-67 відзначали в анеуплоїдних новоутвореннях та в пухлинах ІІІ та ІV стадій, що безпосередньо вказує на прямий зв’язок між високим рівнем проліферації, несприятливим перебігом захворювання та поганою відповіддю пухлини на проведене лікування [10, 13–15].
Але проліферативна активність для НБ виявилася не таким значущим прогностичним фактором, як для пухлин деяких інших гістогенетичних типів (наприклад нейроендокринних) [1]. Перш за все, це може бути пов’язане з біологічними особливостями НБ, які є ембріональними пухлинами, що потребує враховувати фонову проліферативну активність, яка природно є досить високою для тканин дитячого організму. Це стало привидом для пошуку зв’язків між експресією Ki-67 та іншими маркерами, які характеризують ті чи інші властивості клітин НБ [6].
З іншого боку, обмеження інформативності рівня проліферативної активності в НБ як фактора прогнозу пов’язана з гетерогенністю цих пухлин, у тому числі й їх клітинного складу за вмістом нуклеїнових кислот (НК) і, відповідно, плоїдності [2]. Наявність НБ з різною плоїдністю клітин вказує на різні патогенетичні механізми, які ведуть до виникнення НБ [8, 9]. Логічно припустити, що це буде відображатися на проліферативній активності їх клітин. Відповідно, мітотична активність пухлинних клітин має виступати не як самостійний, а похідний фактор прогнозу.
Мета роботи — встановити особливості мітотичної активності в різних за вмістом НК ядрах клітин НБ пухлин.
Об’єкт та методи дослідження
Дослідження проведено на матеріалі біопсій або вилученому при оперативному втручанні від 43 пацієнтів з НБ пухлинами: гангліоневромами (ГН) — 3; гангліонейробластомами (ГНБ) — 14, нейробластомами (НБ’ — власне нейробластома) — 26. Гістологічне типування новоутворень здійснювали з використанням рутинного (гематоксилін й еозин) забарвлення та імуногістохімічного (ІГХ) дослідження.
Отриманий матеріал фіксували в забуференому 10% формаліні з pH 7,4 та ущільнювали у парафін із застосуванням гістіопроцесора «Histos-5» («Milestone», Італія). Із парафінових блоків виготовляли гістологічні зрізи товщиною 5 мкм за допомогою мікротома «Microm НМ325» («Thermo Scientific», Німеччина). Зрізи забарвлювали гематоксиліном і еозином та азур-ІІ-еозином для загальної оцінки пухлини, галоціанін-хромовим галуном за Ейнарсоном (pH 1,62, 37 °С, 24 год) для виявлення вмісту НК у клітинах [3, 4]. Для кожного випадку частину зрізів обробляли РНКазою («MACHEREY-NAGEL GmbH & Co. KG», Німеччина) для екстракції РНК [3]. ІГХ реакцію проводили з моноклональними мишачими антитілами до антигену Ki-67 людини, клон MIB-1 («Dako», Данія), відповідно до протоколу виробника з використанням системи детекції EnVisionTM FLEX, («Dako», Данія). Зрізи забарвлювали гематоксиліном Gill. У якості позитивного контролю брали використані тканинні зразки з визначеною позитивною реактивністю, а для негативного контролю проводили процедуру без застосування первинних антитіл.
Отримані препарати вивчали та фотографували за допомогою мікроскопа Nikon Eclipse 80i з камерою DS-5SMc/L2 (збільшення мікроскопа х400, 1280×960 пікселів RGB) за стандартизованих умов, а зображення обробляли із застосуванням системи аналізу ImageJ 1,46. На зображеннях з препаратів, забарвлених галоціанін-хромовим галуном, у 60 клітинах кожної пухлини визначали: площу перетину ядра клітини (Narea), інтегративну оптичну щільність ядра клітини (NIntDen) та вміст у ньому сумарної кількості НК (NНК) і ДНК (NДНК). Кількість РНК розраховували як різницю між кількістю НК і ДНК. Для оцінки вмісту НК у ядрах пухлинних клітин за одиницю брали їх вміст у ядрах лімфоцитів. Клітини кожної пухлини ранжирували за вмістом ДНК у ядрі. Отриману послідовність поділяли на ранги з кроком, який дорівнював середньому вмісту ДНК у ядрах лімфоцитів: Р1 — до 1, Р2 — 1–2, Р3 — 2–3 і так далі. Для кожного рангу визначали середні розміри ядра [2].
Для кожної пухлини при забарвленні для виявлення сумарних НК та експресії Кі-67 клітини ранжирували за розмірами ядра відповідно до параметрів, встановлених на препаратах, де визначали ДНК. У межах кожного рангу обчислювали абсолютну кількість клітин, середні значення Narea, NIntDen, NДНК, NНК та відсоток клітин, ядра яких експресують Кі-67. Отримані цифрові дані обробляли за допомогою стандартних статистичних методів.
Отримані результати та їх обговорення
Результати проведених досліджень продемонстрували, що середній вміст ДНК у ядрах клітин пухлин у міру підвищення ступеня неопластичної трансформації зменшується: ГН (4,68±0,21) — ГНБ (3,07±0,02) — НБ (2,16±0,03), а мітотична активність, навпаки, зростає (відповідно 4,4±1,5; 15,8±0,5 і 31,8±0,5) (рис. 1). Індекс кореляції при цьому між мітотичною активністю і ступенем анаплазії становить 0,99, кількістю ДНК — –0,94.
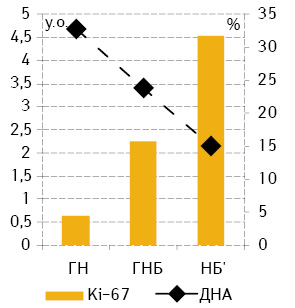
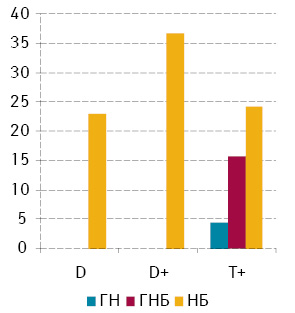
За середнім вмістом ДНК у ядрах клітини пухлини поділено на 3 підгрупи: диплоїдні (D — середній вміст ДНК у ядрах до 1,2), проміжні між ди- та тетраплоїдними (D+ — середній вміст ДНК у ядрах від 1,2 до 2,5), тетра- та гіперплоїдні (T+ — середній вміст ДНК понад 2,5). Серед досліджених ГН і ГНБ переважають пухлини Т+, а D у нашій виборці були відсутні. Серед НБ’, порівняно з більш диференційованими пухлинами, відзначають суттєве переважання пухлин D+ та, на відміну від вищезазначених, суттєву питому частку становили пухлини підгрупи D [2]. Відповідно, статистично достовірне порівняння проліферативної активності між пухлинами різного ступеня анаплазії можна було виконати тільки в пухлинах Т+ (рис. 2), яка незначно відрізнялася від загальних значень (див. рис. 1). Серед НБ’ найбільшу мітотичну активність виявляють у пухлинах групи D+ (див. рис. 2).
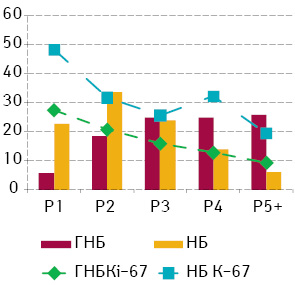
За вмістом ДНК клітини НБ можуть бути поділені на ранги від Р1 до Р12. Але слід зауважити, що клітини з рангом Р5 і більше становили0,05, і тому вони були зведені в один ранг Р5+. Клітинний склад (спектр) НБ, встановлений за вмістом ДНК у їх клітинах, проявляє помірний ступінь залежності від ступеня диференціювання пухлини [2]. У цілому у міру зниження рівня диференціювання клітинний спектр пухлини проявляє тенденцію до зменшення відносної кількості клітин з великим вмістом ДНК у ядрах. Проліферативна активність у ГНБ лінійно зменшується в міру зростання вмісту ДНК, у той час коли відносна кількість клітин пухлини збільшується у цьому напрямку. У ГН’ цей показник має двофазову криву з другим піком у ранзі Р4 (рис. 3).
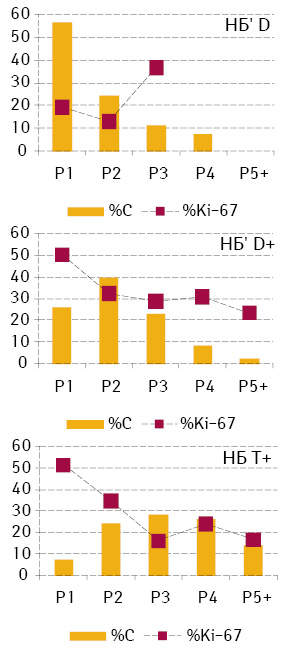
Серед НБ’ різної плоїдності найвищу мітотичну активність відзначена в групі D+ (36,9±0,7) і суттєво нижчу у групах D (22,9±0,4) і Т+ (24,1±0,9). У цілому розподіл мітотичної активності між рангами клітин у цих групах закономірно вказує на тенденцію до збільшення вмісту ДНК у ядрах клітин пухлин (рис. 4).
Оцінка кореляції між середніми значеннями вмісту ДНК у ядрах клітин та середньою мітотичною активністю в ГНБ і НБ’ не виявила прямої залежності між цими показниками. Але аналіз цього показника в кожній окремо взятій пухлині показав, що останній коливається в межах від +1 до −1. При цьому ⅔ пухлин — як ГНБ, так і НБ’ (незалежно від середнього вмісту ДНК) — мають від’ємний знак індексу кореляції, а ⅓ — додатній.
Збільшення вмісту РНК у ядрах пухлинних клітин відбувається непропорційно до зростання вмісту ДНК, що призводить до його відносного зменшення [2]. Однак оцінка відсоткового вмісту РНК у окремо взятих пухлинах дає привід стверджувати, що в пухлинах з додатним індексом кореляції між вмістом ДНК і мітотичною активність вираженість цього процесу менша, ніж у пухлин з від’ємним індексом кореляції.
Таким чином, проведені дослідження показали, що у НБ зі зростанням ступеня дидеференціювання (у ряду ГН-ГНБ-НБ’) відбувається зменшення середнього вмісту ДНК і підвищення проліферативної активності [2]. Але значні діапазони коливань мітотичної активності та їх перекриття у ГНБ і НБ’ не дають можливості з високим ступенем достовірності використовувати їх при визначенні злоякісного потенціалу конкретної окремо взятої пухлини.
Однозначне трактування мітотичної активності може бути одержане лише у крайових частинах цих діапазонів (орієнтовно при експресії Кі-67 35% ядер).
Серед ГНБ і НБ’ можна виділити пухлини, що мають протилежні вектори формування їх клітинного спектра. Перший характеризується зниженням мітотичної активності, а другий, навпаки, її підвищенням на тлі зростання вмісту ДНК у пухлинних клітинах.
Співвідношення ДНК/проліферативна активність серед клітин пухлини, які були досліджені, дозволяє також виділити 2 вектори: пухлини, у яких зростання середнього вмісту ДНК у ядрах клітин відбувається за рахунок високої проліферативної активності (велика частка клітин, у яких відбувається синтез ДНК), і пухлини, в яких цей показник зумовлений більшою часткою у спектрі клітин з високим вмістом ДНК (поліплоїдних). Відповідно до цього пухлини НБ’D+ можуть бути віднесені переважно до першого, НБ’Т+ — до другого типу.
Відзначена також певна різниця у ступені зменшення вмісту РНК у ядрах на фоні неоднозначного розподілу мітотичної активності в пухлинних клітинах у міру зростання вмісту ДНК, є додатковою змінною, яка робить свій внесок у гетерогенність НБ’ [2].
Неоднорідність НБ за вмістом ДНК/проліферативною активністю та вмістом РНК у ядрі є показником різноманітності властивостей та життєздатності пухлинних клітин, що певною мірою пов’язано з різними патогенетичними механізмами онкогенезу [8, 9]. Комплексна оцінка цих параметрів, перш за все при відсутності ампліфікації гена n-myc та 11q аберації, може стати додатковим високоінформативним критерієм гістологічного визначення потенції розвитку НБ [5, 7].
Висновки
Підвищення ступеня анаплазії у НБ (у ряду ГН-ГНБ-НБ’) супроводжується зменшенням середнього вмісту ДНК і зростанням проліферативної активності. Але широкий діапазон коливань останньої у ГНБ і НБ’ не дає можливості (крім крайніх випадків) використовувати її як самостійний критерій визначення злоякісного потенціалу конкретної окремо взятої пухлини.
Серед ГНБ і НБ’ можуть бути виділені пухлини, які мають протилежні вектори формування їх клітинного спектра: за рахунок зниження чи, навпаки, підвищення мітотичної активності в міру збільшення вмісту ДНК в їх клітинах. З іншого боку, НБ також можна розділити на пухлини, в яких зростання середнього вмісту ДНК у ядрах клітин відбувається за рахунок високої проліферативної активності (велика частка клітин, у яких відбувається синтез ДНК), і такі, в яких цей показник зумовлений збільшенням частки у спектрі клітин з високим вмістом ДНК (поліплоїдних).
Різна вираженість ступеня зменшення вмісту РНК у ядрах на фоні неоднозначного розподілу мітотичної активності в пухлинних клітинах у міру зростання вмісту ДНК є додатковою змінною, яка робить свій внесок у гетерогенність НБ’.
Неоднорідність НБ за вмістом ДНК/проліферативною активністю та вмістом РНК у ядрі є показником не тільки гетерогенності цих пухлин за їх клітинним складом, а й відображає певною мірою патогенетичні механізми їх виникнення та може стати достатньо інформативним критерієм визначення ймовірності розвитку цих пухлини.
Список використаної літератури
1. Грабовой А.Н. (2011). Основы морфологической диагностики нейроэндокринных опухолей. Клиническая онкология, 1(1): 102–104.
2. Грабовой А.Н. Зарецкий М.Б. Василишин О.И. (2013). Вміст нуклеїнових кислот у ядрах клітин нейробластом різного ступеня диференціювання. Клиническая онкология, 2(10): 148–151.
3. Лупа Х. (1980). Основы гистохимии (Пер. с немец.). Мир, Москва, 344 с.
4. Ташке К. (1980) Введение в количественную цитогистологическую морфологию. (Пер. с рум.). Изд-во. Акад. Соц. Респ. Румынии., 192 с.
5. Ambros P.F., Ambros I.M., Brodeur G.M., et al. (2009) International consensus for neuroblastoma molecular diagnostics: report from the International Neuroblastoma Risk Group (INRG) Biology Committee. British J. Cancer., 100: 1471–1482.
6. Chen L., Malcolm A.J., Wood K.M. et al. (2007). p53 is Nuclear and Functional in Both Undifferentiated and Differentiated Neuroblastoma Cell Cycle, 6(21): 2685–2696.
7. Cohn S.L., Pearson A.D., London W.B., et al. (2009) The International Neuroblastoma Risk Group (INRG) classification system: an INRG Task Force report. J. Clin. Oncol., 27: 289–97.
8. Davoli T., de Lange T. (2011) The Causes and Consequences of Polyploidy in Normal Development and Cancer. Ann. Rev. Cell Dev. Biol., 27: 585–610.
9. Holland A.J., Cleveland D.W. (2012) Losing balance: the origin and impact of aneuploidy in cancer. EMBO, 13(6): 501–514.
10. Graham D., Magee H., Kierce B. et al. (1995) Evaluation of Ki-67 reactivity in neuroblastoma using paraffin embedded tissue. Pathol. Res. Pract., 191(2): 87–91.
11. Krams M., Heidebrecht H.J., Hero B. et al. (2003) Repp86 expression and outcome in patients with neuroblastoma. J. Clin. Oncol., 21: 1810–1818.
12. Krams M., Hero B., Berthold F. et al. (2002) Proliferation marker KI-S5 discriminates between favorable and adverse prognosis in advanced stages of neuroblastoma with and without MYCN amplification. Cancer, 94: 854–861.
13. Mejía C., Navarro S., Pellín A. et al. (2003) Prognostic significance of cell proliferation in human neuroblastoma: comparison with other prognostic factors. Oncol. Rep., 10(1): 243–247.
14. Shimada H., Ambros I.M., Dehner L.P. et al. (1999) The International Neuroblastoma Pathology Classification (the Shimada system). Cancer, 86: 364 p.
15. Shimada H., Nakagawa A. (2006) Pathology of the Peripheral Neuroblastic Tumors. Laboratory Medicine, 37(11): 684–689.
Митотическая активность и содержание нуклеиновых кислот в ядрах клеток нейробластомных опухолей
Резюме. Рост степени анаплазии в нейробластомных опухолях сопровождается уменьшением среднего содержания ДНК и
ростом пролиферативной активности. Однако широкий диапазон колебаний последней в ганглионевромах и нейробластомах не дает возможности (кроме крайних случаев) использовать ее как самостоятельный критерий определения злокачественного потенциала конкретной отдельно взятой опухоли. Среди ганглионейробластом и нейробластом можно выделить опухоли, имеющие противоположные векторы формирования их клеточного спектра: за счет уменьшения или, наоборот, роста митотической активности по мере увеличения содержания ДНК в опухолевых клетках. С другой стороны, нейробластомные опухоли можно разделить на такие, в которых увеличение среднего содержания ДНК в ядрах клеток происходит за счет высокой пролиферативной активности (большая доля клеток в которых происходит синтез ДНК), и такие, в которых этот показатель обусловлен увеличением доли в клеточном спектре клеток с высоким содержанием ДНК (полиплоидных).
нейробластомные опухоли, Ki-67, нуклеиновые кислоты.














Leave a comment