Сучасні системи оцінки пухлинного ураження нирки (огляд літератури)
Вітрук Ю.В., Стаховський Е.О., Войленко О.А., Стаховський О.Е., Вукалович П.С., Котов В.А., Гаврилюк О.М.
Резюме. Оцінка пухлин нирки променевими методами є складним і багатофакторним процесом. Нові нефрометричні системи оцінки, розроблені останнім часом (PADUA, R.E.N.A.L., C-index та D-A-P nephrometry), дозволяють отримати систематичну й кількісну оцінку пухлинного ураження нирки та мають дві основні цілі: первинну — методологічний аналіз локалізації пухлини та стандартизацію звітності даних; вторинну — яка передбачає визначення успіху резекції нирки, ризику виникнення післяопераційних ускладнень, а також функціональні та онкологічні результати. На основі огляду літератури в статті представлено порівняльну характеристику пухлин різними системами оцінки, їх переваги та недоліки.
 Хірургічне видалення пухлини є золотим стандартом лікування при локалізованому нирково-клітинному раку, у той час як хірургічна абляція та активне спостереження є терапією вибору для пацієнтів з вираженою супутньою патологією [1].
Хірургічне видалення пухлини є золотим стандартом лікування при локалізованому нирково-клітинному раку, у той час як хірургічна абляція та активне спостереження є терапією вибору для пацієнтів з вираженою супутньою патологією [1].
Водночас точність та чіткість описання пухлинного ураження, його зв’язок зі структурами нирки є обов’язковими для остаточного визначення алгоритму ведення хворого [2].
Згідно з останніми версіями стандартів лікування Європейської асоціації урологів (European Association of Urology) та Американської урологічної асоціації (American Urological Association), рекомендовано органозберігаюче лікування (резекція нирки) при одиничних пухлинах діаметром до 7 см, якщо це технічно можливо [3, 4].
У рандомізованому дослідженні EORTC (European Organisation for Research and Treatment of Cancer) показано, що після резекції нирки з приводу пухлини в Т1 стадії отримано такі самі результати, як і після радикальної нефректомії [5].
Резекція нирки дозволяє зберегти її функцію, знизити ризик виникнення ниркової недостатності та ускладнень з боку загального стану здоров’я, забезпечуючи цим в цілому хороші показники загальної виживаності порівняно з радикальною нефректомією, однак характеризується вищою частотою хірургічних ускладнень, у тому числі кровотеч, сечової нориці, а також необхідності повторної операції [6–10].
Особливостями пухлини, які диктують нам можливість часткової резекції нирки, є діаметр, полярне місце розташування, глибина вростання, відношення до судинної ніжки та порожнистої системи нирки. Традиційно хірурги суб’єктивно оцінюють можливості резекції нирки [11].
Ураження, які один лікар вважатиме недоречними при агресивній тактиці або навіть протипоказаними для резекції нирки через його центральне, ендофітне розташування чи у воротах нирки, можуть бути стандартом органозберігаючого лікування для іншого лікаря [12].
Оцінка пухлин нирки променевими методами діагностики є складним і багатофакторним процесом. Нові системи оцінювання, розроблені останнім часом, дозволяють отримати систематичну й кількісну оцінку пухлинного ураження нирки. Нефрометричні системи оцінки переслідують дві основні цілі: первинну — методологічний аналіз локалізації пухлини і стандартизацію звітності даних; вторинну — яка передбачає визначення успіху резекції нирки, ризику виникнення післяопераційних ускладнень, а також функціональні та онкологічні результати. Розмір пухлини може обмежити показання до резекції нирки у зв’язку з пухлинною масою та проростанням в основні структури нирки. Ступінь пухлинного вростання істотно впливає на час ішемії, що пов’язано з тривалішим періодом видалення пухлини, реконструкцією порожнистої системи, а також на частоту післяопераційних ускладнень [13–22].
Порівняльна характеристика пухлин різними системами оцінки істотно відрізняється. На сьогодні зареєстровано нефрометричні скорингові системи: PADUA (Preoperative Aspects and Dimensions Used for an Anatomical score), R.E.N.A.L. (radius, exophytic/endophytic, nearness to collecting system or sinus, anterior/posterior and location relative to polar lines), система C-index та D-A-P nephrometry (diameter-axial-polar), які мають свої переваги та недоліки, тому доцільно розглянути кожну з них окремо.
Європейський уролог V. Ficarra та співавтори запропонували систему опису пухлини нирки — PADUA [23].
Оцінка пухлини згідно з РADUA — проста анатомічна система, яка об’єднує найбільш значні особливості розташування пухлини та її зв’язку з найважливішими структурами нирок, дозволяє передбачити ризик виникнення післяопераційних ускладнень у пацієнтів, у яких планується резекція нирки, відповідно до груп ризику.
Згідно з цією системою, поділ пухлини ґрунтується на 5 анатомічних аспектах: пухлина локалізується на передній чи задній поверхні, розташування (край нирки та полюс), зв’язок як з мискою, так і порожнистою системою нирки, відсоток пухлини, яка вростає в нирку, а також її максимальний діаметр (в сантиметрах).
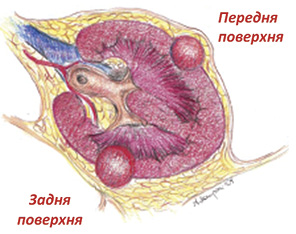
Передню чи задню поверхню розташування пухлини визначають відносно покриття нирки переднім чи заднім листком ниркової фасції і позначають відповідно буквою А (anterior) або P (posterior) (рис. 1).
Полярність розташування пухлини вказує на її приналежність до міжполюсної ділянки нирки, яка визначається на зображеннях комп’ютерної томографії (КТ) осьовими лініями, проведеними перпендикулярно до вертикальної осі нирки у верхньому та нижньому полюсі по концентричному краю ниркової паренхіми, де вона переривається і переходить у жирову тканину чи судини (рис. 2 а).
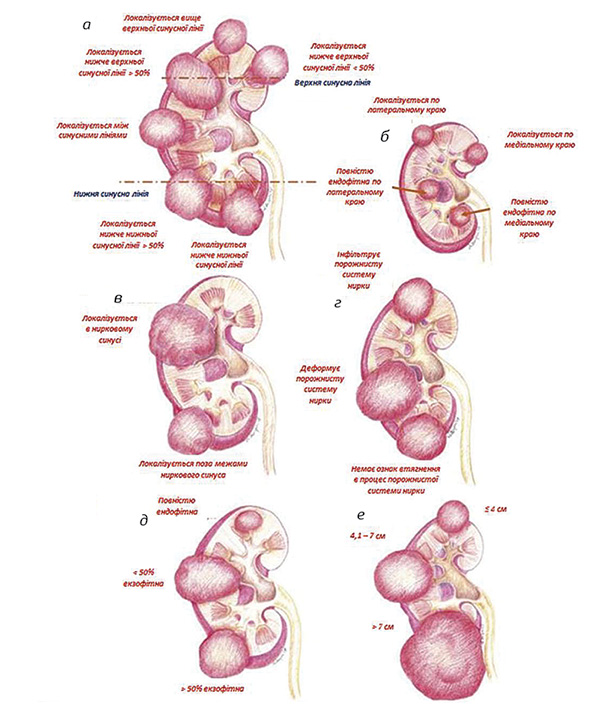
Нирковий синус з’являється на комп’ютерній томоргамі як гіподенсна ділянка на фоні ниркової паренхіми. Синусні лінії — легко впізнаваний орієнтир на КТ-зрізах, але вони також можуть бути простежені на коронарних зображеннях магнітно-резонансної томографії. Один бал присвоюють пухлині, якщо вона розташована поза межами інтерполярного коридора або менше ніж 50% її об’єму — в інтерполярній ділянці, а 2 бали — якщо 50% та більше її розміщено в інтерполярній ділянці.
Якщо пухлина розташована по латеральному краю, їй присвоюється 1 бал, якщо по медіальному — 2 бали (рис. 2б).
Стосунок пухлини до ниркової миски — ще один параметр класифікації. 1 бал дають за відсутності ознак втягнення в пухлинний процес ниркової миски, а 2 бали — при залученні її в процес (рис. 2в).
Те саме стосується порожнистої системи нирки: 1 бал — за відсутності ознак втягнення її в пухлинний процес, а 2 бали — при залученні її в пухлинний процес (рис. 2г).
Із точки зору глибини пухлинного ураження, 1 бал присвоюють пухлині, яка на 50% та більше характеризується екзофітним ростом, 2 бали — коли ріст екзофітний менше ніж на 50%, а 3 бали — при повністю ендофітній пухлині (рис. 2д).
І врешті, оцінка розміру пухлини за її максимальним діаметром: 1 бал — якщо розмір пухлини ≤4 см, 2 бали — 4,1–7 см, а 3 бали — >7 см (рис. 2е).
Кінцевий результат оцінки згідно з системою PADUA — показник суми всіх балів. Ця оцінка створена для того, щоб бути незалежним предиктором післяопераційних ускладнень резекції нирки. Рівень ускладнень статистично корелював зі зв’язком пухлини з міжполюсною ділянкою (p=0,01), локалізацією відносно краю нирки (p=0,005), розташуванням у порожнистій системі нирки чи миски (p<0,001) та глибиною пухлинного ураження (р=0,002). І навпаки, клінічно розмір пухлини та переднє чи заднє розміщення не були статистично достовірними предикторами розвитку ускладнень (р=0,32 та р=0,62 відповідно).
Згідно з цією системою оцінки, виділено 3 групи хворих відносно ризику виникнення ускладнень. V. Ficarra та співавтори повідомляли, що кількість балів >8 корелює зі збільшенням випадків ускладнень при відкритій резекції нирки від 2 до 40%. Ризик ускладнень підвищується до 14,5% для пухлин з PADUA 8–9 балів та 30,6% — для ≥10 балів.
Іншу анатомічну систему, яка представляє собою структуровану кількісну систему оцінки для опису й класифікації найбільш хірургічно значущих анатомічних особливостей солідних пухлин нирок, розроблено американськими науковцями [12]. Альтернативна система називається R.E.N.A.L. nephrometry score, вона побудована на основі 5 найбільш вагомих ознак, які характеризують пухлину нирки, що може підлягти резекції.
Кожну особливість пухлини позначено літерою англійського алфавіту, що й утворює акронім R.E.N.A.L.: R — радіус (максимальний діаметр пухлини); Е — екзофітні/ендофітні властивості пухлини; N — близькість (відстань найближчого краю пухлини до порожнистої системи нирки чи миски; А — розміщення (передня (А) чи задня (Р) поверхня); L — локалізація (відносно полярних ліній). 4 з 5 компонентів (R.E.N.А.L.) оцінюють за шкалою від 1 до 3 балів. П’ятий фактор (A) є суфіксом, який описує, яка маса пухлини в основному розташована на передній (А) або задній (P) поверхні щодо фронтальної площини нирки. Суфікс «X» присвоюють, якщо зв’язок пухлини з передньою чи задньою поверхнею визначити неможливо. Додатковий суфікс «Н» використовують для позначення розміщення пухлини у воротах нирки.
Основною ознакою пухлини нирки, згідно з якою більшість клініцистів визначають складність для резекції, є розмір пухлини. Це найбільш вагома характеристика рентгенологічного обстеження, яка є мінливою в кожному випадку. У рамках системи R.E.N.A.L. радіус (R) вимірюють як максимальний діаметр (см) пухлини в будь-якій площині. Відповідно до класифікації TNM 2002 р. та згідно з цією системою оцінки 1 бал присвоювали пухлині діаметром ≤4 см, 2 бали — >4 см, але <7 см, а 3 бали — пухлині діаметром ≥7 см. Важливо підкреслити, що найбільший діаметр пухлини не може бути визначений тільки на аксіальних зрізах, коронарні та сагітальні зрізи також слід оцінювати при визначенні цієї ознаки.
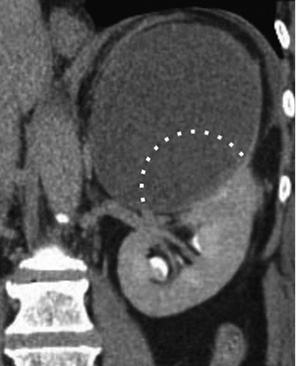
Друга змінна, яка визначає резектабельність пухлини, є її екзофітні чи ендофітні властивості. При більш екзофітній пухлині, як правило, легше виконувати резекцію з або без ішемії нирки. Для кількісної характеристики цієї змінної в системі R.E.N.A.L. пухлині, яка має на 50% або більше екзофітний характер росту, присвоюють 1 бал, пухлині, яка менш ніж на 50% характеризується екзофітним ростом, — 2 бали, а повністю ендофітній (оточеній на 360° нирковою паренхімою) — 3 бали. Важливо відзначити, що в більшості випадків пухлини мають сферичну форму і розташовані симетрично в нирках, однак трапляються й несферично і/або асиметрично розміщені. Якщо пухлина нирки спотворює нормальний контур коркового шару, для ідеальної кількісної оцінки цієї змінної та визначення відсотка екзофітності, необхідно порівняти відстань від удаваного краю нормальної ниркової поверхні до найбільш ендофітного краю пухлини, тобто відстань до найбільш екзофітного компонента (рис. 3).
Третьою змінною пухлини нирки, яку часто якісно описують, є близькість до миски чи порожнистої системи нирки. У рамках системи R.E.N.A.L., насправді, це найглибша частина пухлини, яка має значення при оцінці резектабельності і необхідності складної реконструкції порожнистої системи. Для кількісної оцінки цієї особливості, пухлини на 7 мм або більше від найближчої частини миски чи порожнистої системи нирки отримують 1 бал, ті, які знаходяться на відстані від 4 до 7 мм, — 2 бали, пухлини, які вростають або розташовані в межах 4 мм і менше від порожнистої системи чи миски нирки, — 3 бали. Значення 4 і 7 мм використані для простоти розрахунків, схожі на оцінку (R) розміру пухлини.
Переднє або заднє розташування пухлини нирки — четверта ознака хірургічної змінної. Це особливо важливо при виборі хірургічного доступу до нирки при відкритій операції (люмботомічний, трансабдомінальний серединний, підреберний, торакоабдомінальний), лапароскопічній чи роботизованій (трансперитонеальний, заочеревинний) або черезшкірній абляції.
Ця змінна, можливо, менш важлива в кількісному вигляді як частина R.E.N.A.L. score, переднє/заднє розташування пухлини позначають за допомогою нечислових суфіксів, які описують, чи пухлина лежить, у першу чергу, на передній чи задній поверхні нирки відносно фронтальної її площини. Цю ознаку найкраще оцінювати на аксіальних зображеннях за допомогою умовно намальованої лінії, проведеної паралельно до напрямку внутрішньониркових структур, які ділять навпіл ниркову паренхіму (рис. 4).
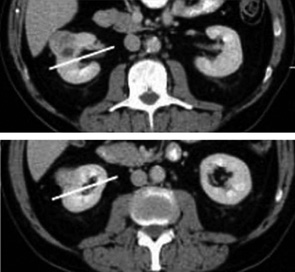
Коли пухлина утворюється в нирці таким чином, що переднє або заднє її розташування визначати неможливо, їй присвоюють суфікс «Х». Важливо зазначити, що А/Р суфікс використовують в кінці нефрометричної суми (тобто 9А — пухлина з сумою балів 9 на передній поверхні).
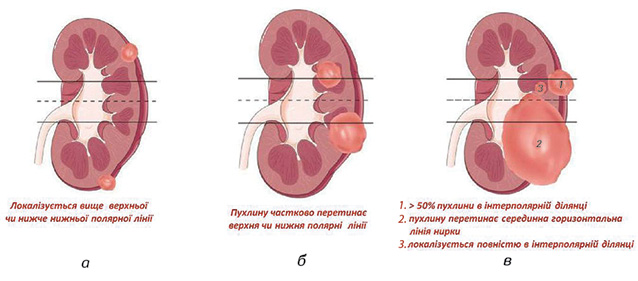
Останньою особливістю є визначення розміщення пухлини відносно хірургічної анатомії нирки (верхній, середній чи нижній сегмент). У цій системі оцінюють відношення пухлини до полярних ліній. Полярні лінії нирки проходять по краях медіальної губи, де паренхіма нирки продовжується у нирковий жир синусів, судин чи порожнистої системи. Найкраще полярні лінії видно у фронтальній площині (рис. 5).
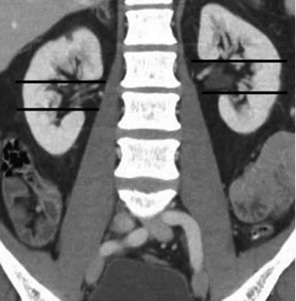
Пухлині, яка розташована повністю над верхньою полярною лінією або нижче нижньої полярної лінії, присвоюють 1 бал (рис. 6а), якщо полярна лінія частково перетинає пухлину, то 2 бали (рис. 6б). Пухлина, яка більше ніж на 50% свого діаметру знаходиться в інтраполярній ділянці або повністю там розміщена, одержує 3 бали (рис. 6в).
Зведену систему оцінки R.E.N.A.L. nephrometry score подано в таблиці.
Таблиця. Зведена система оцінки R.E.N.A.L. nephrometry score
| Показник | Кількість балів | ||
| 1 | 2 | 3 | |
| Радіус (максимальний діаметр), см | ≤4 | >4, але <7 | ≥7 |
| Екзофітний/ендофітний характер росту, % | ≥50 | ≤50 | – |
| Відстань до миски чи порожнистої системи нирки, мм | ≥7 | >4, але <7 | ≤4 |
| Локалізація на передній чи задній поверхні нирки | Бал не дається, додається тільки суфікс «А», «Р» чи «Х» | ||
| Локалізація відносно полярних ліній(якщо пухлина має зв’язок з основною нирковою артерією або веною, додають суфікс «Н» (Нilar)) | Локалізується вище верхньої чи нижче нижньої полярної лінії | Пухлину частково перетинає верхня чи нижня полярна лінія | >50% пухлини в інтерполярній ділянці, чи пухлину перетинає серединна горизонтальна лінія нирки, чи пухлина локалізується повністю в інтерполярній ділянці |
Стосовно розташування пухлини у воротах нирки, що має важливе значення в якості частини системи оцінки нефрометрії, тільки при пухлинах, які стосуються основної ниркової артерії або вени, додають суфікс «Н» (Нilar) для (L) компонента.
Пухлини, які отримали суму згідно з системою R.E.N.A.L. 4–6 балів, належать до низького ступеня, 7–9 — середнього і 10–12 — високого ступеня складності виконання резекції нирки, відповідно, з додаванням суфіксів щодо розміщення відносно поверхні та воріт нирки.
Наприклад, якщо має місце пухлина розміром до 4 см, більше ніж на 50% екзофітного характеру росту, по латеральному краю (відстань до порожнистої системи більше 7 мм), на передній поверхні, у верхньому сегменті нирки, тоді кінцевий результат буде мати такий вигляд (1+1+1+А+1=4А).
Якщо провести порівняльний аналіз, система PADUA оцінює зв’язок пухлини з нирковою мискою та порожнистою системою нирки як два незалежні фактори. Проростання в порожнисту систему нирки може передбачати проведення спеціальної реконструкції. Близькість до миски нирки зазвичай пов’язана з підвищеним ризиком перев’язки основних судин нирки та більшим травмуванням нирки. Система R.E.N.A.L. передбачає визначення відстані до порожнистої системи нирки чи ниркової миски як одного фактора. У зв’язку з цим дана система приділяє менше значення близькості пухлини до структур нирки в загальному заліку. Наприклад, значення близькості пухлини від 4 до 7 мм призначені для зручності оцінки (вони відображають критерії TNM), а не для доведення, що ці відстані можуть вплинути на успіх резекції нирки. В обох системах не враховується специфічне розміщення пухлини, яке безпосередньо може вплинути на ефективність резекції.
Однією з найважливіших особливостей пухлини нирки є медіальне/латеральне розташування. Ця ознака може тільки диктувати можливості виконання резекції нирки, тому що медіально розміщені пухлини можуть бути дуже складними для резекції. Переднє/заднє розміщення пухлини також може обмежити показання до резекції, особливо лапароскопічної. Необхідно проводити подальші дослідження, щоб показати, наскільки оцінка пухлини цими системами корелює з успіхом виконання резекції нирки.
Ще одна відмінність між системами R.E.N.A.L. і PADUA полягає у визначенні інтерполярної ділянки. У системі R.E.N.A.L. міжполюсна ділянка обмежена кортикальним шаром на медіальній поверхні нирки. Нирковий синус може поширюватися вгору на 1–2 см від цього рівня. Система PADUA визначає міжполюсну ділянку між лініями, що проходять по верхньому і нижньому краю порожнистої системи нирки. Ця відмінність важлива у хірургічному плані, оскільки анатомічна відстань 1–2 см від воріт нирки може змінити хід операції, перетворивши її з резекції нирки на радикальну нефректомію. Пухлини, які знаходяться в міжполюсній ділянці, згідно з системою R.E.N.A.L, мають менші шанси резекції.
Усі системи оцінки мають переваги щодо систематичної характеристики особливостей пухлини. Система R.E.N.A.L. превалює над PADUA з точки зору кінцевої оцінки. Оцінка згідно з R.E.N.A.L. дає детальний аналіз різних особливостей пухлини. Оцінка відповідно до системи PADUA є сумою балів, а не окремим детальним описом. У цьому відношенні вона не подає оптимальної інформації, яка підлягає аналізу [11].
На жаль, не існує єдиного визначення важливих анатомічних особливостей. Наприклад, центрально розміщена пухлина визначалася як повністю оточена нормальною нирковою паренхімою [24], принаймні на 60% ендофітна [25], що поширювалася в нирковий синус [26], розташована менш ніж на 5 мм від порожнистої системи або пов’язана з нею чи мискою нирки. Із цього приводу були розроблені дві нові системи оцінки, які забезпечили кількісний опис центральної пухлини на основі двовимірного поперечного перерізу КТ-зображень.
Система оцінки пухлини C-index зареєстрована у 2010 р. M.N. Simmons та співавторами [27]. C-index забезпечує оцінку, яка базується на визначенні діаметра пухлини і відстані від її краю до ниркового центру. Методика розрахунку C-індексу дозволяє застосування стандартної 2D КТ в поперечних зрізах і може бути обчислена швидко з використанням стандартного програмного забезпечення баз даних з автоматизованими розрахунками [11].
Вимірювання C-індексу починається з визначення розмірів нирки в поперечному та поздовжньому напрямку. Вираховують середину нирки. Наступним кроком є визначення розміру пухлини по її найбільшому діаметру та її центру. Потім визначають відстань від центра пухлини до центра нирки (показник «с») згідно з лініями, проведеними перпендикулярно одна до одної, використавши теорему Піфагора. Нарешті, відстань «с» ділять на радіус пухлини і таким чином вираховують C-індекс (рис. 7).
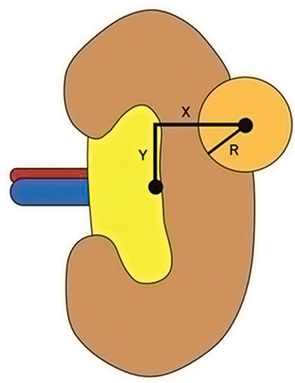
Методологія математичного обчислення C-індексу дозволяє визначити властивості розміщення пухлини. Якщо C-індекс =0, тоді пухлина розміщена безпосередньо в центрі нирки. Якщо C-індекс =1, то пухлина своїм краєм прилягає до його центра. Пухлини, в яких С-індекс >1, розміщені подалі від центра нирки.
Показник C-індексу залежить від діаметра пухлини і її відстані від центра нирки. На прикладі, розглянувши 2 пухлини з найбільшим діаметром 2 і 4 см, край яких знаходиться якраз на відстані 2 см від центра нирки, можна було б очікувати, що при видаленні більшої пухлини існує вищий ризик для пацієнта, ніж меншої пухлини, отже значення С-індексу більш низьке. Це пояснюється математично: С-індекс пухлини діаметром 2 см дорівнює 3 (с=3 см, радіус =1 см), C-індекс пухлини діаметром 4 см дорівнює 2 (с=4 см, радіус =2 см).
C-індекс корелює з частотою післяопераційних ускладнень резекції нирки, що підтверджено у багатофакторному аналізі [20]. Також він може поліпшити функціональні результати, оскільки показано, що на зниження показника швидкості клубочкової фільтрації після лапароскопічної резекції нирки впливали діаметр пухлини та С-індекс. При подальшому аналізі тільки С-індекс, а не розміри пухлини, передбачав зниження функції нирки. Так, при показнику С-індексу ≤2,5 підвищувався ризик розвитку функціональних порушень у 2,2 раза — більше ніж на 30%.
Важко безпосередньо порівнювати C-index з іншими системами оцінки, оскільки вони принципово відрізняються. C-index показує єдиний бал, що базується виключно на розмірах пухлини та глибині її інвазії в нирку. Система C-index не передбачає опису просторових даних про місцезнаходження пухлини, а отже, обмежена щодо порівняння з нефрометричними системами. Основною метою C-index є надання інформації про близькість пухлини до центра нирки.
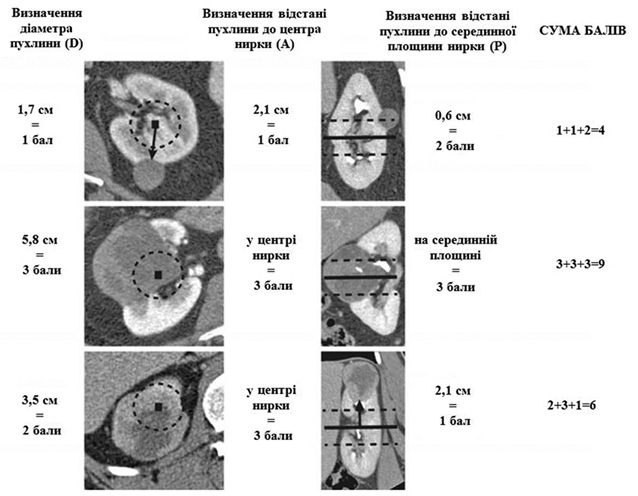
Ще однією системою оцінки, запропонованою M.N. Simmons та співавторами у 2012 р., є Diameter-Axial-Polar Nephrometry [28].
Методологією D-A-P nephrometry є те, що всі вимірювання проводять вручну на аксіальних зрізах контрастної КТ. Виконують 4 кроки:
- вимірюють розміри пухлини за її найбільшим діаметром. Пухлині розміром < 2,4 см присвоюють 1 бал; 2,4 — 4,4 см — 2 бали і >4,4 см — 3 бали;
- вимірюють відстань від центра нирки до найближчого краю пухлини. Якщо відстань становить >1,5 см, присвоюють 1 бал, <1,5 см — 2 бали і 3 бали — якщо пухлина перекриває центральну частину. Якщо відстань від краю пухлини до центральної точки в межах від 0 до 2 мм, то таку пухлину вважають центрально розміщеною (3 бали);
- вимірюють серединну площину шляхом визначення довжини нирки від верхнього до нижнього краю. Сума, розділена надвоє, і є серединна лінія. Якщо пухлина розташована далі ніж на 2 см від цієї лінії, присвоювали 1 бал, менше 2 см — 2 бали та 3 бали — коли лінія проходить через пухлину;
- остаточний результат D-A-P розраховують шляхом додавання балів за діаметр, відношення до осі нирки та серединну площину (рис. 8).
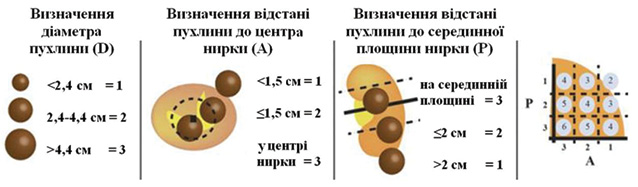
Наприклад, пухлина 1 (axial) + 1 (polar) локалізується подалі від аксіальної лінії нирки та центральної площини, тобто це поверхнева пухлина, яка розміщена на полюсі нирки; пухлина 3 (axial) + 3 (polar) локалізується на аксіальній лінії та центральній площині нирки, тобто центрально розміщена пухлина; пухлина 3 (axial) + 1 (polar) локалізується на аксіальній лінії нирки, але подалі від центральної площини, тобто пухлина на аксіальній лінії в полюсі нирки. Приклад визначення особливостей розташування пухлин згідно з системою D-A-P nephrometry подано на рис. 9.
У дослідженні достовірно показано кореляційну залежність між збереженням ниркової паренхіми після резекції, часом ішемії нирки, об’ємом крововтрати під час резекції нирки та всіма трьома параметрами оцінки системи D-A-P (p<0,001), тому вона являє собою крок вперед у розвитку оптимізованої системи нефрометрії. У порівнянні з R.E.N.A.L. і C-index, методика D-A-P є більш простою і менш мінливою. Формат D-A-P-оцінки легше інтерпретувати та інтуїтивно зрозуміти.
Висновок
Хірурги в своєму арсеналі мають різні способи резекції нирки, що базуються на їх власному досвіді та знаннях, однак результати та частота ускладнень можуть змінюватися. Додавання до обчислення середніх показників нефрометрії для конкретної когорти хворих дозволить порівняти дані, отримані в різних дослідників. Оцінка нефрометричних показників може поліпшити результати резекції нирки шляхом передбачення ризику виникнення ускладнень, оцінки функціональних та онкологічних результатів завдяки тому, що вони поєднують декілька характеристик пухлини в одному аналізі. Немає досліджень, які б аналізували залежність онкологічних результатів від вихідних нефрометричних показників. TNM-класифікація є основою для прогнозування результатів лікування, але не виключено, що нефрометричні індекси могли б давати додаткову інформацію. У зв’язку з цим системи оцінки були б корисними для субстадіювання, що підвищить достовірність класифікації TNM. Також використання нефрометричних показників сприятиме академічній звітності, оскільки це дозволить порівнювати більш подібні групи. Потрібно проводити як ретроспективні, так і проспективні дослідження, з метою оцінки цих можливостей [11].
Таким чином, дослідження, в яких використовували системи нефрометричної оцінки, показали їх доцільність, що дозволяє об’єктивно прогнозувати ризик виникнення ускладнень резекції нирки. Ця оцінка надає важливу інформацію для планування лікування, консультування пацієнтів та належного порівняння груп після резекції нирки. Однак анатомічна оцінка має завжди розглядатися разом із клінічними даними, особливостями пацієнта та досвідом хірурга, щоб вибрати найкращий варіант лікування для кожного окремого пацієнта [6, 29].
Список використаної літератури
1. Chapin B.F., Wood C.G. (2011) The RENAL Nephrometry Nomogram: Statistically Significant, But Is It Clinically Relevant? Eur. Urol., 60: 249–252.
2. Patard J.-J. (2009) Toward Standardized Anatomical Classifications of Small Renal Tumors. Eur. Urol., 56: 794–795.
3. Ljungberg B., Cowan N.C., Hanbury D.C. et al. (2013) EAU guidelines on renal cell carcinoma: the update.
4. Campbell S.C., Novick A.C., Belldegrun A. et al. (2009) Guideline for management of the clinical T1 renal mass. J. Urol., 182: 1271–1291.
5. van Poppel H., Da Pozzo L., Albrecht W. et al. (2011) A prospective randomized EORTC intergroup phase 3 study comparing the oncologic outcome of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur. Urol., 59: 543–552.
6. Volpe A., Terrone C. (2011) Anatomic classification systems of renal tumors: new, useful tools in renal surgical oncology. Eur. Urol., 60: 731–733.
7. Huang W.C., Levey A.S., Serio A.M. et al. (2006) Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study. Lancet Oncol., 7: 735–740.
8. Clark A.T., Breau R.H., Morash C. et al. (2008) Preservation of renal function following partial or radical nephrectomy using 24-h creatinine clearance. Eur. Urol., 54: 143–149.
9. Zini L., Patard J.J., Capitanio U. et al. (2009) Cancer-specific and non-cancer-related mortality rates in European patients with T1a and T1b renal cell carcinoma. BJU Int., 103: 894–898.
10. Thompson R.H., Boorjian S.A., Lohse C.M. et al. (2008) Radical nephrectomy for pT1a renal masses may be associated with decreased overall survival compared with partial nephrectomy. J. Urol., 179: 468–471.
11. Simmons M.N. (2011) Morphometric characterization of kidney tumors. Curr. Opin. Urol., 21: 99–103.
12. Kutikov A., Uzzo R.G. (2009) The R.E.N.A.L. nephrometry score: a comprehensive standardized system for quantitating renal tumor size, location and depth. J. Urol., 182: 844–853.
13. Lifshitz D.A., Shikanov S., Jeldres C. et al. (2009) Laparoscopic partial nephrectomy: predictors of prolonged warm ischemia. J. Urol., 182: 860–865.
14. Porpiglia F., Volpe A., Billia M. et al. (2008) Assessment of risk factors for complications of laparoscopic partial nephrectomy. Eur. Urol., 53: 590–596.
15. Bruner B., Breau R.H., Lohse C.M. et al. (2011) Renal nephrometry score is associated with urine leak after partial nephrectomy. BJU Int., 108: 67.
16. Canter D., Kutikov A., Manley B. et al. (2011) Utility of the R.E.N.A.L. nephrometry scoring system in objectifying treatment decision-making of the enhancing renal mass. Urology, 78: 1089.
17. Simhan J., Smaldone M.C., Tsai K.J. et al. (2011) Objective measures of renal mass anatomic complexity predict rates of major complications following partial nephrectomy. Eur Urol., 60: 724.
18. Kutikov A., Smaldone M.C., Egleston B.L. et al. (2011) Anatomic features of enhancing renal masses predict malignant and high-grade pathology: a preoperative nomogram using the RENAL Nephrometry score. Eur. Urol., 60: 241.
19. Hew M.N., Baseskioglu B., Barwari K. et al. (2011) Critical appraisal of the PADUA classification and assessment of the R.E.N.A.L. nephrometry score in patients undergoing partial nephrectomy. J. Urol., 186: 42.
20. Samplaski M.K., Hernandez A., Gill I.S. et al. (2010) C-index is associated with functional outcomes after laparoscopic partial nephrectomy. J. Urol., 184: 2259.
21. Hayn M.H., Schwaab T., Underwood W. et al. (2011) RENAL nephrometry score predicts surgical outcomes of laparoscopic partial nephrectomy. BJU Int., 108: 876.
22. Cha E.K., Ng C.K., Jeun B. et al. (2011) Preoperative radiographic parameters predict long-term renal impairment following partial nephrectomy. World J. Urol., 1(4): 817–822.
23. Ficarra V., Novara G., Secco S. et al. (2009) Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery. Eur. Urol., 56: 786–793.
24. Black P., Filipas D., Fichtner J. et al. (2000) Nephron sparing surgery for central renal tumors: experience with 33 cases. J. Urol., 163: 737–743.
25. Finley D.S., Lee D.I., Eichel L. et al. (2005) Fibrin glue-oxidized cellulose sandwich for laparoscopic wedge resection of small renal lesions. J. Urol., 173: 1477–1481.
26. Hafez K.S., Novick A.C., Butler B.P. (1998) Management of small solitary unilateral renal cell carcinomas: impact of central versus peripheral tumor location. J. Urol., 159: 1156–1160.
27. Simmons M.N., Ching C.B., Samplaski M.K. et al. (2010) Kidney tumor location measurement using the C-index method. J. Urol., 183: 1708–1713.
28. Simmons M.N., Hillyer S.P., Lee B.H. et al. (2012) Diameter-Axial-Polar Nephrometry: Integration and оptimization of R.E.N.A.L. and Сentrality Index Scoring Systems. J. Urol., 199: 384–390.
29. Simhan J., Smaldone M.C., Tsai K.J. et al. (2011) Objective measures of renal mass anatomic complexity predict rates of major complications following partial nephrectomy. Eur. Urol., 60: 724–730.
Современные системы оценки опухолевого поражения почки (обзор литературы)
Резюме. Оценка опухоли почки лучевыми методами диагностики — сложный и многофакторный процесс. Новые нефрометрические системы оценки, разработанные за последнее время (PADUA, R.E.N.A.L., C-index и D-A-P nephrometry), позволяют получить систематическую и количественную оценку опухолевого поражения почки и преследуют две основные цели: первичную — методологический анализ локализации опухоли и стандартизацию отчетности данных; вторичную — которая предусматривает определение успеха резекции почки, риска возникновения послеоперационных осложнений, а также функциональные и онкологические результаты. На основании обзора литературы в статье представлена сравнительная характеристика опухоли различными системами оценки, их преимущества и недостатки.
почечно-клеточный рак, нефрометрические системы оценки опухоли, резекция почки.














Leave a comment