Прогностические факторы возникновения микрометастазов меланомы кожи в сторожевых лимфатических узлах
Кукушкина М.Н., Коровин С.И., Солодянникова О.И., Сукач Г.Г., Паливец А.Ю., Потороча А.Н. , Остафийчук В.В.
Резюме. На протяжении многих лет ведется поиск демографических, клинических и гистологических факторов, имеющих значение для прогнозирования развития микрометастазов меланомы кожи в сторожевых лимфатических узлах (СЛУ). Наиболее значимыми из них являются толщина опухоли по Breslow >1,0 мм, уровень инвазии по Clark IV-V, изъязвление первичной опухоли. Кроме этого, в некоторых исследованиях показано, что митотический индекс >0, отсутствие опухоль-инфильтрирующих лимфоцитов, мужской пол, регрессия первичной опухоли также повышают риск возникновения метастазов в СЛУ. На примере 156 больных меланомой кожи, находившихся на лечении в Национальном институте рака, изучены прогностические факторы, влияющие на частоту развития микрометастазов в СЛУ. Такие факторы, как локализация первичной опухоли в области туловища и толщина первичной опухоли по Breslow >4 мм, оказались статистически значимыми. Оптимальным пороговым значением толщины опухоли по Breslow для выделения больных с прогнозом метастазирования в СЛУ является 2,5 мм. Для него характерны максимальные уровни чувствительности (86,2%) и специфичности (68,5%). Более молодой возраст больных также ассоциируется с повышением частоты возникновения метастазов в СЛУ, однако этот показатель не является статистически значимым.
Введение
В настоящее время биопсия сторожевых лимфатических узлов (СЛУ) является стандартной диагностической процедурой при меланоме кожи. Наличие или отсутствие микрометастазов в СЛУ — достоверный прогностический фактор: общая 5-летняя выживаемость больных с микрометастазами составляет 64–67%, а без метастатического поражения — 86–92% [1].
Показаниями для выполнения биопсии СЛУ в большинстве клиник мира являются локализованная меланома кожи с толщиной опухоли по Breslow 1,0 мм и более и/или с уровнем инвазии по Clark IV–V, и/или с изъязвлением первичной опухоли при отсутствии клинических признаков поражения регионарных лимфатических узлов. При этом микрометастазы в СЛУ выявляют у 13–30% больных [5, 12].
На протяжении многих лет ведется поиск демографических, клинических и гистологических факторов, имеющих значение для прогнозирования возникновения микрометастазов в СЛУ. Это позволит более точно прогнозировать исход заболевания и в перспективе индивидуализировать лечебную тактику каждого больного.
Практически во всех исследованиях, посвященных изучению прогностических факторов при меланоме кожи, показано, что с увеличением толщины опухоли по Breslow повышается вероятность поражения СЛУ (табл. 1). Следует отметить, что, по литературным данным, при «тонких» меланомах чаще выявляют клинически определяемые метастазы в регионарных лимфатических узлах в отсроченный период, чем микрометастазы при выполнении биопсии СЛУ. Так, при толщине опухоли <0,75 мм эти значения составляют 2,3 и 0,94% соответственно, а при толщине 0,75-1,00 мм – 8,6 и 5,5% [6].
Таблица 1. Частота выявления микрометастазов в СЛУ в зависимости от толщины первичной опухоли
| Толщина первичной опухоли по Breslow, мм | Частота выявления микрометастазов в СЛУ, % |
|---|---|
| <1,0 | 0,9–5,5 |
| 1,01—2,0 | 12–19,7 |
| 2,01—4,0 | 28–33,2 |
| >4,01 | 28–44 |
Вторым по значимости прогностическим фактором является изъязвление первичной опухоли. В частности, у больных с изъязвлением меланомы кожи микрометастазы в СЛУ выявляют в 30–35% случаев [4, 9].
Уровень инвазии по Clark на протяжении многих лет рассматривали как независимый прогностический фактор. В ряде исследований показано, что среди пациентов с уровнем инвазии по Clark IV–V поражение СЛУ имеет место в 20–25% случаев.
Интересно, что увеличение возраста пациентов ассоциируется со снижением частоты поражения регионарных лимфатических узлов: среди больных старше 50 лет частота развития метастазов в регионарных лимфатических узлах, в том числе сторожевых, достоверно снижается, по сравнению с пациентами молодого возраста. При этом повышается риск возникновения отдаленных метастазов и снижается общая выживаемость [3, 11].
Кроме того, в некоторых публикациях показано, что митотический индекс >0, отсутствие опухоль-инфильтрирующих лимфоцитов, мужской пол, регрессия первичной опухоли также повышают риск развития метастазов в СЛУ [7, 13–15].
Однако данные этих исследований зачастую противоречивы. К примеру, S.C. Paek, изучив данные 910 больных, подвергшихся биопсии СЛУ, считает, что прогностическое значение имеют толщина опухоли по Breslow, молодой возраст, ангиолимфатическая инвазия, митотический индекс и локализация опухоли в области туловища и нижних конечностей [10]. В то же время L.L. Kruper, основываясь на данных исследования 628 пациентов, отмечает прогностическое значение только толщины опухоли по Breslow, опухоль-инфильтрирующих лимфоцитов и митотического индекса [8].
Многочисленные исследования в этом направлении не привели к изменению показаний к биопсии СЛУ. По мнению A. Cadili и K. Dabbs, это связано с их противоречивыми результатами, обусловленными отсутствием стандартизированного гистологического исследования СЛУ, что приводит к вариабельности измерений и техники рапортирования в различных клиниках. В частности, измерение толщины опухоли по Breslow является наиболее объективной и с наивысшей точностью выполнимой процедурой по сравнению с другими, поэтому данный показатель отнесен к прогностическим факторам практически во всех исследованиях. В связи с этим авторы считают необходимым изучение относительных прогностических факторов в каждой клинике, в которой биопсия СЛУ является рутинной процедурой [2].
Цель исследования — изучить прогностические факторы, влияющие на частоту развития микрометастазов в СЛУ, на примере 156 больных, находившихся на лечении в отделении опухолей кожи и мягких тканей Национального института рака, которым выполняли биопсию СЛУ.
Материалы и методы
В исследование включено 156 больных с клиническими признаками меланомы кожи либо после предшествующей биопсии опухоли, локализующейся в области туловища и конечностей, при отсутствии клинических признаков поражения регионарных лимфатических узлов и клинико-рентгенологических данных о генерализации процесса. Больные разделены на 2 группы: с микрометастазами в СЛУ (СЛУ+) и без них (СЛУ−). Нами изучены такие характеристики, как пол, возраст, локализация первичной опухоли и СЛУ, толщина опухоли по Breslow, наличие изъязвления.
Техника выполнения биопсии СЛУ
Для выявления СЛУ использован метод радионуклидной детекции.
Накануне операции (за 24 ч) выполняли лимфосцинтиграфию для идентификации регионарного лимфоколлектора и приблизительного местонахождения СЛУ в нем. В качестве лимфотропного радиофармпрепарата использовали коллоиды «Nanocis» или «Nanocoll», меченные радиоактивным 99mТс активностью 75–100 МБк, которые вводили вокруг первичной опухоли или послебиопсийного рубца в 3–4 точки интрадермально. Лимфосцинтиграфию проводили непосредственно после введения изотопа и через 2 ч на гамма-камере либо однофотонном эмиссионном компьютерном гамма-томографе. Динамическая лимфосцинтиграфия помогала определить лимфатические узлы, в которые проходит непосредственный дренаж лимфы от первичной опухоли, а также выявить случаи, когда лимфоотток осуществляется в несколько лимфоколлекторов. Расположение СЛУ отмечали на коже пациента маркером. Следует заметить, что вследствие релаксации и изменения положения больного во время операции маркировка не всегда совпадала с местонахождением СЛУ. Поэтому непосредственно перед операцией еще раз уточняли локализацию СЛУ с помощью портативного гамма-счетчика.
На следующий день во время операции сначала выполняли широкое иссечение первичной опухоли либо послебиопсийного рубца, а затем удаляли СЛУ. Поиск СЛУ во время операции проводили с помощью портативного гамма-счетчика «EuroProbe». После разреза кожи портативным гамма-счетчиком определяли лимфатический узел с высоким накоплением радионуклида и удаляли его. При идентификации СЛУ мы ориентировались на интенсивность накопления радиофармпрепарата, которая в СЛУ должна превышать таковую в соседних не СЛУ in vivo в 3 раза, а ex vivo — в 10 раз. После удаления СЛУ рану обязательно еще раз исследовали гамма-счетчиком.
Срезы удаленных СЛУ, выполненные с шагом в 2 мм, изучали после окраски гематоксилином-эозином; иммуногистохимическое исследование не проводили.
Статистическая обработка данных
Использован двусторонний t-тест для непрерывных переменных и χ2-тесты для категориальных переменных. Применена описательная статистика (среднее, стандартное отклонение, медиана) для всех переменных. Различия оценивали как статистически значимые при р<0,05.
Результаты
Лимфосцинтиграфия была успешна у 156 (96,3%) из 162 пациентов. У 6 больных не удалось выявить СЛУ, что, на наш взгляд, произошло по следующим причинам. У 2 больных имело место выраженное воспаление вокруг первичной опухоли, у 3 — меланома располагалась близко к зоне регионарного лимфоколлектора (подмышечная и паховая области), в 1 случае — причина неудачи не определена.
При проведении лимфосцинтиграфии у 156 больных у 95 (60,9%) выявлен 1 СЛУ, 57 (36,5%) пациентов — 2 СЛУ и 4 (2,6%) — 3 СЛУ. В среднем у 1 больного определяли 1,4 СЛУ.
Микрометастазы в СЛУ выявлены у 29 больных, что составило 18,6%. Среди 156 больных с верифицированной меланомой кожи у 24 (15,4%) пациентов установлена ІА стадия заболевания. Распределение больных по стадиям представлено в табл. 2.
Таблица 2. Распределение больных по стадиям
| Стадия | Количество больных | ||
|---|---|---|---|
| n | % | В группах, n | |
| ІА (T1aN0M0) | 24 | 15,4 | 127 (СЛУ-) |
| ІВ (T1b–2aN0M0) | 38 | 24,4 | |
| ІІА (T2b–3aN0M0) | 28 | 17,9 | |
| ІІВ (T3b–4aN0M0) | 29 | 18,6 | |
| ІІС (T4bN0M0) | 8 | 5,1 | |
| ІІІА (T1a–4aN1a–2aM0) | 16 | 10,3 | 29 (СЛУ+) |
| ІІІВ (T1b–4bN1a–2aM0) | 13 | 8,3 | |
| Всего | 156 | 100 | 156 |
При изучении влияния пола на частоту возникновения микрометастазов в СЛУ отмечено примерно одинаковое соотношение мужчин и женщин в обеих группах с незначительным преобладанием женщин. Средний возраст больных с метастазами в СЛУ был несколько ниже среднего возраста в группе с отрицательными лимфатическими узлами, однако эти различия не были статистически значимыми (табл. 3).
Таблица 3. Влияние пола и возраста на частоту возникновения метастазов в СЛУ
| Характеристика | СЛУ− (127) | СЛУ+ (29) | Всего (156) | р |
|---|---|---|---|---|
| Пол | χ2=0,002 р=0,965 |
|||
| Мужчины | 52 (40,9%) | 12 (41,4%) | 64 (41,0%) | |
| Женщины | 75 (59,1%) | 17 (58,6%) | 92 (59,0%) | |
| Средний возраст | ||||
| Мужчины (x±σ) | 53,9±3,0 | 52,6±14,3 | 53,7±13,2 | 0,74 |
| Женщины (x±σ) | 48,5±4,1 | 43,2±15,7 | 47,5±5,8 | 0,18 |
При локализации меланомы кожи на туловище отмечено статистически значимое повышение частоты поражения СЛУ, при локализации в области конечностей эти различия недостоверны. Также нами не констатировано влияния локализации СЛУ на частоту их поражения. В обеих группах в ⅔ случаев СЛУ локализовались в подмышечных областях. Не отмечено и влияния количества выявленных узлов на частоту их поражения (табл. 4).
Таблица 4. Влияние локализации первичной опухоли, местонахождения и количества СЛУ на частоту возникновения метастазов в СЛУ
| Характеристика | СЛУ− (127) | СЛУ+ (29) | Всего (156) | р |
|---|---|---|---|---|
| Локализация первичной опухоли | ||||
| Верхние конечности | 25 (19,7%) | 3 (10,3%) | 28 (18,0%) | 0,16 |
| Нижние конечности | 34 (26,8%) | 5 (17,3%) | 39 (25.0%) | 0,23 |
| Туловище | 69 (53,5%) | 21 (72,4%) | 89 (57,0%) | 0,046 |
| Локализация СЛУ | ||||
| Надключичная область | 3 (2.4%) | 0 (0,0%) | 3(1,9%) | 0,08 |
| Подмышечная область | 77 (60,6%) | 19 (65,5%) | 96 (61,5%) | 0,62 |
| Пахово-подвздошная область | 47 (37,0%) | 10 (34,5%) | 57 (36,6%) | 0,79 |
| Количество выявленных СЛУ | ||||
| 1 | 76 (59,8%) | 19 (65,5%) | 95 (60,9%) | 0,56 |
| 2 | 47 (37,0%) | 10 (34.5%) | 57 (36,5%) | 0,79 |
| 3 | 4 (3,2%) | 0 (0,0%) | 4 (2,6%) | 0,043 |
При изучении толщины первичной опухоли в исследуемых группах выявлено статистически значимое влияние данного показателя на частоту поражения СЛУ. Медиана толщины опухоли по Breslow в группе с отрицательными лимфатическими узлами составила 1,9 мм (межквартильный интервал 1,1–3,0 мм), а в группе с положительными — 3,8 мм (межквартильный интервал 3,0–6,0 мм) (рис. 1).
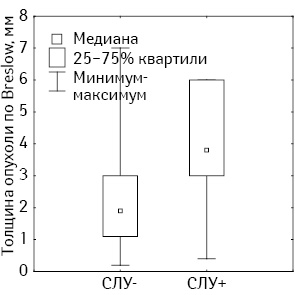
Мы разбили каждую из исследуемых групп на 4 подгруппы в зависимости от толщины опухоли и выявили статистически значимое снижение частоты поражения СЛУ при толщине4 мм эти различия становятся достоверными (табл. 5).
Таблица 5. Влияние толщины опухоли по Breslow и изъязвления на частоту возникновения метастазов в СЛУ
| Характеристика | СЛУ- (127) | СЛУ+ (29) | Всего (156) | Оценка р |
|---|---|---|---|---|
| Толщина по Breslow, мм | ||||
| < 1 | 30 (23,6%) | 1 (3,4%) | 31 (19,9%) | 0,0001 |
| 1,01—2,0 | 40 (31,5%) | 2 (6,9%) | 42 (26,9%) | 0,0001 |
| 2,01— 4,0 | 42 (33,1%) | 14 (48,3%) | 56 (35,9%) | 0,14 |
| >4,01 | 15 (11,8%) | 12 (41,4%) | 27 (17,3%) | 0,002 |
| Средняя толщина | 2,28±1,1 мм | 4,1±1,6 мм | 2,6±1,2 | <0,0001 |
| Частота изъязвления в зависимости от толщины первичной опухоли по Breslow, мм | ||||
| <1 | 4/30 (13,3%) | 0/1 (0,0%) | 4/31 (12,9%) | 0,69 |
| 1,01—2,0 | 11/40 (27,5%) | 0/2 (0,0%) | 11/42 (24,4%) | 0,39 |
| 2,01—4,0 | 22/42 (52,4%) | 7/14 (50,0%) | 29/56 (51,8%) | 0,87 |
| >4,01 | 8/15 (53,3%) | 5/12 (41.7%) | 13/2 (48,1%) | 0,55 |
| Всего | 45/127 (35,4%) | 12/29 (53,3%) | 57/156 (36,5%) | 0,54 |
Для определения порогового уровня толщины опухоли по Breslow, который позволяет прогнозировать наличие метастазов в СЛУ, нами использована методика ROC-анализа. При этом устанавливали оптимальную прогностически значимую толщину опухоли, при достижении или превышении которой формируется высокая истинно положительная оценка прогноза метастазирования (чувствительность) при минимальном уровне ложноположительного прогноза (специфичность).
Полученные результаты приведены на рис. 2. Оптимальным пороговым значением толщины опухоли по Breslow для выделения больных с прогнозируемым метастазированием в СЛУ является значение 2,5 мм. Для него характерны максимальные чувствительность (86,2%) и специфичность (68,5%). Данная модель является статистически значимой: коэффициент AUC=0,805; р=0,0005.

При исследовании количества изъязвлений в подгруппах не выявлено статистически значимого влияния на частоту развития микрометастазов в обеих группах.
Выводы
Таким образом, в нашем исследовании определено, что на частоту возникновения метастазов в СЛУ влияют такие факторы, как локализация первичной опухоли в области туловища и толщина первичной опухоли по Breslow >4 мм.
Оптимальным пороговым значением толщины опухоли по Breslow для выделения больных с прогнозируемым метастазированием в СЛУ является 2,5 мм. Для него характерны максимальные чувствительность (86,2%) и специфичность (68,5%).
Более молодой возраст больных также ассоциируется с повышением частоты возникновения микрометастазов в СЛУ, однако этот показатель не является статистически значимым.
Список использованной литературы
1. Balch C.M., Gershenwald J.E., Soong S.J. (2009) Final version of 2009 AJCC melanoma staging and classification. J. Clin. Oncol., 27: 6199–06.
2. Cadili A., Dabbs K. (2010) Predictors of sentinel lymph node metastasis in melanoma. Can. J. Surg., 53(1): 32–36.
3. Conway W.C., Faries M.B., Nicholl M.B. (2009) Age-related lymphatic dysfunction in melanoma patients. Ann. Surg. Oncol., 16 (6): 1548–52.
4. Cuéllar F.A., Vilalta A., Rull R. (2004) Small cell melanoma and ulceration as predictors of positive sentinel lymph node in malignant melanoma patients. Melanoma Res., 14(4): 277–282.
5. Ellis M.S., Weerasinghe R., Corless C. (2010) Sentinel lymph node staging of cutaneous melanoma: predictors and outcomes. Am. J. Surg., 199(5): 663–668.
6. Karakousis G.C., Gimotty P.A., Botbyl J.D. (2006) Predictors of regional nodal disease in patients with thin melanomas. Ann. Surg. Oncol., 13(4): 533–541.
7. Kaur C., Thomas R.J., Desai N. (2008) The correlation of regression in primary melanoma with sentinel lymph node status. J. Clin. Pathol., 61: 297–300.
8. Kruper L.L., Spitz F.R., Czerniecki B.J. (2006) Predicting sentinel node status in AJCC stage I/II primary cutaneous melanoma. Cancer, 107: 2436–45.
9. Mu E., Lange J.R., Strouse J.J. (2012) Comparison of the use and results of sentinel lymph node biopsy in children and young adults with melanoma. Cancer., 15(10): 2700–07.
10. Paek S.C., Griffith K.A., Johnson T.M. (2007) The impact of factors beyond Breslow depth on predicting sentinel lymph node positivity in melanoma. Cancer, 109: 100–108.
11. Page A.J., Li A., Hestley A. (2012) Increasing Age Is Associated with Worse Prognostic Factors and Increased Distant Recurrences despite Fewer Sentinel Lymph Node Positives inMelanoma. Int. J. Surg. Oncol.: 1–5.
12. Rousseau D.L., Ross M.I., Johnson M.M. (2009) Revised American Joint Committee on Cancer staging criteria accurately predict sentinel lymph node positivity in clinically node-negative melanoma patients. Ann. Surg. Oncol., 10(5): 569–574.
13. Scoggins C.S., Ross M.I., ReintgenD.S. (2006) Gender-Related Differences in Outcome for Melanoma Patients. Ann. Surg., 243(5): 693–700.
14. Sondak V.K., Taylor J.M., Sabel M.S. (2004) Mitotic rate and younger age are predictors of sentinel lymph node positivity: Lessons learned from the generation of a probabilistic model. Ann. Surg. Oncol., 11: 247–258.
15. Taylor R.C., Patel A., Panageas K.S. (2007) Tumor-infiltrating lymphocytes predict sentinel lymph node positivity in patients with cutaneous melanoma. J. Clin. Oncol., 1(7): 869–875.
Прогностичні фактори виникнення мікрометастазів меланоми шкіри в сторожових лімфатичних вузлах
Резюме. Протягом багатьох років ведеться пошук демографічних, клінічних і гістологічних факторів, які мають значення для прогнозування виникнення мікрометастазів меланоми шкіри у сторожових лімфатичних вузлах (СЛВ). Найбільш значущими з них є товщина пухлини за Breslow >1,0 мм, рівень інвазії за Clark IV–V, виразкування первинної пухлини. Крім того, у деяких дослідженнях показано, що мітотичний індекс >0, відсутність пухлиноінфільтруючих лімфоцитів, чоловіча стать, регресія первинної пухлини також підвищують ризик розвитку метастазів у СЛВ. На прикладі 156 хворих на меланому шкіри, що перебували на лікуванні в Національному інституті раку, вивчено прогностичні фактори, які впливають на частоту виникнення мікрометастазів у СЛВ. Такі фактори, як локалізація первинної пухлини в ділянці тулуба й товщина первинної пухлини за Breslow >4 мм, виявилися статистично значущими. Оптимальним пороговим значенням товщини пухлини за Breslow для виділення хворих з прогнозом метастазування в СЛУ є 2,5 мм. Для нього характерні максимальні рівні чутливості (86,2%) та специфічності (68,5%). Більш молодий вік хворих також асоціюється з підвищенням частоти виникнення метастазів у СЛВ, проте ці дані не є статистично достовірними.
Ключевые слова: меланома шкіри, сторожові лімфатичні вузли, мікрометастази, прогностичні фактори.
Prognostic factors of appearing micrometastases in sentinel lymph nodes in skin melanoma
Summary. For many years, the search of demographic, clinical and histological factors that have predictive value for the appearence melanoma micrometastases in sentinel lymph nodes (SLN) is conducted. The most significant of them are the tumor thickness by Breslow more than 1,0 mm, the level of invasion by Clark IV–V and ulceration of the primary tumor. In addition, some studies have shown that the mitotic rate >0, the absence of tumor-infiltrating lymphocytes, male sex, the regression of primary tumor also increase the risk of SLN metastasis. Prognostic factors influencing on the incidence of micrometastases in SLN are studied on the example of 156 patients with primary melanoma who were treated in National Cancer Institute. Such factors as the localization of the primary tumor on the body and tumor thickness by Breslow more than 4 mm are significant. The optimal threshold value of tumor thickness by Breslow for prediction SLN metastasis is 2,5 mm. This threshold is characterized of maximum sensitivity (86,2%) and specificity (68,5%). Younger age of patients is also associated with increased incidence of micrometastases, but these data are not statistically significant.
Key words: skin melanoma, sentinel lymph nodes, micrometastases, prognostic factors.














Leave a comment