Вміст нуклеїнових кислот у ядрах клітин нейробластом різного ступеня диференціювання
Грабовий О.М., Зарецький М.Б., Василишин О.І.
Резюме. У нейробластомах, у міру збільшення вираженості проявів дедиференціювання, відбувається зменшення середнього вмісту ДНК у пухлинних клітинах, клітинний спектр зміщується у бік клітин з низьким вмістом ДНК у ядрах, що веде до зниження рівня клітинної гетерогенності пухлин. Збільшення вмісту РНК у ядрах поліплоїдних клітин нейробластом, яке свідчить про певний ступінь збереження функціональної активності геному, може бути використано як непрямий показник життєздатності клітин та виділення їх морфофункціональних типів, певною мірою здатних до диференціювання. Виходячи з наявності прямої залежності між вмістом ДНК у ядрі клітин нейробластом та його розмірами, каріометричні показники можуть використовуватися для непрямого визначення плоїдності клітин без застосування складних методів забарвлення, що підвищить об’єктивність та достовірність оцінки пухлин у рутинній патогістологічній практиці.

Нейробластома (НБ) належить до групи ембріональних пухлин і є однією з найбільш специфічних солідних утворень дитячого віку, яке діагностують найчастіше, і становить близько 8% усіх видів раку в дітей, займаючи 6-е місце в структурі дитячої онкологічної захворюваності. У 2005 р. запропоновано Систему міжнародної класифікації НБ за групами ризику (International Neuroblastoma Risk Group Staging System — INRGSS) [3, 8]. Вона включає також й індивідуальні генетичні характеристики пухлини — ампліфікацію гена N-myc, делецію 11q, плоїдність і дозволяє виділити 4 групи ризику вже на етапі первинної діагностики: групу дуже низького ступеня ризику, низького ступеня ризику, проміжного ступеня ризику й високого ступеня ризику [6, 16]. На підставі цієї класифікації розроблено нову систему стадіювання INRG — L1, L2, M, MS (International Neuroblastoma Risk Group), у якій одними з параметрів є статус гена N-myc і плоїдність.
Статус гена N-myc є центральним стратифікаційним біологічним маркером для визначення групи ризику, незалежно від гістопатологічної будови НБ і ступеня її диференціювання [4, 5]. Ампліфікація гена N-myc чітко асоціюється зі швидким прогресуванням пухлини і поганим прогнозом у пацієнтів будь-якого віку і з будь-якою стадією захворювання [7]. Водночас прогностично сприятливі форми НБ практично у всіх випадках поліплоїдні та характеризуються відсутністю ампліфікації генів [12]. Гіперплоїдні пухлини без структурних змін хромосом легше піддаються терапії та іноді здатні до спонтанної регресії [11]. Плоїдність у якості монофактора прогнозу має обмежене значення, оскільки анеуплоїдні пухлини можуть також мати сегментарні хромосомні аберації й ампліфікацію гена N-myc, що завжди визначає несприятливий розвиток пухлинного процесу [4]. Однак численними дослідженнями доведено, що плоїдність (ДНК-індекс) є явним прогностичним маркером для дітей з НБ, особливо у віці до 2 років, які мають дисеміноване ураження [11, 16]. Значне збільшення тривалості життя відзначають у дітей з гіперплоїдними (часто триплоїдними) пухлинами порівняно з хворими з диплоїдними. Деякі автори встановили, що навіть у дітей з пухлиною, обмеженою одним регіоном, диплоїдія пов’язана з підвищеним ризиком регіонарного або віддаленого рецидиву [13, 14]. Незважаючи на те що ампліфікація гена N-myc в основному асоційована з диплоїдним вмістом ДНК, диплоїдність є прогностично значущим чинником при IV стадії захворювання без ампліфікації гена N-myc у дітей віком до 2 років.
Мета роботи — встановити зв’язок між вмістом нуклеїнових кислот (НК) у ядрі клітин та ступенем диференціювання НБ та можливість їх використання при гістологічному дослідженні для визначення приналежності пухлини до групи ризику.
Об’єкт та методи дослідження
Дослідження проведено на матеріалі біопсій або вилученому при оперативному втручанні у 39 пацієнтів з НБ: гангліоневроми (ГН) — 3; гангліонейробластоми (ГНБ) — 11, власне нейробластоми (НБ’) — 25. Гістологічне типування новоутворень проведено з використанням рутинного (забарвлення гематоксиліном й еозином) та імуногістохімічного дослідження.
Отриманий матеріал фіксували в забуференому 10% формаліні з pH 7,4 та ущільнювали в парафін із застосуванням гістіопроцесора Histos-5 («Milestone», Італія). З парафінових блоків виготовляли гістологічні зрізи товщиною 5 мкм за допомогою мікротома «Microm НМ325» («Thermo Scientific», Німеччина). Зрізи забарвлювали гематоксиліном та еозином й азур-ІІ-еозином для загальної оцінки пухлини, галоціанін-хромовим галуном за Ейнарсоном (pH 1,62; 37 °С; 24 год) — для виявлення вмісту НК у клітинах [1, 2]. Для кожного випадку частину зрізів обробляли рибонуклеазою («MACHEREY-NAGEL GmbH & Co. KG», Німеччина) для екстракції РНК [1]. Отримані препарати вивчали та фотографували за допомогою мікроскопа «Nikon Eclipse 80i» з камерою DS-5SMc/L2 за стандартизованих умов.
На отриманих зображеннях з препаратів, забарвлених галоціанін-хромовим галуном (збільшення мікроскопа х400, 1280×960 пікселів RGB), у 60 клітинах кожної пухлини за допомогою системи аналізу зображення ImageJ 1,46 визначали: площу перетину ядра клітини (Narea), питому оптичну щільність ядра клітини (NDM), інтегративну оптичну щільність ядра клітини (NIntDen), а також розраховували об’єм ядра (NV) та вміст у ньому сумарної кількості нуклеїнових кислот (NНК) і ДНК (NДНК) за формулами:
NV =¾ • Narea• √(Narea/π)(1)
NНК(NДНК)=NIntDen • ¾ • Narea • √(Narea/π)(2)
У якості вихідної точки відліку для оцінки вмісту НК у ядрах пухлинних клітин використали показники, прийняті за одиницю, притаманні ядрам лімфоцитів (2с), що знаходилися у стромі пухлин. Клітини кожної окремої пухлини ранжували за вмістом ДНК у ядрі. Отриману послідовність поділено на ранги з кроком, який дорівнював середньому вмісту ДНК у ядрах лімфоцитів: Р1 — до 1, Р2 — 1–2, Р3 — 2–3 і так далі. Клітини кожної окремої пухлини при забарвленні НК ранжовано за Narea/NV. Отриману послідовність поділено на ранги за середніми значеннями Narea/NV, встановленими для рангів за вмістом ДНК. У межах кожного рангу визначали абсолютну кількість клітин, середні значення Narea, NIntDen, NV, NДНК чи NНК. Вміст РНК у ядрах клітин обчислювали як різницю між NНК і NДНК для кожної пари рангів. Отримані цифрові дані опрацьовували стандартними статистичними методами.
Результати та їх обговорення
Проведені дослідження показали, що клітини НБ за вмістом ДНК можуть бути поділені на ранги від Р1 до Р10. Іноді в пухлинах виявляють поодинокі клітини, які за вмістом ДНК мають бути віднесені до більш високих рангів. Слід також зазначити, що в складі НБ клітини з рангом Р5 становили <5%, а для більшості середніх значень оцінюваних параметрів р>0,05, тому вони не можуть бути використані для подальшого статистичного аналізу.
Середній вміст ДНК у ядрах клітин пухлин у міру підвищення ступеня неопластичної трансформації зменшується: ГН (4,68±0,21) — ГНБ (3,07±0,02) — НБ (2,14±0,03).
НБ ранжовано за середнім вмістом ДНК у ядрах їх клітин, що дозволило поділити їх на 3 підгрупи: диплоїдні (D — середній вміст ДНК у ядрах до 1,2), проміжні між ди- та тетраплоїдними (D+ — середній вміст ДНК у ядрах від 1,2 до 2,5), тетра- та гіперплоїдні (T+ — середній вміст ДНК понад 2,5) (рис. 1). Виявилося, що серед досліджених ГН і ГНБ переважали пухлини Т+, а D в нашій вибірці були відсутні. Серед НБ’, порівняно з більш диференційованими пухлинами, реєстрували суттєве переважання пухлин D+, та на відміну від вищезазначених показників суттєву питому частку становили пухлини підгрупи D (див. рис. 1).
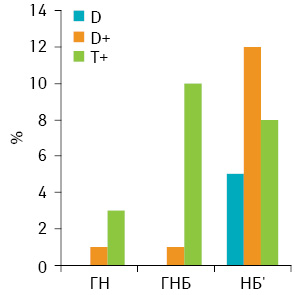
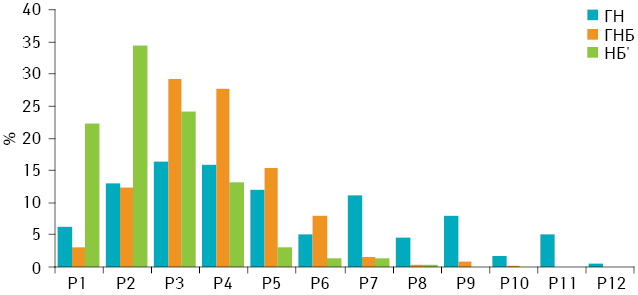
Клітинний склад (спектр) НБ, визначений за вмістом ДНК у їх клітинах, проявляє помірний ступінь залежності від ступеня диференціювання пухлин (рис. 2). У цілому в міру підвищення рівня анаплазії відбувається зміщення клітинного спектра пухлини до зменшення відносної кількості клітин зі збільшеним вмістом ДНК у ядрах. Тобто клітинна гетерогенність зменшується у низці пухлин зі зростанням ступеня їх анаплазії.
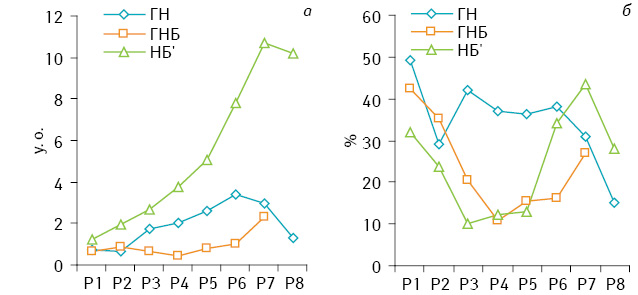
Вміст РНК у ядрах клітин НБ достовірно зменшується у міру зниження ступеня диференціювання пухлин (рис. 3). У ГН і ГНБ абсолютний вміст РНК зростає зі збільшенням кількості ДНК у ядрі. У ГН вміст РНК у діапазоні рангів Р1–Р4 (Р5) практично не змінюється, а далі проявляє тенденцію до збільшення. Відносний вміст РНК у ядрах клітин ГН після достовірного зменшення у клітинах D+ дещо зростає і залишається практично на одному рівні в клітинах Т+, незалежно від вмісту ДНК у ядрах їх клітин (див. рис. 3). У ГНБ і НБ відбувається значне зменшення вмісту РНК у ядрах пухлинних клітин у рангах Р1–Р3 (Р4), після чого спостерігається тенденція до його збільшення.
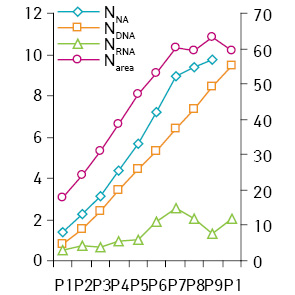
Між вмістом ДНК, НК і розмірами ядер пухлин (Narea, NV) (рис. 4) існує пряма залежність до рангу Р6 (коефіцієнт кореляції 0,96–0,98). У клітинах, які належать до більш високих рангів, ці пропорції порушуються, а кореляція стає нижчою за значення, які вказують на пряму залежність між цими показниками. Це пов’язано як із незначною кількістю таких клітин у складі пухлин, так і значною їх мінливістю. Такі клітини мають ядра з площею перетину понад 55 мкм і об’ємом понад 320 мкм.
Виявлена залежність між вмістом НК та розмірами ядер клітин пухлин дозволила вивести її математичний еквівалент, який виражається рівнянням:
NДНК=Narea • (0,0482 • lnNarea—k) (3)
Враховуючи достовірні відмінності щодо вмісту РНК у ядрах клітин пухлин різного ступеня диференціювання, значення змінної k (за умов налічення не менше ніж 300 пухлинних клітин) становить: ГН — 0,11, ГНБ — 0,1, НБ’ — 0,0703. Зіставлення результатів емпіричного та непрямого (розрахункового) визначення вмісту ДНК у клітинах НБ показало їхню подібність: ГН — р<0,1 у діапазоні Р1–Р3, ГНБ — р<0,05 у діапазоні Р1–Р6, НБ’ — р<0,05 у діапазоні Р1–Р6 (рис. 5).
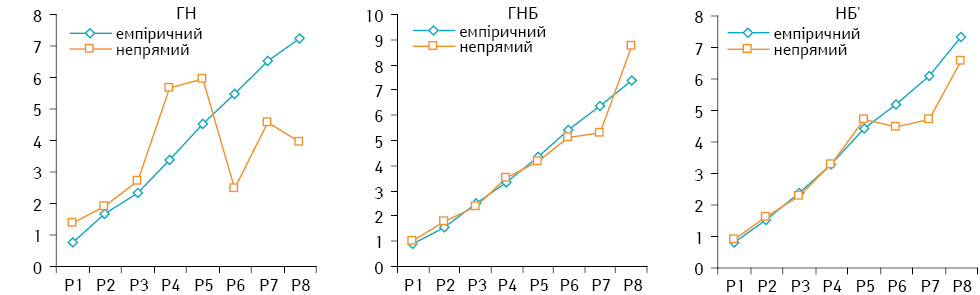
Таким чином, проведені дослідження показали, що різні за ступенем диференціювання НБ є гетерогенними. Так, для досліджених ГН і ГНБ притаманна наявність у їх складі значної частки клітин, у ядрах яких вміст ДНК більший за тетраплоїдний, що є ознакою хромосомної нестабільності [9]. Для НБ’, які серед досліджених пухлин найменш диференційовані, тільки частина пухлин має у своєму складі поліплоїдні клітини та такі, що можуть бути визнані поліплоїдними. Інші НБ’, відповідно, за відсутності ознак хромосомної нестабільності розвиваються за участю інших патогенетичних механізмів (мікросателітна нестабільність тощо) [10]. Або ці пухлини зазнали звуження клітинного спектра за рахунок елімінації морфофункціональних типів клітин з порушеною системою життєзабезпечення.
Привертає до себе увагу той факт, що клітини НБ з вмістом ДНК понад 4с зазвичай не виявляють ознак дегенерації (каріопікноз, лізис хроматину), що є достатньо типовим для пухлин інших гістогенетичних джерел [15]. При цьому відзначають зростання вмісту РНК в ядрах у міру збільшення кількості ДНК. Це можна розглядати як непряму ознаку активності геному і, відповідно, функціональної активності пухлинних клітин у цілому. Вищезазначене дає привід вважати, що поліплоїдні клітини НБ мають достатній рівень активності систем життєзабезпечення і не елімінуються, як це притаманно пухлинам інших гістогенетичних джерел з хромосомною нестабільністю [9, 15].
Різноманітність клітинного складу НБ за вмістом ДНК є непрямим показником різноманітності властивостей та життєздатності пухлинних клітин. Отже, це є достатнім приводом для включення цього критерію до комплексної оцінки властивостей пухлини [6]. Але, оскільки вміст ДНК у ядрах пухлинних клітин залежить не тільки від порушення механізму їх поділу, а й від активності їх синтезу, то плоїдність та проліферативну активність у пухлинах доцільно розглядати як одну змінну. Крім того, на нашу думку, може виявитися інформативною оцінка проліферативної активності у різних сегментах клітинного спектра НБ, що вкаже на морфофункціональний тип клітин, який визначає потенції розвитку пухлини.
Виявлені залежності між розмірами ядер пухлин НБ і вмістом у них ДНК, а також математичний опис цих залежностей, дають можливість визначати плоїдність НБ при рутинному гістологічному дослідженні за умов оцінки не менше ніж 300 клітин.
Висновки
У низці НБ, у міру збільшення вираженості проявів дедиференціювання, відбувається зменшення середнього вмісту ДНК у пухлинних клітинах, клітинний спектр зміщується в бік клітин з низьким вмістом ДНК у ядрах, що веде до зниження рівня клітинної гетерогенності пухлин.
Збільшення вмісту РНК у ядрах поліплоїдних клітин НБ, яке свідчить про певний ступінь збереження функціональної активності геному, може бути використане як непрямий показник життєздатності клітин та виділення їх морфофункціональних типів, певною мірою здатних до диференціювання.
Виходячи з наявності прямої залежності між вмістом ДНК у ядрі клітин НБ та його розмірами, каріометричні показники можуть використовуватися для непрямого визначення плоїдності клітин без застосування складних методів забарвлення, що підвищить об’єктивність та достовірність оцінки пухлин у рутинній патогістологічній практиці.
Список використаної літератури
1. Лупа Х. (1980) Основы гистохимии. (Пер. с немец.). Мир, Москва, 344 с.
2. Ташке К. (1980) Введение в количественную цито-гистологическую морфологию. (Пер. с рум.). Из. Акад. Соц. Респ. Румынии, 192 с.
3. Ambros P.F., Ambros I.M., Brodeur G.M. et al. (2009) International consensus for neuroblastoma molecular diagnostics: report from the International Neuroblastoma Risk Group (INRG) Biology Committee. British J. Cancer, 100: 1471–82.
4. Bagatell R., Beck-Popovich M., London W.B. et al. (2009) Significance of MYCN amplification in international neuroblastoma staging system stage 1 and 2 neuroblastoma: a report from the International Neuroblastoma Risk Group database. J. Clin. Oncol., 27(3): 365–370.
5. Bernardi B.D., Gerrrard M., Boni L. et. al. (2009) Высокие показатели выживаемости при использовании терапии сниженной интенсивности у детей с диссеминированной нейробластомой без амплификации гена MYCN. J. Clin. Oncol., 27(7): 1034–40.
6. Brodeyr G.M., Fong C.T., Morita M. (1988) Molecular analysis and clinical significance of N-myc amplification and chromosome 1q monosomy in human neuroblastomas. Prog. Clin. Biol. Res., 271: 3–15.
7. Canete A., Gerrard M., Rubie H. et al. (2009) Poor survival for infants with MYCN-amplified metastatic neuroblastoma despite intensified treatment: the International Society of Pediatric Oncology European neuroblastoma experience. J. Clin. Oncol., 27(7): 1014–19.
8. Cohn S.L., Pearson A.D., London W.B. et al. (2009) The International Neuroblastoma Risk Group (INRG) classification system: an INRG Task Force report. J. Clin. Oncol., 27: 289–97.
9. Davoli T., de Lange T. (2011) The Causes and Consequences of Polyploidy in Normal Development and Cancer. Ann. Rev. Cell Dev. Biol., 27: 585–610.
10. Holland A.J., Cleveland D.W. (2012) Losing balance: the origin and impact of aneuploidy in cancer. EMBO, 13(6): 501–514.
11. George R.E., London W.B., Cohn S.L. et al. (2005) Hyperdiploidy plus nonamplified MYCN confers a favorable prognosis in children 12 to 18 months old with disseminated neuroblastoma: a pediatric oncology group study. J. Clin. Oncol., 23(27): 6466–73.
12. Ladenstein R., Ambros I.M., Potschger U. et al. (2001) Prognostic significance of DNA di-tetraploidy in neuroblastoma. Med. Pediatr. Oncol., 36: 83–92.
13. Mora J., Cheung N.K., Chen L. et al. (2001) Survival analysis of clinical, pathologic, and genetic features in neuroblastoma presenting as locoregional disease. Cancer, 91: 435–42.
14. Oppedal B.R., Storm-Mathisen I., Lie S.O. et al. (1988) Prognostic factors in neuroblastoma: сlinical, histopathologic, and immunohistochemical features and DNA ploidy in relation to prognosis. Cancer, 62: 772–80.
15. Park S.U., Choi E.S., Jang Y.S. et al. (2011) Effects of Chromosomal Polyploidy on Survival of Colon Cancer Cells. Korean J. Gastroenterol, 57(3): 150–157.
16. Schneiderman J., London W.B., Brodeur G.M. et al. (2008) Clinical significance of MYCN amplification and ploidy in favorable-stage neuroblastoma: a report from the Children’s Oncology Group. J. Clin. Oncol., 26(6): 913–918.
Содержание нуклеиновых кислот в ядрах клеток нейробластом разной степени дифференциации
Резюме. В нейробластомах по мере увеличения выраженности проявлений дедифференцирования происходит уменьшение среднего содержания ДНК в опухолевых клетках, клеточный спектр смещается в сторону клеток с низким содержанием ДНК в ядрах, что ведет к снижению уровня клеточной гетерогенности опухоли. Увеличение содержания РНК в ядрах полиплоидных клеток нейробластом, которое свидетельствует об определенной степени сохранения функциональной активности генома, может быть использовано как косвенный показатель жизнеспособности клеток и выделения их морфофункциональных типов, в определенной степени способных к дифференциации. Исходя из наличия прямой зависимости между содержанием ДНК в ядрах клеток нейробластом и его размерами, кариометрические показатели могут использоваться для косвенного определения плоидности клеток без применения сложных методов окраски, что повысит объективность и достоверность оценки опухолей в рутинной патогистологической практике.
нейробластома, ядро, нуклеиновые кислоты.














Leave a comment