Ефективність неоад’ювантної поліхіміотерапії у хворих на рак грудної залози. Лікувальний патоморфоз
Смоланка І.І., Скляр С.Ю., Іванкова О.М., Костриба О.І., Кротевич М.С., Скорода Л.В.
Резюме. Наведено особливості лікувального патоморфозу при лікуванні хворих на рак грудної залози після застосування неоад’ювантних методів локальної та системної протипухлинної терапії. Особливу увагу приділено аналізу стану васкуляризації строми пухлин грудної залози як фактора прогнозу перебігу захворювання.

Вступ
Доцільність використання неоад’ювантної поліхіміотерапії (НПХТ), особливо при комплексному лікуванні хворих з місцево-поширеними (МП) формами раку грудної залози (РГЗ), на сьогодні вже не викликає дискусій [1–4]. Незважаючи на успіхи в ранній діагностиці РГЗ, майже у 25% хворих на момент встановлення діагнозу реєструють МП РГЗ, а саме: пухлини грудної залози розміром >5 см; пухлини менших розмірів, які займають більшу частину залози (при малому її розмірі) або пухлини будь-яких розмірів, що поширюються на шкіру, грудну стінку або супроводжуються метастазами в аксилярні, внутрішні грудні та надключичні лімфатичні вузли на боці ураження [1, 3, 4]. Ця категорія хворих потребує довготривалого лікування, яке складається з передопераційної (неоад’ювантної) терапії, оперативного втручання та післяопераційної (ад’ювантної) протипухлинної терапії [2, 4–7]. Показники 5-річної виживаності при МП РГЗ коливаються від 27 до 60% і залежать більшою мірою від ступеня первинного розповсюдження пухлинного процесу та адекватності проведеної протипухлинної терапії [1, 2, 5, 9].
За даними Національного інституту раку, застосування НПХТ суттєво не впливає на віддалені результати лікування хворих на МП РГЗ. Зазначено, що при її проведенні різниця показників 5-річної виживаності становить 3–6%, що збігається з даними світових багатоцентрових рандомізованих досліджень. Дуже важливим є створення умов після застосування НПХТ для проведення радикальних, реконструктивних та відновних операцій у цієї категорії хворих.
Зацікавленість проблемою передопераційної протипухлинної терапії постійно зростає, тому що неоад’ювантне лікування при РГЗ дозволяє зменшити обсяг хірургічного втручання та в частини хворих створює сприятливі умови для виконання органозберігаючих або відновних операцій [1–6, 8, 9].
Починаючи з 1990 р. в Національному інституті раку проводять аналіз результатів неоад’ювантного антибластомного впливу на пухлину грудної залози з ретельним дослідженням лікувального патоморфозу [8, 10]. В останнє десятиріччя на підставі морфологічних досліджень стану ангіо-/васкулогенезу різних гістотипів РГЗ доведено, що васкуляризація пухлини відіграє ключову роль у прогресуванні хвороби і є суттєвим фактором прогнозу перебігу захворювання [8, 10, 11].
Мета роботи — дослідити лікувальний патоморфоз та мікроскопічні особливості в пухлинній тканині при РГЗ після проведення неоад’ювантної протипухлинної терапії та оцінити її ефективність.
Об’єкт та методи дослідження
Проведено клініко-рентгенологічний та морфологічний аналіз безпосередніх результатів комплексного лікування 223 хворих на МП РГЗ IIБ–IIIБ стадії. Сучасним стандартом лікування пацієнток з таким поширенням пухлинного процесу є застосування неоад’ювантної протипухлинної терапії, а саме поліхіміотерапії (ПХТ). Оптимізація цитотоксичної терапії є одним з перспективних напрямків покращення результатів лікування РГЗ. Розробки, що ведуться у цій галузі, дають можливість потенціювати ефективність ПХТ за рахунок: по-перше, створення нових хіміопрепаратів; по-друге, удосконалення методів транспортування препаратів до пухлини; по-третє, використання модифікаторів хіміопроменевої терапії (ХПТ) та, по-четверте, призначення індивідуалізованих хіміотерапевтичних режимів.
Досліджено 72 пацієнтки з МП РГЗ, які отримали НПХТ за стандартною схемою FAC, 69 хворих, у яких проводили в передопераційний період селективну внутрішньоартеріальну поліхіміотерапію (ВАПХТ) та 82 хворих на первинно неоперабельний МП РГЗ (Т4N0–2M0, T1–4N3M0), які одержували в передопераційний період комплекс ХПТ (із них 42 пацієнтки отримали ХПТ за стандартами; у 40 — після курсів НПХТ за стандартною схемою FAC застосовували променеву терапію на фоні цитостатика тегафуру в якості модифікатора (табл. 1)). Морфологічний аналіз проведено на операційному матеріалі (видалених пухлинах грудної залози), що з морфологічних позицій співвідноситься з так званими інфільтруючими карциномами, коли розвиток пухлинної інвазії або лікувальна дія цитостатиків уже не дозволяє точно встановлювати походження раку з часток або протоків. Ретроспективно вивчено також архівну групу контролю — 40 хворих на РГЗ, у яких перед операціями не застосовували жодних антибластомних методів лікування.
Таблиця 1. Розподіл хворих на РГЗ залежно від стадії та методів неоад’ювантної протипухлинної терапії
| Стадія процесу | Критерії TNM | Кількість хворих на РГЗ, n (%) | ||
|---|---|---|---|---|
| СПХТ (n = 72) | ХПТ (n = 82) | ВАПХТ (n = 69) | ||
| ІІБ | T2N1 | 4 (5,5) | 2 (2,4) | 2 (2,9) |
| ІІІА | T3N1 | 30 (41,7) | 10 (12,2) | 12 (17,4) |
| ІІІА | T2N2 | 16 (22,2) | 17 (20,7) | 12 (17,4) |
| ІІІА | T3N2 | 12 (16,7) | 20 (24,4) | 21 (30,4) |
| ІІІБ | T4N1–2 | 10 (13,9) | 33 (40,3) | 22 (31,9) |
Обов’язковою умовою при застосуванні НПХТ має бути досягнення позитивного об’єктивного результату (відповіді пухлини, наявності чутливості до проведеного лікування) [1, 2, 5–7]. При первинно неоперабельному РГЗ НПХТ проводять з метою максимальної девіталізації клітин пухлинного вогнища та регіонарних метастазів, що сприяє створенню умов для виконання радикальної операції. Разом з цим стає можливою оцінка індивідуальної чутливості до проведеного цитостатичного лікування (коригування або подальша інтенсифікація ад’ювантної протипухлинної терапії).
Неоад’ювантну системну поліхіміотерапію (СПХТ) проводили за схемою FAC до 4 курсів з інтервалами між курсами 3 тиж. Застосовували хіміопрепарати: доксорубіцин по 50 мг/м, флуороурацил — 500 мг/м та циклофосфамід — 500 мг/м. Сеанс ВАПХТ проводили за допомогою ангіографії з анатомічним доступом до судин грудної залози. Катетеризацію внутрішньої грудної артерії, бокової грудної артерії, поверхневої грудної артерії, підлопаткової артерії та грудної гілки грудоакроміальної артерії проводили у відділенні рентгенохірургії Національного інституту раку (завідувач —професор О.Г. Югрінов).
Перший етап складався з рентгенохірургічної операції й ангіографічного дослідження пухлини та метастазів. При цьому оцінювали стан судин, їх діаметр, тип васкуляризації пухлини. Після чого катетер встановлювали в судину, яка бере участь у кровопостачанні пухлини, та залишали для проведення ВАПХТ. Далі виконували черезкатетерне введення хіміопрепаратів за допомогою дозатора ліків ДЛВ-1. За один сеанс вводили: доксорубіцину — 40 мг/м, цисплатину — 60 мг/м). Інфузію цитостатика проводили зі швидкістю 2–2,5 мл/хв 3–4 год на добу протягом 2–3 діб. Після закінчення ВАПХТ у рентгенохірургічному кабінеті катетери вилучали. Через 3 тиж за допомогою клінічного обстеження, мамографії, ультразвукового дослідження (УЗД) проводили оцінку найближчих результатів ВАПХТ, з урахуванням яких розробляли план подальшого лікування. Після операції досліджували лікувальний патоморфоз.
При мікроскопічному дослідженні гістопрепаратів РГЗ, забарвлених гематоксилін-еозином та пікрофуксином, проводили морфометрію відвідних (дренажних) судин строми пухлини грудної залози з визначенням середньоарифметичного показника їх вмісту за формулою:
ЩВ = (n1 + n2 + n3)/3,
де ЩВ — щільність васкуляризації;
n1 — найбільша сумарна кількість відвідних мікросудин (венозні + лімфатичні) в гістологічному зрізі, виготовленому з периферичної зони пухлини в І полі зору мікроскопа;
n2 — аналогічні умови аналізу мікросудин у проміжній зоні пухлини;
n3 — аналогічні умови аналізу мікросудин з центральної зони пухлини (для мікроскопічного дослідження брали зразки — шматочки — з 3 зон пухлини).
Мікросудини в осередках ракової паренхіми не досліджували, оскільки дистрофічні та некротичні зміни, детерміновані НПХТ, не дозволяють їх чітко візуалізувати.
Неоад’ювантну протипухлинну терапію при первинно неоперабельних формах РГЗ проводили за наступною схемою: до I групи (основна) увійшли 40 пацієнток, котрі одержували комплексне лікування з використанням традиційної ХПТ на фоні радіомодифікаторів (фторпіримідинів), при цьому у хворих проведено 4 курси НПХТ за схемою FAC (циклофосфамід 500 мг/м, флуороурацил 500 мг/м, доксорубіцин 50 мг/м), після чого — курс дистанційної променевої терапії за радикальною програмою: грудна залоза (разова вогнищева доза (РВД) — 2 Гр, сумарна вогнищева доза (СВД) — 40–45 Гр), пахвинні лімфатичні вузли (РВД — 2 Гр, СВД — 40 Гр), парастернальна та надключична ділянки (РВД — 2 Гр, СВД — 40–45 Гр). Курс дистанційної променевої терапії проводили за радикальною програмою на фоні цитостатичного препарату тегафур (800 мг зранку і 400 мг увечері) з метою радіомодифікації.
До II групи (контрольна) увійшли 42 пацієнтки, для лікування яких застосовували традиційну ХПТ, без використання модифікаторів (4 курси НПХТ за схемою FAC та 1 курс дистанційної променевої терапії за радикальною програмою).
Результати та їх обговорення
Безпосередні результати застосування неоад’ювантної протипухлинної терапії вивчали за допомогою клінічних, рентгенологічних, ангіографічних, морфометричних методів. Виконана з лікувальною метою катетеризація судин, які живлять пухлину, дозволяла зробити одночасно діагностичні дослідження, одержати дані про стан кровообігу в патологічному осередку, визначити обсяг і характер ураження, зміни в процесі лікування. Клініко-рентгенологічними критеріями позитивної оцінки результатів лікування при проведенні НПХТ були: зменшення розмірів пухлини або її зникнення; зменшення або зникнення регіонарних метастазів; структурна перебудова пухлини з появою гіперехогенних ділянок і зон некрозу; зниження, аж до повного зникнення, ознак васкуляризації пухлини; поява кальцифікатів в локусах РГЗ, що збігаються з ходом склерозованих судин; зменшення розмірів лімфатичних вузлів з підвищенням їх акустичної щільності; відсутність набряку шкіри; зникнення фіксації грудної залози до грудної стінки.
Для оцінки найближчих результатів лікування розроблено також наступні ангіографічні ознаки редукції пухлини: збіднення судинного малюнка пухлини; зменшення кількості живильних судин; зменшення калібру судин; зникнення ознак неоваскуляризації пухлини; зникнення гіперваскуляризації й фрагментації судин; поява потужного колатерального кровообігу в регіоні; оклюзія судин, які брали участь у кровопостачанні пухлини, з появою колатералей; відсутність атипового розміщення, розширення вен.
Ознаками прогресування пухлинного процесу за ангіографічним дослідженням вважають появу нових осередків неоваскуляризації та гіперваскуляризації або відсутність суттєвих змін в ангіоархітектоніці пухлини, збільшення кількості живильних судин; за клінічними та мамографічними — збільшення набряку грудної залози та шкіри при первинній набряково-інфільтративній формі РГЗ і розміру пухлини при вузлових формах РГЗ, а також при вторинній набряково-інфільтративній формі РГЗ, поява нових регіонарних лімфатичних метастазів, фіксацію пухлини до грудної стінки тощо.
Найближчі результати оцінювали через 3 тиж після закінчення лікування згідно з класифікацією RECIST (response evaluation criteria in solid tumors), до якої включено такі показники відповіді пухлини, як повна та часткова регресія, стабілізація та прогресування процесу (табл. 2).
Таблиця 2. Результати відповіді на проведене лікування у хворих на МП РГЗ
| Кількість хворих | Відповідь пухлини на лікування | |||
|---|---|---|---|---|
| Повна регресія | Часткова регресія | Стабілізація | Прогресування | |
| ВАПХТ (n=69) | 6 (8,7%) | 32 (46,4%) | 29 (42,0%) | 2 (2,9%) |
| СПХТ (n=72) | 2 (2,8%) | 22 (30,6%) | 42 (58,3%) | 6 (8,3%) |
| ХПТ (n=82) | 10 (12,2%) | 39 (47,6%) | 33 (40,2%) | 0 |
При клініко-рентгенологічному досліджені встановлено, що повною регресією пухлини після НПХТ було зменшення її розмірів до встановлення нормальної зональної анатомії, при УЗД сигнал ставав однорідним, набряк та інфільтрація шкіри зникали, мережа кровоносних судин пухлини протягом лікування різко зменшувалася до зникнення. При частковій регресії пухлинного процесу відзначали зменшення пухлини більш ніж на 30% порівняно з початковими даними, при УЗД сигнал ставав більш однорідним, але зберігалася гетерогенна структура пухлини та виражена мережа кровоносних судин. Повну регресію пухлини та відсутність кровоносних судин виявлено у 6 (8,7%) хворих з вузловими формами РГЗ після ВАПХТ (у 4 — після 2 курсів ВАПХТ), у 2 (2,8%) — після 4 курсів СПХТ та у 10 (12,2%) — після модифікованої ХПТ.
При комбінації ХПТ ефект від цитостатичної терапії, згідно з даними моніторингових досліджень, був більш вираженим у хворих основної групи, котрі одержували ХПТ на фоні радіомодифікаторів (фторпіримідинів). У 29 хворих (70,7%) відзначали часткову або повну регресію пухлини грудної залози.
У пацієнток контрольної групи, у яких застосовували традиційну ХПТ, повну та часткову регресію зареєстровано лише у 18 (43,9%) хворих. Різниця між цими показниками є статистично достовірною і демонструє кращий контроль над пухлиною при включенні в схему комплексного лікування модифікаторів.
Таким чином, застосування НПХТ при лікуванні МП РГЗ дозволило досягти об’єктивної відповіді на лікування (об’єктивний клініко-рентгенологічний ефект) у більшості хворих. Повне зникнення регіонарних метастазів у лімфовузлах аксилярної ділянки відзначено більш ніж у 80% випадків.
Найбільш інформативними для аналізу відповіді на лікування були ангіографічні ознаки редукції пухлини, зафіксовані через 3–4 тиж після проведення курсів ПХТ. Судини пухлини служать візуальними мішенями, ураження яких можна реєструвати при агіографічному дослідженні. «Наступ» на судини-мішені під час направленої інфузії цитостатиків за силою впливу перевищує поріг толерантності пухлини до хімічних агентів, введених у системне судинне русло. При цьому відбувається не тільки руйнування біохімічним шляхом новоутворених судин, але й деструкція інших тканин пухлини. На тканинному рівні процес ендоваскулярної абляції пухлини можна уявити у вигляді декількох послідовних етапів. У першу чергу в результаті хімічного опіку руйнується недосконала стінка новоутворених судин. Неоваскулярна мережа набуває підвищеної проникності для цитостатиків. Вони починають легко дифундувати в тканину пухлини, депонуватися в паравазальних просторах, міжклітинних проміжках, проникати в структуру власне пухлинних клітин. Таким чином, пухлина стає поділеною на численні безструктурні фрагменти та ділянки секвестрації, що не мають кровозабезпечення.
Для подолання бар’єра толерантності пухлини до хімічних агентів потрібен довготривалий локальний вплив. Процес руйнування судинного бар’єра пухлини можна зобразити наступним чином. Протягом 1–2 сеансів ПХТ відбувається хімічне наповнення судинного русла пухлини. Це визначається за характерним контрастуванням додаткової (резервної) мережі з найменших судин, що сумарно значно перевищує вихідний рівень васкуляризації. Після 2-го сеансу (2-ї доби) судинний колапс зростає, простежити новоутворені судини окремо одну від одної не можна внаслідок настання раннього та подовженого паренхіматозного забарвлення пухлини. Після 3-го сеансу ПХТ відбувається збіднення судинного малюнка пухлини. При цьому судинна архітектоніка зазнає глибоких змін. Облітерації піддається майже вся судинна мережа пухлини. Швидкість кровообігу різко зменшується, настає стагнація. Пухлина «вимикається» із системи регіонарного кровотоку. У периферичних частках пухлини можуть контрастуватися колатеральні аферентні судини.
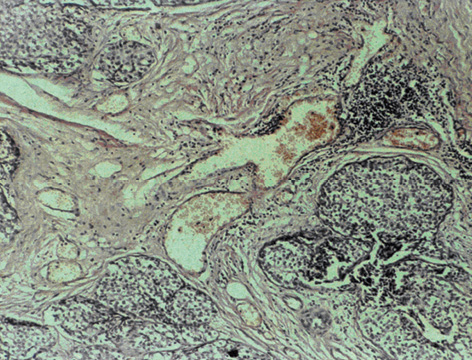
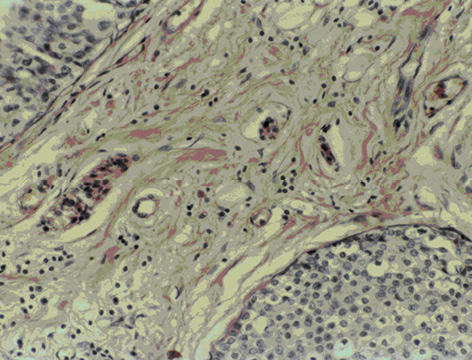
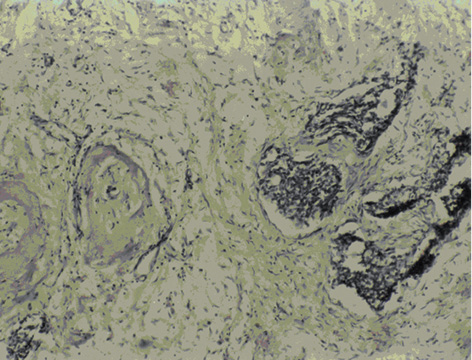
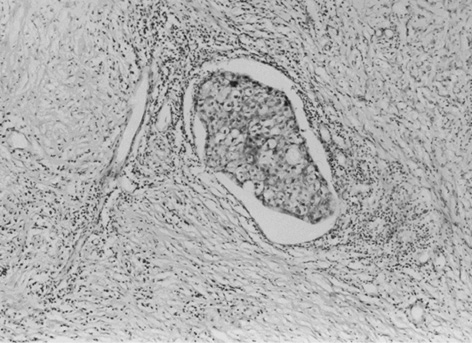
Васкулярно-трофічне забезпечення життєздатності пухлинної паренхіми з боку непухлинної строми дозволяє розглядати стан васкуляризації РГЗ як об’єктивний фактор, який впливає на перебіг хвороби. У групі контролю чітко візуалізуються численні судини мікроциркуляторного русла строми пухлини грудної залози (рис. 1), а у венозних та лімфатичних мікросудинах виявляють множинні ракові клітини та їх комплекси — так звані пухлинні емболи (рис. 2). Після ВАПХТ в РГЗ виникають периваскулярні некрози в ділянках паренхіми та строми, що розташовані поряд з судинами, по яких відбувалося постачання хіміопрепаратів. Особливо важливою морфологічною ознакою ефективності ВАПХТ є загибель ракових емболів у просвітах венозних та лімфатичних судин — анатомічних шляхах потенційного метастазування (рис. 3). Розвиток некрозів паренхіми і строми свідчить про проникнення молекул хіміопрепаратів через судинні стінки артеріального русла, а загибель ракових клітин у дренажних судинах РГЗ — про перехід молекул хіміопрепаратів з артеріального русла у венозне, а також у венозно-лімфатичні анастомози (рис. 4).
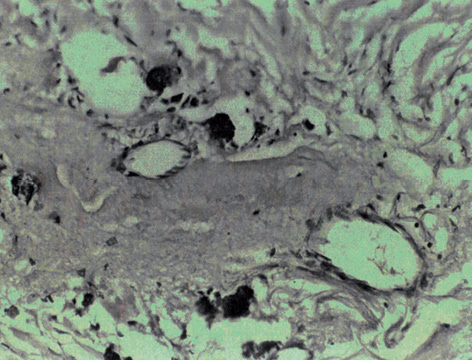
Застосування ВАПХТ дозволяє на передопераційному етапі лікування досягнути значного обсягу девіталізації паренхіми та строми пухлини грудної залози у вигляді субтотальних і навіть тотальних некрозів. З часом, через 2–3 тиж після інфузії хіміопрепаратів, у транспортних судинах розвивається структурна перебудова їх стінок зі звуженням та обтурацією просвітів. Логічно припустити, що неодноразові інфузії хіміопрепаратів (декілька курсів ВАПХТ) спочатку призводять до хімічного пошкодження ендотелію та м’язево-сполучнотканинних елементів судинних оболонок, що потім спричиняє виникнення судинного тромбозу на різних фазах його розвитку (рис. 5).
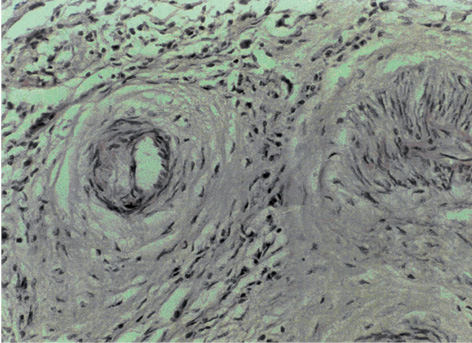
Згідно з вищевикладеним стає очевидною багатовекторність пошкоджувальної дії ВАПХТ, яка завдяки цілеспрямованому постачанню хіміопрепаратів по артеріальних судинах, які живлять пухлину, призводить до розвитку некрозів паренхіми та строми, загибелі внутрішньосудинних пухлинних емболів з подальшою блокадою або обмеженням крово- та лімфообігу через розвиток тромбозу та склерозу судин строми. При застосуванні тільки 1–2 курсів СПХТ таких поширених змін лікувального патоморфозу в пухлині не відбувається. Розвиваються лише дрібноосередкові некрози пухлинної паренхіми зі збереженням структур суміжних ділянок ракових комплексів, а на пухлинні емболи СПХТ фактично не діє (рис. 6). Для об’єктивізації досліджень лікувального патоморфозу, що розвивається внаслідок антибластомної дії НПХТ, результати квантифікаційного аналізу вмісту пухлинної паренхіми узагальнено за даними морфометрії (табл. 3).
Таблиця 3. Морфометрична оцінка антибластомного впливу передопераційних методів протипухлинного лікування
| Режими неоад’ювантної протипухлинної терапії | Кількість хворих | Частковий вміст резидуальної структурно збереженої пухлинної паренхіми (М±m, %) | p |
|---|---|---|---|
| Контроль (тільки операція) | 40 | 78,6±7,7 | p1–2 р1–3>0,05 |
| ВАПХТ | 69 | 26,2±6,44 | р1–4 р1–5 |
| СПХТ (1 курс) | 72 | 70,8±8,9 | р1–5 р1–6 |
| СПХТ (2 курси) | 10 | 50,4±6,8 | р1–7 р2–3 |
| СПХТ (3 курси) | 9 | 36,0±4,1 | р2–4 р2–5 |
| ХПТ за стандартними схемами | 42 | 31,44±2,9 | р3–4 р4–5 |
| Модифікована ХПТ | 40 | 13,02±2,3 | р2–7 р4–7 |
Примітка: обчислення кількості ракових клітин проводили в структурно збережених їх осередках, які не піддавалися впливу хіміотерапії або проявили хіміорезистентність. Такі клітини не мали структурних ознак пошкодження, патологічних мітозів або апоптозу.
Порівняльний аналіз отриманих показників свідчить про вірогідну перевагу методів модифікованої комбінованої ХПТ та ВАПХТ порівняно з 1–3-разовими курсами СПХТ (р
Морфометрична оцінка ефективності лікувального патоморфозу МП РГЗ після проведення НПХТ дає об’єктивну змогу морфологічно визначити на операційному матеріалі антибластомну ефективність її застосування, допомагає планувати та коригувати наступні етапи лікування.
Деталізуючи результати морфометрії, можна зробити висновок про несуттєвість одно- та дворазових курсів СПХТ порівняно з контролем. Для одержання об’єктивного клініко-морфологічного ефекту (зменшення пухлини більш ніж на 50%) необхідне проведення не менше 3 курсів внутрішньовенної СПХТ або модифікованої ХПТ, або ВАПХТ.
В аспекті вивчення стану васкуляризації пухлин при РГЗ проведено морфометрію судин строми карцином у групах СПХТ та контролю. Після ВАПХТ такі дослідження стають неможливими, тому що багато мікросудин у пухлині перебувають у зміненому стані внаслідок дії цитостатиків: патологічні зміни реології крові — агрегація клітин крові, сладж-феномен (клітинна аглютинація, тромбоутворення зі стенозом або обтурацією судинних просвітів клітинними, фібриновими або змішаними мікротромбами); плазматичне просякнення судинних стінок з розвитком фібриноїдного некрозу та периваскулярних плазморагій, склероз з облітерацією просвітів судин до втрати зображень останніх на гістопрепаратах. Усе це унеможливлює чітку реєстрацію реального кількісного вмісту мікросудин після ВАПХТ у ділянках загиблої пухлинної паренхіми та строми. Стан ангіогенезу та його роль у прогностичній оцінці перебігу хвороби достатньою мірою демонструють морфометричні показники васкуляризації пухлин у тих хворих, у яких не проводили передопераційні методи протипухлинної терапії (табл. 4). Щодо визначення стану васкуляризації пухлини при РГЗ у групі хворих, які отримали ВАПХТ, то він може визначатися при візуальному аналізі ангіографічних та ультразвукових зображень у процесі неоад’ювантного лікування і після його закінчення безпосередньо перед операціями.
Таблиця 4. Прогностична морфоклінічна оцінка перебігу хвороби за критерієм стан васкуляризації строми пухлини грудної залози
| Стан васкуляризції пухлини на І поле зору мікроскопа | Прогноз хвороби | Ризик метастазування | Виникнення метастазів після хірургічного лікування | ||
|---|---|---|---|---|---|
| Кількість судин | Щільність розподілу | Кількість випадків, n (%) | Термін виживаності | ||
| >50 | Гіперваскуляризація | Дуже поганий | Високий | 20 (50) | до 1 року |
| 20–50 | Помірна васкуляризація | Поганий | Середній | 9 (22,5) | до 3 років |
| ГіповаскуляризаціяЗадовільнийНизький11 (27,5)до 5 років | |||||
За отриманими даними можна зробити однозначний висновок про незалежність фактора гіперваскуляризації пухлин грудної залози, який може мати самостійне та вирішальне значення в прогностичній оцінці перебігу захворювання і провідну роль поряд з імуногістохімічними показниками молекулярно-біологічних особливостей пухлин при плануванні ад’ювантного лікування.
Одержані результати вивчення лікувального патоморфозу свідчать про ефективність та перспективність проведення НПХТ при лікуванні хворих на МП РГЗ. Але лише морфологічний аналіз пухлинного процесу як локального прояву захворювання не дає цілісного уявлення про ефективність терапії пацієнта онкологічного профілю на рівні всього організму. Тому результати оцінки терапевтичного патоморфозу пухлини необхідно співвідносити з віддаленими результатами комплексного лікування.
Проведені дослідження свідчать про патогенетичне значення лікувального патоморфозу та стану васкуляризації пухлин для прогресуванні РГЗ. При дослідженні операційного матеріалу хворих на РГЗ, які на передопераційному етапі лікування перебували під впливом різних схем НПХТ, стає очевидним, що ці методи протипухлинної терапії дозволяють цілеспрямовано знищувати ракові клітини, які містяться в дренажних — венозних і лімфатичних — мікросудинах та їх анастомозах, з подальшим розвитком хімічно індукованих некрозів у пухлинній паренхімі, виникненням тромбозу і склерозу судин. Завдяки хімічно детермінованій оклюзії та облітерації власних судин пухлини виникає редукція гемо- та лімфомікроциркуляторного русла, що лімітує розвиток неоангіогенезу. Девіталізація пухлинної паренхіми з досягненням стану гіповаскуляризації перед операціями завдяки НПХТ дозволяє підвищити умови абластики під час хірургічних втручань і знизити ризик розвитку метастазів.
Проведення НПХТ дає можливість розпочати комплексне лікування з протипухлинного впливу на пухлинне вогнище та субклінічні метастази, запобігати генералізації процесу, отримувати інформацію про чутливість пухлини до цитостатиків і таким чином уникнути неефективної ад’ювантної терапії. При МП первинно операбельних формах РГЗ (ІІБ–ІІІБ стадія) комплексне лікування доцільно розпочинати з неоад’ювантної системної протипухлинної терапії. Дослідження лікувального патоморфозу після застосування СПХТ свідчить про доцільність передопераційного використання не менш як 3–4 курсів системного лікування. У разі первинно неоперабельних пухлин грудної залози або набряково-інфільтративних форм РГЗ доцільним є застосування модифікованої комбінованої ХПТ або ВАПХТ (за наявності ангіографічної апаратури та клінічного досвіду катетеризації артеріальних судин, які беруть безпосередню участь у кровопостачанні грудної залози), які діють також місцево. Такий підхід створює умови для підвищення якості життя оперованих хворих та покращення результатів їх виживаності.
Список використанної літератури
1. Онкологія (2006) / За ред. І.Б. Щепотіна. Книга плюс, Київ, 496 c.
2. Возный Э.К., Добровольская Н.Ю. (2006) 15-летний опыт комплексного лечения больных местно-распространенным раком молочной железы с использованием неоадъювантной химиотерапии. Материалы Х Российского онкологического конгресса, 21–23 ноября 2006 г., Москва: 64–66.
3. Гарбуков Е.Ю., Слонимская Е.М., Красулина И.А. (2005) Неоадъювантная химиотерапия при раке молочной железы. Сиб. онкол. журн., 2: 14.
4. Донских Р.В., Семиглазов В.Ф., Семиглазов В.В. и др. (2007) Неоадъювантное лечение рака молочной железы. Маммология, 1: 34–38.
5. Семиглазов В.Ф. (2008) Неоадъювантное и адъювантное лечение рака молочной железы. Москва, 288 с.
6. Татарченко А.С., Великая В.В. (2009) Использование различных схем неоадъювантной полихимиотерапии в комплексном лечении больных местно-распространенным раком молочной железы. Сиб. онкол. журн. (Прил. № 1): 193–194.
7. Сивак Л.А., Лялькін С.А., Майданевич М.М. и др. (2011) Сучасні аспекти неоад’ювантної поліхіміотерапії у лікуванні хворих на рак молочної залози. Онкология, 13 (2): 100–102.
8. Смоланка І.І., Скляр С.Ю. (2007) Шляхи підвищення ефективності комплексного лікування хворих на рак молочної залози. Київ, 192 с.
9. Бондарь Г.В., Седаков И.Е., Балашова О.И., Хоменко А.В. (2011) Оценка патоморфологических изменений и выживаемости при селективной внутриартериальной полихимиотерапии местно-распространенного рака молочной железы. Морфологія, 5 (1): 13–23.
10. Галахин К.А., Курик Е.Г., Мельник НН. (2000) Химиотерапевтический патоморфоз злокачественных опухолей. Укр. хіміотерапевт. журн., 4: 8–13.
11. Magennis D. (1998) Angiogenesis: a new prognostic marker for breast cancer. Brit. J. Biomed. Sci., 3: 214–220.
Эффективность неоадъювантной полихимиотерапии у больных раком грудной железы. Лечебный патоморфоз
Резюме. Освещены особенности лечебного патоморфоза при раке грудной железы после использования неоадъювантных методов локальной и системной противоопухолевой терапии. Особое внимание уделено анализу состояния васкуляризации стромы опухолей грудной железы как ключевого фактора прогноза течения заболевания.
рак грудной железы, неоадъювантная противоопухолевая терапия, эффективность лечения, лечебный патоморфоз.














Leave a comment