Захворювання та травматичні пошкодження верхніх сечових шляхів
Обструкція сечоводу у дітей: патогенетичні механізми, діагностика та лікування гідронефрозу та обструктивного мегауретеру
(сучасні погляди на проблему)
С.О. Возіанов, В.Ф. Петербургський
ДУ «Інститут урології НАМН України», Київ, Україна
Хронічна обструкція сечоводу, основними причинами якої є порушення прохідності основних уродинамічних вузлів — мисково-сечовідного і сечовідно-міхурового — зумовлює низку патологічних процесів в нирці та верхніх сечових шляхах, кінцевим результатом інтегрального впливу яких стає прогресуюча атрофія ниркової паренхіми та, відповідно, всіх її структурних складових. Кінцевим результатом обструктивних уропатій (ОУ) є атрофія ниркової паренхіми та формування ниркової недостатності у дітей.
В даній роботі розглядаються питання обструкції сечоводу у дітей в контексті сучасних поглядів на проблему патогенетичних механізмів, діагностики та лікування гідронефрозу та обструктивного мегауретеру.
За останні роки численні дослідження патофізіологічних механізмів, які призводять до прогресування так званих хронічних захворювань нирок, дозволили поглибити наші уявлення про сутність обструктивного процесу та основних внутрішньониркових процесів. Аналіз літературних джерел та власний багаторічний досвід вивчення патогенетичних механізмів хронічної обструкції сечоводу дозволив визначити наступні основні ланки її патогенезу: наявність обструктивного процесу призводить до підвищення внутрішньомискового (або внутрішньоуретерального тиску), що, в свою чергу, порушує гемодинаміку паренхіми нирки, внаслідок чого розвивається дисрегуляція ренін-ангіотензинової системи, яка запускає цілий каскад патологічних внутрішньониркових процесів. Останнім часом набули суттєвого значення неінвазивні методики оцінки глибини порушення функції нирки та ступеня фібротизації її паренхіми шляхом дослідження ролі цитокінів та ензимів сечі. Показана роль виникнення та розвитку гіпоксії, яка стимулює активацію канальцевих ферментів, таких як лізосомні гідролази N-ацетил-β-D-глюкозамінідаза (НАГ) та β-галактозидаза (β-Гал,), в патогенезі порушення функціонального стану нирки, зокрема стану тубулярного нефротелію. Аналіз зміни рівнів активності ферментів, проведений до початку хірургічного лікування у групі дітей з вродженими ОУ та контрольній групі, також показав, що у хворих з обструктивним мегауретером підвищення рівнів активності НАГ та β-Гал було статистично вірогідним (р<0,001).
Розкрито патогенетичну значущість трансформуючого фактора росту β1 (TGF-β1), який як профіброгенний цитокін пригнічує проліферацію ранніх та зрілих Т-клітин та спричиняє таким чином порушення трофіки на рівні нефрону. Встановлено, що дослідження екскреції профіброгенного цитокіну TGF-β1 є одним з маркерів ранніх ознак фібропластичного процесу. Наведено дані дослідження екскреції із сечею прозапального цитокіну — фактору некрозу пухлин (ФНП)-α, який також відносять до найбільш значущих в плані профібротичної дії на паренхіму нирки, а отже, є одним із тих, який має безумовний патогенетичний вплив на уражену нирку при ОУ в дітей.
Аналіз результатів визначення рівнів TGF-β1 та ФНП-α у сечі хворих на ОУ до оперативного втручання показав, що, за середніми даними, рівні TGF-β1 та ФНП-α у цих пацієнтів статистично вірогідно перевищували показники контрольної групи (15,40±1,90 проти 3,85±1,70 пг/мл, р<0,001; та відповідно 66,18±26,77 проти 9,7±2,12 пг/мл, р<0,01).
Представлено основні діагностичні методи при обструкції сечоводу (ехографічні, рентгенологічні, радіологічні, уродинамічні) з урахуванням їх інформативності та можливостей застосування у дітей, особливо раннього віку. Наводяться принципи пієлоуретероанастомозу, які використовуються для корекції обструкції мисково-сечовідного сегмента — формування воронки; відповідне дренування; герметичний анастомоз без натягу, та можливості використання новітніх технологій корекції мисково-сечовідного сегмента — обструкції (лапароскопічна пієлопластика (1993, Schuessler)); робот-асистована лапароскопічна пієлопластика; антеградна або ретроградна ендопієлотомія, при якій ендоскопічно розтинають обструктивний сегмент.
Розглядається проблема нерефлюксуючого мегауретеру в плані класифікації, особливостей уродинаміки, патогенетичних механізмів, значущості діагностичних методик та вибору лікувальних підходів з урахуванням віку дитини, ступеня мегауретеру та функції сечового міхура. Показано, що загальна оцінка ефективності оперативної корекції мегауретеру становила 88,7% позитивних результатів. Разом із тим, диференційований аналіз ефективності лікування мегауретеру з урахуванням функціонального стану сечового міхура показав позитивні результати з відновлення прохідності сечоводу в групі дітей з норморефлексією в 98,2% випадках, негативні − в 2.
Розрахунок ризику негативного результату оперативної корекції мегауретеру у дітей з дисфункцією сечового міхура становить 47,14 (95% довірчий інтервал (ДІ) 11,744−189,233), тоді як при нормальній функції сечового міхура цей ризик становить 0,1465 (95% ДІ 0,040−0,525). Це свідчить про те, що одним з визначальних чинників впливу на сформований уретероцистоанастомоз є функціональний стан сечового міхура.
При аналізі функціонального стану тубулярного апарату паренхіми нирки після успішної корекції уродинаміки позитивна динаміка констатована в 73% випадків, тоді як підвищення рівнів активності цих ензимів (27%), навпаки, є одним із критеріїв подальшого розвитку нефросклерозу. Активність просклеротичних процесів після відновлення пасажу сечі приблизно у 62% пацієнтів залишається доволі високою, що проявляється суттєвим рівнем екскреції з сечею профіброгенного цитокіну TGF-1 через рік після операції. Ці дані вказують, що хірургічна корекція обструктивних уропатій покращує функцію нирки шляхом нормалізації уродинаміки, але не в повному обсязі може перервати патогенетичний ланцюг інтерстиціального фіброзу оперованої нирки. Перервати патогенетичний ланцюг можна шляхом медикаментозного впливу на стан внутрішньониркової гемодинаміки (інгібітори ангіотензинперетворювального ферменту та блокатори рецепторів ангіотензину II).
Оценка ранних послеоперационных осложнений у больных, оперированных по Андерсену — Хайнсу
Ю.Я. Когут
ГУ «Институт урологии НАМН Украины», Киев, Украина
В настоящее время в хирургическом лечении гидронефроза ведущее место занимает операция Андерсена — Хайнса, при которой производится резекция суженного лоханочно-мочеточникового сегмента с частью лоханки (Карпенко В.С., 1974; 1985; Anderson J.С., Hynes W., 1949).
Большинство урологов заканчивает пиелоуретеропластику дренированием почки, в ряде случаев нефростомию дополняют шинированием мочеточника. Другие отдают предпочтение операции Андерсена — Хайнса без нефростомии.
В литературе слабо представлена комплексная клинико-функциональная оценка эффективности операции Андерсена — Хайнса без и с нефростомией. Фактически нет авторов, которые располагали бы значительным клиническим материалом, хорошо изученным в ближайшие и отдаленные сроки. В связи с этим не разработаны четкие показания к пиелоуретеропластике без нефростомии, с нефростомией и с шинированием мочеточника. Зачастую преувеличивается возможность возникновения мочевых свищей, острогнойных осложнений в почке при глухом шве лоханки. Не решена лечебная тактика при несостоятельности шва анастомоза после операции Андерсена — Хайнса без нефростомии.
Цель работы — повышение эффективности операции Андерсена — Хайнса без и с нефростомией на основании анализа ближайших послеоперационных осложнений.
Во всех случаях применялась собственная модификация оригинальной операции Андерсена — Хайнса, принципиальным отличием которой является отсутствие языкообразного лоскута в нижней части резецированной лоханки. Оптимальным считался такой объем резекции, при котором достигалось соответствие объемов чашек и вновь сформированной лоханки. Важное значение уделялось микрохирургической технике формирования лоханочно-мочеточникового соустья, которая исключает образование клапанов, деформаций, сужений анастомоза и обеспечивает раннее восстановление пассажа мочи.
Операция Андерсена — Хайнса без нефростомии производилась в таких случаях:
1. При достаточной функции почки, сохраненной систолодиастолической активности внепочечной лоханки.
2. При отсутствии острогнойного воспаления в почке.
3. При полноценных тканях лоханки и широком диаметре мочеточника.
4. При адекватной резекции лоханки, отсутствии натяжения сшиваемых тканей лоханки и мочеточника.
Показаниями для операции Андерсена — Хайнса с нефростомией были:
- резкое снижение функции почки, тонуса и сократительной активности лоханки;
- гидронефроз, осложненный острогнойным пиелонефритом;
- истончение или воспалительная инфильтрация стенок лоханки и мочеточника, недостаточная резекция внутрипочечной лоханки, узкий просвет мочеточника;
- натяжение сшиваемых тканей лоханки и мочеточника;
- внутрипочечное кровотечение после удаления больших конкрементов.
Течение ближайшего послеоперационного периода изучено у 222 больных, подвергнутых операции Андерсена — Хайнса без нефростомии (157) и с нефростомией (65), при одно- и двустороннем гидронефрозе. Обострение хронического пиелонефрита отмечено в 16,6% случаев после пиелоуретеропластики без дренирования и в 36,9% — с дренированием почки. Острогнойных воспалений почек не выявлено. Обострение хронической почечной недостаточности констатировано соответственно в 4,5 и 7,7% наблюдений. Вторичное кровотечение из почечной паренхимы значительно реже наблюдалось после операции Андерсена — Хайнса без нефростомии (0,6%), чем с нефростомией (6,2%). Повторные оперативные вмешательства в ближайший послеоперационный период произведены в 2,3% случаев. У больных, оперированных без дренирования почки, они составили 1,9%, с дренированием — 3,1%. Вместе с тем, после пиелоуретеропластики без нефростомии выполнены только органосохраняющие операции — нефростомия с интубацией мочеточника (1), релюмботомии с ушиванием кровоточащих сосудов (2), тогда как после пластического вмешательства с нефростомией дважды произведены вторичные нефрэктомии.
Послеоперационное просачивание мочи в рану изучили на материале 264 больных, оперированных по Андерсену — Хайнсу. Несостоятельность шва пиелоуретерального соустья отмечена в 26 (14,4%) случаях из 180 пиелоуретеропластик без нефростомии. Погрешности в технике наложения швов на анастомоз стали причиной просачивания мочи из забрюшинного пространства в первые 2 сут после операции (7). Появление мочи на 3-е и последующие сутки расценивали как осложнение раневого процесса вследствие обострения пиелонефрита и повышения внутрилоханочного давления (19). Кроме того, несостоятельность шва пиелоуретерального соустья обусловливали неблагоприятная хирургическая анатомия (9), неадекватная резекция лоханки (6), чрезмерное натяжение лоханки и мочеточника при формировании анастомоза (5), воспалительная инфильтрация сшиваемых тканей (6).
Просачивание мочи в повязку чаще отмечено у пациентов, у которых гидронефроз осложнился пиелонефритом, камнеобразованием и хронической почечной недостаточностью. У 16 больных просачивание мочи прекратилось самопроизвольно. Им рекомендовались активный двигательный режим, обильное питье, прием растительных диуретиков, при обострении пиелонефрита дополнительно назначались антибиотики широкого спектра действия. У 10 пациентов не прослеживалась тенденция к уменьшению количества отделяемой из раны мочи. В таких случаях производилась ретроградная катетеризация лоханки, которая в 9 наблюдениях способствовала отхождению солей, слизи, сгустков крови и устраняла условия для несостоятельности шва анастомоза. У 1 больного (0,6%) катетеризация успеха не имела. Мочевой свищ закрылся после повторного оперативного вмешательства: нефростомии с интубацией мочеточника.
Просачивание мочи в рану после операции Андерсена — Хайнса с нефростомией отмечали значительно чаще — у 52 (61,9%) из 84 больных. В течение 1–2 сут после извлечения дренажа промокание повязки мочой отмечено в 45 случаях. У 4 пациентов истечение мочи длилось от 3 до 17 сут и также прекратилось самопроизвольно. Мочевые свищи не имели тенденции к заживлению у 3 больных с рецидивным сужением пиелоуретерального соустья. Им пришлось выполнить нефрэктомию (2), либо оставить нефростому пожизненно (1).
Следовательно, более благоприятное течение послеоперационного периода констатировано у лиц, оперированных по Андерсену — Хайнсу без нефростомии. Не оправдываются опасения тех урологов, которые предсказывали большое количество длительных мочевых свищей, острогнойных воспалительных осложнений почек и повторных органоуносящих операций. Внедрение собственной модификации операции Андерсена — Хайнса позволило сократить число осложнений, уменьшить послеоперационный койко-день и снизить инвалидность.
Тактика оперативного лечения гидронефроза у взрослых
Н.И. Симченко
Могилевская областная больница, Республика Беларусь
Введение. Гидронефроз отмечается сравнительно часто и занимает 6-е место среди заболеваний почек. По данным Marshall (1984), нижнеполярные добавочные сосуды при гидронефротической трансформации составляют 14–52%. В отличие от начальных стадий заболевания, когда органосохраняющий подход является общепринятым, при диагностировании гидронефроза III степени у взрослых многие авторы отдают предпочтение нефрэктомии. Частота органоуносящих вмешательств достигает 37% (Братчикова О.И. и соавт., 1997; Павловская З.А., 1999). Нефрэктомии ведут к инвалидизации больных трудоспособного возраста. Результаты функциональных методов исследования у взрослых с гидронефрозом при невосстановленном оттоке мочи не отражают реальных изменений почечной паренхимы и могут привести к выбору органоуносящей тактики. Изменения почки при терминальной А стадии гидронефроза в значительной степени обратимы, что позволяет у большинства больных выполнить реконструктивную операцию.
Материалы и методы. В течение 2008–2012 гг. в нашем отделении выполнено 28 органосохраняющих пластических операций больным в возрасте 25–45 лет с гидронефрозом IIIА степени. 4 больным с гидронефрозом IIIБ степени была выполнена нефрэктомия в связи с отсутствием паренхимы почки и ее функции. Всем пациентам проводили комплексное обследование, физикальные и лабораторные исследования, а также УЗИ, динамическую и статическую нефросцинтиграфию с лазиксом, эходопплерографию. После проведения УЗИ для уточнения метода операции выполнялась МСКТ с трехмерной реконструкцией изображения. Все больные — женского пола.
Результаты и обсуждение. Причиной гидронефроза было наличие добавочного нижнеполярного сосуда. Устранение добавочного сосуда не обеспечивает восстановления нормальной уродинамики мочевых путей, поскольку в стенке мочеточника возникают изменения анатомического характера. Выполнялась резекция ЛМС с реимплантацией мочеточника в лоханку. Реальная протяженность диспластических изменений в стенке мочеточника превышает определяемую при внешнем осмотре ЛМС. При выполнении реконструктивных операций осуществлялось внутреннее дренирование верхних мочевыводящих путей (интраоперационное стентирование мочеточника — 10 случаев) или сочетание его с нефростомией (18 случаев).
Выводы. Благодаря компенсаторной реакции неизмененных нефронов почка сохраняет свою функцию даже при значительно выраженном гидронефрозе, так как не все нефроны погибают в одно и то же время. Данные комплексного исследования позволяют утверждать, что терминальная IIIА стадия заболевания по существу таковой не является, а возникшие изменения в значительной степени обратимы. Радикальное иссечение диспластического сегмента прилоханочного мочеточника с последующим формированием анастомоза обеспечивает быструю и выраженную редукцию гидронефроза по сравнению с использованием диспластического сегмента мочеточника. Применение высокотехнологичных методов исследования (МСКТ, МРТ, виртуальная эндоскопия, эхо-допплерография) и лечения (современный шовный материал, внутреннее дренирование верхних мочевых путей) больных гидронефрозом способствовало получению хорошего функционального результата операций — 92%.
Тактика уролога при гидронефрозе ІІІ стадии в сочетании с мочекаменной болезнью и нефроптозом
И.М. Русинко1, А.В. Приходько1, А.В. Дулепин1, К.А. Троян1, Е.А. Квятковский2, Е.П. Украинец4, В.В. Коштура3
1КУ «Днепропетровское 12-е территориальное медицинское объединение Днепропетровского областного совета», Днепропетровск, Украина
2Городская клиническая больница № 9, Днепропетровск, Украина
3КУ «Городская поликлиника № 3», Днепропетровск, Украина
4КУ «Областная клиническая больница им. И.И. Мечникова», Днепропетровск, Украина
Вступление. Гидронефроз — устойчивое, прогрессивно нарастающее расширение чашечно-лоханочной системы с атрофией почечной паренхимы и нарушением ее функций, обусловленное нарушением оттока мочи.
Материалы и методы. Различают два вида гидронефроза: первичный, или врожденный и вторичный, или приобретенный. Гидронефроз бывает асептическим и инфицированным, открытым, закрытым и интермиттирующим. Выделяют 4 стадии течения гидронефроза (Терещенко А.В., 1981; Люлько А.В. и соавт., 1985):
- I стадия — пиелоэктазия;
- II стадия — пиелокаликоэктазия;
- III стадия — пиелокаликоэктазия с истончением ткани почки;
- IV стадия — пиелокаликоэктазия с отсутствием почечной паренхимы.
Результаты. Лечение больных гидронефрозом может быть консервативным и оперативным. Оперативное лечение при гидронефрозе может быть органоуносящим (нефрэктомия) и органосохраняющим, направленным на создание хорошо функционирующего ЛМС. Решающим фактором, определяющим характер вмешательства, является оценка сохранности паренхимы почки, произведенной во время операции.
Вопросами оперативного лечения гидронефроза мы занимаемся с 1977 г. Для иллюстрации вариантов течения гидронефроза ІІІ стадии в сочетании с различными заболеваниями и оперативной тактикой, предпринятой нами при этом, приводим два клинических случая.
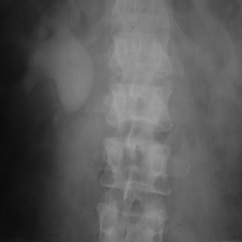
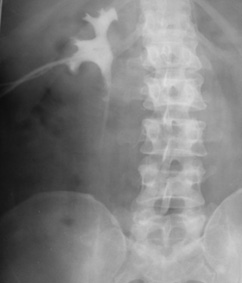
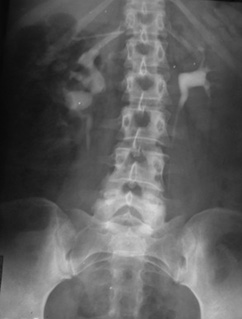
1. Гидронефроз по причине добавочного сосуда, осложненный нефролитиазом. Больной Н., 42 года, поступил с жалобами на боль в правом подреберье и правой поясничной области. Болеет около 5 лет. Не обследовался. Состояние резко ухудшилось последние 2 нед. На УЗИ Ro-урологически — выявлен конкремент верхней трети правого мочеточника, правосторонний гидронефроз ІІ–ІІІ стадии с резким нарушением функции почки (рис. 1). Через 4 ч собирательная система правой почки представляет собой большую полость. Конкремент находится на 2 см ниже нижнего контура полости почки. После обследования больному выполнена операция — правосторонняя уретеролитотомия, иссечение резко дилатированной рубцовоизмененной лоханки и 4 см рубцовоизмененной верхней трети мочеточника с сохранением добавочного нижнеполярного сосуда. Пластика правого ЛМС по Кучеру с нефростомией и дренированием мочеточника. По нефростомическому дренажу за первые 10 сут выделялось до 3500 мл мочи за сутки. На 21-й день после операции выполнена антеградная пиелография (рис. 2). Проходимость ЛМС хорошая. Удален мочеточниковый катетер и пережат нефростомический дренаж. Через сутки удален нефростомический дренаж. Мочевой свищ зажил в течение суток. Через 1,5 мес после операции больному выполнена контрольная экскреторная урография (рис. 3). Функция оперированной правой почки хорошая.

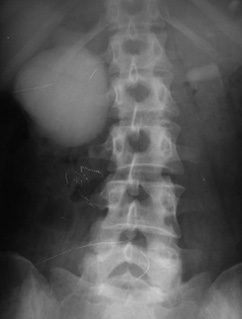
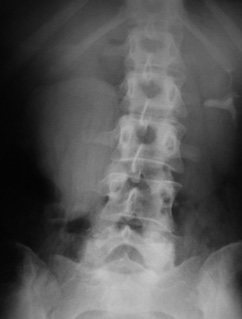
Другим заслуживающим внимания наблюдением является правосторонний гидронефроз ІІІ стадии в сочетании с нефроптозом. Больная Д., 34 года, поступила с жалобами на ноющую боль и вздутие в правом подреберье, слабость. Самостоятельно пальпировала опухолевидное образование в правом подреберье ближе к средней линии живота. Больная наблюдалась в частной клинике более 10 лет по поводу парапельвикальных кист правой почки. Впервые обследована у уролога онкологического диагностического центра, где заподозрена стриктура правого ЛМС. Направлена в наше отделение, где рентгеноурологически у больной установлен диагноз — стриктура правого ЛМС, правосторонний гидронефроз ІІІ стадии с резким снижением функции почки, правосторонний нефроптоз (рис. 4, 5). Больной выполнена операция — иссечение рубцовоизмененной перерастянутой лоханки, нижний уретерокаликоанастомоз с нефростомией и дренированием мочеточника. Правосторонняя нефропексия. Послеоперационное течение гладкое. По нефростоме за первые 12 сут выделялось до 2000 мл мочи за сутки. После выполнения антеградной пиелографии удален мочеточниковый дренаж. Проходимость мочеточниково-чашечного анастомоза хорошая. Пациентка выписана в удовлетворительном состоянии с улучшением под наблюдение уролога. Через год выполнена контрольная экскреторная урография — функция оперированной правой почки удовлетворительная, рецидива гидронефроза и нефроптоза нет (рис. 6).
Обструктивный мегауретер — варианты клинического течения
Э.А. Стаховский, О.Н. Гаврылюк, А.А. Кононенко, А.Э. Стаховский
Национальный институт рака,отделение пластической и реконструктивной онкоурологии, Киев, Украина
Обструктивный мегауретер — довольно частое заболевание у взрослых, которое характеризуется полиэтиологичностью, разнообразием терминологии и анатомо-функциональных изменений. Многолетний опыт лечения больных обструктивным мегауретером свидетельствует о том, что отсутствуют единые взгляды на этиологию, патогенез и лечение обструктивного мегауретера. Это диктует необходимость унификации терминологии и стадирования заболевания как нужных инструментов для формирования показаний к оперативному лечению и оценки его эффективности. В настоящее время недостаточно освещена этапность изменений функции, уродинамики и структуры верхних мочевыводящих путей при врожденном и приобретенном мегауретере. В основе развития мегауретера лежат сложные патогенетические механизмы (Стаховский Э.А., 1998), которые необходимо учитывать при выборе оперативного вмешательства.
Цель работы — изучить анатомо-функциональные изменения в почках и верхних мочевыводящих путях при обструктивном мегауретере и определить стадийность этих изменений.
Материал и методы. В основу данной работы положены результаты комплексного исследования 379 больных с обструктивным мегауретером. Средний возраст больных составил 33,5±0,5 года.
Особенности клинических проявлений нарушения уродинамики и функции почек при обструктивном мегауретере требовали специального клинико-лабораторного, рентгенорадиологического и функциональных методов исследования. Функциональное состояние почек оценивали на основании изучения клубочковой фильтрации (КФ) по клиренсу эндогенного креатинина. Определялись следующие параметры деятельности почек: содержание креатинина в плазме крови, величина КФ, канальцевая реабсорбция воды, индекс осмотической концентрации мочи. Рентгенологическое исследование мочевыводящих путей включало обзорную, диурезную урографию, экскреторную цистографию, уретроцистографию. По данным радионуклидной ренографии и динамической нефросцинтиграфии оценивали время максимальной секреции (Тmax), период полувыведения (Т½), показатель Винтера, определяли КФ и эффективный почечный плазмоток (ЭПП) раздельно для каждой почки и суммарно.
Морфологические исследования предусматривали изучение изменений в стенке расширенного мочеточника и области стриктуры. Производили морфометрию стенки мегауретера с определением толщины наличия каждого слоя — подслизистого, мышечного и адвентиции.
Результаты. В результате комплексного изучения было установлено, что расширение мочеточника следует рассматривать как симптомокомплекс, включающий обструкцию, расширение мочеточника и нарушение его функции. В основе развития обструктивного мегауретера лежат различные этиологические факторы: первичные — патологические изменения локализуются в мочеточнике, и вторичные, косвенно затрудняющие отток мочи по верхним мочевыводящим путям.
Клиническая картина обструктивного мегауретера в компенсированной стадии асимптоматична. Комплексы симптомов появляются при декомпенсированном мегауретере в результате нарушения уродинамики, присоединения инфекции и прогрессирущей эктазии мочеточника. Наиболее частым проявлением обструктивного мегауретера была боль (78%), локализовавшаяся в поясничной области, тупого характера. При вторичном мегауретере, вызванном инфравезикальной обструкцией, ведущим симптомом являлась дизурия, характеризующаяся учащенным, затрудненным мочеиспусканием, истончением струи мочи. Данные симптомы сопровождались наличием хронической задержки мочи.
Вариабельность анатомо-функциональных изменений при обструктивном мегауретере позволила выделить 5 вариантов клинического течения, которые соответствуют стадиям развития мегауретера.
I стадия заболевания (14 мочеточников) характеризовалась сохранной функцией почки, нормальной сократительной активностью мочеточника, иногда с умеренной гиперкинезией, незначительным расширением мочеточника, которое проявлялось в виде стаза мочи. После введения лазикса рентгеноконтрастное вещество без задержки выводилось из мочевых путей. Секреторно-экскреторные процессы характеризовались незначительным замедлением Т½ радиофармпрепарата из почки и незначительным снижением ЭПП 253±6 мл/мин на стороне поражения. КФ на стороне поражения составила 48,5±3,5 мл/мин.
II стадия (55 мочеточников) проявлялась нормальной или умеренно сниженной функцией почки, расширением нижней трети мочеточника при сохранении нормальной или повышенной сократительной активности в вышележащих отделах мочеточника. После введения лазикса выявлена положительная динамика пассажа мочи. В этой группе отмечалось умеренное замедление времени секреции и выраженное замедление экскреции. ЭПП — 211,6±13 мл/мин; КФ — 42,4±2,3 мл/мин. Следует отметить, что у 34 больных с полимегакаликозом выявлено нарушение секреторно-экскреторных процессов и КФ.
III стадия (126 мочеточников) характеризовалась умеренным снижением функции почки, эктазией мочеточника по всей длине с уменьшением сократительной функции мочеточника и выраженной его дилатацией. В этой стадии прогрессивно ухудшались секреторно-экскреторные процессы в мочевыводящих путях. ЭПП — 174,4±11,8 мл/мин; КФ — 33,4±3,5 мл/мин. Использование лекарственных средств с целью стимуляции диуреза усиливало эктазию мочевыводящих путей, а при радионуклидном исследовании не влияло на конфигурацию ренограммы. Эти признаки свидетельствуют о наличии устойчивой обструкции и декомпенсированной функции мочеточника.
IV стадия (269 мочеточников) характеризовалась выраженными анатомо-функциональными нарушениями: резким снижением функции почек в результате эктазии мочеточника и чашечно-лоханочной системы почки, отсутствием их сократительной активности либо спонтанными, асинхронными сокращениями. Полостная система почек и мочеточники контрастируются на отстроченных снимках. Ренограмма имеет вид восходящей кривой. На этой стадии заболевания отмечается выраженное снижение ЭПП — 136,3±10,4 мл/мин и КФ — 24,1±2,7 мл/мин. Применение диуретиков дало положительный эффект у 80 больных, в остальных случаях повышения диуреза и расширения полостной системы не отмечено.
V стадия (40 мочеточников) характеризовалась утратой функции почки и выраженной атонией мочеточника. При комплексном исследовании у больных этой группы установлены необратимые изменения в почке. ЭПП 78,7±6,6 мл/мин; КФ — 14,2±1,8 мл/мин. Радионуклидная кривая имела изостенурический вид. Эти изменения носили односторонний характер.
Проведенные рентгенорадиологические исследования показали, что обструктивный мегауретер имеет определенные стадии развития, в конечном итоге приводящие к утрате функции почки.
В основе уродинамических нарушений при обструктивном мегауретере лежат изменения морфологических структур мочевыводящих путей. Изучение стенки расширенного мочеточника при различных видах его обструкции свидетельствует, что в основе патологических изменений лежит соединительно-тканное замещение мышечного и подслизистого слоев. Степень этих изменений прямо пропорциональна эктазии мочеточника. В нарушении сократительной способности мочеточника основное значение имеют склеротические изменения. Это проявляется в нарушении синцитиоподобного строения лейомиоцитов путем их разобщения волокнами соединительной ткани. Этот процесс лежит в основе нарушения трофики — микроциркуляции, иннервации стенки мегауретера.
Преимущественно гипертрофические изменения мышечной оболочки были выявлены у больных с травматическими повреждениями стенки мочеточника. При морфологическом анализе изменений у больных с врожденным мегауретером отмечено значительное уменьшение объема гладкомышечных слоев по сравнению с нормой. Мышечные пучки были уменьшены в размерах и, как правило, замурованы в грубоволокнистую соединительную ткань. Доля мышечной ткани сокращалась и составляла около 20% всей толщины стенки. Гладкомышечные пучки истончены и часто разделены соединительнотканными муфтами. В случаях выраженной эктазии мочеточника (диаметром >3 см) мышечные слои почти полностью замещались соединительной тканью, лишь очагово определялись истонченные пучки лейомиоцитов. Фактически вся стенка мочеточника представляла собой единое фиброзное образование с лимфоидноклеточной инфильтрацией.
Анализ комплексного исследования показал, что в основе развития мегауретера лежит нарушение пассажа мочи по мочеточнику, приводящее к нарушению сократительной деятельности мочеточника, гибели его мышечных клеток и нарушению функции почки. В то же время эти процессы могут развиваться в течение длительного времени. Это обусловлено защитными компенсаторными механизмами, которые заложены в органах мочевыводящих путей. Следует подчеркнуть, что продвижению мочи из почки в мочевой пузырь способствуют три фактора: давление, создаваемое нефроном, перистальтика и гидростатическое давление.
При обструкции пузырно-уретерального сегмента в первую очередь нарушается перистальтика мочеточника, ответственная за продвижение мочи от лоханки до мочевого пузыря. Степень ее нарушения прямо пропорциональна эктазии мочеточника. Перистальтика характеризуется снижением амплитуды и отсутствием формирования болюса мочи. Участки, где эктазия мочеточника в диаметре превышала 2 см, характеризовались адинамией.
Потеря эффективного продвижения мочи в виде болюса объясняется нарушением сократительной способности мочеточника и его эктазией. Самосохранение почки при обструктивном мегауретере обусловлено тем, что неэффективность перистальтики компенсируется гидростатическим давлением мочи выше обструкции. Эктазия мочеточника, с одной стороны, вызывает повышение интралюминального давления, с другой — расширение мочеточника служит защитным буфером, предохраняющим почку от повышения внутрилоханочного давления, то есть, при потере эффективной перистальтики благодаря повышению интралюминального давления и эктазии увеличивается столб гидростатического давления в мочеточнике. Это способствует транспорту мочи и сохранению уродинамики при нарушении проходимости пузырно-мочеточникового сегмента. Существованием компенсаторно-приспособительного механизма объясняются сохранность функции почки и отсутствие параллелизма между дилатацией мочеточника и функцией почки. В тех случаях, когда обструкция пузырно-мочеточникового сегмента приводит к повышению внутрилоханочного давления, превышающего давление КФ, отмечается прогрессивное ухудшение функции почки.
Результаты комплексного изучения верхних мочевыводящих путей, выполненные в различные сроки заболевания, свидетельствуют о стадийности развития обструктивного мегауретера и необходимости осуществления раннего оперативного вмешательства. Ухудшение функции почки неизбежно, пока не восстановлено адекватное прохождение мочи по мочеточнику в мочевой пузырь.
Кишкова пластика сечоводу в лікуванні рецидивної обструкції верхніх сечових шляхів
В.А. Котов, О.А. Войленко, Ю.В. Вітрук, О.Е. Стаховський, О.А. Кононенко, Е.О. Стаховський
Національний інститут раку, відділення пластичної та реконструктивної онкоурології, Київ, Україна
Вступ. Рецидивна обструкція сечоводів (РОС) викликає грубі зміни в його стінці, порушення евакуаторної функції по верхніх сечових шляхах (ВСШ), що, в свою чергу, зумовлює пієлонефрит, гідронефротичну трансформацію нирки, а в разі ураження єдиної функціонуючої нирки або двобічної патології — хронічну ниркову недостатність (ХНН). Протяжні ураження сечоводів вимагають використання кишкового трансплантата з метою відновлення пасажу сечі по ВСШ. Тонкокишковий трансплантат відновлює анатомічну цілісність та прохідність ВСШ, а також за рахунок пристальтичних скорочень сприяє активному проходженню болюсу сечі у сечовий міхур. Заміщення сечоводу сегментом тонкої кишки дозволяє позбавити хворого від довічної сечової стоми або нефректомії.
Мета роботи — визначення ефективності уретероілеопластики в лікуванні РОС.
Матеріал та методи. Клинічний матеріал становили 42 хворих, що раніше були оперовані з приводу уретерогідронефрозу, а в післяопераційний період у них діагностована РОС. У подальшому з метою відновлення пассажу сечі по ВСШ їм виконана кишкова пластика сечоводу (однобічна — 34 (80,9%), двобічна — 8 (19,1%)). При двобічній уретероілеопластиці використовувався один кишковий трансплантат, що розташовувався ізоперистальтично. Парціальна уретероілеопластика виконана у 11 (26,1%), субтотальна — у 19 (45,2%), тотальна — у 12 (28,6%) хворих. Середній вік пацієнтів становив 31 (±3,7) рік, чоловіків — 24 (57,1%), жінок — 28 (42,9%). Незадовільні результати первиних операцій у 32 пацієнтів зумовили виконання нефростомії (однобічна — 28, двобічна — 6). Всім хворим (n=42) проведено комплексне обстеження, яке включало клініко-лабораторні, ренгенорадіологічні та інструментальні методи дослідження. З метою запобігання міхурово-кишковому рефлюксу у 8 (19,7%) хворих дистальний відділ кишкового трансплантата моделювався за методикою інтраілеальної пластики Е.О. Стаховського, що передбачало формування в місці кишково-міхурового анастомозу двох окремих каналів. Операції, що передували виникненню РОС: уретероцистонеостомія (УЦНС) — 35, резекція уретероцеле — 3, апендикулярна пластика сечоводу — 2, операція Боарі — 2. Віддалені результати вивчені у 34 (80,9%) хворих в строки від 3 міс до 25 років. Оцінка ефективності оперативного лікування виконувалася за 3-бальною шкалою.
Результати. У 28 (82%) з 34 хворих (що обстежені у віддалений післяопераційний період) уродинаміка була відновлена. Оцінка віддалених результатів: добрий — 21 (61,7%), задовільний — 7 (20,5%) та незадовільний — 6 (17,6%). Ускладненням раннього післяопераціоного періоду були неспроможність сечовідно-кишкового анастомозу — 1, що потребувало нефростомії, а в подальшому реанастомозування; гостра кишкова непрохідність — 1, що зумовило виконання обвідного кишкового анастомозу; загострення пієлонефриту — 8; загострення ХНН — 11. Ускладненнями пізнього післяопераційного періоду були стриктури сечовідно-кишкового — 5, кишково-міхурового — 3 анастомозів, міхурово-кишковий рефлюкс — 5, загострення пієлонефриту — 12, прогресування ХНН — 8. Реанастомозування сечовідно-кишкового з’єднання виконано у 4 пацієнтів. Нефректомія після кишкової пластики сечоводу у віддалений післяопераційний період виконана 7 (16,6%) хворим. У 2 випадках виникла кила післяопераційного рубця, що потребувало пластики передньої черевної стінки. У 6 хворих з нейрогенними змінами в сечовому міхурі в подальшому виконувалась катетеризація сечового міхура, хірургічна корекція інфравезикальної обструкції — 4.
Висновки. Заміщення сечоводу тонкокишковим трансплантатом ефективна у хворих з роздільною клубочковою фільтрацією ≥20 мл/хв. З метою запобігання міхурово-кишковому рефлюксу ефективне застосування інтраілеальної пластики за методикою Е.О. Стаховського з формуванням в дистальному відділі кишкового трансплантата двох окремих каналів. Уретероілеопластика при рецидивній обструкції сечоводу є альтернативою довічній сечовій стомі або нефректомії. Спайкова хвороба кишечнику, нейрогенний сечовий міхур, інфравезикальна обструкція є протипоказанням до виконання уретероілеопластики сечоводу.
Модифікація реконструктивно-відновлювальних операцій Demel — Дерев’янко при високих стриктурах тазового відділу сечоводу
Л.П. Саричев1, А.Ф. Філоненко2, С.А. Сухомлин1, Я.В. Саричев1, Ю.В. Курячий2
1ВДНЗУ «Українська медична стоматологічна академія»,
кафедра урології, медичної сексології з анестезіологією та інтенсивною терапією, Полтава, Україна
2Полтавська обласна клінічна лікарня ім. М.В. Скліфосовського, Україна
З підвищенням хірургічної активності в акушерсько-гінекологічній практиці, онкології та урології збільшується частота пошкоджень тазового відділу сечоводу з сечовою інфільтрацією тканин та розвитком високих стриктур сечоводу.
При дефектах до 8 см утворення анастомозу стає можливим за умов мобілізації сечового міхура та Psoas Hitch Procedure. При більш високих стриктурах сечоводу частіше виконують уретероцистоанастомоз за Hook-Boari (1893). Недоліком означеної операції вважають склерозування неостоми з гідронефротичною трансформацією нирки. Вищезазначене зумовило пошук шляхів підвищення ефективності реконструктивно-відновлювальних операцій при високих стриктурах тазового відділу сечоводу.
Проведений аналіз віддалених результатів оперативного лікування 27 хворих віком 26–69 років з високими стриктурами тазового відділу сечоводу — 8–14см, які перебували на лікуванні в урологічному відділенні Полтавської обласної клінічної лікарні ім. М.В. Скліфосовського (2003–2012 рр.). Чоловіків — 11, жінок — 16. Причиною високих стриктур сечоводу у 14 були ушкодження під час акушерських та гінекологічних операцій, у 2 випадках — онкологічна патологія, у 11 — сечокам’яна хвороба.
Операцію Demel — Дерев’янко (1924; 1979), доповнену подвійним антирефлюксним захистом, виконували через 2–4 міс після ятрогенного ушкодження сечоводу. Сечовий міхур мобілізували та пересікали впоперек з протилежного ураженому сечоводу боку: чим протяжнішим був дефект сечоводу, тим нижче виконували розтин сечового міхура та ширший клапоть викроювали для формування трубки. Без натягування культю сечоводу занурювали у попередньо сформований підслизовий тунель довжиною 3 см і фіксували зовні до сечового міхура 3 вузловими швами (хромований кетгут 3/0–4/0). Близько 1 см сечоводу виводили у сечовий міхур, формували манжетку Рікардо і фіксували до стінки сечового міхура 3 вузловими швами (хромований кетгут 3/0–4/0). Проводили інтубацію сечоводу катетером-стентом типу «pig-tail» 6–8 F. Сформовану трубку і сечовий міхур зашивали наглухо синтетичними швами (вікрил 2/0–4/0) і дренували балон-катетером Foly 18–20F, який видаляли на 10–12-ту добу після операції. Катетер-стент видаляли через 1–1,5 міс після операції.
При контрольному обстеженні в строки від 1 до 10 років в усіх пацієнтів сформована трубка забезпечувала задовільний пасаж сечі. У 3 випадках (11%) виявлено міхурово-сечовідний рефлюкс, який не супроводжувався гідронефротичною трансформацією нирки.
Уретерокаликоанастомоз — современный подход к старой операции
В.Н. Лесовой1, Д.В. Щукин1, И.А. Гарагатый1, И.М. Антонян2, П.В. Мозжаков1, Г.Г. Хареба1, В.В. Мегера2
1Харьковский национальный медицинский университет, Украина
2Харьковский областной центр урологии и нефрологии им. В.И. Шаповала, Украина
3Харьковская медицинская академия последипломного образования, Украина
Введение. Протяженные стриктуры верхней трети мочеточника, выраженный рубцовый процесс в области лоханки, а также гидронефроз у пациентов с внутрипочечной лоханкой являются показаниями к выполнению одного из вариантов сложной пластической реконструкции верхних мочевых путей — уретерокаликоанастомоза. В последние годы данная операция выполняется крайне редко из-за своей сложности и большой частоты стриктур анастомоза. Мы проанализировали ранние результаты уретерокаликоанастомоза у небольшой серии пациентов.
Материал и методы. В исследование включено 10 пациентов, которые были оперированы в клинике с 2011 по 2013 г. У 8 из них отмечалась мочекаменная болезнь, у 1 — выраженный фиброз в области внутрипочечной лоханки, еще у одной пациентки выявлен ретроперитонеальный фиброз с поражением мочеточников и лоханок обеих почек. В качестве первичной операции уретерокаликоанастомоз выполнен у 5 больных. В одном наблюдении анастомоз накладывался при проведении аутотрансплантации почки. Хорошее функциональное состояние почки отмечали у 7 из 10 пациентов. Толщина паренхимы <10 мм зафиксирована у 3 больных, в остальных наблюдениях этот параметр составлял ≥16 мм.
Техника уретерокаликоанастомоза включала резекцию нижнего полюса почки с выделением нижней чашки в условиях тепловой ишемии. Следующим этапом выполняли тщательное ушивание поврежденных сосудов и накладывали анастомоз между чашкой и мочеточником после снятия сосудистого турникета. В двух случаях с гемостатической целью паренхима почки прошивалась п-образными швами. Мочеточниковый стент удаляли через 2 мес после операции. Результаты оценивали на основании анализа жалоб пациентов, клинической картины, данных ультрасонографии, МСКТ или экскреторной урографии.
Результаты. Среднее время тепловой ишемии почки составило 12,2 мин (от 7 до 20 мин). Во всех случаях анастомоз накладывался в условиях хорошей видимости без какого-либо натяжения. Значительных послеоперационных осложнений, связанных с резекцией почки, не выявлено. Ранние результаты отслеживали у 7 пациентов. Сроки наблюдения варьировали от 2 до 24 мес (в среднем 8,4 мес). Хорошие функциональные результаты отмечены у всех оперированных больных. Однако ретенционные изменения сохранились у 2 пациентов с толщиной почечной паренхимы 7–9 мм.
Выводы. Уретерокаликоанастомоз обеспечивает хорошие функциональные результаты у большинства больных со сложной или рецидивной патологией лоханочно-мочеточникового сегмента. Приоритеты такого подхода мы видим в анастомозировании неизмененных тканей нижней чашки и мочеточника, а также в том, что анастомоз накладывается в условиях хорошей видимости. Однако необходим дальнейший анализ результатов, полученных в более длительные сроки наблюдения
Уретерогидронефроз — оптимизация лечебной тактики
Э.А. Стаховский
Национальный институт рака, отделение пластической и реконструктивной онкоурологии, Киев, Украина
Обструкция мочеточников, ведущая к гидронефротической трансформации, пиелонефриту, хронической почечной недостаточности, инвалидности и, в конечном итоге, к летальному исходу, является сложной трудно разрешимой проблемой в урологии. В широком освещении материалов проблемы используют различные термины, создано множество классификаций, имеются разногласия относительно показаний, тактики и объема оперативного лечения. Следует также подчеркнуть, что в предложенном большом количестве методов хирургического лечения часто не учитываются морфофункциональные изменения, лежащие в основе обструктивного мегауретера, вследствие чего лечение оказывается малоэффективным, часто заканчивается рецидивом и развитием новых осложнений.
Цель работы — оптимизировать оперативное лечение в зависимости от этиологии, анатомо-функциональных изменений и стадии заболевания.
Материал и методы. В основу работы положены результаты комплексного исследования и оценки эффективности оперативного лечения 417 больных с обструктивным мегауретером, средний возраст — 33,5±0,5 года. Больным проведен комплекс диагностических мероприятий, включающий общеклинические, лучевые, функциональные, патоморфологические, биохимические и биофизические методы исследования. Одним из важных аспектов проблемы обструктивного мегауретера является отбор данных, позволяющих установить диагноз и показания к оперативному лечению. Несмотря на появление новых методов исследования — компьютерная томография, ядерно-магнитный резонанс, ультразвуковое исследование, рентгенография остается ведущим методом в установлении диагноза мегауретера. В частности, диурезная экскреторная урография с большой степенью точности позволяет выявить обструкцию мочеточника и оценить анатомо-функциональные изменения в верхних мочевыводящих путях.
Результаты и их обсуждение. Результаты исследований показали, что расширение мочеточника — мегауретер следует рассматривать как симптомокомплекс, включающий обструкцию, расширение мочеточника и нарушение его функции. Анализ причин мегауретера позволил распределить их на 2 группы — первичные и вторичные. К первичным отнесли патологические изменения, локализующиеся в самом мочеточнике — врожденное сужение пузырно-мочеточникового соустья (38,3%), приобретенная стриктура мочеточника (15,3%), эктопия устьев (2,1%), уретероцеле (9,2%), полип мочеточника (0,5%). Ко вторичным — заболевания, косвенно затрудняющие пассаж мочи по верхним мочевым путям, — склероз предстательной железы (14,7%), клапан (2,1%) или стриктура (2,4%) уретры, сосудистая аномалия (1,6%), ретроперитонеальный фиброз (2,4%).
Анализ клинического материала позволил сформулировать показания и противопоказания к оперативному лечению обструктивного мегауретера. Операция показана при неэффективности консервативного лечения; прогрессировании мегауретера; рецидивировании пиелонефрита, боли, артериальной гипертензии; прогрессировании почечной недостаточности. Операция противопоказана в случаях отсутствия нарушения функции почки при уродинамике в стадии компенсации, терминальной почечной недостаточности, декомпенсации сопутствующих заболеваний. От оперативного вмешательства можно временно воздержаться у больных с I и II стадией мегауретера. Эти случаи должны характеризоваться отсутствием жалоб, незначительным расширением мочеточника, нормальной секреторной функцией почек, отсутствием инфекции в мочевыводящих путях.
В настоящее время для восстановления пассажа мочи по мочеточнику используется широкий диапазон корригирующих оперативных вмешательств. Анализ результатов хирургических вмешательств позволил разработать классификацию операций при обструктивном мегауретере. В зависимости от этиологии, патогенеза обструкции, а также анатомо-функциональных изменений в мочевыводящих путях были применены следующие виды операций: пластические, реконструктивные, восстановительные и органоуносящие (табл. 1).
Таблица 1. Виды пластических операций при обструктивном мегауретере
| Метод операции | Количество больных | Количество мочеточников |
|---|---|---|
| Уретероцистонеостомия Лидбеттера — Политано Рикардо — Бемингауза Хендрена Интрауретеральная пластика Кохена Боари Пластика уретероцеле Иссечение уретероцеле Уретеро-уретероанастомоз |
38 54 23 56 8 6 8 14 11 |
41 60 29 61 11 6 13 19 11 |
| Всего | 219 | 252 |
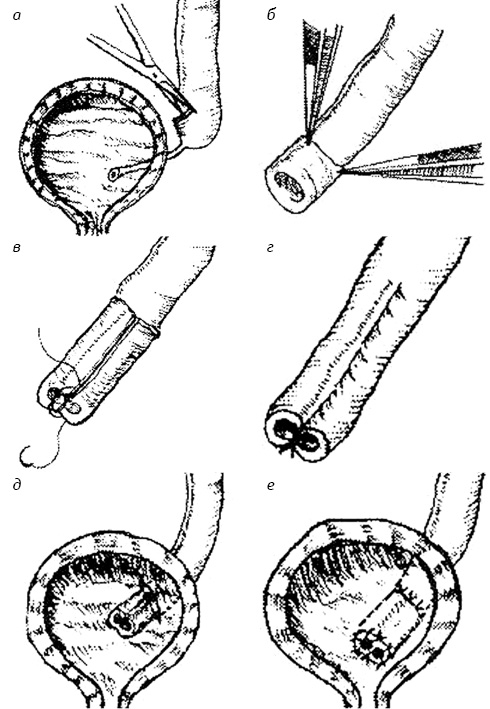
Пластические операции были выполнены 219 (52%) больным. К пластическим операциям отнесены оперативные вмешательства на мочеточнике или пузырно-мочеточниковом сегменте, предусматривающие устранение обструкции с последующим восстановлением целостности мочевого тракта. Пластические операции, направленные на восстановление проходимости пузырно-мочеточникового сегмента, должны, с одной стороны, устранить обструкцию и восстановить пассаж мочи по мочеточнику, а с другой — предотвратить развитие рефлюкса и стриктуры анастомоза. Чтобы удовлетворить этим требованиям, уретероцистонеостомию выполняли с созданием антирефлюксного механизма. В тех случаях, когда эктазия мочеточника не превышала 1 см в диаметре, мочеточник при имплантации в мочевой пузырь не моделировался. В случаях, когда расширение мочеточника >1 см, использовали различные методы моделирования. В этих случаях нецелесообразно моделирование всего мочеточника, как предлагают некоторые авторы, также как и двухэтапное моделирование. Следует помнить, что моделирование мегауретера производится в условиях выраженных трофических нарушений в стенке мочеточника и замещения мышечного слоя соединительной тканью. Поэтому резекция расширенного мочеточника по всей его длине связана с риском ишемии и способствует усугублению склеротических изменений. Среди операций, предусматривающих моделирование мочеточника при мегауретере, наиболее физиологичной и патогенетически обоснованной является разработанный нами способ уретероцистонеостомии с интрауретеральной пластикой (Stakhovskyi Е., 1990). Этот метод предусматривает минимальную травму при сохранении целостности стенки, кровоснабжения и иннервации. Метод позволяет эффективно использовать весь просвет мочеточника для восстановления пассажа мочи и в тоже время достичь эффективного соотношения длины и ширины его имплантируемой части как 5 : 1 (рис. 1).
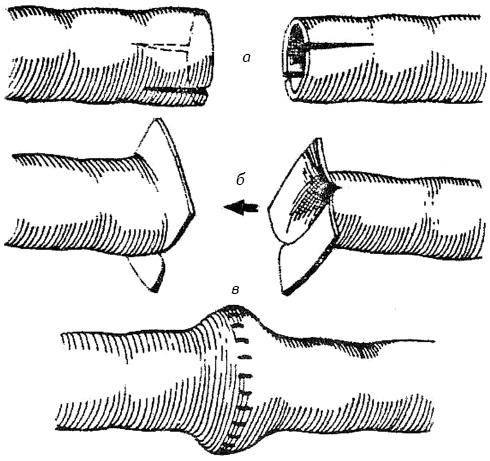
В группу пластических операций вошли оперативные вмешательства, предполагающие восстановление мочеточника конец в конец. Существующие до настоящего времени методы не предусматривают профилактику стриктуры анастомоза, что является наиболее частым их осложнением. Поэтому мы применили новый способ пластики трубчатых полых органов, при котором окружность анастомоза в 2 раза больше, чем окружность мочеточника, что предотвращает развитие стриктуры анастомоза (рис. 2) (авторское свидетельство № 1577768, 1990 г.).
Реконструктивные операции предусматривали восстановление пассажа мочи путем реконструкции мочевого тракта. С этой целью использовали замещение мочеточника отрезком тонкой кишки или червеобразным отростком, аутотрансплантацию почки (табл. 2).
Таблица 2. Виды реконструктивных операций при обструктивном мегауретере
| Вид операции | Количество больных | Количество мочеточников |
|---|---|---|
| Интестинальная пластика мочеточника | 73 | 95 |
| Аппендикулярная пластика мочеточника | 5 | 5 |
| Аутотрансплантация почки | 2 | 2 |
| Всего | 80 | 102 |
Они выполнялись при необратимых изменениях или обширных дефектах мочеточника и являлись альтернативой нефрэктомии или пожизненной нефростомии. Использование подвздошной кишки было обусловлено ее анатомо-физиологическими особенностями — хорошей мобильностью, кровоснабжением и сократительной способностью. Кишечный трансплантат, выкроенный из подвздошной кишки, легко размещается изоперистальтически для замены левого, правого или обоих мочеточников.
Противопоказания к интестинальной пластике мочеточника: инфравезикальная обструкция, хроническая почечная недостаточность — терминальная стадия, болезнь Крона, илеит, спаечная болезнь кишечника.
Реконструктивные операции предусматривают сохранение функционирующей почки. Их широкое внедрение позволит уменьшить количество нефрэктомий и инвалидизацию больных с обструктивным мегауретером.
Восстановительные операции при обструктивном мегауретере предусматривали восстановление пассажа мочи путем устранения причин, косвенно влияющих на функцию мочеточника. В эту группу отнесены следующие виды оперативных вмешательств: у 56 (13,4%) больных склерозом предстательной железы выполнена простатэктомия; у 8 (1,9%) — удаление клапана уретры; у 9 (2,6%) — пластика уретры по поводу ее стриктуры; у 1 (0,2%) — иссечение добавочного сосуда и еще в 1 (0,2%) случае — делиберация мочеточника.
Из 417 больных органоуносящие операции проведены у 43 (10,3%), из них у 3 (0,6%) — гемирезекция верхней половины удвоенной правой почки. Показанием к выполнению органоуносящей операции являлась терминальная стадия мегауретера.
У 154 (37%) больных в послеоперационный период отмечали различные осложнения, которые удлиняли время выздоровления, а в ряде случаев были причиной повторной операции. У 4 (1%) пациентов послеоперационные осложнения привели к летальному исходу. Причиной смерти явились тромбэмболия легочной артерии (2), перитонит (1), острая сердечно-сосудистая недостаточность (1).
Отдаленные результаты изучены у 313 больных в сроки от 6 мес до 15 лет. В 82% случаев оперативное лечение было эффективным. Обязательным условием положительного результата стали прекращение прогрессирования мегауретера, сохранение функции почки и уродинамики. Неудовлетворительные результаты у 35 (8,4%) больных диктовали необходимость выполнения повторной операции. Такой подход позволил в общей сложности получить 91% положительных результатов.
Выводы. Успех оперативного лечения обструктивного мегауретера зависит от этиологии, правильной оценки функционального состояния почки и мочеточника, а также выбора метода оперативного лечения. Патогенетически обосновано применение пластических, реконструктивных и восстановительных операций при обструктивном мегауретере, которые адекватно восстанавливают пассаж мочи по верхним мочевыводящим путям и сохраняют функцию почки.
Оцінка ефективності магнітно-резонансної урографії з діуретичним навантаженням в діагностиці уретерогідронефрозу
О.М. Гаврилюк, Т.С. Головко, Ю.В. Вітрук, О.А. Войленко, О.І. Яцина
Національний інститут раку, Київ, Україна
Вступ. У діагностиці дилатації верхніх сечових шляхів (ВСШ) променеві методи відіграють вагому роль, впливають на формування діагнозу та подальшу тактику лікування. Традиційні рентгенологічні методики дають уяву про анатомо-функціональний стан ВСШ, однак обмежені у визначенні причини обструкції. При афункційній нирці, слабкому контрастуванні сечовивідних шляхів, нирковій недостатності діагностичне значення рентгенологічних методів знижується.
Можливості магнітно-резонансної томографії (МРТ) ширші. МР-урографія з діуретичним навантаженням входить в сучасні протоколи дослідження, рекомендовані міжнародними урологічними асоціаціями.
Мета роботи — оцінити можливості МР-урографії із застосуванням діуретичного навантаження в діагностиці уретерогідронефрозу (УГН).
Матеріали та методи. Аналізували дані 75 хворих на інвазивний рак сечового міхура, що перебували на лікуванні у відділенні пластичної та реконструктивної онкоурології з 2010 по 2012 р., в яких основне захворювання ускладнилося УГН. Вік хворих становив 27–73 (55,7±8,8) роки. Чоловіків — 52 (69,3%), жінок — 23 (30,7%).
Всі пацієнти обстежені за методикою МР-урографії в режимі гідрографії на МР-томографі Sіgna Ovation 0.35T фірми «General Еleсtriс». Застосовували адаптовані МР-протоколи для визначення анатомо-функціонального стану ВСШ та сечового міхура.
Для діагностики стану ВСШ по оптимальному зрізу виконувалась розмітка для отримання зображень в корональній площині зважених по Т2. Потім пацієнтам вводили внутрішньовенно лазикс з розрахунку 0,8 мг/кг маси тіла. У протокол дослідження входило сканування в аксіальній площині в Т1 та Т2 зважених зображеннях та сагітальній площині в Т2. Проводили сканування в корональній площині в режимі пригнічення жиру з зоною дослідження, що включає ВСШ та сечовий міхур. В протокол включено обов’язкове застосування парамагнетичних контрастних засобів в Т1 зважених зображеннях.
Оцінювали положення, форму, розмір, стан ВСШ та сечового міхура до та після фармакологічного тесту. При оцінці УГН аналізували товщину паренхіми нирки, ступінь та форму розширення ЧМК, функціональний стан дилатованого сечоводу, рівень та причину обструкції.
Результати. У результаті дослідження однобічний УГН діагностовано у 60 (80%), а двобічний — у 15 (20%) пацієнтів. Оцінюючи стан нирок та ВСШ, прийшли до висновку про можливість класифікувати УГН за допомогою МРТ.
Варіабельність анатомо-функціональних змін дозволила виділити 5 стадій. Ознаками УГН І стадії було незначне розширення сечоводу, яке виявлялось у вигляді стазу сечі. Після внутрішньовенного введення лазиксу сеча вільно проходить через ВСШ. Паренхіма нирки збережена. Порожниста система нирки нерозширена. Такий вид порушень був діагностований у 24 (32%) пацієнтів.
Для УГН ІІ стадії характерно розширення нижньої третини сечоводу, після введення лазиксу відмічали посилення діурезу та ектазію сечоводу. Паренхіма нирки збережена, виявлено розширення миски та чашечок (полімегакалікоз). УГН ІІ стадії відмічено у 27 (36%) хворих.
Нерівномірне стоншення паренхіми нирки, деревоподібна деформація розширеного чашечко-мискового комплексу, дилатація сечоводу по всій довжині та після введення лазиксу — посилення ектазії вище обструкції — характерні ознаки УГН ІІІ стадії, що виявлені у 17 (22,7%) пацієнтів.
Для УГН IV стадії характерна значна ектазія ЧМК, сечовід різко розширений, коліноподібно звитий. Введення лазиксу або неефективне, або ефект незначний, скоротливі властивості ВСШ відсутні або хаотичні. Внаслідок змін паренхіма нирки стоншена, візуалізується фрагментарно, що діагностовано у 4 (5,3%) хворих.
УГН V стадії діагностовано у 3 (4%) пацієнтів, він характеризувався вираженою атонією розширеного сечоводу, паренхіма нирки стоншена у вигляді полікістозного утворення.
Практично завжди застосування МРТ, МР-урографії дозволяє виявити причину обструкції.
Висновки. МР-урографія — перша методика, що дозволяє візуалізувати ВСШ без інвазивного втручання, променевого навантаження та застосування контрасту, є високоінформативним методом дослідження при обструктивних процесах ВСШ. Методика не потребує використання контрастних засобів, може проводитись пацієнтам з вираженою нирковою недостатністю, з алергічними реакціями на йодовмісні контрасти. Практично завжди застосування МР-урографії дозволяє крім рівня обструкції, ступеня дилатації сечовивідних шляхів, виявити інтра- та екстрапорожнинну причину обструкції. Як показало дослідження, МРТ є перспективним альтернативним методом візуалізації ВСШ.
Причини пошкодження сечоводів при онкологічних захворюваннях
О.А. Кононенко, О.А. Войленко, П.С. Вукалович, О.Ю. Столярова, В.А. Котов, Ю.В. Вітрук
Національний інститут раку, Київ, Україна
Вступ. За останні десятиріччя частота пошкоджень верхніх сечовивідних шляхів значно зросла. Це пов’язано з розширенням показань до оперативного лікування злоякісних новоутворень малого таза, товстої кишки, широким впровадженням у практику ендоурологічних, лапароскопічних втручань і частим застосуванням великофракційного опромінення.
Частота пошкоджень сечоводів коливається в широких межах. В акушерсько-гінекологічній практиці ятрогенні травми сечоводів (ЯТС) виявляють у 0,5–30%, онкопроктології — в 0,9–10% випадків. Нерідко відзначають пошкодження сечоводу в ангіохірургії, урології та абдомінальній хірургії.
Мета дослідження. Вивчити причини виникнення ЯТС при онкологічних захворюваннях.
Матеріали та методи. Клінічному аналізу піддано 32 пацієнти з ЯТС, ускладненими уретерогідронефрозом (УГН), сечовою норицею, яким з 2008 по 2012 р. проведено обстеження та оперативне лікування у відділенні пластичної та реконструктивної онкоурології Національного інституту раку. Однобічний УГН діагностовано у 19 (59%) пацієнтів, двобічний — у 9 (28%), УГН єдиної нирки — у 2 (6%) хворих. Сечову норицю виявлено у 7 (22 %) пацієнтів (сечовідно-піхвова — у 5 (16%), сечовідно-шкірна — у 2 (6%)). Вік пацієнтів становив 57,1±12,1 року. Чоловіків було 7 (22%), жінок — 25 (78%). Оцінку рівня обструкції проводили за допомогою антеградної пієлоуретерографії, екскреторної урографії або ретроградної уретерографії, функцію нирок — шляхом визначення швидкості клубочкової фільтрації за допомогою динамічної реносцинтиграфії і кліренсу ендогенного креатиніну.
Результати. Найбільш часто ЯТС діагностовано після онкогінекологічних оперативних втручань, що становить 17 (53%) випадків. Пангістеректомію та білатеральну сальпінгоофоректомію виконано у 12 (37,6%) пацієнток. У 5 (29%) випадках проведено неоад’ювантний курс дистанційної променевої терапії (ДПТ) на органи малого таза. Сумарна вогнищева доза (СВД) — 46 + 2,4 Гр. При цьому у 2 хворих мала місце комбінована травма сечоводу та сечового міхура. У 4 (12,6%) випадках травма сечоводу виникла в результаті надпіхвової ампутації матки з придатками, у 1 (3,1%) — в результаті лапароскопічно асистованої трансвагінальної гістеректомії.
ЯТС як результат радикального курсу променевої терапії, з приводу раку шийки матки діагностовано у 6 (18,8%) хворих, СВД (ДПТ + БТ) становила 80,4 + 17,2 Гр.
ЯТС в результаті черевно-промежинної екстирпації прямої кишки виникла — в 3 (9,3%), черевно-анальної резекції — в 1 (3,1%) та передньої резекції — в 1 (3,1%) випадку.
Термічна травма сечоводу як результат малоінвазивних ендоскопічних методів лікування виникла при трансуретральній резекції сечового міхура в проекції трикутника Льєто у 3 (14%) випадках і лапароскопічної передньої резекції прямої кишки — у 1 (3%).
Висновки. Підвищення радикалізму та розширення показань до хірургічного лікування місцево-поширених пухлин органів черевної порожнини та малого таза зумовлюють пошкодження сечоводів.
Визначення поглинутої дози опромінення, детальне вивчення анатомії сечоводів, їх стентування та візуалізація під час операції сприяють профілактиці їх пошкодження.
Профилактика и лечение повреждений мочеточника при уретероскопии
С.П. Степушкин, Р.В. Соколенко, И.Д. Алифанов
КЗ «Днепропетровская городская многопрофильная клиническая больница № 4 ДОC» урологическое отделение № 1, Украина
При выполнении уретероскопии возможно развитие интраоперационных (отрыв, перфорация, травма слизистой мочеточника, кровотечение) и послеоперационных (инфекционно-воспалительные осложнения, стриктура мочеточника, инкрустация стента) осложнений.
Целью исследования явилось улучшение качества диагностики и лечения пациентов с мочекаменной болезнью, папиллярными опухолями верхних мочевых путей, стриктурами мочеточника и профилактика развития осложнений уретероскопии.
Материалы и методы. Проанализирован опыт проведения 1100 уротероскопий у пациентов в возрасте от 18 до 75 лет (средний возраст больных 51,5±12,6 года) за 15 лет. 80,6% операций проведено по поводу конкрементов мочеточника, 19,4% — по другим показаниям. Наиболее частой локализацией конкрементов мочеточника была его нижняя треть (72,8% случаев), в средней трети конкременты выявляли у 19,7%, в верхней трети — у 4,5% больных. У 40,9% пациентов средний диаметр конкрементов не превышал 5–6 мм, у 44,9% составлял 7–9 мм, у 14,2% пациентов — 10 мм и более или был в наличии.
Результаты исследования. Развитие осложнений уретероскопий отмечено у 211 (19,2%) больных. В 125 случаях (11,4%) выявлены интраоперационные, в 86 (7,8%) — послеоперационные осложнения.
Невозможность или трудности при выполнении уретероскопии отмечены нами в 2% случаев — не удалось достичь конкремента или удалить его в полном объеме. Осложнения уретероскопии чаще выявляли при применении форсированных движений инструментом и тракции крупных фрагментов, особенно в зоне воспалительных изменений слизистой оболочки мочеточника в месте длительного стояния камня. Наиболее тяжелымы осложнениями уретероскопии были случаи отрыва мочеточника у 3 больных (0,3% уретероскопий), кровотечения — у 14 (1,3%), перфорация мочеточника — у 4 пациентов (0,4%). Данные осложнения регистрировали на этапе освоения метода, они были следствием безуспешных попыток тракции конкрементов больших размеров петлей-ловушкой. При возникновении полного отрыва мочеточника выполняли операцию наложения уретероцистоанастомоза, у одного из пациентов имело место развитие вторичного гнойно-воспалительного процесса на фоне сопутствующего сахарного диабета II типа, что потребовало выполнения нефрэктомии.
В случаях выраженной уретероррагии или перфорации мочеточника операцию завершали установкой стента или перкутанной нефростомой. Повторное оперативное вмешательство выполнялось через 6–8 нед после повреждения стенки мочеточника.
Инфекционно-воспалительные осложнения отмечены в 4,5% уретероскопий, наиболее часто выявляли пиелонефрит, уретрит, воспаление предстательной железы.
Выводы. Таким образом, для профилактики интраоперационных осложнений показано использование струн-проводников, обеспечение адекватного визуального контроля, манипулирование инструментом в зоне выраженных воспалительных изменений стенки мочеточника следует проводить с максимальной осторожностью. Для лечения осложнений уретероскопии операция на мочеточнике должна заканчиваться дренированием верхних мочевых путей. При гнойно-септических осложнениях необходимо своевременное и адекватное назначение антибактериальной, противовоспалительной терапии на фоне дренирования верхних мочевых путей.
Аналіз надання допомоги при розпізнаних та запідозрених ятрогенних травмах сечоводів під час акушерсько-гінекологічних та хірургічних операцій
В.І. Горовий, І.В. Барало, В.П. Головенко, О.Л. Кобзін, Ю.Б. Потєха, А.В. Дубовий, О.М. Капшук, В.Б. Мудрицький
Вінницька обласна клінічна лікарня ім. М.І. Пирогова
Вінницький Національний медичний університет ім. М.І. Пирогова, Вінниця, Україна
Вступ. Ятрогенні пошкодження сечоводів під час акушерсько-гінекологічних та хірургічних операцій, за даними літератури, виявляють у 0,1–5% випадків і лише у 10–30% хворих діагностують під час операції. Надання кваліфікованої інтраопераційної допомоги в таких випадках сприяє профілактиці тяжких ускладнень, які розвиваються при нерозпізнаному пошкодженні сечоводу.
Мета. Аналіз випадків надання інтраопераційної допомоги при розпізнаних та запідозрених ятрогенних травмах сечоводу під час акушерсько-гінекологічних та хірургічних операцій.
Матеріали та методи дослідження. Проаналізовано рапорти викликів урологів Вінницької обласної лікарні в операційні хірургічних, гінекологічних та акушерських відділень Вінниці та області за останні 15 років за даними Вінницького обласного центру екстреної медицини та медицини катастроф.
Результати. Пошкодження сечоводів діагностовано в 36 випадках під час гінекологічних операцій, 2 — акушерських та 5 — хірургічних, ще в 4 випадках виконували ревізію тазових відділів сечоводів до сечового міхура під час гінекологічних операцій — пошкодження сечоводів не виявлено. Діагностовано наступні пошкодження сечоводів: двобічна перев’язка у 4 хворих, однобічна — у 7 (при знятті лігатур відновлено прохідність сечоводів і не було необхідності в їх стентуванні); прошивання сечоводу — у 6 хворих; пристінкова перев’язка — у 2; вигин сечоводу — у 3. Проведено зняття лігатури, розправлення сечоводу, а в 3 випадках — їх стентування. Часткове пересічення діагностовано у 7 випадках — виконано зашивання стінки сечоводу вікриловими (4–0) швами зі встановленням стента (5 випадків) чи уретральної інтубуючої трубки (2 випадки), яку виводили через сечовий міхур назовні разом із катетером Фолі. Повне пересічення сечоводу діагностовано у 13 хворих (5 — під час хірургічних втручань на сигмоподібній кишці): уретероуретероанастомоз виконано у 8 хворих, уретероцистонеоанастомоз — у 5. Сегментарне висічення сечоводу зареєстровано у 1 хворої, було виконано уретеропієлостомію in situ через тяжкий стан хворої та довготривалу гінекологічну операцію (через 3 дні у неї виконано кільцеподібну нефростомію).
Висновки. Інтраопераційну допомогу при розпізнаних пошкодженнях сечоводів під час акушерсько-гінекологічних та хірургічних операцій повинен надавати кваліфікований уролог, який має досвід проведення відновлювальних пластичних операцій з урахуванням тяжкості стану пацієнтів та характеру пошкодження. При пластиці сечоводу необхідно використовувати синтетичний матеріал, який розсмоктується тривалий час (вікрил).
Robotic assisted laparoscopical pieloplasty — step by step surgical technique
C. Ivan, N. Crisan, C. Manea, I. Coman
Urology department of Cluj Napoca Municipal Hospital, Romania
Introduction and objectives. Our purpose is the evaluation of robotic surgery implementation on retroperitoneal approach in the treatment of pyeloureteral jonction syndrome in an experienced center on laparoscopy and lomboscopy.
Material and Methods. In this procedure using retroperitoneal approach with triangular trocars positioned a distance of 8 cm between them. The first trocar is positioned at the intersection of paravertebral muscle and rib 12, the second troacar robot is placed at 1–2 cm above the iliac crest and the third at the meeting along the coast line 12 and the anterior axillary line. 4th trocar help, the 12 mm is placed medial anterior iliac spine and the camera work is created using a balloon dissection.
Results. The robotic pieloplasty was introduced in our center after accumulating previous experience with the classical and laparoscopic approach. Between January 2010 — January 2013, 18 pieloplasties procedures were performed using the robotic retroperitoneal technique. The blood loss was insignificant and the mean console time was 42 min. Of the 18 patients, 3 patients had complications of the internal ureteral drainage requiring repositioning of the double J stent. No patient required conversion to the classical or laparoscopic method.
Conclusions. Robotic surgical technique of pyeloplasty is easy to assimilate into service with experience in laparoscopy. Retroperitoneal approach offers the advantage of direct access to the junction. Our initial experience confirms minimal morbidity with good functional results.














Leave a comment