Інвазивний аспергільоз у хворих на гостру мієлоїдну лейкемію
Дягіль І.С., Мартина З.В. , Товстоган А.О., Кравченко С.М. , Афанасіаді Д.Р. , Романенко Н.Г. , Кузьменко В.Ф. , Міщенюк О.Ю.
Резюме. У статті наведено клінічні приклади, які слугують підтвердженнями того, що інвазивний аспергільоз займає одну з лідируючих позицій у структурі смертності хворих на гострі лейкемії. Стратифікація груп ризику інвазивних грибкових інфекцій та адекватне використання сучасних методів діагностики забезпечують своєчасну верифікацію інвазивного аспергільозу. У свою чергу, оптимізоване ведення пацієнтів є передумовою раннього призначення специфічної терапії, що поліпшує прогноз захворювання.

Нові розробки в галузі експериментальної та клінічної гематології, удосконалення програм хіміотерапії та терапії супроводу посприяли збільшенню кількості ремісій та підвищення виживаності пацієнтів із гострими лейкеміями (ГЛ). У більшості світових протоколів з лікування ГЛ найефективнішою є високодозова хіміотерапія, яка вимагає застосування в супровідній терапії потужних антибіотиків широкого спектра дії, що зумовило підвищення інвазивності грибкових інфекцій, які посіли одне з провідних місць серед причин смертності пацієнтів з ГЛ.
Гриби родів Candida та Aspergillus займають лідируючі позиції в спектрі збудників інвазивних грибкових інфекцій (ІГІ) у хворих на гематологічну патологію. Розповсюдженість інвазивного кандидозу (ІК) в когорті пацієнтів з ГЛ коливається в межах від 8 до 18% [20].
Aspergillus є наступними за поширеністю грибами після Candida в спектрі збудників мікозів. У зазначеній популяції хворих виявляють декілька видів Aspergillus. Провідну позицію в структурі патогенів інвазивного аспергільозу (ІА) займає A. fumigatus, частота виділення збудника сягає 66%, A. flavus ідентифікують у 14% випадків, а види A. niger та A. terreus представлені 7 та 4% відповідно [13].
Частота розвитку ІА у хворих на ГЛ коливається від 4 до 15% [10]. Ризик ІА у пацієнтів з ГЛ насамперед корелює з тривалістю та глибиною нейтропенії. Протягом перших тижнів нейтропенії ризик розвитку легеневої форми ІА становить 1% на добу, але зростає до 4,3% на добу з 24-ї доби гранулоцитопенії [1]. Також відзначено асоціативний зв’язок між ризиком розвитку ІА та формою ГЛ. Пацієнти з рефрактерною та рецидивною формами гострої мієлоїдної лейкемії (ГМЛ) мають вищий рівень ризику виникнення ІА порівняно з хворими на ГМЛ de novo [21].
Впровадження в схеми терапії супроводу нових протигрибкових препаратів групи азолів призвело до зростання протягом останніх двох десятиліть частоти випадків системних мікозів, спричинених грибами роду Fusarium та Zygomycetes, резистентних до зазначених антимікотиків.
Zygomycetes у пацієнтів з ГЛ, за даними епідеміологічного дослідження GIMEMA (Gruppo Italiano per le Malattie Ematologiche dell’Adulto), є другими за розповсюдженістю пліснявими грибами серед збудників ІГІ [12]. Однак абсолютна кількість випадків інвазивного фузаріозу та зигомікозу залишається малою. За результатами багатоцентрового дослідження SEIFEM-2004, яке включало 11 802 пацієнти, як Zygomycetes, так і Fusarium є тільки в 0,1% випадків збудником ІГІ [11].
Діагностика всіх ІГІ дотепер залишається складним завданням для клініцистів. Зокрема, верифікація ІА ускладнюється гетерогенністю та неспецифічністю клінічної картини, низькою патогномонічністю радіологічних симптомів, неспроможністю використання усього спектра ресурсів мікологічної діагностики.
Згідно з критеріями діагностики ІА у імунокомпетентних пацієнтів з онкогематологічними захворюваннями існує три рівні вірогідності діагнозу, а саме: доведений, вірогідний та можливий. Зазначимо, що у світовій літературі та практиці термін «ІА» може бути застосований лише у випадку доведеного або вірогідного ІА. Діагноз доведеного ІА встановлюють на основі гістопатологічного або цитологічного підтвердження інфекційного процесу та/або наявності позитивного результату культурального дослідження зі зразка, отриманого в стерильних умовах з місця, що клінічно або радіологічно узгоджується з інфекцією, де у звичайних умовах відсутня колонізація гриба роду Aspergillus. Тобто реалізація мікробіологічних критеріїв для діагностування ІА з рівнем вірогідності «доведений» потребує проведення інвазивних, високотравматичних процедур, що часто неможливо в даній популяції хворих.
Верифікація ІА з рівнем доказовості «вірогідний» також потребує мікологічного підтвердження, однак з певними відмінностями для встановлення діагнозу: по-перше, мікробіологічні докази виділення збудника можуть бути отримані з нестерильного матеріалу (мокрота, аспірат з синусів, бронхоальвеолярний лаваж (БАЛ)), а по-друге, в якості мікологічного критерію можуть використовуватися сурогатні методи дослідження, а саме — тест на галактоманан (ГМ) та 1–3-β глюкан (1–3-βГ) [19].
Варто зауважити, що незважаючи на впровадження в алгоритм діагностики нових інструментальних та лабораторних методів, а також навіть при використанні рекомендованих критеріїв верифікації ІА, близько 30% епізодів захворювання діагностують лише після проведення аутопсії [18].
Враховуючи все вищенаведене, актуальним є питання своєчасної діагностики та адекватної тактики лікування хворих на ГЛ, які отримують високодозову хіміотерапію, що підвищує ризик розвитку інфекційних ускладнень, у тому числі грибкових. Тому вважаємо за доцільне винести на обговорення два клінічні випадки ГЛ, ускладненням якої був ІА.
Клінічний випадок № 1
Пацієнт С., 25 років, чоловічої статі, вперше госпіталізований до відділення радіаційної гематології ДУ «Національний науковий центр радіаційної медицини (ННЦРМ) НАМН України» з діагнозом гостра монобластна лейкемія, ГМЛ М5а, І гострий період.
З анамнезу відомо, що пацієнт вважає себе хворим протягом останнього місяця, коли з’явилися слабкість при «звичайному» фізичному навантаженні та відчуття «серцебиття» у стані спокою. Останні 3 доби почав турбувати біль у горлі, що супроводжувався підвищенням температури тіла до 39,5 °С. Хворий звернувся до обласної лікарні за місцем проживання, де на основі загально-клінічного аналізу крові виявлено панцитопенію, а також те, що кістковий мозок тотально заміщений бластними клітинами. Пацієнт упродовж доби отримував симптоматичну терапію, після чого для проведення специфічної терапії переведений до відділення радіаційної гематології ДУ «ННЦРМ НАМН України».
На момент поступлення пацієнт був у важкому стані, ECOG 3. Скарги на загальну слабкість навіть при помірному фізичному навантаженні, підвищення температури тіла до фебрильних значень — 38,5–39,5 °С, біль у горлі. Свідомість ясна. Ознаки анемічного (блідість шкіри, тахікардія), геморагічного (поодинокі екхімози на шкірі тулуба) та інфекційно-токсичного синдрому (гіперемія зіва, гіпертермія, тахіпное).
Враховуючи те, що пацієнт перебував у стані фебрильної нейтропенії, негайно розпочато антибактеріальну терапію цефтазідімом (2000 мг 3 рази на добу), що призвело до нормалізації температури тіла на 3-тю добу лікування. Через 2 дні розпочато індукцію ремісії за протоколом «7+3» в стандартних дозах на тлі терапії супроводу. Деконтамінацію кишечнику та профілактику мікозу проводили ципрофлоксацином (500 мг 2 рази на добу) та ітраконазолом (400 мг 1 раз на добу) відповідно. Після закінчення курсу хіміотерапії хворий отримував гранулоцитарний колонієстимулюючий фактор з розрахунку 5 мкг/кг протягом 16 днів до відновлення кількості гранулоцитів >500 в 1 мм3 крові.
Друга хвиля фебрильної нейтропенії виникла через 2 доби після закінчення курсу індукції ремісії. За загально-клінічним аналізом крові: лейкоцити — 0,4×109/л, еритроцити — 2,4×1012/л, тромбоцити — 12×109/л, швидкість осідання еритроцитів (ШОЕ) — 65 мм/год. Проведено забір венозної крові для бактеріологічного дослідження та визначення чутливості до антибіотиків, взято мазки з зіву та носа. Розпочато терапію іміпенемом (1000 мг 3 рази на добу) у комбінації з амікацином (15 мг/кг 3 рази на добу), профілактику мікотичних ускладнень продовжено ітраконазолом. Незважаючи на призначене лікування, стан пацієнта залишався важким: температура тіла становила 38,4 °С, тахіпное, тахікардія; за загально-клінічним аналізом крові: лейкопенія — 0,05×109/л, еритроцитопенія — 2,0×1012/л та глибока тромбоцитопенія — 0,5 ×109/л, ШОЕ — 55 мм/год.
На 3-тю добу фебрилітету у хворого з’явилися скарги на рідкий сухий кашель, виникли біль за ходом стравоходу, нудота, що завершилася дворазовим блюванням (в блювотних масах — домішки крові). При обстеженні хірургом діагностовано ерозивний езофагіт, ускладнений кровотечею. На шкірі тулуба та кінцівок виявлено множинні геморагії. За загальним аналізом крові: анемія ІІІ ступеня (гемоглобін — 60 г/л), тромбоцитопенія (тромбоцити — 2×109/л) та лейкопенія ІV ступеня (лейкоцити — 0,1×109/л). Усе вищезазначене обумовило необхідність проведення замісної терапії тромбоконцентратом та свіжозамороженою плазмою на тлі гемостатичних препаратів.
Наступного дня у хворого утримувалася висока температура тіла — до 39 °С (4-та доба фебрильної нейтропенії). Незважаючи на терапію антигеморагічними препаратами, включаючи тромбоконцентрат, відзначали прогресію геморагічного синдрому. Під час фізикального обстеження легень виявлено крепітацію, а також притуплення легеневого звуку над поверхнею нижньої частки лівої легені. Зважаючи на важкий соматичний стан пацієнта, нейтропенію, фебрилітет до 39 °С та тромбоцитопенію IV ступеня (тромбоцити — 4×109/л), рентгенографію органів грудної порожнини (РГ-ОГП) не проводили. Додатково призначено лінезолід (600 мг 2 рази на добу).
Після стабілізації загального стану хворого на 5-й день фебрилітету проведено РГ-ОГП. На рентгенограмі виявлено множинні інфільтративні тіні розміром від 2 до 6 см в діаметрі в обох легенях та затемнення лівого реберно-діафрагмального синуса. Враховуючи наявність лихоманки, відсутність відповіді на антибактеріальну терапію призначено антимікотик широкого спектра дії — амфотерицин В (0,3 мг/кг в 1-й день з послідовним підвищенням дози на 5 мг щодня).
Наступної доби (6-й день фебрильної нейтропенії) на лівому плечі пацієнта з’явилася зона некрозу правильної округлої форми діаметром 3 см з чітким рівним контуром. З кашлем у хворого почала виділятися мокрота з домішками крові (біологічний матеріал відправлено на морфологічне та мікробіологічне дослідження), посилювалася легенева недостатність, що проявлялося задишкою при мінімальному фізичному навантаженні, підвищенням частоти дихальних рухів та зниженням сатурації кисню в крові.
За результатами загального аналізу крові (тромбоцитопенія IV ступеня) та коагулограми (подовження протромбінового часу, збільшення об’єму продуктів деградації фібрину та зниження рівня фібриногену) діагностовано розвиток синдрому дисемінованого внутрішньосудинного згортання.
Таким чином, все вищеперераховане слугувало аргументом для переведення пацієнта до відділення реанімації та інтенсивної терапії, де розпочато інтенсивну терапію та продовжено терапію супроводу. Бронхоскопію з діагностичною метою не проводили у зв’язку з тромбоцитопенією IV ступеня (тромбоцити — 5×109/л) та гіпоксією (парціальне напруження кисню в артеріальній крові становило 70 мм рт. ст.).
Необхідно зазначити, що мікробіологічний аналіз, який неодноразово проводили протягом усього періоду перебування хворого в стаціонарі, показав стерильність зразків крові пацієнта. При культуральних дослідженнях сечі бактеріурії не виявлено, а при вивченні посівів мазків зі слизових зіву та носа зафіксовано тільки групу симбіонтних бактерій у низьких титрах.
На 8-й день від початку розвитку фебрильної нейтропенії відбулася нормалізація температури тіла, відзначено покращення показників дихальної функції пацієнта.
Наступної доби (9-й день фебрильної нейтропенії) хворому проведено комп’ютерну томографію органів грудної порожнини (КТ-ОГП), за результатами якої виявлено множинні вогнища за типом «матового скла» — симптоми «ореола» та декілька вогнищ з формуванням порожнини, що відповідає визначенню симптому «півмісяця» (рис. 1). Враховуючи радіологічну картину, яка характерна для ІГІ, взято зразок крові для проведення тесту на ГМ методом імуноферментного аналізу (ІФА).
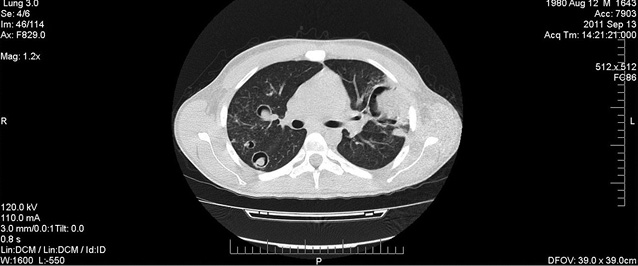
Того ж дня у зв’язку з розвитком токсичного нефриту ІІ ступеня, амфотерицин В замінено на вориконазол (6 мг/кг 2 рази на добу per os протягом 1-ї доби з наступною редукцією дози до 4 мг/кг 2 рази на добу). Терапія останнім продовжувалася 16 діб.
На тлі призначеної антимікотичної та антибактеріальної терапії протягом наступних 2 тиж реєстрували покращення загального стану хворого з регресією лабораторних та клінічних симптомів сепсису: уповільнення ШОЕ та зменшення С-реактивного протеїну. Завершення періоду гранулоцитопенії відбулося на 15-ту добу після курсу поліхіміотерапії (ПХТ). Відзначали нормалізацію температури тіла вдень зі збереженням субфебрилітету в другій половині доби. Залишалася помірна задишка, рідкий сухий кашель, що супроводжувався виділенням незначної кількості слизистої мокроти з домішками крові, хрипи не вислуховувалися.
На 18-ту добу після закінчення ПХТ виконано пункційну біопсію кісткового мозку, за результатами якої діагностовано кістковомозкову ремісію.
Кожні 5 діб з моменту радіологічно зафіксованих змін у легенях проводили контрольну РГ-ОГП.
На 20-ту добу після закінчення курсу індукції ремісії при проведенні чергового рентгенологічного обстеження, незважаючи на клінічну стабілізацію стану, виявлено розширення тіні серця. Проведено ехокардіографію, за результатами якої верифіковано ексудативний перикардит. Враховуючи основний діагноз, ступінь важкості стану, хворого переведено до Інституту серцево-судинної хірургії, де проведено пункцію перикарду з аспірацією 600 мл серозно-геморагічної рідини та встановлено перикардіальний дренаж. Через 1 добу хворий повернувся у відділення гематології, де продовжував отримувати антиінфекційну та симптоматичну терапію.
Наступні 4 доби пацієнт перебував у стані середнього ступеня важкості, скаржився на надсадний кашель з незначною кількістю важковиділюваної мокроти з домішками крові. Під час аускультації легень вислуховувалося везикулярне дихання з жорстким відтінком, перкуторно визначався легеневий звук з тимпанітом.
На 24-ту добу (вночі) у пацієнта під час приступу кашлю виникла профузна легенева кровотеча з відкашлюванням шматків легень, яка призвела до асфіксії, гострої серцево-судинної недостатності та смерті хворого.
У гістологічному препараті тканин легень, печінки, отриманих під час аутопсії, виявлено септований міцелій грибів роду Aspergillus.
Одержаний вже після смерті хворого результат тесту на ГМ методом ІФА свідчив про субпорогове значення рівня антигену в сироватці.
Клінічний випадок № 2
Пацієнт Т., чоловічої статі, 30 років, госпіталізований до відділення радіаційної гематології ДУ «ННЦРМ НАМН України» вперше з діагнозом гострий монобластний лейкоз, М 5, І гострий період.
З анамнезу захворювання відомо, що пацієнт вважав себе хворим протягом останнього місяця, коли помітив підвищення температури тіла до 39 °С та появу сухого кашлю. Під час обстеження за місцем проживання виявлено зміни в гемограмі: анемія І ступеня (гемоглобін — 108 г/л), лейкопенія ІІ ступеня (лейкоцити — 2,0×109/л), прискорене ШОЕ (54 мм/год), бластні клітини — 42%. У відділенні радіаційної гематології ДУ «ННЦРМ НАМН України» при обстеженні (у кістковому мозку вміст мієлобластів — 81,5%) діагностовано ГМЛ.
Загальний стан хворого тяжкий, ЕКОГ 3. Скарги при надходженні до стаціонару на періодичний нападоподібний кашель із виділенням незначної кількості слизистої мокроти, підвищення температури тіла до 37,5–38,1 °С, підвищене потовиділення, загальну слабкість, відчуття «серцебиття» та задишку при помірному фізичному навантаженні. Відзначалася періодична кровоточивість ясен та слизової оболонки носа протягом останнього місяця.
Під час об’єктивного обстеження хворого виявлено ознаки анемічного (шкіра та видимі слизові бліді, тахікардія), геморагічного синдрому (геморагічна висипка на шкірі та слизових ротової порожнини), а також ентеропатії (випорожнення 3–4 рази на добу). Пальпувалися піднижньощелепні, пахвові лімфатичні вузли. Нижній край печінки визначається на 2 см нижче від реберної дуги. Інших змін під час фізикального обстеження органів і систем не виявлено.
Враховуючи мієлоїдний варіант ГЛ, розпочато індукційний курс ПХТ за схемою «7+3» в стандартних дозах на тлі терапії супроводу. Для профілактики контамінації кишкової флори призначено ципрофлоксацин (500 мг 2 рази на добу), а з метою профілактики грибкових ускладнень — ітраконазол (200 мг 2 рази на добу).
Постцитостатична гранулоцитопенія (лейкоцити — 0,6×109/л) розвинулася на останній (7-й) день курсу хіміотерапії та зберігалася протягом наступних 20 діб. Увесь період гранулоцитопенії пацієнт отримував гранулоцитарний колонієстимулюючий фактор з розрахунку 5 мкг/кг маси тіла.
На 2-гу добу після завершення курсу індукції ремісії у хворого підвищилася температура тіла до 38,7 °С, виник біль у лівій половині грудної клітки, що посилювався під час акту дихання. Аускультативно в легенях визначалося везикулярне дихання, перкуторно — ясний легеневий звук. Після забору венозної крові для мікробіологічного дослідження призначено цефепім (1000 мг 2 рази на добу) в комбінації з амікацином (500 мг 2 рази на добу). При рентгенологічному дослідженні виявлено інфільтрацію паренхіми верхньої частки лівої легені.
Незважаючи на активну антибактеріальну терапію, температура тіла утримувалася на рівні 38,0–38,5 °С і на 4-ту добу фебрилітету додано лінезолід (600 мг 2 рази на добу), профілактика мікозу продовжена ітраконазолом.
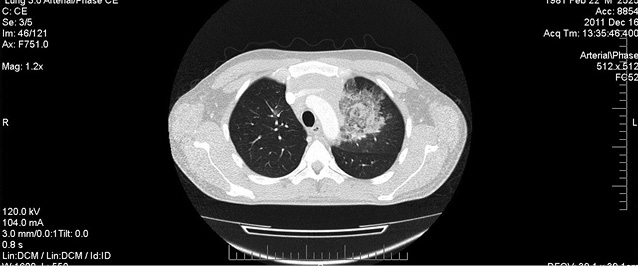
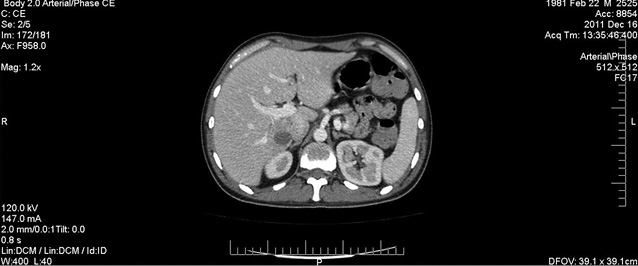
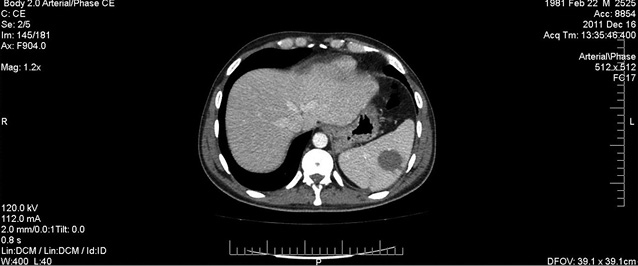
На 5-й день фебрильної нейтропенії стан хворого залишався вкрай тяжким: збільшувалася вираженість ознак порушень з боку легень — над проекцією верхньої частки лівої легені визначалося послаблення дихання та вислуховувалися крепітуючі хрипи. При КТ-обстеженні ОГП: у верхній частці лівої легені виявлено декілька вогнищ консолідації легеневої тканини за типом «матового скла» — симптом «ореола» (рис. 2), а в доступній огляду ділянці печінки та селезінки знайдено вогнища округлої форми діаметром до 20 мм та 23–25 мм відповідно (рис. 3, 4). Це дало підстави думати про розвиток ІГІ. Тієї ж доби призначено амфотерицин В (стартова доза 0,25 мг/кг, з наступним збільшенням дози на 5 мг щодня). Однак у хворого через 48 год після початку терапії вищезазначеним антимікотиком відзначено підвищення кліренсу креатиніну більше ніж на 25% від вихідного рівня, що зумовило необхідність редукції дози амфотерицину В до максимально переносимої.
Незважаючи на призначене лікування (14-та доба фебрильної нейтропенії) у хворого виявлено негативну рентгенологічну динаміку: збільшення розмірів та кількості фокусів у лівій легені та поява нових вогнищ у верхній частці правої легені за типом «матового скла». Пацієнт консультований у центрі сепсису, проведено БАЛ, а отриманий матеріал відправлено для гістологічного, мікроскопічного та культурального дослідження. Результати останнього показали ріст грибів роду Candida. У зв’язку з відсутністю відповіді на обрану терапію, погіршенням стану хворого проведено заміну цефепіму з амікацином на меропенем (1000 мг 3 рази на добу), амфотерицин В замінено на каспофунгін (70 мг 1 раз на добу протягом 1-ї доби з наступною редукцією дози до 50 мг).
На 24-ту добу після закінчення індукційного курсу відбулося відновлення кількості гранулоцитів — >500 в 1 мм3 крові. За результатами контрольної пункції кісткового мозку: кістковомозкової ремісії не досягнуто. За даними чергової КТ-ОГП зберігалася негативна динаміка: радіологічні ознаки інфільтратів з некротичним вмістом в обох легенях — симптом «півмісяця» (рис. 5). Взято зразок крові для дослідження рівня ГМ методом ІФА.
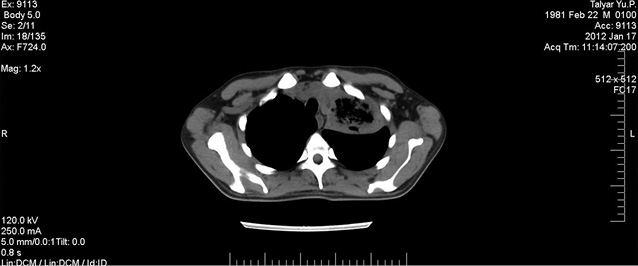
На 35-й день після закінчення курсу ПХТ, незважаючи на антиінфекційну, дезінтоксикаційну, замісну терапію компонентами крові, констатовано значне погіршення загального стану: розвинувся сопор, зумовлений прогресією поліорганної недостатності, на тлі синдрому дисемінованого внутрішньосудинного згортання розпочалася шлунково-кишкова кровотеча. Заходи інтенсивної терапії виявилися неефективними, констатовано біологічну смерть. Аутопсію не проводили у зв’язку з відмовою родичів померлого.
Результати тесту на ГМ отримано через 10 днів після забору матеріалу, вже після смерті хворого. Титр ГМ дорівнював 1,5 ОО, що свідчило про наявність аспергільозу.
Обговорення
Метою розгляду клінічних випадків, які ускладнилися розвитком ІА, є аналіз особливостей перебігу захворювання, допущених помилок у процесі його діагностики та тактики лікування, які дедалі частіше реєструють у хворих на ГЛ у зв’язку з усе ширшим застосуванням високодозової хіміотерапії та є однією з основних причин високої смертності навіть при досягненні кістковомозкової ремісії. Рівень летальності від ІА корелює з терміном призначення специфічної терапії антимікотичними препаратами.
У першому клінічному випадку хворому емпірично призначено протигрибковий препарат широкого спектра дії — амфотерицин В. Унаслідок розвитку ниркової токсичності та підвищення рівня впевненості в ІА (характерний радіологічний симптомокомплекс, поява некротичного вогнища на плечі), амфотерицин В замінено на вориконазол. Зауважимо, що обидва препарати входять до переліку рекомендованих більшістю міжнародних стандартів антимікотичних препаратів як для емпіричного лікування фебрильної нейтропенії, так і специфічної терапії ІА. Хоча, враховуючи те, що пацієнт на момент виникнення епізоду постцитостатичної хвилі фебрилітету перебував у стані нейтропенії щонайменше протягом 10 діб, специфічну терапію розпочато з затримкою. Про це, зокрема, свідчить наявність радіологічного симптому «півмісяця», який з’являється на 3-му тижні розвитку аспергільозу і є прогностично несприятливим маркером [2, 16]. У середньому від моменту розвитку глибокої нейтропенії до появи клінічних або радіологічних симптомів, що змушують думати про ІА, проходить близько 2 тиж, що пов’язано з неспецифічністю клінічної картини та пізньою маніфестацією останньої [16]. Зауважимо, що застосування РГ в якості інструментального методу ідентифікації радіологічних симптомів ІА абсолютно недоцільне. Результати, отримані M. Subira та співавторами, свідчать, що у 32% пацієнтів з легеневою формою ІА на рентгенограмі відсутні будь-які симптоми ураження легень, і тільки у 8% випадків виявлені зміни стали приводом запідозрити легеневу форму ІА [18].
Також зазначимо, що більшість хворих на легеневу форму, яка зустрічається в 90% випадків ІА, помирають внаслідок масивної легеневої кровотечі саме після відновлення гранулоцитів, що зумовлено виділенням нейтрофілами, які мігрують у вогнищі запалення, ферменту еластази, яка розщеплює сполучнотканинний компонент судинної стінки. Таким чином, раннє призначення антимікотика, можливо, на етапі другої лінії протиінфекційної терапії, потенційно дозволила б зменшити інфекційне вогнище дисемінації Aspergillus, мікотичне навантаження на орган та ступінь інвазії великих судин грибами.
Описана в другому клінічному випадку протигрибкова терапія амфотерицином В, призначена емпірично, ймовірно, була розпочата в більш ранні терміни від початку розвитку інфекції порівняно з 1-м хворим. Нагадаємо, що на момент проведення пацієнту № 2 першої КТ ОГП в легенях виявлено симптом «ореола», який ідентифікують в 30–60% випадків ІА, у 75% хворих він зникає впродовж першого тижня від початку захворювання [8].
Вищенаведені радіологічні ознаки хоча й зареєстровано при ІА, не є абсолютно патогномонічними, оскільки їх виявляють при інших ІГІ. Варто зазначити, що залучення в інфекційний процес селезінки та печінки не є характерним для ІА. Зокрема, ураження паренхіми печінки констатують тільки в 15% випадків [5]. Таким чином, нехарактерні вогнища ураження, виявлення грибів роду Candida у БАЛ та розвиток нефротоксичності спонукали до заміни амфотерицину В саме на каспофунгін — препарат з вищим рівнем специфічності щодо дріжджових грибів. Хоча слід зауважити, що культуральний метод діагностики у хворих онкогематологічного профілю дає відповідь на рівні 50–57% у випадку використання БАЛ у якості матеріалу для посіву та 20–22% при культуральному аналізі мокроти [18]. Тому в клінічному випадку № 2 був відсутній ріст грибів роду Aspergillus.
Підсумовуючи обговорення емпіричного призначення антимікотичної терапії пацієнту № 2, зауважимо, що, ймовірно, відсутність ефекту на амфотерицин В пояснюється недостатньою концентрацією препарату для пригнічення росту грибів роду Aspergillus. Слід пам’ятати, що призначення амфотерицину В часто супроводжується розвитком нефротоксичності, тому застосування препарату в ефективній дозі було неможливим. Іншою можливою причиною незадовільної відповіді є ймовірне інфікування штамами грибів A. terreus або A. nidulans, резистентних до амфотерицину В [17]. Призначення каспофунгіну, який хоча й чинить мікостатичну дію на Aspergillus, проведено вже на етапі розгорнутого інфекційного процесу, що не могло вплинути на розвиток останнього.
Тому, враховуючи наш досвід, шлях зниження летальності хворих на ГЛ з високим ризиком розвитку ІА — це суворе дотримання алгоритму антиінфекційної терапії при фебрильній нейтропенії.
Нагадаємо, що монотерапія або комбінована схема антибіотикотерапії першої лінії має бактеріостатично охоплювати як грампозитивні, так і грамнегативні бактерії, з урахуванням також Pseudomonas aeruginosa. Друга лінія антимікробної терапії направлена на полірезистентні штами грампозитивної флори, а третя — на міцеліарні та дріжджоподібні гриби. Своєчасне емпіричне призначення антибактеріальних препаратів та адекватна оцінка відповіді на них дозволяє розпочати лікування антимікотиком на більш ранньому етапі інфекційного процесу. Враховуючи те, що терміни модифікації першої лінії терапії згідно з більшістю світових рекомендацій варіюють у межах від 2 до 5 діб, а наступної — від 5 до 7 діб з моменту призначення обраної схеми лікування, можливо, було б доцільніше проводити оцінку ефективності з визначенням подальшої тактики в більш ранні терміни, що забезпечить призначення емпіричної протигрибкової терапії на початку розвитку інфекційного процесу.
Емпіричне застосування антимікотика, тобто без мікробіологічного підтвердження, на етапі третьої лінії терапії згідно з рекомендаціями Американської асоціації з вивчення інфекційних захворювань (Infectious Diseases Society of America — IDSA) призначають на 4–7-му добу фебрильної нейтропенії в разі відсутності відповіді на адекватну терапію антибіотиками. До препаратів першої лінії відносять ліпосомальний амфотерицин В, ліпідну колоїдну дисперсію амфотерицину В, ліпідний комплекс амфотерицину В, а також ітраконазол, вориконазол та каспофунгін [6, 7]. Рекомендації щодо терапії пацієнтів з ІГІ онкогематологічного профілю, розроблені Комітетом стандартів у гематології Великобританії (British Committee for Standards in Hematology — BCSH), стосовно кола препаратів для емпіричної терапії ІГІ обмежуються ліпосомальним амфотерицином В та каспофунгіном. Вориконазол застосовують у випадку ІГІ з рівнем доказовості «доведений» або «вірогідний» [15]. Нагадаємо, що терапія верифікованого ІА регламентована, зокрема, поновленими в 2009 р. рекомендаціями Міжнародного товариства імунологів (European Conference on Infections in Leukemia — ECIL) із застосування протигрибкових препаратів у пацієнтів з лейкеміями та IDSA. Препаратом першої лінії з найвищим рівнем доказовості згідно з рекомендаціями ECIL є вориконазол, до зазначеної лінії також включено (з нижчим рівнем доказовості): ліпосомальний амфотерицин В, ліпідний комплекс амфотерицину В та каспофунгін [3]. IDSA рекомендує використовувати як препарат першої лінії вориконазол. Інші наведені антимікотики, у тому числі позаконазол та ітраконазол, — в якості препаратів другої лінії терапії [19].
У процесі обговорення методів верифікації ІА, окрім уже проаналізованих діагностичних підходів, у наведених прикладах використано непрямий мікологічний метод — визначення рівня ГМ методом ІФА, який рекомендують як спосіб ранньої діагностики ІА, та який є найпоширенішим мікологічним методом у світі. Його переваги: швидкість проведення, висока чутливість та специфічність тесту. Згідно з результатами більшості клінічних досліджень чутливість та специфічність методу сягає 90% саме для хворих на онкогематологічну патологію [14]. Хоча не існує регламентованого алгоритму моніторування рівня ГМ у крові або БАЛ, відповідно до світової практики тест рекомендують проводити двічі на тиждень з моменту розвитку нейтропенії з метою скринінгу або відразу після появи симптомів, які клінічно або радіологічно узгоджуються з ІА [4]. Така стратегія дозволяє знизити відсоток хибнонегативних результатів тесту.
Рівень циркулюючого антигену гриба прямо пропорційно корелює з мікотичним навантаженням, а застосування емпіричної протигрибкової терапії пригнічує як секрецію ГМ грибом, так і безпосередньо інгібує ріст міцелію Aspergillus, що пояснює субпорогове значення рівня ГМ у хворого № 1, у якого дослідження проводили після тривалого періоду лікування антимікотиками [9]. Зауважимо, що проведення цього сурогатного тесту у випадках обох пацієнтів було значно відстрочено у зв’язку з неможливістю його виконання на території України.
Налагоджене скринінгове тестування рівня ГМ дозволило б оптимізувати тактику ведення пацієнтів, які отримують високодозову хіміотерапію. У випадку відсутності або несвоєчасного використання скринінгових методів діагностики ІГІ, таких як ГМ або 1–3-β-D-глюкан, що дають можливість верифікувати ІА на рівні вірогідного, терапія з перших днів розвитку ІА, на жаль, майже неможлива.
Наведені клінічні приклади демонструють неспецифічність клінічної картини та суперечливість діагностичних ознак ІА, який супроводжує перебіг захворювання у пацієнтів, що отримують високодозову хіміотерапію. Несвоєчасність діагностичних та практичних підходів, настороженість щодо розвитку ІА різко знижують виживаність пацієнтів із ГЛ та іншими захворюваннями, при яких розвивається глибокий імунодефіцит.
Список використаної літератури
1. Gerson S., Talbot G., Hurwitz S. et al. (1984) Prolonged granulocytopenia: the major risk factor for invasive pulmonary aspergillosis in patients with acute leukemia. Ann. Intern. Med., 100: 345–51.
2. Greene R., Schlamm H., Oestmann J. et al. (2007) Imaging findings in acute invasive pulmonary aspergillosis: clinical significance of the halo sign. Clin. Infect. Dis., 44: 373–9.
3. Herbrecht R., Fluckiger U., Gachot B. et al. Antifungal Therapy in Leukemia Patients 2009 Update of the ECIL 1 and ECIL 2 Guidelines. Ptotocol 3rd European Conference on Infections in Leukemia. ICHS. (http://www.ichs.org/Resources/Documents/ECIL%203%20Antifungal%20therapy%20Update%202009.pdf).
4. Hope W., Walsh T. (2005) Laboratory diagnosis of invasive aspergillosis. Lancet Infect. Dis., 5: 609–22.
5. Horix A., Kamix M., Kishi Y., et al. (2002) Clinical significance of extra-pulmonary involvement of invasive aspergillosis: a retrospective autopsy-based study of 107 patients. J. Hosp. Infect., 50: 175–82.
6. Hughes W., Armstrong D., Bodey G. et al. (2002) 2002 Guidelines for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer. Clin. Infect. Dis., 34: 730–51.
7. Freifeld A., Bow E., Sepkowitz K. et al. (2011) Clinical Practice Guideline for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer: 2010 Update by the Infectious Diseases Society of America. Clin. Infect. Dis., 52(4): 56–93.
8. Kuhlman J., Fishman E., Siegelman S. (1985) Invasive pulmonary aspergillosis in acute leukemia: characteristic findings on CT, the CT halo sign and the role of CT in early diagnosis. Radiology, 157: 611–4.
9. Marr K., Balajee S., McLaughlin L. (2004) Detection of Galactomannan Antigenemia by Enzyme Immunoassay for the Diagnosis of Invasive Aspergillosis: Variables That Affect Performance The J. of Infect. Dis., 190: 641–9.
10. Marr K., Carter R., Boeckh M., et al. (2003) Invasive aspergillosis in allogeneic stem cell transplant recipients: changes in epidemiology and risk factors. Blood. 2003; 100: 4358–66.
11. Pagano L., Caira M., Candoni A. et al. (2006) The epidemiology of fungal infections in patients with hematologic malignancies: the SEIFEM-2004 study. Haematologica, 91: 1068–75.
12. Pagano L., Fianchi L., Caramatti C. et al. (2004) Cryptococcosis in patients with hematologic malignancies. A report from GIMEMA-infection. Gruppo Italiano Malattie EMatologiche dell’Adulto Infection Program. Haematologica, 89: 852–6.
13. Patterson T., Kirkpatrick W., White M. et al. (2000) Invasive aspergillosis: disease spectrum, treatment practices, and outcomes. I3 Aspergillus Study Group. Medicine, 79: 250–60.
14. Pfeiffer C., Fine J., Safdar N. et al. (2006) Diagnosis of invasive aspergillosis using a galactomannan assay: a meta-analysis. Clin. Infect. Dis., 42: 1417–27.
15. Prentice A., Glasmacher A., Hobson R. et al. Guidelines on the management of invasive fungal infection during therapy for haematological malignancy British Committee for Standards in Haematology. (http://www.bcshguidelines.com/process1.asp#App3).
16. Segal B., Freifeld A., Baden L. et al. (2008) Prevention and treatment of cancerrelated infections. J. Natl. Compr. Canc. Netw., 6: 122–74.
17. Steinbach W., Benjamin D., Kontoyiannis D. et al. (2004) Infections due to Aspergillus terreus: a multicenter retrospective analysis of 83 cases. Clin. Infect. Dis., 39: 192–8.
18. Subira M., Martino R., Franquet T. et al. (2002) Invasive pulmonary aspergillosis in patients with hematologic malignancies: survival and prognostic factors. Haematologica, 87: 528–34.
19. Walsh T., Anaissie E., Denning D., et al. (2008) Treatment of Aspergillosis: Clinical Practice Guidelines of the Infectious Diseases Society of America Denning Clin. Infect. Dis., 46: 327–60.
20. Wingard J., Leather H. (2004) A new era of antifungal therapy. Biol. Blood Marrow Transplant., 10: 73–90.
21. Wirk B., Wingard J. (2009) Current Approaches in Antifungal Prophylaxis in High Risk Hematologic Malignancy and Hematopoietic Stem Cell Transplant Patients. Mycopathologia, 168: 299–311.
Инвазивный аспергиллез у больных острой миелоидной лейкемией
Резюме. В статье представлены клинические примеры, которые являются подтверждением того, что инвазивный аспергиллез занимает одну из лидирующих позиций в структуре смертности больных острой лейкемией. Стратификация групп риска инвазивных грибковых инфекций и адекватное использование современных методов диагностики обеспечивают своевременную верификацию инвазивного аспергиллеза. В свою очередь, оптимизация ведения пациентов является предпосылкой раннего назначения специфической терапии, что улучшает прогноз заболевания.
Ключевые слова: инвазивная грибковая инфекция, инвазивный аспергиллез, острая лейкемия, диагностика, антимикотическая терапия.
Invasive aspergillosis in patients with acute leukemia
Summary. The article presents clinical cases that serve as evidence that invasive aspergillosis the leading ones in the structure of mortality of patients with acute leukemia. Risk stratification of invasive fungal infections and adequate use of modern diagnostic methods provide timely verification of invasive aspergillosis. In turn, the optimized management of patients is a prerequisite for early appointment of a specific therapy improves prognosis.
Key words: invasive fungal infection, invasive aspergillosis, acute leukemia, diagnostic, antimycotic therapy.














Leave a comment