Современные аспекты использования агонистов лютеинизирующего гормона — рилизинг-гормона в лечении рака предстательной железы (обзор литературы)
Резюме. Основным принципом гормональной терапии рака предстательной железы (РПЖ) является изоляция опухоли от стимулирующего действия андрогенов — андрогенная блокада (депривация, абляция). Угнетение андрогенной функции достигается разными путями: хирургической кастрацией; медикаментозной кастрацией — торможением секреции гонадотропных гормонов гипофиза (агонисты лютеинизирующего гормона — рилизинг-гормона (ЛГ-РГ)) или, наоборот, препятствием им проявлять свою активность (антагонисты ЛГ-РГ); блокадой андрогенных рецепторов в ткани опухоли (антиандрогены) или их сочетанием. Хотя сегодня двустороннюю орхиэктомию, которая приводит к быстрому, глубокому, длительному и необратимому угнетению выработки тестостерона, выполняют редко, ее считают эталоном андрогенной депривации, с которым сравнивают эффективность препаратов, применяемых для медикаментозной кастрации. Значительное количество пациентов неадекватно реагируют на лечение и страдают от неожиданных подъемов уровня тестостерона или даже не достигают заветного уровня кастрации. В 2–12,5% пациентов агонисты ЛГ-РГ не обеспечивают кастрационного уровня тестостерона ≤50 нг/дл, в 13–46% — ≤20 нг/дл, а в 4–12,5% пациентов повторные инъекции приводят к отсроченным его подъемам. Применение препарата Элигард в трех лекарственных формах повышает лечебный эффект благодаря содержанию двойной дозы активного вещества по сравнению с другими препаратами этого класса, обеспечивает оптимальный контроль за уровнем тестостерона — поддержание его уровня ниже кастрационного в течение всего периода лечения, выраженность побочных эффектов сопоставима и даже меньше, чем при лечении другими агонистами ЛГ-РГ, а путь введения — малотравматичен.

Рак предстательной железы (РПЖ) занимает второе место среди наиболее распространенных онкологических заболеваний и шестое — среди наиболее значимых причин смерти от рака мужчин во всем мире. Так, по данным Международного агентства по изучению рака, в 2008 г. зарегистрировано 899 тыс. новых случаев заболевания и 258 тыс. смертей. Если данная тенденция будет сохраняться (вследствие роста самой заболеваемости или старения мирового населения), тогда в 2030 г. диагностируют около 1,7 млн новых случаев и 499 тыс. смертей от РПЖ [1].
Самый высокий уровень заболеваемости на 100 тыс. населения в 2008 г. отмечали в развитых странах: США (118,2), Новой Зеландии (104,4), Швеции (97,0), Канаде (96,6), Финляндии (95,2), а самый низкий — в Южной и Центральной Азии, Северной Африке и Восточной Азии: Индии и Таиланде (4,4), Республике Корея (9,6), Китае (12,0), Японии (15,1) и Сингапуре (17,8). Смертность от РПЖ самая высокая в странах Карибского бассейна, а также в ряде стран Южной и Западной Африки, Южной Америки: Тринидаде и Тобаго (53,6), Кубе (22,6), Норвегии (21,3), Швеции (21, 1) и Дании (19,9), самая низкая — в большей части Азии: Узбекистане (1,5), Таджикистане (2,0), Кыргызстане (3,4), Республике Корея (3,9) и Китае (4,0); Северной Африке, а также Северной Америке [2].
Если проанализировать показатели последних лет в Украине, то также отмечается рост заболеваемости РПЖ, обусловленный не биологическими особенностями опухоли в популяции, а являющийся результатом улучшения диагностики. Если в 2001 г. диагностировано 4837, то в 2011 г. — 7250 новых случаев, причем значительный прирост заболеваемости наблюдали у лиц в возрасте 40–59 и старше 80 лет. Так, уровень заболеваемости к 2011 г. составил 33,5, а смертности — 15,8 на 100 тыс. населения. Несмотря на широкое использование простатспецифического антигена (ПСА) и трансректального ультразвукового исследования предстательной железы, уровень выявления заболевания в начальной стадии низкий и составляет около 50%. Наряду с этим низкий уровень предоставления специализированного радикального лечения приводит к высокой смертности и низкому показателю 1- и 5-летней выживаемости, который составляет 79,9 и 45,2% соответственно. Если рассмотреть выживаемость в зависимости от стадии заболевания, то при I–II стадии уровень 5-летней выживаемости составляет 66,8%, при III стадии — 41,3%, а при IV — 13,8%, тогда как мировой показатель при локализованном РПЖ составляет 100%, при метастатическом — 28,8% (средний — 69,9%) [3].
В настоящее время радикальная простатэктомия является единственным методом лечения локализованного РПЖ, который продемонстрировал преимущество в выживаемости по сравнению с консервативным лечением пациентов в проспективном рандомизированном исследовании [4]. Показанием к ее проведению является локализованный РПЖ низкого и промежуточного риска (стадия Т1b–T2, сумма Глисона 2–7, ПСА <20 нг/мл) и ожидаемая продолжительность жизни >10 лет. Возможными показаниями являются: клиническая стадия Т1а и ожидаемая продолжительность жизни >15 лет или сумма Глисона 7; локализованная форма РПЖ малого объема и высокого риска (стадия Т3а или показатель по шкале Глисона 8–10, или ПСА >20 нг/мл) у отобранных пациентов; локализованная форма РПЖ очень высокого риска (стадия Т3b–T4N0 или любая ТN1) у тщательно отобранных больных в контексте мультимодального лечения [5].
До настоящего времени не проведено рандомизированных исследований, посвященных сравнению радикальной простатэктомии и дистанционной лучевой терапии или брахитерапии при локализованном РПЖ. Но, согласно консенсусу, принятому в Национальном институте рака Америки в 1988 г., лучевая терапия обеспечивает такую же выживаемость, как и после простатэктомии, а качество жизни оказывается не хуже [6].
Трансперинеальная интерстициальная брахитерапия с имплантацией радиоактивных зерен является возможным методом терапии у больных РПЖ стадии Т1–2а с дифференцированием опухоли по шкале Глисона <7 (или 3+4), уровнем ПСА ≤10 нг/мл, объемом предстательной железы ≤50 см3, отсутствием трансуретральной резекции предстательной железы в анамнезе, удовлетворительным статусом по шкале I-PSS. Немедленная спасительная лучевая терапия у больных после хирургического лечения с местно-распространенным РПЖ (рT3N0M0) улучшает биохимическую и клиническую безрецидивную выживаемость [5].
Еще 60 лет назад Чарльз Хаггинс (Charles Huggins) и сотрудники установили, что больные РПЖ положительно реагируют на орхиэктомию или лечение эстрогенными препаратами, то есть на создание искусственного дефицита андрогенов в организме. Андрогены не инициируют злокачественное перерождение ткани предстательной железы, но их присутствие является необходимым условием прогрессирования опухолевого процесса в стадии гормонозависимого роста [7]. Это достижение медицинской науки отмечено Нобелевской премией в 1966 г.
Основным принципом эндокринной терапии РПЖ является изоляция опухоли от стимулирующего действия андрогенов — андрогенная блокада (депривация, абляция). Угнетение андрогенной функции достигается разными путями: хирургической кастрацией, медикаментозной кастрацией — торможением секреции гонадотропных гормонов гипофиза (агонисты) или, наоборот, препятствием им проявлять свою активность (антагонисты), или блокадой андрогенных рецепторов в ткани опухоли. Главное теоретическое условие гормональной терапии РПЖ — клетки опухоли реагируют на андрогены пролиферацией подобно клеткам ткани железы. Эндокринная терапия (орхиэктомия и/или лечение гормональными препаратами) показана во всех случаях РПЖ, в том числе после радикальной простатэктомии.
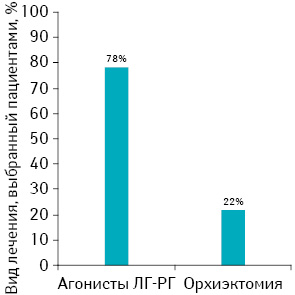
Паллиативная гормональная терапия является стандартным методом терапии первой линии для пациентов с местно-распространенным, распространенным и метастатическим, рецидивирующим или прогрессирующим РПЖ и включает: хирургическую или медикаментозную кастрацию, антиандрогенную терапию или сочетание обеих. Для оптимального применения гормональной терапии необходимо согласие как пациента, так и врача [8]. Согласно исследованиям [9, 10], проведенным еще 20 лет назад, в которых сравнивали осознанный выбор пациентов вида лечения РПЖ, 115 (78%) опрошенных выбрали медикаментозное лечение, а 32 (22%) — орхиэктомию. Основными причинами выбора гормональной терапии было избежание хирургии (36%), успех лечения (18%), удобство приема препарата (10%), консультация врача (10%). При проведении опроса через 3 мес 93% пациентов ответили, что они сделают такой же выбор снова (рис. 1).
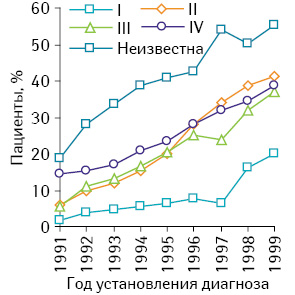
В недавнем исследовании SEER (Surveillance, Epidemiology and End Results) [11] медицинской базы данных населения по изучению тенденций в использовании агонистов ЛГ-РГ в лечении РПЖ за период с 1991 по 1999 г. показано повышение доли мужчин, которые получили ≥1 дозы агонистов ЛГ-РГ в первые 6 мес после установления диагноза рака. Эта переменная построена согласно стадии опухоли и году. Частота использования агонистов ЛГ-РГ повысилась со временем при всех стадиях заболевания. Высокий коэффициент применения был у больных с IV стадией заболевания и составил в 1999 г. 55,7% (рис. 2).
В опубликованных рандомизированных исследованиях [12, 13], сравнивающих эффективность медикаментозной и хирургической кастрации у больных РПЖ, не выявлено статистического расхождения (р=0,33) показателя общей выживаемости в обеих исследуемых группах, что подтверждало идентичность консервативного и хирургического лечения.
При сравнении влияния хирургической и медикаментозной кастрации на качество жизни и психосоциальный статус на основе опросника Functional Living Index: Cancer (FLIC) в одном из первых исследований [14] показано, что качество жизни пациентов, получавших консервативное лечение в течение 6 мес, является достоверно более высоким (р=0,0001), чем у пациентов после орхиэктомии (рис. 3).

Данные рандомизированных контролируемых исследований по использованию аналогов ЛГ-РГ, проведенных с января 2000 г. по июль 2011 г., а также доклады международных конференций, состоявшихся в 2010 и 2011 гг., были проанализированы и систематизированы в зависимости от различных клинических состояний: неметастатического рака (как первичный и единственный метод лечения, в сочетании с местными процедурами), а также при биохимическом рецидиве и метастатическом поражении [15].
При сравнении андрогенной депривации (через 6 мес после установления диагноза) с тактикой динамического наблюдения у больных РПЖ в сТ1–сТ2 стадии статистической разницы между обеими группами не отмечено [16, 17]. Однако выявлено недостоверное преимущество в канцерспецифической выживаемости у мужчин с низкой степенью дифференциации опухоли [17].
По результатам программы Early Prostate Cancer (EPC), в которой определяли роль ежедневного использования бикалутамида 150 мг в качестве дополнительного к стандартному лечению (радикальная простатэктомия, лучевая терапия или выжидательная тактика) локализованного или местно-распространенного неметастатического РПЖ по сравнению с плацебо среди 2285 пациентов, которых наблюдали в среднем 7,4 года, не достигнуто улучшения показателя общей выживаемости [18].
В двух исследованиях SPCG-7/SFUO III фазы, в которых сравнивали эффективность андрогенной депривации как самостоятельно, так и в сочетании с лучевой терапией у больных с Т1–сТ4N0 стадией показали достоверное (р<0,0001) снижение смертности у пациентов, получавших комбинированное лечение [19].
Кроме того, по результатам CAN-NCI-C-PR3, исследования, в котором мужчины с высоким риском M0 заболевания были рандомизированы в зависимости от использования андрогенной депривации как самостоятельно, так и в сочетании с лучевой терапией, риск смерти был достоверно ниже (на 23%) у пациентов с местно-распространенным РПЖ или высокого риска, получивших комбинированное лечение, а канцерспецифическая выживаемость — выше на 43% [20].
Еще в одном исследовании сравнивали использование андрогенной депривации в течение 3 лет с или без лучевой терапии у 263 мужчин с Т3–сT4 стадией РПЖ. Продемонстрированы очевидные преимущества с точки зрения 5-летней безрецидивной выживаемости и 5-летней выживаемости без метастазирования в пользу сочетанного лечения [21].
При сравнении андрогенной депривации самостоятельно и в комбинации с радикальным хирургическим лечением у пациентов с положительными лимфатическими узлами показано преимущество операции с первичной медикаментозной терапией, однако эти данные были ретроспективными, не существует рандомизированных клинических исследований, которые бы подтверждали этот вывод [22–25].
Во многих рандомизированных клинических исследованиях показано значительное преимущество при кратковременной или долгосрочной андрогенной депривации в сочетании с лучевой терапией [26–34], однако результаты зависели от групп риска, предложенных A.V. D’Amico и соавторами: низкий риск (Т1–cT2a, сумма Глисона 2–6, ПСА <10 нг/мл), промежуточный риск (cT2b, сумма Глисона 7, ПСА 10,1–20 нг/мл), высокий риск (cT2c или сумма Глисона 8–10 или ПСА >20 нг/мл) [35].
В анализе двух исследований European Organisation for Research and Treatment of Cancer (EORTC) подняли вопрос оптимальной продолжительности гормонального лечения пациентов с местно-распространенным РПЖ. В исследовании EORTC 22863 пациенты получали лучевую терапию в дозе 70 Гр самостоятельно и в сочетании с андрогенной депривацией в течение 3 лет. Разница показателя 5- и 10-летней общей выживаемости между двумя группами составляла 20% [17, 36]. С учетом этого преимущества в исследовании EORTC 22961, в котором все пациенты получали лучевую терапию в дозе 70 Гр и гормональную терапию на протяжении 6 мес или 3 лет, преимущества в канцерспецифической выживаемости имели больные, получавшие длительную терапию (отношение рисков 1,71; 95% доверительный интервал 1,14–2,57; р=0,002), однако 4% разница в показателе 5-летней общей выживаемости в пользу длительного лечения незначительна [26].
Кроме того, в исследовании Radiation Therapy Oncology Group (RTOG) 9202, в котором все пациенты получили лучевую терапию и были рандомизированы в 2 группы: в первой проводили 4-месячную андрогенную депривацию в неоадъювантном режиме и во время лечения; во второй — 4-месячную неоадъювантную терапию и в продолжение 2 лет в адъювантном режиме. В течение 10 лет наблюдения все результаты были улучшены в группе с долгосрочной терапией, за исключением показателя общей выживаемости (51,6 и 53,9%; р=0,36). Интересно, что при анализе состояния пациентов с суммой Глисона 8–10 лучший показатель общей выживаемости зафиксирован при долгосрочной терапии (р=0,0061) [37].
Роль неотложной андрогенной депривации у пациентов с высоким риском рецидива после местного лечения остается невыясненной. Одним исследованием, которое имеет клиническое значение, проведенным за последнее десятилетие, является Eastern Cooperative Oncology Group (ECOG) 3886. В нем пациенты, перенесшие радикальную простатэктомию и имевшие метастазы в регионарные лимфоузлы, рандомизированы относительно неотложной или отложенной (до появления метастазов в кости) андрогенной депривации. При среднем сроке наблюдения в 11,9 года результаты исследования показали значительное улучшение общей выживаемости (р=0,04) и канцерспецифической выживаемости (р<0,0001) у пациентов, получавших неотложную терапию после операции [38, 39].
В части исследований EPC пациентов с местно-распространенным РПЖ рандомизировали в группы, в одной из которых проводили радикальную простатэктомию и лечение бикалутамидом (150 мг), и не были показаны преимущества в выживаемости по сравнению с мужчинами, получавшими плацебо (р=0,51). Однако в этом исследовании только 2% пациентов имели метастазы в лимфоузлы [40].
Не вызывает дискуссии необходимость срочного назначения андрогенной депривации у пациентов с метастатическим РПЖ. В этих условиях риск возникновения симптомов (боль в костях, почечная недостаточность, анемия, патологические переломы, компрессия спинного мозга) ниже. Медиана выживаемости варьирует в зависимости от тяжести заболевания и интенсивности боли и составляет от 7 до 181 мес после установления диагноза до возникновения гормонорезистентности [41, 42].
При местно-распространенном и метастатическом РПЖ хирургическая или медикаментозная кастрация часто сочетаются с антиандрогенами. Несмотря на многочисленные клинические исследования, сравнивающие кастрацию с максимальной андрогенной блокадой, роль последней остается невыясненной [43–48]. Большой метаанализ показал, что максимальная андрогенная депривация снижает риск смерти только на 2% (на 8% — при применении ципротерона ацетата), однако показатель выживаемости был настолько мал, что она не может быть рекомендована к широкому применению в клинической практике [49].
Подытоживая вышесказанное, использование андрогенной депривации нецелесообразно как самостоятельно, так и в сочетании с хирургическим, лучевым лечением или наблюдением при локализованной форме, а также у пациентов с местно-распространенным РПЖ низкого риска.
Показаниями к ее применению являются:
- сочетание с лучевой терапией у пациентов с местно-распространенным РПЖ промежуточного риска продолжительностью 4–6 мес;
- сочетание с лучевой терапией у пациентов с местно-распространенным РПЖ высокого риска продолжительностью 24–36 мес;
- в адъювантном режиме у пациентов со множественными метастазами в регионарные лимфоузлы после радикального лечения или с высоким риском возникновения отдаленных метастазов (сумма Глисона ≥8, время удвоения ПСА <12 мес);
- в адъювантном режиме при биохимическом рецидиве у пациентов с высоким риском возникновения отдаленных метастазов (сумма Глисона ≥8, время удвоения ПСА <12 мес);
- метастатический РПЖ (рекомендуется применение антиандрогенов у всех пациентов за 2–7 дней до назначения агонистов ЛГ-РГ).
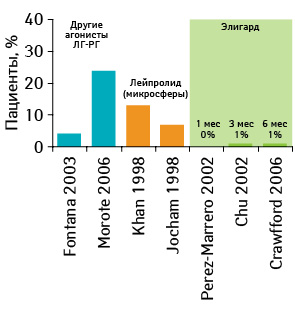
Хотя сегодня двустороннюю орхиэктомию выполняют редко, она считается эталоном андрогенной депривации, с которым сравнивают препараты, применяемые для медикаментозной кастрации [50, 51]. Хирургическая кастрация приводит к быстрому, глубокому, длительному и необратимому угнетению выработки тестостерона. Используя технику двойного изотопного разбавления производной, уровень тестостерона в сыворотке крови 50 нг/дл считался стандартным уровнем кастрации, который использовали в регистрационных исследованиях [52]. С появлением более чувствительных методов измерения тестостерона в нескольких исследованиях показано, что хирургическая кастрация обычно приводит к снижению уровняю тестостерона, значительно ниже исторического (рис. 4) [53–59].
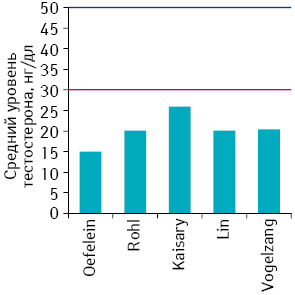
Например, M.G. Oefelein и коллеги измеряли уровень тестостерона у 35 мужчин, перенесших двустороннюю орхиэктомию по поводу РПЖ, используя хемилюминесцентный анализ, и показали, что медиана сывороточного уровня тестостерона составляет 15 нг/дл, а более 90% пациентов достигли уровня 20 нг/дл. Таким образом, величина уровня тестостерона <20 нг/дл была предложена как более показательный уровень, который достигается после хирургической кастрации [53, 60].
Доказательства клинической значимости снижения уровня тестостерона представлены в исследовании J. Morote и соавторов [61]. В этот ретроспективный анализ включены 73 пациента с неметастатическим РПЖ, получавших ежемесячно инъекции агониста ЛГ-РГ. Уровень тестостерона определяли по меньшей мере 3 раза с помощью хемилюминесцентного метода 1 раз в год. У 44% пациентов все три определения были ниже предлагаемого уровня <20 нг/дл, в то время как 32% имели по крайней мере одно повышение в диапазоне 20–50 нг/дл, а 25% — тоже одно >50 нг/дл.
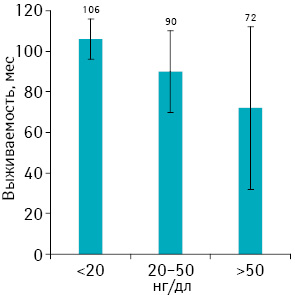
Чтобы изучить влияние этих повышений на клиническое течение заболевания, пациентов рандомизировали в 3 группы по отношению к выживаемости без прогрессирования, которую определяли как продолжительность жизни без перехода в гормональную независимость. Средняя выживаемость составила 106 мес у пациентов с уровнем тестостерона <20 нг/дл, 90 мес — с уровнем 20–50 нг/дл и 72 мес — с уровнем >50 нг/дл (р=0,0207; рис. 5).
Дальнейший анализ показал, что уровень тестостерона 32 нг/дл был предельным, что позволило разделить больных на 2 группы, которые достоверно отличались по выживаемости. Средний показатель выживаемости без прогрессирования был значительно выше у пациентов, у которых наблюдали неожиданное повышение уровня тестостерона, но <32 нг/дл, и составил 137 мес, тогда как у пациентов, в которых отмечали неожиданное повышение уровня тестостерона >32 нг/дл, — 88 мес (р<0,03; рис. 6).
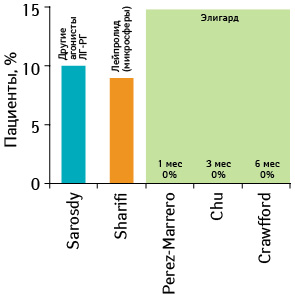
При применении традиционных агонистов ЛГ-РГ значительное количество пациентов не достигают должного уровня понижения концентрации тестостерона, кроме того у части больных отмечают неожиданные подъемы уровня тестостерона на фоне терапии [62–65]. У 2–12,5% пациентов агонисты ЛГ-РГ не обеспечивают кастрационного уровня тестостерона ≤50 нг/дл, а у 13–46% — ≥20 нг/дл. У 4–12,5% пациентов повторные инъекции приводят к отсроченным подъемам тестостерона [62, 63, 66–71].
Поэтому существует необходимость улучшения данного вида терапии. По нашему мнению, перспективным в этом плане является обсуждение эффективности нового лейпролида-депо — препарата Элигард, который доступен для введения 1 раз в месяц, 3 мес и 6 мес*. Лейпролида ацетат — синтетический аналог нонапептида ЛГ-РГ, где 6-я аминокислота включается для лейцина, и отсутствует глицин в положении 10 [72]. Обычно лейпролида ацетат вводят внутримышечно в виде микросфер, однако в исследованиях, представленных выше, показано, что не у всех пациентов достигается необходимый уровень кастрации. Поэтому в препарате Элигард используется новая система доставки препарата [62], состоящая из D,L-лактид-гликолид-полимера, растворенного в N-метил-2-пирролидоне, — жидком носителе (рис. 7).
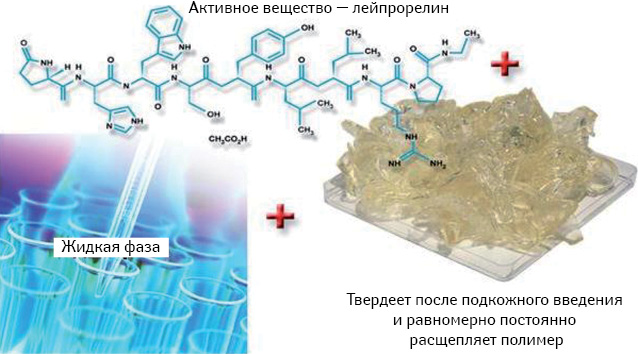
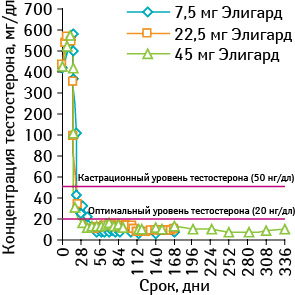
Препарат вводят подкожно в виде жидкости, которая застывает на месте и медленно разлагается со временем, обеспечивая постоянное и контролируемое высвобождение лекарственного средства [73]. Подкожные инъекции показали меньше побочных эффектов по сравнению с внутримышечными и поэтому являются более безопасными [74]. Элигард доступен в трех различных дозировках для введения 7,5; 22,5 и 45 мг. По сравнению с микросферами-депо Atrigel® обеспечивает поступление двойной дозы лейпролида ацетата. Согласно исследованию, проведенному C. Schulman и соавторами [75], при применении всех 3 форм препарата Элигард у пациентов достигается устойчивое подавление уровня тестостерона на 21-й день лечения (рис. 8).
Описанная фармакокинетика в клинических испытаниях [74, 76, 77] подтвердила устойчивое и контролируемое высвобождение лейпролида ацетата с Atrigel® во весь период действия (рис. 9).
Таким образом, Atrigel® формула дает явное преимущество по сравнению с другими существующими системами доставки.
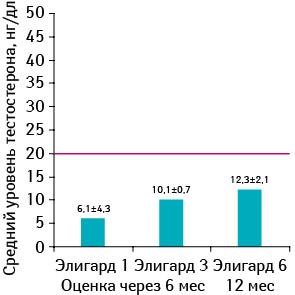
Клинические испытания [74, 76] показали, что Элигард эффективнее других агонистов ЛГ-РГ или лейпролида ацетата в виде микросфер снижает уровень тестостерона до значений, эквивалентных хирургической кастрации. Так, все пациенты при применении 1- и 3-месячной и 99% при 6-месячной форме достигли снижения уровня тестостерона ≤50 нг/дл (рис. 10); и 98; 94 и 88% соответственно при использовании 1-, 3-, 6-месячной форм достигли снижения уровня тестостерона ≤20 нг/дл (рис. 11).
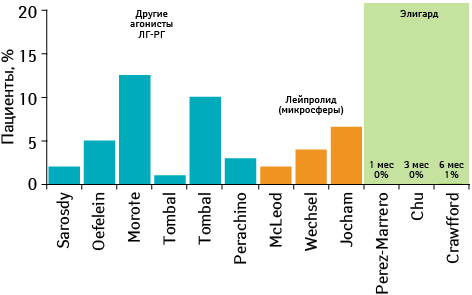
Не отмечено повышения уровня тестостерона у больных при лечении 1-месячной формой препарата Элигард, и только в 1% случаев повышение имело место при применении 3- и 6-месячной формы, что было значительно ниже по сравнению с другими агонистами ЛГ-РГ (рис. 12).
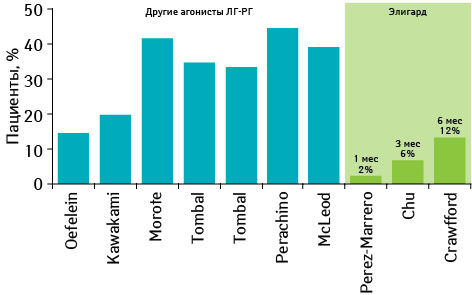
Также не выявлено повышения уровня тестостерона вследствие последующего введения всех форм препарата Элигард, что могло быть связано с двойной дозой лейпролида и замедленным высвобождением препарата благодаря системе доставки (рис. 13).
Результаты клинических исследований в отношении обеспечения оптимального контроля над уровнем тестостерона при применении препарата Элигард и других агонистов ЛГ-РГ суммированы в табл. 1 [62–71, 74–76].
Таблица 1. Результаты клинических исследований препарата Элигард и других агонистов ЛГ‑РГ
| Результаты | Пациенты, получавшие обычные формы агонистов ЛГ-РГ, % | Пациенты, получавшие Элигард (для введения с интервалом 1 и 3 мес), % |
|---|---|---|
| Не достигли уровня тестостерона ≤50 нг/дл | 2,0–12,5 | 0–1,0 |
| Не достигли уровня тестостерона ≤20 нг/дл | 13–46,4 | 2,5–6,0 |
| Неожиданное повышение уровня тестостерона на фоне терапии | 4,0–12,5 | 0–1 |
| Подъемы уровня тестостерона после каждой инъекции | 10 | 0 |
Несмотря на поступление двойной дозы препарата, побочные эффекты при применении всех форм Элигарда такие же, как при приеме других агонистов ЛГ-РГ, что является результатом снижения уровня тестостерона. Отмечают основные проявления: приливы, снижение либидо, гинекомастия (табл. 2).
Феномен «вспышки», который является следствием кратковременного повышения уровня тестостерона и возникает при монотерапии (без использования антиандрогенов) агонистами ЛГ-РГ у 10% пациентов, не отмечают при лечении препаратом Элигард [76, 78, 79].
Таблица 2. Сравнение побочных эффектов при применениии агонистов ЛГ-РГ и препарата Элигард
| Побочные эффекты | В целом агонисты ЛГ-РГ | Элигард |
|---|---|---|
| Приливы | 50–70% | 57–59% |
| Гинекомастия | 5–15% | 1–2% |
| Астения | 6–15% | 6–17% |
| Тошнота | 0–13% | 0–3% |
В месте введения препарата побочное проявление незначительное и кратковременное, характерное для подкожных инъекций. Мягкое ощущение жара отмечали у 29% пациентов, без существенных изменений. Использование более короткой, меньшего диаметра иглы, по сравнению со способом введения других агонистов ЛГ-РГ, скорее всего, внесло свой вклад в относительное отсутствие дискомфорта после инъекции. Объем вводимого вещества препарата Элигард составляет 0,375 мл для формы 22,5 мг, что меньше по сравнению с другими продуктами лейпрорелина (2 мл препарата, содержащего микросферы 11,25 мг лейпрорелина ацетата для подкожных инъекций).
Подытоживая вышесказанное, можно выделить основные преимущества препарата Элигард:
- повышение лечебного эффекта благодаря содержанию двойной дозы активного вещества по сравнению с другими препаратами этого класса;
- возможность индивидуализации лечения благодаря наличию 3 лекарственных форм с различными интервалами введения: 1 раз в месяц, 1 раз в 3 мес, 1 раз в 6 мес;
- оптимальный контроль за уровнем тестостерона — длительное поддержание его уровня <20 нг/дл у значительного числа пациентов;
- эффективнее других агонистов ЛГ-РГ снижает уровень тестостерона: <50 нг/дл — в 100%, а <20 нг/дл — у 94% пациентов (для введения с интервалами в 1 и 3 мес);
- отсутствие подъема уровня тестостерона (феномена «вспышки») после повторного введения;
- поддержание уровня тестостерона ниже кастрационного в ходе всего лечения;
- побочные эффекты сопоставимы с другими агонистами ЛГ-РГ, а путь введения — малотравматичен.
Вышеперечисленные преимущества препарата Элигард дают основания рекомендовать его для широкого применения в медицинской практике для лечения пациентов с РПЖ.
Список использованной литературы
1. Ferlay J., Shin H.R., Bray F. et al. (2010) GLOBOCAN 2008, Cancer incidence and mortality worldwide: IARC CancerBase No. 10. Lyon, France: International Agency for Research on Cancer.
2. Center M.M., Jemal A., Lortet-Tieulent J. et al. (2012) International Variation in Prostate Cancer Incidence and Mortality Rates. Eur. Urol., 61: 1079–1092.
3. Бюлетень Національного канцер-реєстру «Рак в Україні» 2001–2011.
4. Bill-Axelson A., Holmberg L., Filen F. et al. (2008) Radical prostatectomy versus watchful waiting in localized prostate cancer: the Scandinavian prostate cancer group-4 randomized trial. J. Natl. Cancer. Inst., 100(16): 1144–1154.
5. EAU (2012) Guidelines on Prostate Cancer.
6. Consensus statement: the management of clinically localized prostate cancer. (1988) National Institutes of health Consensus Development Panel (no authors listed). NCI Monogr., (7): 3–6.
7. Huggins C., Stevens Jr. R.E., Hodges C.V. (1941) The effect of castration on advanced carcinoma of the prostate gland. Arch. Surg., 43: 209.
8. Mottet N., Bellmunt J., Bolla M. et al. (2011) EAU Guidelines on Prostate Cancer. Part II: Treatment of Advanced, Relapsing, and Castration-Resistant Prostate Cancer. Eur. Urol., 59: 572–583.
9. Cassileth B.R., Soloway M.S., Vogelzang N.J. et al. (1989) Patients’ choice of treatment in stage D prostate cancer. Urology, 33 (Suppl): 57–62.
10. Soloway M. et al. (1990) Recent advances in urological cancers diagnosis and treatment. Paris: 72–74.
11. Shahinian V.B., Kuo Y.F., Freeman J.L. et al. (2005) Increasing use of gonadotropin-releasing hormone agonists for the treatment of localized prostate carcinoma. Cancer, 103(8): 1615–1624.
12. Kaisary A.V., Tyrrell C.J., Peeling W.B., Griffiths K. (1991) Comparison of LHRH analogue (Zoladex) with orchiectomy in patients with metastatic prostatic carcinoma. Br. J. Urol., 67(5): 502–208.
13. Vogelzang N.J., Chodak G.W., Soloway M.S. et al. (1995) Goserelin versus orchiectomy in the treatment of advanced prostate cancer: final results of a randomized trial. Zoladex Prostate Study Group. Urology, 46(2): 220–226.
14. Cassileth B.R., Soloway M.S., Vogelzang N.J. et al. (1992) Quality of life and psychosocial status in stage D prostate c ancer. Zoladex Prostate Cancer Study Group. Qual. Life Res., 1(5): 323–329.
15. Pagliarulo V., Bracarda S., Eisenberger M.A. et al. (2012) Contemporary Role of Androgen Deprivation Therapy for Prostate Cancer. Eur. Urol., 31: 11–25.
16. Wong Y.-N., Freedland S.J., Egleston B. et al. (2009) The role of primary androgen deprivation therapy in localized prostate cancer. Eur. Urol., 56: 609–616.
17. Lu-Yao G.L., Albertsen P.C., Moore D.F. et al. (2008) Survival following primary androgen deprivation therapy among men with localized prostate cancer. JAMA, 300: 173–181.
18. McLeod D.G., Iversen P., See W.A. et al. (2006) Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cancer. BJU Int., 97: 247–254.
19. Widmark A., Klepp O., Solberg A. et al. (2009) Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomized phase III trial. Lancet, 373: 301–308.
20. Warde P.R., Mason M.D., Sydes M.R. et al. (2010) Intergroup randomized phase III study of androgen deprivation therapy (ADT) plus radiation therapy (RT) in locally advanced prostate cancer (CaP) (NCICCTG, SWOG, MRC-UK, INT: T94–0110; NCT00002633) [abstract CRA4504]. J. Clin. Oncol., 28: 18s.
21. Mottet N., Peneau M., Mazeron J. et al. (2010) Impact of radiotherapy combined with androgen deprivation versus ADT alone for local control of clinically locally advanced prostate cancer [abstract 4505]. J. Clin. Oncol.; 28: 15s.
22. Engel J., Bastian P.J., Baur H. et al. (2010) Survival benefit of radical prostatectomy in lymph node-positive patients with prostate cancer. Eur. Urol., 57: 754–761.
23. Frohmuller H.G.W., Theiss M., Manseck A., Wirth M.P. (1995) Survival and quality of life of patients with stage D1 (T1–3 pN1–2 M0) prostate cancer: radical prostatectomy plus androgen deprivation versus androgen deprivation alone. Eur. Urol., 27: 202–206.
24. Ghavamian R., Bergstralh E.J., Blute M.L. et al. (1999) Radical retropubic prostatectomy plus orchiectomy versus orchiectomy alone for pTxN+ prostate cancer: a matched comparison. J. Urol., 161: 1223–1227.
25. Grimm M.-O., Kamphausen S., Hugenschmidt H. et al. (2002) Clinical outcome of patients with lymph node positive prostate cancer after radical prostatectomy versus androgen deprivation. Eur. Urol., 41: 628–634.
26. Bolla M., de Reijke T.M., Van Tienhoven G. et al. (2009) Duration of androgen suppression in the treatment of prostate cancer. N. Engl. J. Med., 360: 2516–2527.
27. Bolla M., Van Tienhoven G., Warde P. et al. (2010)External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomized study. Lancet Oncol., 11: 1066–1073.
28. Crook J., Ludgate C., Malone S. et al. (2004) Report of a multicenter Canadian phase III randomized trial of 3 months vs. 8 months neoadjuvant androgen deprivation before standard-dose radiotherapy for clinically localized prostate cancer. Int. J. Radiat. Oncol. Biol. Phys., 60: 15–23.
29. Denham J.W., Steigler A., Lamb D.S. et al. (2005)Short-term androgen deprivation and radiotherapy for locally advanced prostate cancer: results from the Trans-Tasman Radiation Oncology Group 96.01 randomized controlled trial. Lancet Oncol., 6: 841–850.
30. Granfors T., Modig H., Damber J.E., Tomic R. (2006) Long-term followup of a randomized study of locally advanced prostate cancer treated with combined orchidectomy and external radiotherapy versus radiotherapy alone. J. Urol., 176: 544–547.
31. Jones C.U., Hunt D., McGowan D.G. et al. (2011)Radiotherapy and shortterm androgen deprivation for localized prostate cancer. N. Engl. J. Med., 365: 107–118.
32. Pilepich M.V., Winter K., Lawton C.A. et al. (2005) Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma longterm results of phase III RTOG85–31. Int. J. Radiat. Oncol. Biol. Phys., 61: 1285–1290.
33. Roach M., Bae K., Speight J. et al. (2008) Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: long-term results of RTOG 8610. J. Clin. Oncol., 26: 585–591.
34. See W.A., Tyrrell C.J., CASODEX Early Prostate Cancer Trialists’ Group. (2006) The addition of bicalutamide 150 mg to radiotherapy significantly improves overall survival in men with locally advanced prostate cancer. J. Cancer Res. Clin. Oncol., 132 (Suppl 1): S7–16.
35. D’Amico A.V., Whittington R., Malkowicz S.B. (1998) Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA, 280: 969–974.
36. Bolla M., Collette L., Blank L. et al. (2002) Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet, 360: 103–106.
37. Horwitz E.M., Bae K., Hanks G.E. et al. (2008) Ten-year follow-up of Radiation Therapy Oncology Group Protocol 92–02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J. Clin. Oncol., 26: 2497–2504.
38. Messing E.M., Manola J., Sarosdy M. et al. (1999) Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N. Engl. J. Med., 341: 1781–1788.
39. Messing E.M., Manola J., Yao J. et al. (2006) Eastern Cooperative Oncology Group study: immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol., 7: 472–479.
40. McLeod D.G., See W.A., Klimberg I. et al. (2006) The bicalutamide 150 mg early prostate cancer program: findings of the North American trial at 7.7-year median follow up. J. Urol., 176: 75–80.
41. Medical Research Council Prostate Cancer Working Party Investigators Group. (1997) Immediate versus deferred treatment for advanced prostatic cancer: initial results of the Medical Research Council Trial. Br. J. Urol., 79: 235–246.
42. Eisenberger M.A., Crawford E.D., Wolf M. et al. (1994) Prognostic factors in stage D2 prostate cancer; important implications for future trials: results of a cooperative intergroup study (INT. 0036). The National Cancer Institute Intergroup Study № 0036. Semin. Oncol., 21: 613.
43. Boccardo F., Pace M., Rubagotti A. et al. (1993) Goserelin acetate with or without flutamide in the treatment of patients with locally advanced or metastatic prostate cancer. The Italian Prostatic Cancer Project (PONCAP) Study Group. Eur. J. Cancer, 29A: 1088–1093.
44. Crawford E.D., Eisenberger M.A., McLeod D.G. et al. (1989) A controlled trial of leuprolide with and without flutamide in prostatic carcinoma. N. Engl. J. Med., 321: 419–424.
45. Dijkman G.A., Janknegt R.A., De Reyke T.M., Debruyne F.M.J. (1997) Long-term efficacy and safety of nilutamide plus castration in advanced prostate cancer, and the significance of early prostate specific antigen normalization. J. Urol., 158: 160–163.
46. Eisenberger M.A., Blumenstein B.A., Crawford E.D. et al. (1998) Bilateral orchiectomy with or without flutamide for metastatic prostate cancer. N. Engl. J. Med., 339: 1036–1042.
47. Collette L., Studer U.E., Schröder F.H. et al. (2001) Why phase III trials of maximal androgen blockade versus castration in M1 prostate cancer rarely show statistically significant differences. Prostate, 48: 29–39.
48. Tyrrell C.J., Iversen P., Tammela T. et al. (2006) Tolerability, efficacy and pharmacokinetics of bicalutamide 300 mg, 450 mg or 600 mg as monotherapy for patients with locally advanced or metastatic prostate cancer, compared withcastration.BJU Int., 98: 563–72.
49. Prostate Cancer Trialists’ Collaborative Group. (2000) Maximum androgen blockade in advanced prostate cancer: an overview of the randomised trials. Lancet, 355: 1491–1498.
50. Schulman C.C., Irani J., Morote J. et al. (2010) Androgen-Deprivation Therapy in Prostate Cancer: A European Expert Panel Review. Eur. Urol. (Suppl. 9): 675–691.
51. Tombal B., Berges R. (2008) Optimal control of testosterone: a clinical case-based approach of modern androgen deprivation therapy. Eur. Urol., Suppl., 7: 15–21.
52. Shearer R.J., Hendry W.F., Sommerville I.F., Fergusson J.D. (1973) Plasma testosterone: an accurate monitor of hormone treatment in prostatic cancer. Br. J. Urol., 45: 668–677.
53. Oefelein M.G., Feng A., Scolieri M.J. (2000) Reassessment of thedefinitionof castrate levels of testosterone: implications for clinical decision making. Urology, 56: 1021–1024.
54. Kaisary A.V., Tyrrell C.J., Peeling W.B., Griffiths K. (1991) Comparison of LHRH analogue (Zoladex) with orchiectomy in patients with metastatic prostatic carcinoma. Br. J. Urol., 67: 502–508.
55. Rohl H.F., Beuke H.P. (1992) Effect of orchidectomy on serum concentrations of testosterone and dihydrotestosterone in patients with prostatic cancer. Scand. J. Urol. Nephrol., 26: 11–4.
56. Lin B.J., Chen K.K., Chen M.T., Chang L.S. (1994) The time for serum testosterone to reach castrate level after bilateral orchiectomy or oral estrogen in the management of metastatic prostatic cancer. Urology, 43: 834–837.
57. Vogelzang N.J., Chodak G.W., Soloway M.S. et al. (1995) Goserelin versus orchiectomy in the treatment of advanced prostate cancer: final results of a randomized trial. Zoladex Prostate Study Group. Urology, 46: 220–226.
58. Tombal B., Berges R. (2005) How good do current LHRH agonists control testosterone? Can this be improved with Eligard1? Eur. Urol. Suppl., 4(8): 30–36.
59. Novara G., Galfano A., Secco S. et al. (2009) Impact of surgical and medical castration on serum testosterone level in prostate cancer patients. Urol. Int., 82: 249–255.
60. Zlotta A., Debruyne F.M.J. (2005) Expert opinion on optimal testosterone control in prostate cancer. Eur. Urol. Suppl., 4(8): 37–41.
61. Morote J., Orsola A., Planas J. et al. (2007) Redefining clinically significant castration levels in patients with prostate cancer receiving continuous androgen deprivation therapy. J. Urol., 178: 1290–1295.
62. Oefelein M.G., Cornum R. (2000) Failure to achieve castrate levels of testosterone during luteinizing hormone releasing hormone agonist therapy: the case for monitoring serum testosterone and a treatment decision algorithm. J. Urol., 164: 726–729.
63. Morote J., Esquena S., Abascal J.M. et al. (2006) Failure to maintain a suppressed level of serum testosterone during longacting depot luteinizing hormone-releasing hormone agonist therapy in patients with advanced prostate cancer. Urol. Int., 77: 135–138.
64. Perachino M., Cavalli V., Ferraris V. (2007) Do all patients receiving LHRH therapy for advanced prostate cancer achieve castrate levels of testosterone? Results of a prospective study on 105 patients. Eur. Urol. Suppl., 6: 87 (abstract no. 258).
65. Periti P., Mazzei T., Mini E. (2002) Clinical pharmacokinetics of depot leuprorelin. Clin. Pharmacokinet., 41: 485–504.
66. Sarosdy M.F., Schellhammer P.F., Soloway M.S. et al. (1999) Endocrine effects, efficacy and tolerability of a 10.8-mg depot formulation of goserelin acetate administered every 13 weeks to patients with advanced prostate cancer. BJU Int., 83(7): 801–806.
67. McLeod D., Zinner N., Tomera K. et al. (2001) A phase 3, multicenter, open-label, randomized study of abarelix versus leuprolide acetate in men with prostate cancer. Urology, 58(5): 756–761.
68. Wechsel H.W., Zerbib M., Pagano F., Coptcoat MJ. (1996) Randomized open labelled comparative study of the efficacy, safety and tolerability of leuprorelin acetate 1M and 3M depot in patients with advanced prostatic cancer. Eur. Urol., 30 Suppl. 1: 7–14; discussion 19–21.
69. Jocham D. (1998) Leuprorelin three-month depot in the treatment of advanced and metastatic prostate cancer: long-term follow-up results. Urol. Int., 60, Suppl. 2: 18–24; discussion 35.
70. Khan M.S., O’Brien A. (1998) An evaluation of pharmacokinetics and pharmacodynamics of leuprorelin acetate 3M-depot in patients with advanced and metastatic carcinoma of the prostate. Urol. Int., 60(1): 33–40.
71. Fontana D., Mari M., Martinelli A. (2003) 3-month formulation of goserelin acetate («Zoladex» 10.8-mg depot) in advanced prostate cancer: results from an Italian, open, multicenter trial. Urol. Int., 70(4): 316–320.
72. Periti P., Mazzei T., Mini E. (2002) Clinical pharmacokinetics of depot leuprorelin. Clin. Pharmacokinet., 41: 485–504.
73. Ravivarapu H.B., Moyer K.L., Dunn R.L. (2000) Sustained suppression of pituitary-gonadal axiswith an injectable, in situ forming implant of leuprolide acetate. J. Pharm. Sci., 89: 732–741.
74. Perez-Marrero R., Tyler R.C. (2004) A subcutaneous delivery system for the extended release of leuprolide acetate for the treatment of prostate cancer. Expert. Opin. Pharmacother., 5: 447–457.
75. Schulman C., Alcaraz A., Berges R. et al. (2007) Expert opinion on 6-monthly luteinizing hormone-releasing hormone agonist treatment with the single-sphere depot system for prostate cancer. BJU Int.,100, Suppl. 1: 1–5.
76. Chu F.M., Jayson M., Dineen M.K. et al. (2002) A clinical study of 22.5 mg. LA-2550: a new subcutaneous depot delivery system for leuprolide acetate for the treatment of prostate cancer. J. Urol.,168: 1199–1203.
77. Crawford E.D., Sartor O., Chu F. et al. (2006) A 12-month clinical study of LA-2585 (45.0 mg): a new 6-month subcutaneous delivery system for leuprolide acetate for the treatment of prostate cancer. J. Urol., 175: 533–536.
78. Berges R., Bello U. (2006) Effect of a new leuprorelin formulation on testosterone levels in patients with advanced prostate cancer. Curr. Med. Res. Opin., 22(4): 649–55.
79. Perez-Marreno R., Chu F.M., Gleason D. et al. (2002) A six-month open label study assessing a new formulation of leuprolide 7.5 mg for suppression of testosterone in patients with prostate cancer. Clin. Ther., 24: 1902–14.
Сучасні аспекти використання агоністів лютеїнізуючого гормону — риліизинг-гормону в лікуванні раку передміхурової залози (огляд літератури)
Резюме. Основним принципом гормональної терапії раку передміхурової залози (РПЗ) є ізоляція пухлини від стимулюючої дії андрогенів — андрогенна блокада (депривація, абляція). Пригнічення андрогенної функції досягається різними шляхами: хірургічною кастрацією; медикаментозною кастрацією — гальмуванням секреції гонадотропних гормонів гіпофізу (агоністи лютеїнізуючого гормону — рилізинг-гормону (ЛГ-РГ)) чи, навпаки, перешкоджанням їм проявляти свою активність (антагоністи ЛГ-РГ); блокадою андрогенних рецепторів у тканині пухлини (антиандрогени) або їх поєднанням. Хоча сьогодні двобічну орхіектомію, яка призводить до швидкого, глибокого, тривалого та незворотного пригнічення вироблення тестостерону, виконують рідко, її вважають еталоном андрогенної депривації, з яким порівнюють ефективність препаратів, які застосовують для медикаментозної кастрації. Значна кількість пацієнтів неадекватно реагують на лікування та страждають від несподіваних підйомів рівня тестостерону чи навіть не досягають необхідного рівня кастрації. У 2–12,5% пацієнтів агоністи ЛГ-РГ не забезпечують кастраційного рівня тестостерону ≤50 нг/дл, у 13–46% — ≤20 нг/дл, а у 4–12,5% пацієнтів повторні ін’єкції призводять до відстрочених його підйомів. Застосування препарату Елігард у трьох лікарських формах підвищує лікувальний ефект завдяки вмісту подвійної дози активної речовини порівняно з іншими препаратами цього класу, забезпечує оптимальний контроль за рівнем тестостерону — підтримання його рівня нижче кастраційного протягом усього періоду лікування; вираженість побічних проявів зіставна та навіть менша, ніж при лікування іншими агоністами ЛГ-РГ, а шлях введення — малотравматичний.
Ключевые слова: рак передміхурової залози, андрогенна депривація, рівень тестостерону, агоністи ЛГ-РГ, Елігард.
Modern aspects of agonists luteinizing hormone — releasing hormone in the treatment of prostate cancer (review)
Summary. The basic principle of hormone therapy for prostate cancer (PCa) is the isolation of the tumor from the stimulatory effect of androgens — androgen blockade (deprivation, ablation). Inhibition of androgen function is achieved in different ways: surgical castration; medical castration — inhibition of secretion of pituitary gonadotropins (luteinizing hormone agonists — releasing hormone (LH-RH)) or, on the contrary, an obstacle to show them their activity (antagonists of LH-RH), the blockade of androgen receptor in the tumor tissue (androgens), or a combination thereof. Although today bilateral orchiectomy, which leads to faster, deeper, long-term and irreversible inhibition of testosterone production, is performed rarely, it is considered the standard androgen deprivation is the yardstick with which to compare drugs used for medical castration. A significant number of patients not adequately respond to treatment and suffer from sudden rise in testosterone levels, or do not even reach the promised level of castration. 2–12.5% of patients in the LH-RH agonists do not provide castrate testosterone levels ≤50 ng/dl in 13–46% ≤20 ng/dl in 4–12,5% of patients repeated injections cause a delayed lift. Use of the drug Eligard in three dosage forms increases the therapeutic effect due to the content a double dose of the active substance as compared to other drugs in this class, provides optimum control over the level of testosterone — keeping it below the castration during the period of treatment, the side effects are comparable or even lower than the treatment of other LH-RH agonists, and the route of administration — low-impact.
Key words: prostate cancer, androgen deprivation, the level of testosterone, LH-RH agonists, Eligard.














Leave a comment