Нехромафінні парагангліоми середостіння
Захаричев В.Д.1, Ганул А.В.2, Семиволос А.В.2, Кротевич М.С.2
- 1Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
- 2Національний інститут раку, Київ
Резюме. Парагангліоми середостіння — рідкісні, добре васкуляризовані пухлини з хромафінної тканини парааортальних гангліїв. Автори мають власний досвід обстеження та лікування 26 пацієнтів з внутрішньогрудними нехромафінними парагангліомами, з яких у 27 пухлини локалізувалися у передньому середостінні. Радикальні операції виконані 13 пацієнтам, паліативні втручання — 2. Вперше застосована внутрішньоартеріальна поліхіміотерапія у якості як неоад’ювантного, так і самостійного лікування. Аналіз власних спостережень дозволив зробити такі висновки: протипухлинна хіміотерапія, особливо при внутрішньоартеріальному введенні, чинить виражену лікувальну дію; найефективніше комплексне лікування з неоад’ювантною хіміо-променевою терапією.
Резюме. Параганглиомы средостения — редкие, обильно васкуляризированные опухоли из хромаффинной ткани парааортальных ганглиев. Авторы располагают собственным опытом обследования и лечения 26 пациентов с внутригрудными нехромаффинными параганглиомами, из которых у 24 опухоли локализовались в переднем средостении. Радикальные операции выполнены 13 пациентам, паллиативные — 2. Впервые применена внутриартериальная регионарная химиотерапия как в качестве неоадъювантного, так и самостоятельного лечения. Анализ собственных наблюдений позволил сделать следующие выводы: противоопухолевая химиотерапия, особенно при внутриартериальном введении, оказывает выраженное лечебное действие; наиболее эффективно комплексное лечение с неоадъювантной химио-лучевой терапией.

ВВЕДЕНИЕ
Нехромаффинные параганглиомы (ПГ), известные также как хемодектомы, могут иметь различную локализацию. Наиболее часто их выявляют в области каротидного гломуса, яремной ямки, орбиты, спинномозговом канале, среднего уха, в забрюшинном пространстве. Вместе с тем имеются сообщения о более редкой их локализации: щитовидная железа, мочевой пузырь, предстательная железа, подвздошная область, легкое, сердце, средостение [2, 3, 4, 9, 22, 23, 24]. Особенностью этих опухолей считается их способность к мультифокальному росту [7, 8, 13, 21]. Чаще эти опухоли идиопатические, но в литературе описаны семейные случаи, которые составляют 7–9% всех ПГ, наследуются они по аутосомно-доминантному типу [19, 21]. В этой связи должно быть рекомендовано клиническое и рентгенологическое обследование родственников пациента [19].
ПГ — опухоль, исходящая из ткани нервных гребешков, которые развиваются в симпатических параганглиях. По классификации ВОЗ ПГ включены в группу параганглиом и гломусных опухолей. Термин «ПГ» применяется, главным образом, по отношению к опухолям из нехромаффинных параганглиев. Эти опухоли называют также зернистоклеточной, альвеолярной опухолью, карциноидом, нехромаффинной ПГ, хемодектомой. Близость клеток ПГ к нервным клеткам и волокнам свидетельствует не только об их генетическом, но и функциональном родстве. Предполагается, что нехромаффинные ПГ секретируют полипептидные гормоны, не являющиеся катехоламинами.
Внутригрудные ПГ, локализующиеся преимущественно в средостении — редкие опухоли, отличаются сложностью дооперационной диагностики и выбора адекватного метода лечения при наличии распространенного инфильтрирующего роста.
Размер и локализация ПГ средостения вариабельны, они редко достигают больших размеров, преимущественная локализация этих опухолей — переднее средостение, где источником их развития являются парааортальные симпатические ганглии [1]. Однако есть сообщения о локализации ПГ в заднем средостении, происходящих, по-видимому, из паравертебральной цепочки симпатических ганглиев [2, 9, 17].
Микроскопическое строение ПГ любой локализации однотипно. В зависимости от группировки клеток, количества стромы и сосудов выделяют альвеолярный (альвеолярно-трабекулярный), трабекулярный, ангиоматозный и солидный варианты ПГ. Эти варианты часто сочетаются в одной и той же опухоли, но обычно преобладает один из них.
Злокачественный вариант опухоли, по распространенному мнению, отмечают редко [17, 21, 25], характеризуется выраженным инфильтрирующим ростом. Метастазы злокачественной ПГ появляются относительно поздно, вначале в регионарных лимфатических узлах, затем быстро наступает гематогенное метастазирование. Описаны наблюдения злокачественных ПГ с наличием множественных органных метастазов, включая легкое, печень, кости, головной мозг, орбиту [15, 24, 25,].
По мнению B. Baysal и соавторов [7], критерий злокачественности ПГ основывается на клиническом прогрессировании заболевания более, чем на гистологической картине. ПГ без клеточной атипии может метастазировать в регионарные лимфоузлы или отдаленные органы путем гематогенного распространения, хотя метастазы отмечают редко. Группа американских авторов [16] исследовали ангиогенез при феохромоцитомах и ПГ и пришли к заключению, что выраженная сосудистая сеть опухоли коррелирует с их способностью к инвазивному росту и ангиогенез опухоли может быть использован для оценки вероятности злокачественного поведения ПГ.
При наличии в средостении нехромаффинной несекретирующей ПГ, характеризующейся локальным ростом, клинические проявления опухоли обычно минимальные и заболевание выявляют случайно при компьютерной (КТ) или магнито-резонансной томографии (МРТ), проводимых по поводу других заболеваний [12, 18, 21].
Выбор лечебной тактики при нехромаффинных ПГ средостения обусловлен конкретными объективными данными. Радикальное хирургическое удаление остается стандартом лечения из-за угрозы озлокачествления опухоли и низкой чувствительности к химио- или лучевой терапии [26]. Основываясь на анализе собственного многолетнего клинического опыта и данных литературы, мы поставили задачу оценить результаты различных лечебных подходов и определить оптимальный метод лечения пациентов со злокачественными ПГ средостения, а также установить основные прогностические факторы изучаемой категории пациентов.
объект И МЕТОДЫ ИССЛЕДОВАНИЯ
В отделении опухолей органов грудной полости Национального института рака в 1968–2010 гг. находились под наблюдением 26 больных с внутригрудной локализацией ПГ, из которых 25 — с локализацией в средостении (24 — в переднем и 1 — в заднем).
Отмечено примерно одинаковое распределение больных по полу — 14 женщин и 12 мужчин. Возраст пациентов составлял 14 лет – 74 года. Все больные прошли полное клиническое обследование с широким применением инструментальных методов, включая КТ, эндоскопическое, функциональное и цитоморфологическое исследования. Диагностические операции (парастернальная медиастинотомия, торакотомия, биопсия увеличенных периферических лимфоузлов) выполнены 13 больным. У 10 из них верифицирована злокачественная ПГ. Трансторакальная пункционная биопсия опухоли для цитологического исследования произведена 13 пациентам.
Хирургическое вмешательство предпринято у 17 пациентов, из них у 12 операция была составляющей комплексного или комбинированного лечения, у 3 — как самостоятельное лечение и у 2 закончилась пробной торакотомией.
Комбинированное лечение, включавшее предоперационную лучевую терапию и операцию, проведено 6 пациентам. Комплексное лечение получили 6 пациентов (в том числе неоадъювантную химиотерапию), 3 — в сочетании с лучевой терапией. У 5 из этих больных применена методика внутриартериального введения противоопухолевых химиопрепаратов.
Больным с наличием отдаленных метастазов проводили паллиативное лечение: 4 — лучевую терапию, 5 — только полихимиотерапию.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Большинство пациентов (17 (65,4%)) поступили в клинику с распространенным опухолевым процессом, у 8 (30,8%) выявлены дистантные метастазы (у 4 — в шейно-надключичные лимфоузлы, у 4 — в легкое, плевру, у 2 — в кости). Однако отдельные литературные сообщения свидетельствуют, что метастазы при ПГ отмечают редко — около 5–10% случаев [8, 9].
Больные ПГ средостения были распределены по клиническим стадиям: І стадия (Т1N0M0) — 1, ІІ стадия (T2N0M0) — 5, ІІІ стадия (T3N0M0) — 11, ІV cтадия — наличие отдаленных метастазов (М1) — 8 и (Т4N2М0) — 1.
Клиническая картина нехромаффинной ПГ средостения зависит от степени распространенности опухоли, ее локализации и способности к инфильтрирующему росту. При злокачественных вариантах ПГ, локализующихся в переднем средостении, превалируют симптомы компрессионного синдрома, включая синдром сдавления верхней полой вены, что отмечали у большинства наблюдаемых нами пациентов. ПГ средостения могут быть локально инвазивными, прорастать аорту и ее ветви, легочную артерию, перикард, сердце, что обусловливает клиническую симптоматику.
Из субъективных симптомов, наиболее часто заставляющих наших пациентов обращаться за медицинской помощью, отмечали боль в груди, за грудиной в области сердца (у 23). M. Вrown и соавторы [7] описали случай ПГ переднего средостения, выявленной при коронарной ангиографии, произведенной по поводу атипичной боли в области сердца и одышки. Кровоснабжение опухоли осуществлялось ветвями коронарных артерий.
Основным методом распознавания опухоли остается рутинное рентгенологическое исследование, позволяющее определить наличие патологической тени в средостении, преимущественно в передневерхнем его отделе. Размеры, конфигурация и локализация тенеобразования во многом обусловливается типом роста опухоли — инкапсулированным (доброкачественным) или инфильтрирующим (злокачественным). Для доброкачественных ПГ характерно наличие односторонне расположенной парамедиастинальной тени, округлой или несколько продолговатой формы, средней интенсивности, с ровными четкими контурами. В боковой проекции ПГ локализуются вблизи дуги аорты, занимая передний или переднесредний отделы средостения, редко — заднего. Злокачественные ПГ обычно расположены за грудиной, срединно, обусловливая рентгенологически определяемое расширение срединной тени в верхнем отделе, контуры тени четкие, местами неровные.
КТ или МРТ средостения позволяют определить истинное расположение опухоли, вовлечение в патологический процесс соседних структур и анатомических образований.
Специфичным исследованием для ПГ является сцинтиграфия с І- или І-метайодбензилгуанидином (MIBG-сцинтиграфия). MIBG накапливается значительно больше в злокачественных ПГ по сравнению с доброкачественными, обеспечивая тем самым диагностический критерий дифференцировки этих опухолей [18, 26]. MIBG-сцинтиграфия в сочетании с КТ обеспечивает анатомическую и функциональную информацию с хорошей чувствительностью (80–90%) и специфичностью (95–100%) [18].
Дооперационный диагноз верифицируется цитологическим и гистологическим исследованиями материала, полученного при игловой биопсии опухоли или при медиастиноскопии. По мнению R. Rana и соавторов [20], при диагностике ПГ достаточно убедительны цитологические особенности. Однако при цитологическом исследовании материала пункционной биопсии опухоли у 13 наших пациентов ни в одном случае не установлен правильный морфологический диагноз ПГ. Лишь у одной пациентки при иммуногистохимическом исследовании пунктата опухоли была диагностирована злокачественная ПГ.
Характер роста ПГ предопределяет возможность радикального ее удаления. По мнению большинства авторов, лечение ПГ средостения должно быть хирургическим, за исключением злокачественных вариантов с наличием отдаленных метастазов. При инфильтрирующем росте опухоли и подрастании ее к магистральным сосудам, сердцу, трахее радикальное удаление оказывается невозможным или сопряжено со значительными техническими трудностями и вероятными тяжелыми интраоперационными осложнениями. C. Andrade и соавторы [5] описали случай ПГ, локализующейся в аортопульмональном окне, хирургическое удаление которой осложнилось массивным кровотечением, остановленным только тампонадой плевральной полости. K.S. Williams и соавторы [27] представили наблюдение ПГ среднего средостения, распространявшейся интраперикардиально, плотно сращенной с аортой у основания правой коронарной артерии. Выделение опухоли осложнилось острой массивной геморрагией до 4 л крови.
Из 26 наших больных различные методы лечения предприняты у 24. Операции выполнены 17 больным, из них радикальные — 13, паллиативные — 2 и пробные торакотомии — 2. Из числа радикальных операций у 7 пациентов вместе с удалением опухоли произведена резекция соседних анатомических структур (легкое, перикард, левая плечеголовная вена). Лишь у 3 больных лечение ограничилось самостоятельной радикальной операцией. Комбинированное лечение (предоперационная лучевая терапия и операция) проведено 6 пациентам и комплексное лечение (неоадъювантная химиотерапия или химиотерапия в сочетании с лучевой) — 6 больным. Осложнений во время и после операций не отмечено.
По мнению M. Brown [7], продолжительность жизни больных не зависит даже от радикальности (полного или частичного) удаления ПГ и составляет 3–13 лет. В наблюдении автора после частичного удаления ПГ средостения больной жил в течение 14 лет без прогрессирования заболевания. В наблюдении L. Mancini и F. Roncaroli [17] больной со злокачественной ПГ средостения был жив через 27 лет после хирургического удаления опухоли. Вместе с тем, имеются сообщения о развитии метастазов после полного удаления опухоли спустя длительный период [20].
Отношение к лучевой терапии при неоперабельных ПГ противоречиво — от оценки метода как эффективного, позволяющего авторам [2] рекомендовать включение облучения в комбинированное лечение злокачественных ПГ, до негативного [25]. Нам представляется возможным объяснить столь противоречивые суждения разнообразием гистологических типов ПГ. Исходя из наших наблюдений, можно отметить умеренную чувствительность ПГ к лучевой терапии. У большинства больных, которым была проведена лучевая терапия в качестве предоперационного или самостоятельного лечения, выявлено прогрессирование опухолевого роста. Лишь у одного больного после радикального удаления ПГ с предоперационной лучевой терапией не отмечено прогрессирования опухоли в течение 4,7 года, 5 пациентов умерли от пролонгации заболевания в сроки от 5,5 до 48 мес, средняя продолжительность их жизни после лечения составила 32,7 мес. После пробной торакотомии с предоперационной лучевой терапией пациентка прожила более 3 лет, еще одна пациентка после паллиативного удаления опухоли с пред- и послеоперационным облучением средостения жила 21 мес.
О применении химиотерапии в лечении злокачественных ПГ имеются единичные сообщения [2, 15, 25]. A. Argiris и соавторы [6], применяя при метастатической форме ПГ химиотерапию циклофосфаном, доксорубицином и дакарбазином, отметили выраженное клиническое улучшение, но при этом не выявлено значительных изменений опухоли на КТ; пациент наблюдался без прогрессирования заболевания 24 мес. Временное улучшение лабораторных данных и уменьшение на 20% размеров метастазов в печени в результате применения циклофосфана, винкристина и дакарбазина у больного злокачественной метастазирующей ПГ отмечали S. Kimura с соавторами [15]. По опыту H. Huang и соавторов [14], применявших этот режим химиотерапии у пациентов со злокачественными ПГ, получен убедительный паллиативный эффект с медианой выживания 3,3 года.
По нашим наблюдениям, положительный непосредственный эффект и лучшие результаты безрецидивного выживания больных с ПГ получены от проводимого лечения с химиотерапией. Значительное уменьшение выраженности как клинических симптомов компрессионного синдрома (включая синдром сдавления верхней полой вены), так и рентгенологически регистрируемых размеров опухоли в средостении, было достигнуто в результате проводимой внутриартериальной регионарной полихимиотерапии. Злокачественная ПГ у большинства больных оказалась чувствительной к химиотерапии, проводимой несколькими блоками, включавшими цисплатин, циклофосфан, винкристин и дакарбазин, у отдельных пациентов добавляли доксорубицин или ластед. Продолжительность жизни пациентов после проведенного комплексного лечения с использованием указанных химиопрепаратов составила от 23 мес до 7,7 года, 4 больных продолжают наблюдаться 3–7 лет. Средняя продолжительность жизни в этой группе пациентов составила 58,3 мес.
Представляем одно из наших наблюдений. Больная М., 31 год, поступила в отделение опухолей органов грудной полости 3.12.2007 г. с диагнозом «опухоль средостения. Тимома?». На момент поступления больная предъявляла жалобы на сухой кашель, одышку при физической нагрузке, боль в правой половине грудной клетки, повышение температуры тела до 37,5 °С по вечерам, кожный зуд. Для верификации диагноза дважды выполняли трансторакальную пункционную биопсию опухоли средостения, однако, кроме данных о злокачественной опухоли, уточняющей информации получено не было. 6.12.2007 г. были выполнены диагностическая торакотомия справа, биопсия опухоли, катетеризация обеих внутренних грудных артерий. На основании данных патогистологического (рис. 1) и иммуногистохимического исследований, а также данных спиральной КТ, был установлен клинический диагноз «злокачественная параганглиома средостения». Метастазы опухоли в лимфатические узлы корня правого легкого, паратрахеальные лимфатические узлы.
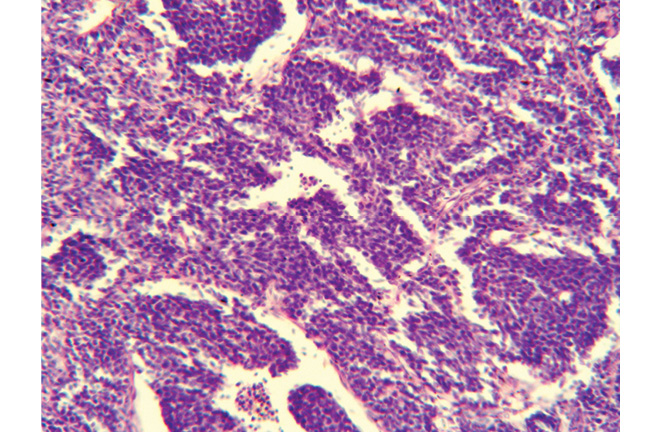
С 18 по 21 декабря 2007 г. пациентка получила цикл внутриартериальной полихимиотерапии по схеме цисплатин + ластет + винкристин. С января по май 2008 г., с интервалом в 3 нед, было проведено еще 4 цикла системной полихимиотерапии по аналогичной схеме, так как катетеры в обеих внутренних грудных артериях были тромбированы, несмотря на профилактическую гепаринотерапию. Курс полихимиотерапии больная перенесла удовлетворительно. 26.05.2008 г. она была прооперирована. Выполнено удаление опухоли средостения с резекцией верхней доли левого легкого, резекцией перикарда, тотальной медиастинальной лимфодиссекцией. По данным патогистологического исследования, удаленная опухоль — злокачественная ПГ с выраженным лечебным патоморфозом, объем жизнеспособной опухолевой ткани составил 23,7% (рис. 2, 3). Через 10 дней после операции больная выписана в удовлетворительном состоянии.
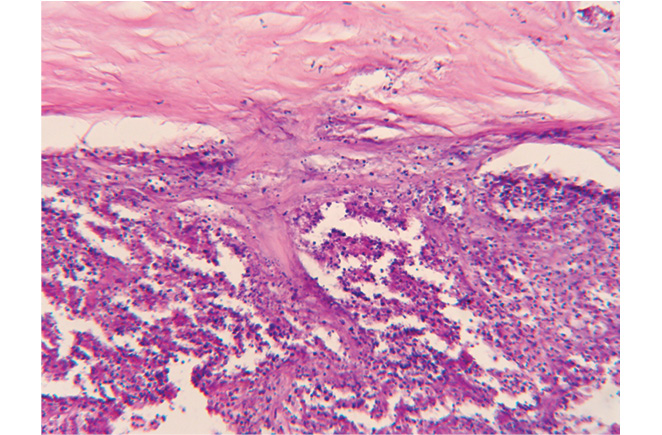
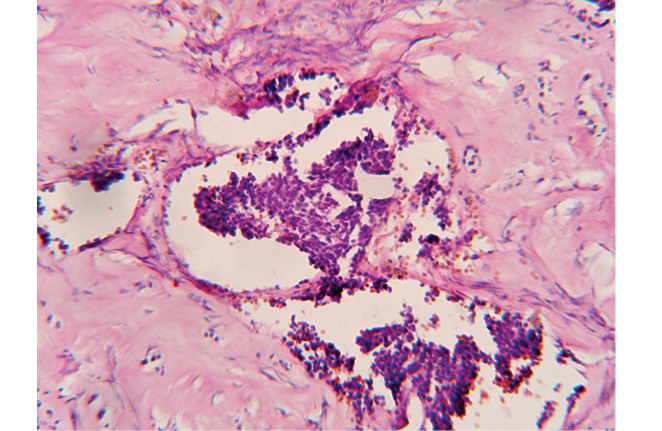
Через 3 мес, при контрольном осмотре, выявлено прогрессирование заболевания — увеличение шейно-надключичных лимфатических узлов справа до 1,5–2 см, солитарный метастаз в S5 печени до 5 см в диаметре. Выполнена широкая лимфодиссекция шейно-надключичной области справа. В удаленных лимфоузлах подтверждено наличие метастазов злокачественной ПГ. Проведен цикл полихимиотерапии по схеме ифосфамид +доксорубицин. В дальнейшем пациентка получила 5 циклов полихимиотерапии по идентичной схеме по месту жительства. 25.06.2009 г. больной проведено оперативное вмешательство по поводу метастаза в печень. Выполнена резекция S5 печени с метастазом злокачественной параганглиомы. Заключение гистологического исследования: в печени, лимфоузлах разрастание низкодифференцированной опухоли — злокачественная ПГ.
В настоящее время состояние пациентки удовлетворительное, данных о прогрессировании заболевания нет.
Накопленный собственный материал позволяет сделать следующие выводы:
1. Нехромаффинная ПГ средостения развивается с одинаковой частотой как у мужчин, так и у женщин, не зависит от возраста пациентов.
2. Из 26 наблюдавшихся пациентов у 25 была гистологически подтвержденная злокачественная ПГ, что позволяет нам не согласиться с имеющимися в литературе утверждениями о большой редкости злокачественных вариантов ПГ средостения.
3. Уточненная дооперационная диагностика ПГ средостения очень сложна и возможна лишь при гистологическом (иммуногистохимическом) исследовании биопсийного или операционного материала опухоли.
4. Преимущественная локализация ПГ в средостении — передний отдел, верхний этаж, в области дуги аорты и магистральных венозных стволов средостения.
5. Для злокачественной ПГ средостения характерны инфильтрирующий рост, врастание в соседние анатомические структуры, высокая плотность васкуляризации, быстрый рост опухоли и способность к метастазированию.
6. Большинство гистологических вариантов злокачественной ПГ средостения умеренно чувствительны к ионизирующему облучению. Лучевая терапия оказывает паллиативный лечебный эффект.
7. Противоопухолевая химиотерапия, включающая цисплатин, винкристин, дакарбазин, циклофосфан оказывает выраженное лечебное действие на большинство вариантов злокачественной ПГ. Регионарная внутриартериальная химиотерапия является методом выбора в качестве предоперационного лечения злокачественной ПГ средостения.
ЛИТЕРАТУРА
- 1. Дедков И.П., Захарычев В.Д., Бабий Я.С. (1969) Хемодектомы средостения. Вопр. онкол., 15(4): 22–9.
- 2. Захарычев В.Д., Ганул А.В., Галахин К.А. и др. (2005) Внутригрудные нехромаффинные параганглиомы (хемодектомы). Онкология, 1: 79–85.
- 3. Кармазовский Г.Г., Коростелев А.Н., Дубова Е.А. и др. (2011) Параганглиома сердца. Хирургия, Т. 1: 61–64.
- 4. Седых С.А., Тепляков В.В., Епифанов С.В. и др. (2009) Диагностика и лечение злокачественной параганглиомы подвздошно-паховой области. Сибирский онкологический журнал, 6(36): 78–82.
- 5. Andrade C.F., Сamargo S.M., Zachet M. et al. (2003) Nonfuncioning paraganglioma of the aortopulmonary window. Ann. Thorac. Surg., 75(6): 1950–1951.
- 6. Argiris A., Mellot A., Spies S. (2003) PET scan assessment of chemotherapy response in metastatic paraganglioma. Am. J. Clin. Oncol., 26(6): 563–566.
- 7. Baysal B.E., Farr J.E., Rubinstein W.S. et al. (1997) Fine mapping of an imprinted gene for familial nonchromaffin paragangliomas, on chromosome 11q22. Am. J. Hum. Genet., Jan., 60(1): 121–132.
- 8. Brown M.L., Zayas G.E., Abel M.D. et al. (2008) Mediastinal Paragangliomas: The Mayo Clinic Experience. Ann. Thorac. Surg., 86: 946–951.
- 9. Cha R., Rainear K., Paczolt E. et al. (1997) Cardiac paraganglioma in New Jersey. N. J. Med., Jul., 94(7): 35–37.
- 10. Gonias S., Goldsy R., Matthay K.K. et al. (2009) Phase II study of high-dose [131 j] metaiodobenzylguanidine therapy for patient with metastatic pheochromacytoma and paraganglioma. J. Clin. Oncol., 27(25): 4162–4168.
- 11. Joshua A.M., Ezzat S., Asa S.L. et al. (2009) Ratinale and evidence for sunitinib in the treatment of malignant paraganglioma/pheochromacytoma. J. Clin. Endocrinol. Metab., 94(1): 5–9.
- 12. Ilias I., Pecack K. (2004) Current approaches and recommended algoritm for the diagnostic localization of pheochromacytoma. J. Clin. Endocrinol Metab., 89(2): 479–491.
- 13. Hoffmann J., Krober S.M., Hahn U. et al. (1997) Polytopic manifestations of paragangliomas. Diagnosis, differential diagnosis and indications for therapy. Cancer., Jan. 15, 79(2): 398–402.
- 14. Huang H., Abraham J., Hung E. et al. (2008) Treatment of malignant pheochromacytoma/paraganglioma with ciclophosphamide, vincristine and dacarbazine/
recommendation from a 22-year follow-up of 18 patients. Cancer., 113(8): 2020–2028. - 15. Kimura S., Iwai M., Fukuda T. et al. (1997) Combination chemotherapy for malignant paragangliom. Intern. Med., Jan., 36(1): 35–39.
- 16. Liu Q., Djuricin G., Staren E.D. et al. (1996) Tumor angiogenesis in pheochromocytomas and paragangliomas. Surgery, Dec., 120(6): 938–942.
- 17. Mancini L., Roncaroli F. (1997) Malignant paraganglioma of the posterior mediastinum with 27 years follow-up. Pathologica, Apr., 89(2): 184–188.
- 18. Maurea S., Cuocolo A., Reynolds J.C. et al. (1996) Diagnostic imaging in patients with paragangliomas. Computed tomography, magnetic resonance and MIBG scintigraphy comparison. J. Nucl. Med., Dec., 40(4): 365–371.
- 19. Perel Y., Schlumberger M., Marguerite G. et al. (1997) Pheochromocytoma and paraganglioma in children: a report of 24 cases of the French Society of Pediatric Oncology. Pediatr. Hematol. Oncol., Sep-Oct., 14(5): 413–422.
- 20. Rana R.S., Dey P., Das A. (1997) Fine needle aspiration cytology of extra-adrenal paragangliomas. Cytopathology, Apr., 8(2): 108–113.
- 21. Rao A.B., Koeller K.K., Adair C.F. (1999) Paragangliomas of the head and neck: radiologic-pathalogic correlation. Radiographics, 19: 1605–1632.
- 22. Shapiro B., Gonzales E., Weissman A. et al. (1997) Malignant paraganglioma of the prostate: case report, depiction by meta-iodobenzylguanidine scintigraphy and review of the literature. J. Nucl. Med., Mar., 41(1): 36–41.
- 23. Shono T., Sakai H., Minami Y. et al. (1999) Paraganglioma of urinary bladder: a case report and review of the Japanese literature. Urol. Int., 62(2): 102–105.
- 24. Stanulla H. (1982) Intrathoracal nonchromaffin paragangliomas (chemodectomas) (author’s transl). Zentralbl. Allg. Pathol., 126(1–2): 151–156.
- 25. Tomita H., Yamashita H., Tamaki N. (1996) Malignant paraganglioma with intracranial metastasis: a case report. No Shinkei Geka., Nov., 24(11): 1045–1048.
- 26. Wald O., Shapira O.M., Murar A. et al. (2010) Paraganglioma of the mediastinum: challenges in diagnosis and surgical management. J. Cardiovasc. Surg., 5: 19–23.
- 27. Williams K.S., Temeck B.K., Pass H.I. (1994) Intrapericardial pheochromacytoma complicated by massive intraoperativ hemorrhage. Southern. Med. J., 87(11): 1164–1167.














Leave a comment