Клинические особенности злокачественных трофобластических опухолей, инициированных пузырным заносом, у женщин разных возрастных групп
Резюме. Описаны клинические особенности злокачественных трофобластических опухолей, инициированных пузырным заносом, у женщин разных возрастных групп.
Трофобластическая болезнь беременности (ТББ) — это сборное понятие, включающее группу доброкачественных и злокачественных новообразований трофобласта. Заболевание относится к редким (1–2,5% среди злокачественных новообразований женских половых органов) и развивается преимущественно у женщин детородного возраста [1].
Наиболее часто в клинической практике встречаются полный и частичный пузырный занос (ПЗ) [2, 3]. Эти доброкачественные опухоли могут инициировать все известные до настоящего времени злокачественные трофобластические опухоли (ЗТО): хориокарциному, связанную с беременностью, опухоль плацентарной площадки и эпителиоидную трофобластическую опухоль [4–7].
В настоящее время в литературе дискутируется вопрос об особенностях клинического течения, диагностики и лечения ЗТО у женщин подросткового возраста и взрослых женщин [8–10].
Цель настоящего исследования — изучить клинические особенности ЗТО, инициированных ПЗ, у женщин разных возрастных групп.
Материалы и методы
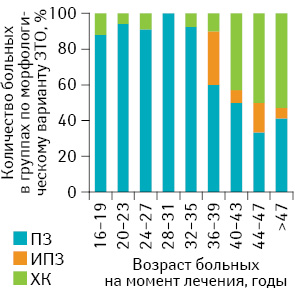
Обследованы и пролечены 186 женщин со ЗТО, инициированными ПЗ, получавшие специальное лечение в отделении онкогинекологии Национального института рака с 1999 по 2012 г. 25 обследованных (13,4%) составили женщины подросткового возраста и 161 (86,6%) — женщины в возрасте старше 20 лет (рис. 1).
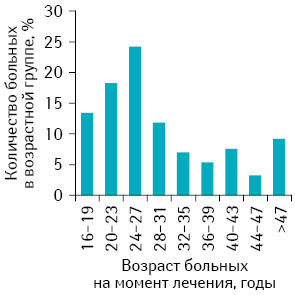
Возраст больных подростковой группы колебался от 16 до 19 лет и составил в среднем 18,0±1 год. Учитывая особенности биологического поведения ЗТО у женщин в возрасте 40 лет и старше (1 балл согласно прогностической балльной шкале FIGO-ВОЗ), взрослые женщины были разделены на 2 группы: средняя возрастная группа — 20–40 лет — и старшая возрастная группа — ≥40 лет. Средний возраст пациенток средней возрастной группы составил 27±5 лет. Большинство больных средней возрастной группы (63,7%) были в возрасте 20–27 лет. В старшей возрастной группе возраст пациенток колебался от 40 до 55 лет и составил в среднем 46±4 года. Следует подчеркнуть, что 4 женщины старшей возрастной группы (10,8%) были в возрасте старше 50 лет. Известно, что у женщин старше 50 лет наибольший относительный риск развития полного ПЗ (относительный риск 519) [11]. Такой высокий риск обусловлен сочетанием относительно небольшого количества спонтанных беременностей и повышенного количества аномальных ооцитов. Сегодня в литературе описаны отдельные случаи ПЗ и ЗТО, инициированных ПЗ, у женщин в возрасте старше 50 лет [12, 13]. Различия по возрасту в 3 обследованных группах статистически значимы (р<0,001).
Стадирование больных обследованных групп проведено согласно анатомической классификации FIGO-ВОЗ (2002) (табл. 1).
Таблица 1. Распределение больных по стадиям заболевания
| Стадия заболевания | <20 лет, n (%) | 20–40 лет, n (%) | ≥40 лет, n (%) |
|---|---|---|---|
| I | 20 (80) | 107 (86,3) | 26 (70,3) |
| II | 1 (4) | 2 (1,6) | 4 (10,8) |
| III | 4 (16) | 15 (12,1) | 7 (18,9) |
| Всего (186) | 25 (13,4) | 124 (66,7) | 37 (19,9) |
Как видно по данным табл. 1, у большинства обследованных женщин заболевание диагностировано в I стадии.
Все пациентки до начала лечения отнесены к группе низкого риска резистентности к метотрексату (индивидуальное количество баллов согласно прогностической бальной шкале FIGO-ВОЗ ≤6) [2], поэтому сравнительный анализ правомочен.
Для изучения зависимости распространенности опухолевого процесса и морфологического варианта опухоли от возраста больной со ЗТО, инициированной ПЗ, применена логистическая регрессия по методике, описанной в работе Ng. Andrew [14]. Методика предусматривает предсказание вероятности возникновения некоторого события по значениям множества признаков.
Результаты и их обсуждение
Проведенное исследование позволило выделить следующие клинические особенности ЗТО, инициированных ПЗ, в разных возрастных группах.
Полный ПЗ инициировал развитие ЗТО в большинстве случаев во всех возрастных группах: в 92,0% случаев — у подростков, в 87,9% — в средней возрастной группе и в 83,8% — в старшей возрастной группе (р>0,05).
Один из факторов риска малигнизации ПЗ — кисты яичников размером более 6 см в диаметре (табл. 2).
Таблица 2. Распределение больных в возрастных группах в зависимости от локализации кист яичников
| Кисты яичников | <20 лет, n (%) | 20–40 лет, n (%) | ≥40 лет, n (%) |
|---|---|---|---|
| Односторонние | – | 23 (18,5) | – |
| Двухсторонние | 1 (4) | 37 (29,5) | – |
| Всего (n=186) | 25 (13,4) | 124 (66,7) | 37 (19,9) |
Как видно по данным табл. 2, из 186 обследованных женщин кисты яичников размером более 6 см в диаметре диагностированы у 61 больной (32,8%): у 1 больной подростковой группы и 60 женщин средней возрастной группы. На сонограммах яичники имели вид многокамерных образований с множественными анэхогенными включениями и тонкими равномерными перемычками, с единичными сосудами в стенке кист. Размеры кист колебались от 6 до 16 см и составляли в среднем 11,3±0,8 см в диаметре. Таким образом, кисты яичников чаще (р<0,05) диагностированы у женщин средней возрастной группы.
Основной критерий диагностирования ЗТО после удаления ПЗ, принятый сегодня, — уровень хорионического гонадотропина (ХГЧ) в сыворотке крови. В подростковой группе исходный уровень ХГЧ составил 37 357±132,8 мМЕ/л, в средней группе — 16 499±85,4 мМЕ/л, в старшей возрастной группе — 13 297±75,4 мМЕ/л. Таким образом, более высокий исходный уровень ХГЧ в сыворотке крови диагностирован у женщин подростковой группы (р<0,05).
В этой же возрастной группе даже при I стадии заболевания чаще диагностированы опухолевые узлы в миометрии (рис. 2–4) размером более 5 см в диаметре (2 балла согласно прогностической балльной шкале FIGO-ВОЗ) (табл. 3).
Результаты проведенных исследований продемонстрировали наличие положительной корреляционной связи между уровнем ХГЧ в сыворотке крови и размером опухолевого узла в миометрии, коэффициент корреляции r=0,88±0,09 (p<0,05). Таким образом, размер опухолевого узла в миометрии отражает активность опухолевого процесса.
Таблица 3. Распределение больных с I стадией заболевания в зависимости от размера опухолевого очага в матке
| Размер опухолевых очагов | <20 лет, n (%) | 20–40 лет, n (%) | ≥40 лет, n (%) |
|---|---|---|---|
| Только ХГЧ | 2 (10,0) | 17 (15,9) | 7 (26,9) |
| Опухоль <3 см | 7 (35,0) | 34 (31,8) | 16 (61,6) |
| Опухоль ≥3 — <5 см | 1 (5,0) | 46 (43,0) | 2 (7,7) |
| Опухоль ≥5 см | 10 (50,0) | 10 (9,3) | 1 (3,8) |
| Всего (n=153) | 20 (13,1) | 107 (69,9) | 26 (17,0) |
Опухолевые узлы располагались субмукозно в 27,9% случаев и были причиной кровянистых выделений из половых путей различной интенсивности. Анемию как следствие кровотечений чаще (р<0,05) отмечали у женщин подростковой группы — в 30% случаев.
В обследованных группах зарегистрированы следующие морфологические варианты ЗТО, инициированной ПЗ: 1) ПЗ (злокачественная опухоль диагностирована согласно критериям FIGO-ВОЗ 2002 г. по уровню ХГЧ и данным лучевых методов исследования); 2) инвазивный ПЗ; 3) хориокарцинома (рис. 5).
По данным проведенного регрессионного анализа установлено статистически значимое (p<0,05) повышение вероятности инвазивного ПЗ и хориокарциномы каждые 4 года — с увеличением возраста — на 58,9 и 49,6% соответственно у больных со ЗТО, инициированными ПЗ (рис. 6).
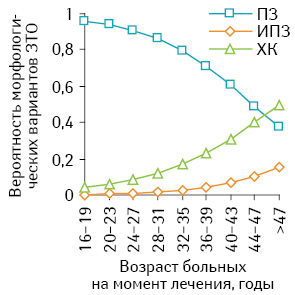
Полученные результаты математически обосновывают рациональность комбинированного метода лечения больных группы низкого риска в возрасте от 40 лет и старше с опухолевыми узлами в матке и свидетельствуют о целесообразности пересмотра алгоритма наблюдения пациенток с метастатическим ПЗ этой возрастной группы.
Во всех группах зарегистрировано по 1 случаю синхронного рака: в средней и старшей возрастной группе — рак шейки матки, в подростковой группе — пограничная серозно-папиллярная киста яичника.
Таким образом, нет достоверных различий в характере опухоли, инициирующей развитие ЗТО у женщин подросткового возраста и взрослых женщин. Вместе с тем в подростковой группе чаще диагностируют опухолевые узлы в миометрии >5 см в диаметре с высокой гормональной активностью (исходный уровень ХГЧ в сыворотке крови достоверно выше), кровянистые выделения из половых путей различной интенсивности и, как следствие, анемию.
В 87,5% случаев при четком соблюдении алгоритма наблюдения больных после удаления ПЗ ЗТО можно диагностировать на доклиническом этапе даже у пациенток с ПЗ группы высокого риска [15]. Такое лечение технически легко выполнимо, экономически выгодно, дает быстрый клинический эффект и не снижает качества жизни больной. Как правило, поздняя диагностика ЗТО у женщин подросткового возраста обусловлена несоблюдением больными требований мониторинга уровня сывороточного ХГЧ.
Полученные в проведенном исследовании результаты о более агрессивном течении ЗТО у женщин подросткового возраста свидетельствует о необходимости санитарно-просветительской работы среди подростков нашей страны для предупреждения развития диссеминированных форм ЗТО, особенно в Сумской, Одесской, Днепропетровской и Житомирской областях, в которых отмечен высокий уровень заболеваемости ПЗ в данной возрастной группе.
Список использованной литературы
1. Lurain J.R. (2010) Gestational trophoblastic disease I: epidemiology, pathology, clinical presentation and diagnosis of gestational trophoblastic disease, and management of hydatidiform mole. Am. J. Obstet. Gynecol., 203(6): 531–539.
2. Berkowitz R.S, Goldstein D.P. (2009) Current management of gestational trophoblastic diseases. Gynecol Oncol., 112: 654–662.
3. Seckl M.J., Sebire N.J., Berkowitz R.S. (2010) Gestational trophoblastic disease. Lancet, 376: 717–729.
4. Coulson L.E., Kong C.S., Zaloudek C. (2000) Epithelioid trophoblastic tumor of the uterus in a postmenopausal woman: a case report and review of the literature. Am. J. Surg. Pathol., 24(11): 1558–1562.
5. Ohira S., Yamazaki T., Hatano H. et al. (2000) Epithelioid trophoblastic tumor metastatic to the vagina: an immunohistochemical and ultrastructural study. Int. J. Gynecol. Pathol., 19(4): 381–386.
6. Shih I.M., Kurman R.J. (2001) The pathology of intermediate trophoblastic tumors and tumor-like lesions. Int. J. Gynecol. Pathol., 20(1): 31–47.
7. Moore-Maxwell C.A., Robboy S.J. (2004) Placental site trophoblastic tumor arising from antecedent molar pregnancy. Gynecol. Oncol., 92(2): 708–12.
8. Braga A., Growdon W., Bernstein M. (2011) Is adolescence a risk factor for postmolar gestational trophoblastic neoplasia? CME J. Gynecol. Oncol., 94.
9. Rauh-Hain J.A., Growdon W.B., Braga A. et al. (2011) Clinical features and chemotherapy outcomes in adolescent patient with gestational trophoblastic neoplasia compared to adult women. CME J. Gynecol. Oncol., 48.
10. Pires E.K., Maesta I., Giraldo H.P. (2011) Gestational trophoblastic disease: still a life threatento teenagers in developing countries. CME J. Gynecol. Oncol., 92.
11. Soper J., Creasman W.T. (2012) Гестационная трофобластическая болезнь / В кн.: «Клиническая онкогинекология» Под. ред. Ф. Дж. Дисаи, У.Т. Крисмана, пер. с англ. под ред. Е.Г. Новиковой, т. 2., Практич. Мед., Москва: 180–221.
12. Elias K.M., Goldstein D.P., Berkowitz R.S. (2010) Complete hydatidiform mole in women older than age 50. J. Reprod. Med., 55(5–6): 208–212.
13. Lok C.A., Zürcher A.F., van der Velden J. (2005) A case of a hydatidiform mole in a 56-year-old woman. Int. J. Gynecol. Cancer., 15(1): 163–166.
14. Andrew Ng. Stanford CS 229 Lecture Notes (http://see.stanford.edu/materials/aimlcs229/ cs229-notes1.pdf).
15. Цип Н.П., Воробьева Л.И. (2012) Мониторинг больных после удаления пузырного заноса. Клин. онкология, 8(4): 81–84.
Клінічні особливості злоякісних трофобластичних пухлин, ініційованих міхуровим заносом, у жінок різних вікових груп
Резюме. Описано клінічні особливості злоякісних трофобластичних пухлин, ініційованих міхуровим заносом, у жінок різних вікових груп.
Ключові слова: міхуровий занос, злоякісні трофобластичні пухлини, клінічні характеристики.
Clinical features of gestational trophoblastic neoplasia after hydatidiform mole in women of different age groups
Summary. We describe the clinical features of gestational trophoblastic neoplasia after hydatidiform mole in women of different age groups.
Key words: hydatidiform mole, gestational trophoblastic neoplasia, clinical features.














Leave a comment