Клініко-лабораторні критерії прогнозу прогресування захворювання в процесі інтерферонотерапії у хворих на меланому шкіри з метастазами в регіонарні лімфатичні вузли
Фільчаков Ф.В., Льон Г.Д., Кукушкіна С.М., Шуміліна К.С., Коровін С.І., Кукушкіна М.М., Вітрук Т.С.
Резюме. Авторами проведено імунологічний моніторинг 40 хворих на меланому шкіри з метастазами в регіонарні лімфатичні вузли (ММРЛВ) в динаміці комбінованого лікування та встановлено, що імунологічними критеріями несприятливого прогнозу є зменшення кількості циркулюючих природних кілерних клітин, регуляторних Т-лімфоцитів, Т-хелперів, що експресують рецептор до інтерлейкіну-2, та підвищення мітоген-індукованої проліферації Т-лімфоцитів in vitroу перші 3 міс ад’ювантної терапії інтерфероном-α2b. Ймовірно, застосування цих імунологічних критеріїв при обстеженні хворих на ММРЛВ дозволить визначати індивідуальні особливості перебігу захворювання, прогнозувати відповідь організму на біотерапію і таким чином оптимізувати тактику лікування.

ВСТУП
Меланома шкіри залишається головною причиною смертності пацієнтів зі злоякісними новоутвореннями шкіри [1]. В Україні лише 41,8% хворих звертаються до онколога на ранніх стадіях локалізованої меланоми шкіри, а у 58% пацієнтів меланому діагностують на II–IV стадії, коли подальший розвиток захворювання практично неминучий [2]. У такій ситуації терапевтичні можливості обмежені та спрямовані на підвищення протипухлинної резистентності організму і покращення якості життя пацієнтів [3].
Водночас досягнення імунотерапії в лікуванні цієї категорії хворих залишаються досить скромними, а погляди різних авторів на цей метод протипухлинного лікування не збігаються. Зокрема, результати застосування інтерферону-α (ІФН-α) в ад’ювантній терапії неоднозначні та викликають дискусії щодо доцільності його призначення всім хворим [4]. Різні погляди на цю проблему перш за все пов’язані з емпіричним призначенням ІФН без достатнього обґрунтування. Певно, з цієї причини застосування модифікаторів біологічних реакцій не дає бажаних результатів, а в деяких випадках може знижувати ефективність основного лікування. Із цим погоджуються експерти Міжнародного товариства з імунотерапії раку (International Society Immunotherapy of Cancer — SITC) [5]. На думку авторів даної роботи, широкому впровадженню імунотерапії, яка безпосередньо впливає на протипухлинну резистентність організму, заважає відсутність єдиної методології оцінки імунного статусу пацієнтів і консенсусу щодо потенційних біомаркерів, дослідження яких дозволить прогнозувати перебіг захворювання та відповідь на імунотерапію. У свою чергу, низька прогностична точність традиційних систем оцінки, що засновані на дослідженні зразків тканини, отриманих під час хірургічного висічення первинної пухлини, також пов’язана з обмеженням у визначенні виключно гістопатологічних особливостей пухлини без урахування морфологічних особливостей формування протипухлинної імунної відповіді організму в різних умовах активності пухлинного процесу [6].
З огляду на вищенаведене, метою даного дослідження є визначення імунологічних критеріїв прогнозу прогресування захворювання на тлі інтерферонотерапії у хворих на меланому шкіри з метастазами в регіонарні лімфатичні вузли (ММРЛВ) для оптимізації комбінованого лікування.
Об’єкт та методи дослідження
Характеристика хворих. У дослідження включено 40 хворих з гістологічно підтвердженим діагнозом ММРЛВ ІІІВ–ІІІС стадії, які надали письмову поінформовану згоду на участь у дослідженні. Серед пацієнтів було 23 чоловіки та 17 жінок; середній вік хворих становив 54,9±2,7 року (від 30 до 71 року). Також обстежено 60 практично здорових людей (ПЗЛ) у тій самій віковій категорії.
Шляхом рандомізації хворих розподілено на контрольну (20 осіб) та основну (20 осіб) групи. Пацієнти контрольної групи через 8–10 діб після хірургічного лікування отримували індукційний курс інтерферонотерапії рекомбінантним ІФН-α2b (підшкірно по 9 млн МО щоденно упродовж 23 днів), після закінчення якого одержували підтримуючий курс інтерферонотерапії (підшкірно по 3 млн МО 3 рази на тиждень упродовж 12 міс). Хворі основної групи розпочинали лікування з індукційного курсу інтерферонотерапії (підшкірно по 9 млн МО щоденно протягом 23 днів), після цього отримували хірургічне лікування, через 8–10 діб після якого їм призначали підтримуючий курс терапії із застосуванням ІФН-α2b (підшкірно по 3 млн МО 3 рази на тиждень упродовж 12 міс).
За період спостереження імунологічне дослідження крові хворих проводили 3 рази: через 8–10 днів після хірургічного лікування, через 3 та 12 міс від початку підтримуючого курсу терапії ІФН-α2b.
Проведення даного дослідження схвалено локальною комісією з питань етики Національного інституту раку.
Методи дослідження
Кількість лейкоцитів у периферичній крові та лейкоцитарну формулу визначали загальноприйнятим методом [7]. Фенотипічні характеристики лімфоцитів периферичної крові (ЛПК) визначали методом проточної цитофлуориметрії [8, 9] з використанням моноклональних антитіл до CD3, CD19, CD4, CD8, CD16, HLA-DR, CD95, мічених флуоресцеїнізотіоціанатом («Сорбент», Росія), CD25, мічених фікоеритринціаніном-5, CD127, мічених фікоеритрином («Beckman Coulter», США), як описано [10]. Результати підраховували на проточному цитофлуориметрі FACScan («Becton Dickinson», США) з використанням програми «Cell Quest». Гейт популяції клітин встановлювали на підставі комбінації прямого та бокового світлорозсіювання і розміру клітин [11]. Під час обліку результатів налічували 2×103 лімфоцитів при визначенні основних популяцій та 10×103 — при визначенні регуляторних Т-лімфоцитів (Трег, CD4+25high127low-neg). Імунорегуляторний індекс (ІРІ) визначали як співвідношення CD4/CD8.
Функціональну активність ЛПК досліджували в цитотоксичному тесті (результат виражали цитотоксичним індексом у відсотках) [8], реакції бласттрансформації з фітогемаглютиніном (ФГА, 10 мкг/мл, результат виражали відсотком бласттрансформованих лімфоцитів) [12] та реакції гальмування міграції лейкоцитів з ФГА (10 мкг/мл, результат виражали індексом міграції у відсотках) [13].
Методи обробки результатів
Статистичну обробку отриманих даних проводили з використанням програм Excel (MS Office 2003, XP) та STATІSTІCA 6,0 (StatSoft Inc., США). Для встановлення вірогідності розбіжностей показників незалежних груп застосовано критерій Манна — Вітні, показників групи в динаміці лікування — одновибірковий критерій Вілкоксона [14]. Для визначення сили та направленості кореляційного зв’язку між показниками застосовано коефіцієнт рангової кореляції Спірмена (r) [15]. Розбіжності та кореляційну залежність між показниками оцінювали як вірогідні при р<0,05.
Результати та їх обговорення
У попередньому дослідженні [10] ми повідомляли про особливості імунореактивності у хворих на ММРЛВ в умовах дії вищенаведених схем інтерферонотерапії упродовж 3 міс. У короткому викладі: встановлено, що неоад’ювантне застосування індукційного курсу ІФН-α2b сприяє відновленню після хірургічного лікування кількості Т-лімфоцитів, але не усуває підвищений вміст Трег. Навпаки, аналогічний курс ІФН-α2b, проведений в ад’ювантному режимі, не відновлює знижений вміст Т-лімфоцитів у циркуляції, проте сприяє зниженню рівня Трег.
Подальше спостереження за цими пацієнтами упродовж 12 міс показало, що незалежно від застосованої схеми інтерферонотерапії у 50% хворих розвинулися метастази у віддалених органах. У зв’язку з цим з метою визначення імунологічних критеріїв прогнозу ефективності комбінованого лікування хворих контрольної та основної груп на етапі після проведення хірургічного лікування об’єднано в одну групу (40 осіб) з наступним розподілом на 2 підгрупи залежно від наявності (20 хворих) або відсутності (20 хворих) віддалених метастазів, що виникли протягом 12 міс від початку лікування.
У результаті аналізу досліджуваних показників імунної системи при розподілі пацієнтів у такий спосіб виявлено наступне. Після хірургічного лікування кількість лейкоцитів та абсолютний вміст лімфоцитів у периферичній крові хворих знаходяться в межах фізіологічної норми (рис. 1 а). При цьому відзначають відносну лімфоцитопенію зі збереженням кількості основних популяцій лімфоцитів (Т-, В-клітин та природних кілерних клітин — ПКК) на рівні такої у ПЗЛ. Проте Т-клітинна ланка імунної системи зазнає певних змін: зменшуються відносна та абсолютна кількість цитотоксичних Т-лімфоцитів (ЦТЛ) зі збільшенням ІРІ та підвищується відносний вміст Трег (р<0,05). Останнє є характерною ознакою метастатичної меланоми, що, як продемонстровано нами раніше, свідчить про посилення дисфункції імунної системи в цієї категорії хворих [16]. За даними G.C. Cesana та співав. [17], збільшення кількості Трег (ідентифікованих за маркером FOXP3) у периферичній крові корелює з поганим прогнозом захворювання.
Як видно з представлених даних (рис. 1 б), через 3 міс застосування інтерферонотерапії у хворих зі сприятливим перебігом захворювання кількість лейкоцитів та загальний вміст лімфоцитів суттєво зменшуються відносно вихідного значення та фізіологічної норми (р<0,05). Абсолютна лімфоцитопенія зумовлена зменшенням кількості Т-лімфоцитів (Т-хелперів і ЦТЛ) та ПКК (р<0,05). Проте відносний вміст лімфоцитів та їх основних популяцій знаходиться в межах показників ПЗЛ, окрім підвищення частки В-лімфоцитів. Відносна кількість Трег зменшується порівняно з вихідним значенням (р<0,05), але зберігається вищою за фізіологічну норму.
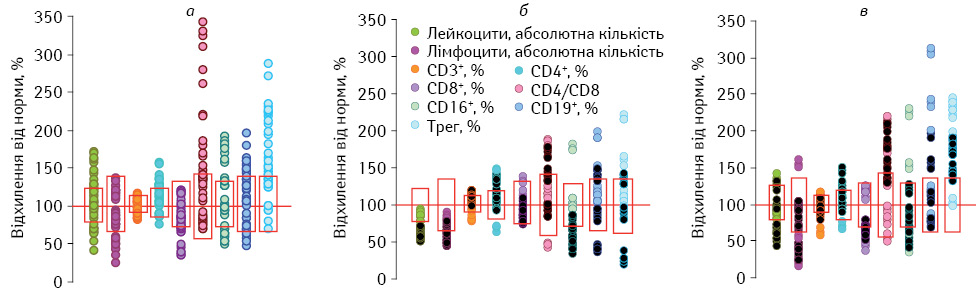
На цьому етапі лікування у пацієнтів з генералізацією процесу також відзначають лейкопенію з лімфоцитопенією за рахунок зменшення абсолютного вмісту основних популяцій лімфоцитів (р<0,05, див. рис. 1 б). Проте, на відміну від хворих зі сприятливим перебігом захворювання, лейкопенія та дефіцит ПКК більш виражені (р<0,05). Виявлено глибокі зміни в популяційному складі ЛПК: відносний вміст ПКК значно знижується на тлі суттєвого збільшення частки Т-лімфоцитів, а саме Т-хелперів. При цьому спостерігається диспропорція вмісту СD4+– та СD8+-лімфоцитів, що відображає підвищений ІРІ (р<0,05). Важливо зазначити, що, на відміну від хворих зі сприятливим перебігом захворювання, генералізація пухлинного процесу призводить до суттєвого зменшення відносної кількості Трег порівняно з вихідним значенням (р<0,05). Це суперечить вищенаведеним фактам, що пов’язано як з різними методиками визначення Трег, так і станом імунної системи пацієнтів в умовах застосування в нашому дослідженні іншого режиму інтерферонотерапії.
Отже, незалежно від ефективності лікування хворих застосування ІФН-α2b в ад’ювантному режимі упродовж 3 міс призводить до розвитку лейкопенії з лімфоцитопенією за рахунок зниження вмісту Т-лімфоцитів та ПКК. Ці явища більш виражені в пацієнтів з генералізацією процесу, ніж у хворих зі сприятливим перебігом захворювання. Крім того, для пацієнтів з прогресуванням захворювання характерними є більш глибокі зміни в Т-клітинній ланці імунної системи, що може свідчити про виснаження компенсаторних механізмів імунної системи.
На користь цього свідчать результати кореляційного аналізу, проведеного через 3 міс застосування ІФН-α2b в ад’ювантному режимі. Встановлено, що між кількістю лейкоцитів, відносним вмістом ПКК та Трег у периферичній крові та прогресуванням захворювання є зворотна кореляційна залежність (відповідно, r=–0,548; r=–0,550; r=–0,557; р<0,05). На відміну від вищезазначеного між відносною кількістю Т-лімфоцитів у циркуляції та ефективністю лікування існує пряма кореляційна залежність (r=0,504; р<0,05).
Після завершення курсу інтерферонотерапії у пацієнтів зі сприятливим перебігом захворювання кількість лейкоцитів та лімфоцитів у периферичній крові відновлюється до фізіологічної норми, але залишаються передумови для розвитку лімфоцитопенії (рис. 1 в). Зокрема, зберігається зниженим абсолютний вміст ПКК та ЦТЛ (р<0,05). При цьому відбувається зменшення відносного вмісту ПКК порівняно з показником у ПЗЛ (р<0,05). У пацієнтів з прогресуванням захворювання також усувається лейкопенія, але, на відміну від хворих зі сприятливим перебігом захворювання, зберігається абсолютна лімфоцитопенія, зумовлена зниженням вмісту Т- та В-лімфоцитів (р<0,05). Крім того, реєструють зменшення в циркуляції відносної кількості лімфоцитів порівняно з показником у ПЗЛ (р<0,05). У популяційному складі ЛПК відзначають зменшення відносної кількості Т-лімфоцитів до фізіологічної норми зі збільшенням частки Т-хелперів на тлі зниження вмісту ЦТЛ, що відображається на ІРІ, який суттєво зростає відносно такого в ПЗЛ (р<0,05). При цьому відносна та абсолютна кількість ПКК відновлюється до фізіологічних значень. Важливо зазначити, що на цьому етапі спостереження незалежно від ефективності лікування рівень Трег в периферичній крові хворих значно підвищується відносно такого через 3 міс інтерферонотерапії та фізіологічної норми (р<0,05).
Аналіз вмісту активованих лімфоцитів (СD25+, СD4+25+, HLA-DR+, СD95+) у периферичній крові хворих на ММРЛВ залежно від ефективності лікування показав, що після проведення хірургічного лікування відбувається суттєве підвищення відносного вмісту всіх досліджуваних активованих лімфоцитів (р<0,05; рис. 2 а). Через 3 міс застосування інтерферонотерапії (рис. 2 б) у пацієнтів зі сприятливим перебігом захворювання відносний вміст лімфоцитів з пізніми маркерами активації (HLA-DR+, СD95+) знижується до фізіологічної норми, внаслідок чого лімфоцитопенія асоціюється зі зменшеним абсолютним вмістом цих клітин (р<0,05). Водночас вміст СD25+– та СD4+25+-лімфоцитів не зазнає істотних змін. У хворих з прогресуванням захворювання відбуваються подібні зміни відносної кількості HLA-DR+– та СD95+-лімфоцитів. Відносний вміст СD25+-лімфоцитів знижується до фізіологічної норми, проте відносна кількість СD4+25+-лімфоцитів зберігається збільшеною. У хворих цієї підгрупи лімфоцитопенія супроводжується зменшенням абсолютної кількості всіх досліджуваних активованих лімфоцитів (р<0,05).
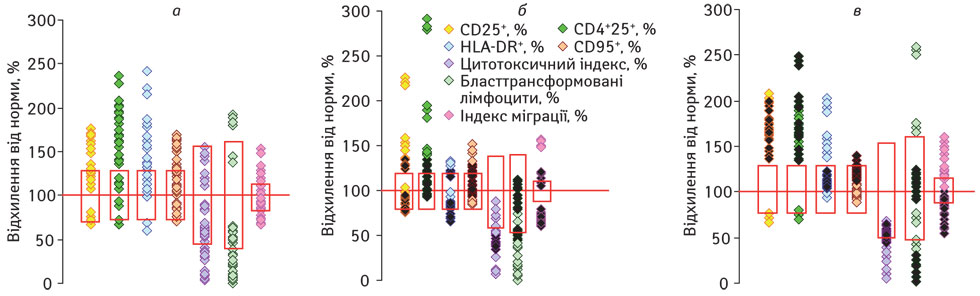
Примітки до рис. 1, 2: 1) Вісь абсцис (100%) відповідає середньому арифметичному значенню показника у ПЗЛ, прямокутником позначено його стандартне відхилення; 2) У чорний колір зафарбовано значення показників пацієнтів з прогресуванням захворювання
Отже, лімфоцитопенія, що формується упродовж 3 міс на тлі проведення ад’ювантної інтерферонотерапії незалежно від ефективності лікування, супроводжується зменшенням частки активованих HLA-DR+– та СD95+-лімфоцитів зі збереженням підвищеного рівня СD4+25+-лімфоцитів. Крім того, у хворих з генералізацією процесу, на відміну від пацієнтів зі сприятливим перебігом захворювання, відзначають зниження пропорції лімфоцитів з рецептором до інтерлейкіну-2 (ІЛ-2) (СD25+), що на тлі вираженої лімфоцитопенії також може свідчити про виснаження компенсаторних механізмів імунної системи. На це, зокрема, вказують результати кореляційного аналізу, який показав, що між абсолютною кількістю СD4+25+-лімфоцитів та прогресуванням захворювання існує зворотна залежність (r=–0,567; р<0,05).
Після завершення інтерферонотерапії (рис. 2 в) у пацієнтів зі сприятливим перебігом захворювання вміст активованих лімфоцитів не зазнає суттєвих змін, окрім збільшення відносної кількості HLA-DR+-лімфоцитів (р<0,05). У хворих з генералізацією процесу спостерігають підвищення відносного вмісту CD25+-, CD4+25+– та HLA-DR+-лімфоцитів (р<0,05), але, на відміну від пацієнтів зі сприятливим перебігом захворювання, відбувається суттєве зростання вмісту лімфоцитів, схильних до апоптозу (CD95+).
Дослідження функціональної активності лімфоцитів показало, що після хірургічного лікування суттєво (р<0,05) пригнічується цитотоксичність та мітоген-індукована проліферація ЛПК (див. рис. 2 а). Цитотоксична активність лімфоцитів у динаміці лікування хворих обох підгруп не зазнає суттєвих змін (див. рис. 2 б, в). У пацієнтів зі сприятливим перебігом захворювання через 3 міс застосування інтерферонотерапії мітоген-індукована проліферація лімфоцитів зберігається зниженою, після завершення курсу лікування — відновлюється (див. рис. 2 б, в). На відміну від цього, у хворих з прогресуванням захворювання через 3 міс інтерферонотерапії відповідь лімфоцитів in vitro на ФГА підвищується до фізіологічної норми, і навпаки, після її завершення – знижується (р<0,05).
Схожу залежність простежують при дослідженні функції лімфоцитів щодо продукування фактора, що гальмує міграцію лейкоцитів. У пацієнтів зі сприятливим перебігом захворювання після хірургічного лікування та через 3 міс інтерферонотерапії індекс міграції знаходиться в межах фізіологічної норми, але значно (р<0,05) зростає після завершення лікування. На відміну від цього, у хворих з генералізацією процесу через 3 міс застосування ІФН-α2b ця функція Т-лімфоцитів виявляється пригніченою (р<0,05) і залишається такою до кінця спостереження.
Отже, досліджувані показники функціональної активності лімфоцитів хворих (за винятком цитотоксичної активності) на тлі ад’ювантної інтерферонотерапії упродовж 3 міс по-різному змінюються залежно від ефективності лікування. Проте зв’язок з прогресуванням захворювання встановлено тільки для відповіді лімфоцитів in vitro на ФГА (r=0,730; р<0,05).
Таким чином, імунологічними критеріями прогнозу несприятливого перебігу захворювання у пацієнтів із ММРЛВ, які отримують комбіноване лікування із застосуванням ІФН-α2b, є зниження в циркуляції вмісту ПКК, Трег, Т-хелперів з рецептором до ІЛ-2 та збільшення пропорції Т-лімфоцитів з підвищеною здатністю до мітоген-індукованої проліферації in vitro на тлі лейкопенії в перші 3 міс інтерферонотерапії.
Висновки
1. Дослідження показників імунної системи у хворих на меланому шкіри є важливою складовою лабораторно-діагностичного комплексу в контролі за ефективністю лікування.
2. Моніторинг перебігу захворювання на основі визначення зміни показників імунної системи у пацієнтів із ММРЛВ у процесі комбінованого лікування дозволяє до появи клінічних ознак прогнозувати його прогресування.
3. Зниження в циркуляції рівня ПКК, Трег, Т-хелперів з рецептором до ІЛ-2 та підвищення мітоген-індукованої проліферації Т-лімфоцитів in vitro на тлі лейкопенії у перші 3 міс ад’ювантної терапії ІФН-α2b є найбільш інформативними критеріями несприятливого перебігу ММРЛВ.
Список використаної літератури
1. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2012) Рак в Україні, 2010–2011. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 13, Київ: 124 с.
2. Коровин С.И., Гулак Л.О., Федоренко З.П. и др. (2010) Проблема меланомы кожи в Украине. Онкология (спец. выпуск), 12 (1): 46–52.
3. Mimeault M., Batra S.K. (2012) Novel biomarkers and therapeutic targets for optimizing the therapeutic management of melanomas. World J. Clin. Oncol., 10(3): 32–42.
4. Коровин С.И., Кукушкина М.Н., Паливец А.Ю. и др. (2012) Интерферон в лечении меланомы кожи. Клиническая онкология, 5(1): 38–42.
5. Fox B.A., Schendel D.J., Butterfield L.H. et al. (2011) Defining the critical hurdles in cancer immunotherapy. J. Translat. Med., 9: 214–253 (Doi: 10.1186/1479-5876-9-214).
6. Wolchok J.D., Hoos A., O’day S. et al. (2009) Guidelines for the evaluation of immune therapy activity in solid tumors: Immune-related response criteria. Clin. Cancer Res., 15(23): 7412–7420.
7. Руководство по клинической лабораторной диагностике: в 2 ч. (1982). Под ред. М.А. Базарновой. Киев, Вища школа, Ч. 2: 175 с.
8. Пинегин Б.В., Ярилин А.А., Симонова А.В. и др. (2001) Применение проточной цитометрии для оценки функциональной активности иммунной системы человека. Пособие для врачей-лаборантов. Москва, 55 с.
9. Вопросы современной проточной цитометрии. Клиническое применение (2008) Под ред. С.В. Хайдукова, А.В. Зурочки. Челябинск, 195 с.
10. Фільчаков Ф.В., Шуміліна К.С., Кукушкіна С.М. та ін. (2011) Особливості імунореактивності організму хворих на меланому шкіри з метастазами в регіональні лімфовузли в умовах дії різних схем інтерферонотерапії. Клиническая онкология, 4 (4): 102–106.
11. Хайдуков С.В. (2007) Подходы к стандартизации метода проточной цитометрии для иммунофенотипирования. Настройка цитометров и подготовка протоколов для анализа. Мед. иммунол., 9(6): 569–574.
12. Фільчаков Ф.В., Шуміліна К.С., Льон Г.Д. та ін. (2011) Вплив різних схем інтерферонотерапії на функціональну активність лімфоцитів у хворих на меланому шкіри. Імунологія та алергологія, 2: 120–125.
13. Лаповець Л.Є., Луцик Б.Д., Лебедь Г.Б. та ін. (2008) Посібник з лабораторної імунології. Kиїв, 268 с.
14. Лапач С.Н., Чубенко А.В., Бабич П.Н. (2001) Статистические методы в медико-биологических исследованиях с использованием Excel. Киев, Морион, 408 с.
15. Мінцер О.П., Вороненко Ю.В., Власов В.В. (2003) Оброблення клінічних і експериментальних даних у медицині. Кн. 5: Навч. посіб. Інформаційні технології в охороні здоров’я і практичній медицині: У 10 кн. За ред. О.П. Мінцера. Київ, Вища школа, 350 с.
16. Фильчаков Ф.В., Кукушкина С.Н., Шумилина Е.С. и др. (2012) Клинико-лабораторные критерии диагностики иммунной дисфункции у больных меланомой кожи. Онкология, 14 (2): 139–144.
17. Cesana G.C., DeRaffele G., Cohen S. et. al. (2006) Characterization of CD4+CD25+ regulatory T cells in patients treated with high-dose interieukin-2 for metastatic melanoma or renal cell carcinoma. J. Clin. Oncol., 24: 1169–1177.
Клинико-лабораторные критерии прогноза прогрессирования заболевания в процессе интерферонотерапии у больных меланомой кожи с метастазами в регионарные лимфатические узлы
Резюме. Авторами проведен иммунологический мониторинг 40 больных меланомой кожи с метастазами в регионарные лимфатические узлы (ММРЛУ) в динамике комбинированного лечения и установлено, что иммунологическими критериями неблагоприятного прогноза являются уменьшение количества циркулирующих естественных киллерных клеток, регуляторных Т-лимфоцитов, Т-хелперов, экспрессирующих рецептор к интерлейкину-2, и повышение митоген-индуцированной пролиферации Т-лимфоцитов in vitro в первые 3 мес адъювантной терапии интерфероном-α2b. Вероятно, использование этих иммунологических критериев при обследовании больных ММРЛУ позволит определять индивидуальные особенности течения заболевания, прогнозировать ответ организма на биотерапию и таким образом оптимизировать тактику лечения.
Ключевые слова: меланома кожи, интерферонотерапия, иммунологические критерии прогноза эффективности лечения.
Clinicоlaboratory criteria of prediction of disease progression in course of interferontherapy in patients with cutaneous regional metastatic melanoma
Summary. Authors made the immunologic monitoring of 40 patients with regional metastatic melanoma (RMM) in dynamics of the combined treatment and it was found that the decreased levels circulating natural killer cells, Treg, T-helper cells with the receptor for IL-2 and the increased mitogen-induced proliferation of T cells in vitroduring the first 3 months of adjuvant IFN-α2b therapy were the immunological criteria for unfavorable prognosis for a disease. Probably, the using these immunological criteria for investigation of RMM patients will allow to determine individual peculiarity of disease course, to predict the response of organism on biotherapy and so to optimize the treatment tactics.
Key words: cutaneous melanoma, interferontherapy, immunological criteria of prediction of efficiency of treatment.














Leave a comment