Лікування хворих на саркому м’яких тканин високого ступеня ризику
Паливец А.Ю., Коровин С.И., Кукушкина М.Н., Смакова М.С. , Тарасова Т.А., Волков И.Б., Литвиненко А.А.
Резюме. Мета дослідження — порівняти результати комбінованого лікування хворих на саркоми м’яких тканин (СМТ) високого ступеня ризику із застосуванням різних методик неоад’ювантного лікування. До дослідження залучено 41 хворого на СМТ, яких поділено на 2 групи залежно від отриманої неоад’ювантної поліхіміотерапії — трьох- або чотирьохкомпонентної. Чотирьохкомпонентну неоад’ювантну системну поліхіміотерапію пацієнти переносили задовільно, прояви її токсичності не перевищували такі при трикомпонентній поліхіміотерапії. Продемонстровано тенденцію до підвищення в основній групі порівняно з контрольною показників 2-річної виживаності: загальна становила 85,7 та 80% відповідно, а безрецидивна — 80,95 та 70% відповідно (р>0,05). Виявлено статистично достовірне (р<0,05) підвищення в основній групі безметастатичної 2-річної виживаності до 76,19% проти 50% в контрольній групі.

Вступ
Лікування хворих на саркому м’яких тканин (СМТ) є однією з невирішених проблем клінічної онкології. У дорослих дана патологія становить 1,0–2,5% усіх злоякісних новоутворень. У 2010 р. в Україні зареєстровано приблизно 1750 випадків захворювання на СМТ, а рівень захворюваності становив 3,54 на 100 000 стандартизованого населення України [1]. Серед осіб чоловічої статі цей показник дещо вищий, ніж у жінок, і дорівнював 4,03‱ і 3,26‱ відповідно.
Загальновідомим є факт високого рівня захворюваності на СМТ у дітей, у яких він є найвищим серед захворюваності на солідні пухлини. Ще один пік захворюваності зареєстровано в дорослих старших вікових груп. Як у чоловіків, так і жінок найвищий показник зафіксовано у віці 80–84 років, незначно нижчий — у чоловіків у віці понад 85, а у жінок — 75–79 років.
Слід відзначити, що СМТ характеризуються агресивним перебігом і несприятливим прогнозом, що перетворює лікування даного контингенту хворих на складне завдання [2]. Провідним методом лікування пацієнтів з даною патологією залишається хірургічний, який можна умовно поділити на дві групи втручань: органозберігаючі та такі, що призводять до каліцтв (ампутації та екзартикуляції кінцівок). Методом вибору є широке видалення пухлини в межах здорових тканин. Операції, що спричиняють каліцтва, виконують приблизно в 10% хворих, а раніше подібні хірургічні втручання проводили майже в кожному другому випадку [2].
Проте результати хірургічного лікування, особливо при саркомах високого ступеня злоякісності, залишаються незадовільними. У зв’язку з вищезазначеним перевагу надають багатокомпонентному лікуванню із застосуванням оперативного втручання, променевої та хіміотерапії [3]. Основні надії, які покладають на неоад’ювантну терапію, це: зменшення загального об’єму пухлини та перифокального набряку; формування псевдокапсули навколо новоутворення та більш чітке відокремлення пухлини від навколишніх здорових тканин; вплив на віддалені субклінічні мікрометастази та запобігання хвилі виникнення віддалених метастазів після видалення пухлини [4–8].
Так, у ретроспективному дослідженні C.M. Pezzi, до якого увійшли 46 хворих, індукційна хіміотерапія доксорубіцином, циклофосфамідом і дакарбазином призвела до повної, часткової чи мінімальної регресії новоутворення у 40% випадків [9].
Р. Pisters із M.D. Anderson Cancer Center (Онкологічний центр ім. М.Д. Андерсона, Хьюстон, США) повідомив про віддалені результати індукційної доксорубіциновмісної хіміотерапії (у середньому 3 цикли) у 76 хворих на СМТ кінцівок у III стадії. Повну регресію новоутворення відзначали в 9% хворих, часткову — у 19%, мінімальну — у 13%, стабілізацію — у 30%, прогресування процесу — у 30% хворих. Загальна 5-річна виживаність становила 59%, безметастатична — 52% [10]. Автори зазначили відсутність суттєвої різниці у виживаності пацієнтів з повною або частковою регресією і решти хворих.
У проспективне дослідження E.S. Casper та співавторів, проведене в Memorial Sloan — Kettering Cancer Center (Меморіальний онкологічний центр ім. Слоуна — Кеттерінга, Нью-Йорк, США), залучено 29 хворих на СМТ у III стадії, які отримали 2 курси індукційної хіміотерапії на базі доксорубіцину. Але за стандартними критеріями часткової відповіді відзначено лише одного пацієнта. Різниця з раніше описаним дослідженням була суттєвою, вона залишається нез’ясованою. Можливо, вона могла бути пов’язаною з нижчими курсовими дозами доксорубіцину, меншою кількістю курсів хіміотерапії. Не виключено, що різниця зумовлена складом хворих: до дослідження могли бути включені особи з більшою розповсюдженістю захворювання, тобто з більш несприятливим прогнозом [11].
В індукційній хіміотерапії також використовуються режими із залученням доксорубіцину та іфосфаміду. Так, у рандомізованому дослідженні EORTC (European Organisation for Research and Treatment of Cancer) Soft Tissue Bone Sarcoma Group і NCI (National Cancer Institute) Canada Clinical Trials Group задіяно 134 хворих на СМТ високого ступеня злоякісності. Усі пацієнти отримали по 3 курси хіміотерапевтичного лікування іфосфамідом у разовій дозі 5 г/м2 в комбінації з доксорубіцином у разовій дозі 50 мг/м2 . Найбільш частою побічною дією хіміотерапії були нудота, блювання та алопеція — до 95% випадків, а також лейкопенія — в 32% хворих. Зафіксовано 1 випадок смерті пацієнта від фебрильної нейтропенії. Загальна 5-річна виживаність хворих становила 65% [12].
За даними літератури, індукційна терапія найбільш доцільна при місцево-поширених формах захворювання, особливо при розмірах пухлини >10 см. Таким чином, у деяких випадках неоад’ювантна терапія дозволяє досягати 100% некрозу тканини новоутворення [13]. Серед хіміопрепаратів найвищу ефективність при СМТ мають антрацикліни, вінкаалкалоїди, алкілувальні агенти, препарати платини [13–18].
Обнадійливі результати отримано при індукційному хіміопроменевому лікуванні хворих на СМТ високого ступеня злоякісності та великого розміру T.F. Delaney і співавторами. Протокол лікування включав 3 курси хіміотерапії доксорубіцином, іфосфамідом і дакарбазином та 2 курси променевої терапії по 22 Гр. Лікування продовжували хірургічним втручанням із мікроскопічною оцінкою країв резекції пухлини. Дана методика, застосована у 48 хворих, забезпечила загальну 5-річну виживаність у 87%, а безметастатичну 5-річну — на рівні 70% [19].
Важливе місце в лікуванні хворих на СМТ займає такий компонент, як променева терапія. Застосування променевої терапії в до- та післяопераційний період зумовило 64% 5-річну загальну виживаність і 94% 5-річну безрецидивну [20, 21]. При порівнянні до- і післяопераційної променевої терапії виявлено низку переваг індукційного лікування: це менші розміри та більш низькі дози опромінення, що дозволяє знизити частоту ускладнень без зменшення ефективності лікування і забезпечує кращу переносимість лікування [22–25].
За даними М.D. Anderson Cancer Center, при доопераційному опроміненні локальні рецидиви виникли у 12% хворих, а після післяопераційного — у 33% (р≤0,01) [26].
Існує думка, що променева терапія на доопераційному етапі пригнічує ангіогенез в пухлині, чим сприяє покращенню віддалених результатів лікування [27, 28]. Тому A. Pollack зі співавторами твердять про переваги індукційної терапії при місцево-поширених формах захворювання [26]. Подібної думки дотримується і H.D. Suit, котрий продемонстрував, що пухлини розміром >10 см більш ефективно піддаються лікуванню індукційною променевою терапію [28].
Водночас необхідно зазначити, що доопераційне опромінення супроводжується більшою кількістю ускладнень з боку післяопераційної рани. Це підтверджено проспективним рандомізованим дослідженням Canadian Sarcoma Group і NCI Canada Clinical Trials Group, завершеному в Princess Margaret Hospital (Госпіталь принцеси Маргарет, Торонто, Канада) [24]. При індукційній променевій терапії частота ускладнень достовірно вища й досягала 30% (р≤0,01) проти 17% при післяопераційному опроміненні. Подібні дані одержано й групою D. Wayne з M.D. Anderson Cancer Center [29] та іншими дослідниками [30, 31].
Таким чином, злоякісні новоутворення м’яких тканин, особливо високого ступеня ризику, які супроводжуються частим рецидивуванням та метастазуванням, потребують мультимодального підходу із залученням багатьох спеціалістів-онкологів: онкохірургів, радіологів, хіміотерапевтів [32–35].
Національні стандарти передбачають у лікуванні хворих на СМТ високого ступеню ризику II–III стадії проведення неоад’ювантної та ад’ювантної хіміопроменевої терапії (поліхіміотерапії — ПХТ). Поширену трикомпонентну схему неоад’ювантної системної хіміотерапії (вінкристин, доксорубіцин, циклофосфамід) доповнено препаратом дакарбазин — протипухлинним засобом із фармакологічної групи алкілувальних агентів, який позитивно зарекомендував себе в схемах лікування хворих з розповсюдженими формами СМТ.
Залучення додаткового препарату може підвищити цитотоксичну дію доопераційного лікування, зменшити розміри новоутворення, забезпечити більш сприятливі умови для хірургічного втручання та поліпшити віддалені результати терапії.
У контексті викладених даних нами виконано проспективне рандомізоване дослідження з лікування пацієнтів із СМТ високого ступеня ризику із застосуванням різних схем неоад’ювантного лікування.
Мета дослідження — порівняти результати комбінованого лікування хворих на СМТ високого ступеня ризику різними методиками.
Об’єкт та методи дослідження
До дослідження залучено 41 хворого на СМТ високого ступеня ризику. Про наявність високого ступеня ризику в пацієнтів свідчать: глибоке розташування пухлини (під фасцією), виявлення низько- та недиференційованих форм сарком, розмір пухлини >5 см в одному з вимірів, а також рецидивування захворювання. У дослідженні взяли участь хворі без тяжкої супутньої патології в стадії декомпенсації.
Перед початком дослідження пацієнтів рандомізовано методом конвертів на 2 групи: основну та контрольну. Основна група (21 особа) отримувала лікування наступним чином: неоад’ювантна системна чотирьохкомпонентна ПХТ (вінкристин, дакарбазин, доксорубіцин, циклофосфамід), променева терапія, хірургічне втручання, системна ад’ювантна ПХТ, ад’ювантна променева терапія. Контрольну групу (20 осіб) лікували за такою схемою: неоад’ювантна системна трьохкомпонентна ПХТ (вінкристин, доксорубіцин, циклофосфамід), променева терапія, хірургічне втручання, системна ад’ювантна ПХТ, ад’ювантна променева терапія.
Оцінку результатів лікування передбачали виконати шляхом вивчення відповіді новоутворення на неоад’ювантну терапію за зміною його розмірів за даними рентгенівської комп’ютерної томографії (КТГ), магнітно-резонансної томографії (МРТ) та лікувального патоморфозу — об’ємної частки життєздатної пухлинної паренхіми (ОЧЖПП).
Усім хворим перед початком лікування проводили КТГ або МРТ, під час якої вимірювали розміри новоутворення. Аналогічна процедура відбувалася перед хірургічним етапом лікування для вивчення наслідків неоад’ювантної терапії. Нами використано критерії RECIST 1.1 (2000) відповіді на терапію у пацієнтів з СМТ.
За критеріями RECIST оцінюють найбільші діаметри вогнища ураження. Суму діаметрів до лікування розглядають як базовий розмір і порівнюють з такою після лікування. Критерії ефекту терапії наступні:
- повна регресія — зникнення всіх вогнищ ураження в термін не менше 4 тиж;
- часткова регресія — зменшення вимірюваних вогнищ на 30% та більше;
- стабілізація процесу — зменшення вимірюваних вогнищ менше, ніж на 30%, та збільшення до 20%;
- прогресування процесу — збільшення на 20% і більше вимірюваних вогнищ чи поява нових патологічних вогнищ.
При проведенні неоад’ювантного лікування побічні явища оцінювали за шкалою NCIC.
Алгоритм лікування хворих в основній та контрольній групах представлено на рис. 1.
| Рандомізація хворих на СМТ високого ступеня ризику | ||
 |
 |
|
| Основна група | Контрольна група | |
 |
 |
|
| Системна ПХТ СYVADIC | Системна ПХТ VAC | |
 |
 |
|
| Променева терапія СВД 40 Гр (РВД — 2,2 Гр) | Променева терапія СВД 40 Гр (РВД — 2,2 Гр) | |
 |
 |
|
| Обстеження | Обстеження | |
 |
 |
|
| Оперативне втручання — видалення пухлини (через 4 тиж) | Оперативне втручання — видалення пухлини (через 4 тиж) | |
 |
 |
|
| Оцінка лікувального патоморфозу | Оцінка лікувального патоморфозу | |
 |
 |
|
| Лікування згідно зі Стандартами діагностики і лікування онкологічних хворих | ||
У пацієнтів із СМТ високого ступеня ризику основної групи проводили наступне лікування:
а) неоад’ювантна системна ПХТ:
1-й день: вінкристин — 1,4 мг/м2, не більше 2 мг;
- доксорубіцин — 50 мг/м2;
- дакарбазин — 400 мг/м2;
- циклофосфамід — 0,5 г/м2;
2-й день: дакарбазин — 400 мг/м2;
3-й день: дакарбазин — 400 мг/м2;
б) доопераційна променева терапія на ділянку пухлини до сумарної вогнищевої дози (СВД) 40 Гр при разовій вогнищевій дозі (РВД) 2,2 Гр;
в) хірургічне втручання з видаленням пухлини через 4 тиж після закінчення опромінення;
г) ад’ювантна системна ПХТ: 2 курси з інтервалом 3 тиж:
1-й день: вінкристин — 1,4 мг/м2, не більше 2 мг;
- доксорубіцин — 20 мг/м2;
- циклофосфамід — 0,5 г/м2;
2-й день: доксорубіцин — 20 мг/м2;
- циклофосфамід — 0,5 г/м2;
3-й день: доксорубіцин — 20 мг/м2;
- циклофосфамід — 0,5 г/м2;
д) ад’ювантна променева терапія на ділянку післяопераційного рубця СВД 15 Гр при РВД 2,2 Гр.
Хворі на СМТ високого ступеня ризику контрольної групи одержували наступне лікування:
а) неоад’ювантна системна ПХТ:
1-й день: вінкристин — 1,4 мг/м2, не більше 2 мг;
- доксорубіцин — 20 мг/м2;
- циклофосфамід — 0,5 г/м2;
2-й день: доксорубіцин — 20 мг/м2;
- циклофосфамід — 0,5 г/м2;
3-й день: доксорубіцин — 20 мг/м2;
- циклофосфамід — 0,5 г/м2;
б) доопераційна променева терапія на ділянку пухлини до СВД 40 Гр при РВД 2,2 Гр;
в) хірургічне втручання з видаленням пухлини через 4 тиж після закінчення опромінення;
г) ад’ювантна системна ПХТ: 2 курси з інтервалом 3 тиж:
1-й день: вінкристин — 1,4 мг/м2, не більше 2 мг;
- доксорубіцин — 20 мг/м2;
- циклофосфамід — 0,5 г/м2;
2-й день: доксорубіцин — 20 мг/м2;
- циклофосфамід — 0,5 г/м2;
3-й день: доксорубіцин — 20 мг/м2;
- циклофосфамід — 0,5 г/м2.
д) ад’ювантна променева терапія на ділянку післяопераційного рубця СВД 15 Гр при РВД 2,2 Гр.
Для оцінки лікувального патоморфозу гістологічні препарати виготовляли з тканин центральної, проміжної та периферичної зон пухлини післяопераційного матеріалу. Забарвлення гістопрепаратів проводили гематоксилін-еозином.
Оцінювання терапевтичного патоморфозу проводили за допомогою методу гістостереометрії з використанням окулярної тест-сітки Автанділова. При підрахунках визначали ОЧЖПП у відсотках. Вивчення мікропрепаратів здійснювали на мікроскопі Zeiss Axiostar (Plus) під малим (об’єктив ×10, окуляр ×10), а потім великим (об’єктив ×40, окуляр ×7) збільшенням. У кожному зрізі під мікроскопом вивчали 11 полів зору (стандартне збільшення ×280) з використанням окулярної тест-сітки Автанділова [36].
Для кількісних критеріїв обліку загибелі пухлинної паренхіми, індукованої протипухлинною терапією, використовували схему — шкалу оцінки лікувального патоморфозу за операційним матеріалом за Г.А. Лавніковою. Якщо ОЧЖПП коливається від 100 до 50%, то це I ступінь лікувального патоморфозу, інтервал від 50 до 20% відповідає II ступеню лікувального патоморфозу, від 20 до 1% — III ступеню, повна втрата пухлинної паренхіми — IV ступеню.
Статистичну обробка отриманих даних проведено з використанням програм Excel (MS Office 2003, XP) і STATІSTІCA 6,0 (StatSoftInc., США). Показники виживаності розраховували за методом Каплана — Мейєра.
Результати та їх обговорення
В основній групі (21 особа) чоловіків було 12 (57,2%), жінок — 9 (42,8%). До контрольної групи (20 пацієнтів) увійшли 10 осіб чоловічої статі (50%) і 10 осіб жіночої статі (50%). Розподіл хворих за статтю в досліджуваних групах наведено в табл. 1.
В основній групі хворі були у віці від 19 до 68 років, переважна більшість — у віці після 40 років (62%), середній вік — 43,5+4,8 року. У контрольній групі вік пацієнтів коливався від 18 до 72 років, також переважали хворі у віці більше 40 років (70%), середній вік становив 49,1±5,1 року. Різниця в середньому віці 5,6 року статистично недостовірна (р>0,05). Більш докладні дані про вікову структуру основної та контрольної груп наведено в табл. 2.
Таким чином, за віковими характеристиками основна та контрольна групи хворих на СМТ високого ступеня ризику були подібними.
Таблиця 1. Розподіл хворих на СМТ високого ступеня ризику за статтю в основній та контрольній групах
| Стать хворих | Основна група | Контрольна група | ||
|---|---|---|---|---|
| n | % | n | % | |
| Чоловіки | 12 | 57,2 | 10 | 50,0 |
| Жінки | 9 | 42,8 | 10 | 50,0 |
| Усього | 21 | 100,0 | 20 | 100,0 |
Таблиця 2. Розподіл хворих на СМТ високого ступеня ризику за віком в основній та контрольній групах
| Вік хворих, роки | Основна група | Контрольна група | ||
|---|---|---|---|---|
| n | % | n | % | |
| 19–29 | 4 | 19,0 | 2 | 10,0 |
| 30–39 | 4 | 19,0 | 4 | 20,0 |
| 40–49 | 5 | 23,8 | 2 | 10,0 |
| 50–59 | 5 | 23,8 | 6 | 30,0 |
| 60 і більше | 3 | 14,4 | 6 | 30,0 |
| Усього | 21 | 100,0 | 20 | 100,0 |
Усім хворим основної та контрольної груп перед початком лікування проведено морфологічне дослідження, при котрому виявлено, що у всіх присутні низько- та недиференційовані (G3–4) форми СМТ, що були розташовані під фасцією та мали розмір >5 см в одному з вимірів. Виходячи з вищезазначеного, всі пацієнти мали III стадію захворювання, або G3–4T2bN0M0.
Характеристику основної та контрольної груп за морфологічною будовою новоутворення представлено в табл. 3.
Значною була кількість злоякісних мезенхімом — 7 (33,3%) в основній групі та злоякісних фіброзних гістіоцитом — 7 (35,0%) в контрольній. Інші морфологічні форми діагностували рідше. Важливою є інформація про локалізацію захворювання у пацієнтів із СМТ високого ступеня ризику, яку подано в табл. 4. Найбільш часто місцем розвитку пухлини було стегно — 13 випадків (61,8%) в основній групі та 11 (55,0%) в контрольній.
Таблиця 3. Розподіл хворих на СМТ високого ступеня ризику за морфологічною будовою в основній та контрольній групах
| Морфологічна форма пухлини | Групи хворих | Усього | ||||
|---|---|---|---|---|---|---|
| Основна | Контрольна | |||||
| n | % | n | % | n | % | |
| Злоякісна мезенхімома | 7 | 33,3 | 2 | 10,0 | 9 | 21,9 |
| Рабдоміосаркома | 1 | 4,8 | 2 | 10,0 | 3 | 7,3 |
| Ліпосаркома | 4 | 19,0 | 1 | 5,0 | 5 | 12,3 |
| Ангіосаркома | 3 | 14,3 | 3 | 15,0 | 6 | 14,6 |
| Нейросаркома | 1 | 4,8 | 1 | 5,0 | 2 | 4,9 |
| Злоякісна фіброзна гістіоцитома | 2 | 9,5 | 7 | 35,0 | 9 | 21,9 |
| Лейоміосаркома | 1 | 4,8 | 2 | 10,0 | 3 | 7,3 |
| Синовіальна саркома | 2 | 9,5 | 2 | 10,0 | 4 | 9,8 |
| Усього | 21 | 100 | 20 | 100 | 41 | 100 |
Таблиця 4. Розподіл хворих на СМТ високого ступеня ризику за локалізацією в основній та контрольній групах
| Локалізація пухлини | Групи хворих | Усього | ||||
|---|---|---|---|---|---|---|
| Основна | Контрольна | |||||
| n | % | n | % | n | % | |
| Передпліччя | 1 | 4,8 | 3 | 15,0 | 4 | 9,8 |
| Плече | 1 | 4,8 | 1 | 5,0 | 2 | 4,9 |
| Стегно | 13 | 61,8 | 11 | 55,0 | 24 | 58,3 |
| Гомілка | 2 | 9,5 | 3 | 15,0 | 5 | 12,3 |
| Тулуб | 3 | 14,3 | 1 | 5,0 | 4 | 9,8 |
| Ступня | 1 | 4,8 | 1 | 5,0 | 2 | 4,9 |
| Усього | 21 | 100 | 20 | 100 | 41 | 100 |
Підсумовуючи вищенаведені дані, можна зробити висновок, що за головними характеристиками основна та контрольна групи хворих на СМТ були досить однорідними та подібними.
Проведення неоад’ювантного лікування в основній та контрольній групах не супроводжувалося вираженими побічними явищами. Найбільш часто в обох групах виявляли алопецію I ступеня: в основній групі у 52,4±11,1% пацієнтів, у контрольній — у 65,0±10,9%. Різниця між ними в 12,6% статистично недостовірна (р>0,05). Також достатньо часто відзначали нудоту під час та після введення хіміопрепаратів: в основній групі — у 52,4±11,1% пацієнтів, у контрольній — у 65,0±10,9%. Зафіксована між ними різниця в частоті — 12,6% — також була статистично недостовірною (р>0,05).
Одним із зареєстрованих ускладнень була зміна складу периферичної крові. Так, лейкопенію I ступеня тяжкості відзначено у 38,1±10,9% хворих в основній групі та у 25,0±9,9% в контрольній. Наявна різниця в 13,1% статистично недостовірна (р>0,05). Не виявлено достовірної відмінності в частоті розвитку нейтропенії в обох групах.
В основній групі нейтропенію I ступеня тяжкості діагностовано у 33,3±10,5% хворих, а в контрольній — у 20,0±9,2%, різниця в 13% — незначуща (р>0,05). Зменшення кількості тромбоцитів (тромбоцитопенія I ступеня тяжкості) зареєстровано в основній групі у 19,0±8,8% хворих і у 15,0±8,2% — у контрольній, тобто відмінність статистично недостовірна. Лікування ускладнень проводили за загальновідомими принципами, що сприяло зворотному їх розвитку в усіх хворих протягом 4–6 діб. Решта ускладнень мали поодинокий характер і суттєво не вплинули на перебіг лікування. Таким чином, суттєвої різниці в проявах токсичності під час неоад’ювантного лікування в основній і контрольній групах не виявлено.
У всіх хворих основної та контрольної груп проведено оцінку відповіді на проведене неоад’ювантне лікування за критеріями RECIST 1.1 (2000). Отримані результати продемонстровано в табл. 5.
Аналіз наведених даних показує, що в основній групі частка повних та часткових регресій становила 33,6±7,5%, а в контрольній — 15,0±5,2%. Різниця в 18,6% між групами була статистично достовірною (р<0,05). Прогресування новоутворення, що проявилося збільшенням розмірів пухлини, діагностували в обох групах однаково часто: 9,6±4,6% — в основній групі та 10,0±4,1% — у контрольній, тобто різниця між ними несуттєва (р>0,05).
Наші дані зіставні з результатами C.M. Pezzi [9], який повідомляє про різний ступінь регресії новоутворення у 40% хворих, та Р. Pisters із M.D. Anderson Cancer Center, котрий виявив часткову та повну регресію у 28% пацієнтів [3].
Таблиця 5. Оцінка ефекту неоад’ювантного лікування у хворих на СМТ високого ступеня ризику за критеріями RECIST в основній та контрольній групах
| Критерії RECIST | Основна група | Контрольна група | ||
|---|---|---|---|---|
| n | % | n | % | |
| Повна регресія | 1 | 4,8 | 0 | 0,0 |
| Часткова регресія | 6 | 28,8 | 3 | 15,0 |
| Стабілізація | 12 | 56,8 | 15 | 75,0 |
| Прогресування | 2 | 9,6 | 2 | 10,0 |
| Усього | 21 | 100,0 | 14 | 100,0 |
Усім пацієнтам, залученим до дослідження, виконано хірургічний етап лікування. В основній групі у 20 хворих проведено широке видалення пухлини, у 1 (4,8%) — ампутацію кінцівки у зв’язку з великим розповсюдженням новоутворення. У контрольній групі ампутацію кінцівки виконано теж у 1 (5%) хворого у зв’язку з поширенням захворювання на кісткові структури, у решти хворих — широке видалення пухлини.
Морфометричне дослідження операційного матеріалу в основній та контрольних групах показало наступне (табл. 6). В основній групі III та IV ступінь патоморфозу відзначали в 7 хворих (33,3±7,5%), що більше, ніж у контрольній групі — у 3 пацієнтів (15,0±5,2%). Тобто більш виражений патоморфоз — III та IV ступеня — на 18,3% частіше проявлявся в основній групі (р<0,05).
Таблиця 6. Порівняльна оцінка патоморфозу у хворих на СМТ високого ступеня ризику в основній та контрольній групах
| Ступінь патоморфозу | Основна група | Контрольна група | ||
|---|---|---|---|---|
| n | % | n | % | |
| I | 1 | 4,8 | 3 | 15,0 |
| II | 13 | 61,9 | 14 | 70,0 |
| III | 6 | 28,5 | 3 | 15,0 |
| IV | 1 | 4,8 | 0 | 0,0 |
| Усього | 21 | 100,0 | 14 | 100,0 |
Якщо порівняти середнє значення ОЧЖПП в основній групі, то воно дорівнювало 26,2±9,6%, а в контрольній — 37,1±10,8%. Таким чином, можна говорити про тенденцію до підвищення цитотоксичної дії неоад’ювантного лікування та збільшення рівня девіталізації новоутворення в основній групі на 10,9% порівняно з контролем, але ця різниця була недостовірною (р>0,05). Слід відзначити, що 100% лікувального патоморфозу досягнуто нами в 1 випадку в основній групі, що збігається з повідомленнями про поодинокі спостереження в літературі [13].
Проведено вивчення віддалених результатів в основній та контрольній групах. В основній групі локальні рецидиви захворювання виникли у 2 хворих у термін від 4 до 8 міс, у контрольній групі — у 3 хворих у строк від 5 до 14 міс. Віддалені метастази діагностували в основній групі у 5 хворих, розвинулися вони в період від 6 до 18 міс після лікування, а в контрольній — у 9 пацієнтів у такі самі строки. В основній групі померли 4 хворих, у контрольній — 5.
У табл. 7 наведено дані про 2-річну виживаність хворих в основній та контрольній групах.
Таблиця 7. Показники 2-річної виживаності хворих на СМТ високого ступеня ризику в основній та контрольній групах
| Види виживаності | 2-річна виживаність хворих, % (M±m) | |
|---|---|---|
| Основна група | Контрольна група | |
| Загальна | 85,71±6,63 | 80,00±7,94 |
| Безрецидивна | 80,95±7,29 | 70,00±9,25 |
| Безметастатична | 76,19±7,56 | 50,00±9,80 |
Загальна 2-річна виживаність хворих на СМТ високого ступеня ризику в основній групі дорівнювала 85,71±6,63%, що було вище на 5,71% порівняно з контролем (80,00±7,94%), але різниця була статистично недостовірною (р>0,05). Більш докладну інформацію щодо даного питання представлено на рис. 2.
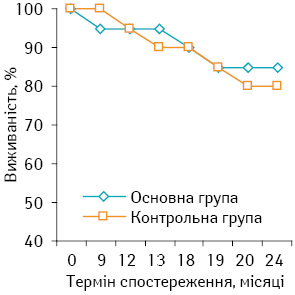
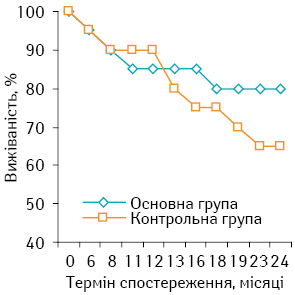
Безрецидивна 2-річна виживаність хворих на СМТ високого ступеня ризику в основній групі становила 80,95±7,29%, що на 10,95% вище, ніж у контрольній (70,00±9,25%), але зафіксована різниця була статистично недостовірною (р>0,05). Детальнішу інформацію подано на рис. 3.
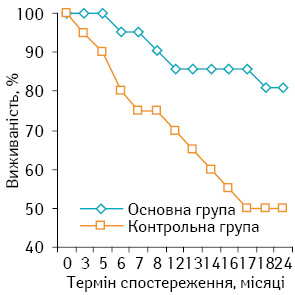
Безметастатична 2-річна виживаність хворих на СМТ високого ступеня ризику в основній групі (76,19±7,56%) була на 26,95% вищою, ніж у контрольній (50,00±9,80%), що було статистично достовірно (р<0,05). Докладну інформацію з даного приводу представлено на рис. 4.
Таким чином, аналіз віддалених результатів у хворих на СМТ високого ступеня ризику в основній та контрольній групах показав тенденцію до підвищення загальної та безрецидивної 2-річної виживаності в основній групі (р>0,05) і достовірне підвищення безметастатичної 2-річної виживаності у цій самій групі (р<0,05).
Висновки
1. Чотирьохкомпонентну неоад’ювантну системну ПХТ пацієнти переносили задовільно, прояви її токсичності не перевершували такі при трикомпонентній ПХТ.
2. Продемонстровано тенденцію до підвищення в основній групі порівняно з контрольною показників 2-річної виживаності: загальна — 85,71 та 80,00% відповідно та безрецидивна — 80,95 та 70,00% відповідно (р>0,05).
3. Виявлено статистично достовірне (р<0,05) підвищення в основній групі безметастатичної 2-річної виживаності до 76,19% проти 50% у контрольній групі.
Список використаної літератури
1. Щепотiн I.Б., Федоренко З.П., Гайсенко А.В. та ін. (2012) Рак в Україні, 2010–2011. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. Київ, 13: 42–43.
2. Шугабейкер П.Х., Малауэр М.М. (1996) Хирургия сарком мягких тканей. Медицина, Москва, 440 с.
3. Pisters P.W.T., O’Sullivan B., Maki R.G. (2007) Evidence-Based Recommendations for Local Therapy for Soft Tissue Sarcomas. J. Clin. Oncol., 25(8): 1003–1008.
4. Simpson-Herren L., Sanford A.H., Simpson-Herren L., Holmquist J.P. (1976) Effects of surgery on the cells kinetics of residual tumor. Cancer Treat. Rep., 60: 1749.
5. De Vita V., Hellmann S., Rosenberg P. (2001) Cancer: Principles and Practice of Oncology, 6th Edition. Published by Lippincott Williams & Wilkins (Copyright): 261.
6. Holland J.F., Frei E. (2003) Cancer Medicine 6. BC Decker Inc. London: 2699.
7. Pollock R.E. (2002) Soft tissue sarcomas. BC Decker Inc. London: 372.
8. Sadoski C., Suit H., Rosenberg A. et al. (1993) Preoperative radiation, surgical margins, and local control of extremity sarcomas of soft tissues. J. Surg. Oncol., 52: 223.
9. Pezzi C.M., Pollock R.E., Evans H.I. et al. (1990) Preoperative chemotherapy for soft tissue sarcomas of the extremitics. Ann.Surg., 2 (11): 476.
10. Pisters P.W.T., Patel S.R., Varma D.G.K. et al. (1997) Preoperative chemotherapy for stage IIIB extremity soft tissue sarcoma: long-term results from a single institution. J. Clin. Oncol., 15: 3481–87.
11. Casper E.S., Gaynor J.J., Harrison L.B. et al. (1994) Preoperative and postoperative adjuvant combination chemotherapy for adults with high-grade soft tissue sarcoma. Cancer, 73: 1644–51.
12. Gortzak E., Azzarelli A., Buesa J. et al. (2001) A randomized phase II study on neo-adjuvant chemotherapy for «high-risk» adult soft-tissue sarcoma. Europ. J. Cancer, 37: 1096–1103.
13. King J.J., Fayssoux R.S., Lackman R.D. et al. (2009) Early Outcomes of Soft Tissue Sarcomas Presenting With Metastases and Treated With Chemotherapy. Am. J. Clin. Oncol., 32(3): 308–313.
14. Penel N., Italiano F., Isambert N. Et al. (2009) Factors affecting the outcome of patients with metastatic leiomyosarcoma treated with doxorubicin-containing chemotherapy. Ann. Oncol., 21(6): 1361–1365.
15. Алиев М.Д., Мехтиева Н.И., Бохян Б.Ю. (2005) Факторы прогноза сарком мягких тканей. Вопр. онкологии, 51(3): 288–299.
16. Gronchi A., Miceli R., Colombo C. et al. (2011) Primary extremity soft tissue sarcomas: outcome improvement over time at a single institution. Ann. Oncol., 22(9): 1675–1681.
17. Зубарев А.Л., Кудрявцева Г.Т., Курильчик А.А. (2010) Комбинированное лечение распространенных сарком мягких тканей. Саркомы костей, мягких тканей и опухоли кожи, 2: 35–38.
18. Constantinidou A., Jones R.L., Olmos D. et al. (2012) Conventional anthracycline-based chemotherapy has limited efficacy in solitary fibrous tumour. Acta Oncologica, 51 (4): 550–554.
19. Delaney T.F., Spiro I., Suit H.D. et al. (2001) Neoadjuvant chemotherapy and radiotherapy for large extremity soft tissue sarcomas. Proc. ASTRO, 51: 148.
20. Alektiar K.M., Brennan M.F., Healey J.H. et al. (2008) Impact of Intensity-Modulated Radiation Therapy on Local Control in Primary Soft-Tissue Sarcoma of the Extremity. J. Clin. Oncol., 26(20): 3440–3444.
21. Mendenhall W.M., Indelicato D.J., Scarborough M.T. et al. (2009) The Management of Adult Soft Tissue Sarcomas. Am. J. Clin. Oncol., 32 (4): 436–442.
22. Barkley H.T., Marin R.G., Romshdahl M.M. et al. (1988) Treatment of soft tissue sarcomas by preoperative irradiation and conservative surgical resection. Int. J. Radiat. Oncol. Biol. Phys., 14: 693–699.
23. O’Sullivan B., Davis A.A. (2001) A randomized phase III trial of preoperative compared to postoperative radiotherapy in extremity soft tissue sarcoma. Proc. ASTRO, 51: 151.
24. O’Sullivan B., Davis A.A. , Turcotte R. et al. (2002) Preoperative versus postoperative radiotherapy in soft — tissue sarcoma of the limbs: a randomized trial. Lancet, 359: 2235–2241.
25. Tyldesley S., Fryer K., Minchinton A. et al. (1997) Effects of debulking surgery on radiosensitivity, oxygen tension and kinetics in a mouse tumor model. Clin. Invest. Med., 20: 83.
26. Pollack A., Zagars G., Goswitz M. et al. (1998) Preoperative vs. postoperative radiotherapy in the treatment of soft tissue sarcomas: a matter of presentation. Int. J. Radiat. Oncol. Biol. Phys., 42: 563.
27. Hartford A.C., Gohongi T., Fukumura D. et al. (2000) Irradiation of a primary tumor, unlike surgical removal, enhances angiogenesis suppression at a distal site: potential role of host–tumor interaction. Cancer Res., 60: 2128–2131.
28. Vaidya J., Palazzo F. (2002) Radiotherapy in soft tissue sarcoma. The Lancet, 360: 1989 .
29. Suit H.D., Spiro I. (1994) Role of radiation in the management of adult patients with sarcoma of soft tissue. Semin. Surg. Oncol., 10: 347–356.
30. Wayne J.D., Langstein H., Pollack A. et al. (2000) Preoperative radiotherapy for extremity soft tissue sarcoma: site-specific wound complication rates and the impact of reconstructive surgery. Proc. Amer. Soc. Clin. Oncol., 19: 558a.
31. Bujko K., Suit H.D., Springfield D.S., Convery K. (1993) Wound healing after preoperative radiation for sarcoma of soft tissues. Surg. Gynaecol. Obster., 176: 114–134.
32. Cheng E., Dusenbery K., Winters M., Thompson R. (1996) Soft tissue sarcomas: preoperative versus postoperative radiotherapy. J. Surg. Oncol., 61: 90–99.
33. Sabolch A., Feng M., Griffith K. et al. (2012) Risk Factors for Local Recurrence and Metastasis in Soft Tissue Sarcomas of the Extremity. Am. J. Clin. Oncol., 35(2): 151–157.
34. Mendenhall W.M., Indelicato D.J., Scarborough M.T. (2009) The Management of Adult Soft Tissue Sarcomas. Am. J. Clin. Oncol., 32(4): 436–442.
35. Bui-Nguyen B., Ray-Coquard I., Chevreau C. et al. (2012) High-dose chemotherapy consolidation for chemosensitive advanced soft tissue sarcoma patients: an open-label, randomized controlled trial. Ann. Oncol., 23(3): 777–784.
36. Автандилов Г.Г. (1990) Mедицинская морфометрія. Медицина, Москва, 383.
Лечение больных саркомой мягких тканей высокой степени риска
Резюме. Цель исследования — сравнить результаты комбинированного лечения больных саркомой мягких тканей (СМТ) высокой степени риска с использованием различных методик неоадъювантного лечения. В исследование включен 41 больной СМТ, которые разделены на 2 группы в зависимости от проведенной неоадъювантной полихимиотерапии — трех- или четырехкомпонентной. Четырехкомпонентную неоадъювантную системную полихимиотерапию удовлетворительно переносили пациенты, проявления ее токсичности не превосходили таковые при трехкомпонентной полихимиотерапии. Продемонстрирована тенденция к повышению в основной группе по сравнению с контрольной показателей 2-летней выживаемости: общая составляла 85,7 и 80% соответственно, а безрецидивная — 80,95 и 70% соответственно (р>0,05). Выявлено статистически достоверное (р<0,05) повышение в основной группе безметастатической 2-летней выживаемости до 76,19% против 50% в контрольной группе.
Ключевые слова: саркома мягких тканей, комбинированное лечение, полихимиотерапия, лучевая терапия, хирургическое лечение.
Treatment of patients with high risk soft tissue sarcoma
Summury. Research purpose — to compare the results of the combined treatment of patients with soft tissue sarcoma (STS) of high risk with application of different methods of neoadjuvant treatment. To research it was attracted 41 patient with STS, which parted on 2 groups depending on got neoadjuvant chemotherapy — three- or four-component. Quarternary neoadjuvant system chemotherapy was satisfactorily carried patients, and for did not excel such the displays of toxiness at three-component. A tendency is shown to the increase in a basic group as compared to control indexes 2-years survival: general — 85,7% but 80% accordingly, and non-recurrence — 80,95% but 70% accordingly (p>0,05). Found out statistically a reliable (p<0,05) increase in the basic group of non-metastatic 2-years survival to 76,19% against 50% in a control group.
Key words: soft tissue sarcoma, combined treatment, polychemotherapy, radiation treatment, surgical treatment.














Leave a comment