Возможности эхокардиографии в оценке кардиотоксичности химиотерапевтического лечения больных онкологического профиля (состояние проблемы в литературе, результаты собственных исследований)
Солодянникова О.И., Головко Т.С., Лаврик Г.В., Шевчук Л.А.
Резюме. Ретроспективно проанализирован мониторинг результатов эхокардиографии пациентов, которые проходили лечение в клинике Национального института рака. Эхокардиографию проводили с целью оценки кардиотоксического влияния химиотерапевтического лечения. Использование эхокардиографии позволило определить ранние, субклинические проявления кардиотоксичности, что имеет значение при включении в терапию схем полихимиотерапии с кардиотоксическим действием.

Неуклонный рост заболеваемости онкологической патологией предполагает усовершенствование существующих методов диагностики, развитие новых диагностических и терапевтических технологий. В лечении пациентов с метастазами солидных опухолей первоочередное значение имеют побочные эффекты, снижающие качество жизни и не позволяющие достичь желаемых результатов лечения. Пациент может получить сопровождающуюся симптомами, но имеющую кратковременное течение кардиальную дисфункцию как «плату» за более высокую вероятность излечения. Но следует помнить о том, что в будущем излечившийся от рака пациент не захочет иметь кардиальную патологию. Таким образом, необходимо контролировать лечение опухоли и минимизировать кардиоваскулярные побочные эффекты.
За последнее время существенно изменился подход к лечению больных онкологического профиля: если ранее применяли цитотоксические препараты короткими, но интенсивными курсами для достижения небольшого увеличения выживаемости, то в настоящее время терапия некоторыми химиопрепаратами может продолжаться долгие годы. При этом следует учитывать, что пациенты часто имеют сопутствующую кардиальную патологию, предрасположенность к ней и возрастные изменения сердечно-сосудистой системы. Кроме того, проводимые клинические исследования имеют строгие критерии включения и исключения и не всегда точно отражают частоту развития кардиотоксичности [39].
К основным кардиоваскулярным побочным эффектам противоопухолевой терапии относятся: удлинение интервала QT и аритмии, ишемия и инфаркт миокарда, артериальная гипертензия, венозная и артериальная тромбоэмболии, кардиальная дисфункция в виде нарушения систолической и диастолической функций и сердечная недостаточность (СН). Чаще отмечают развитие СН, которая может иметь различную тяжесть, быть обратимой или необратимой, развиваться непосредственно по завершении лечения либо быть отдаленным следствием [5–11].
В табл. 1 приведен перечень химиотерапевтических препаратов, применение которых сопровождается теми или иными признаками кардиотоксичности.
Таблица 1. Побочные эффекты основных химиопрепаратов
| Химиотерапевтический препарат | Клинические проявления токсичности |
|---|---|
| Блеомицин | Пульмониты, лихорадка, реакции гиперчувствительности, мукозит, десквамация, признаки умеренной кардиотоксичности |
| Карбоплатин | Миелосупрессия, тошнота, рвота, признаки умеренной кардиотоксичности |
| Цисплатин | Нефротоксичность, сильная тошнота и рвота, нейротоксичность, признаки умеренной кардиотоксичности |
| ЦиклофосфамидИфосфамид | Миелосупрессия, геморрагический цистит, умеренная или сильная тошнота и рвота, синдром неадекватной секреции антидиуретического гормона, признаки умеренной кардиотоксичности |
| Цитарабин | Миелосупрессия, мукозит, сильная тошнота и рвота, нейротоксичность, конъюнктивит, признаки умеренной кардиотоксичности |
| Дакарбазин | Сильная тошнота, рвота, миелосупрессия, лихорадка, флебит, признаки умеренной кардиотоксичности |
| ДаунорубицинДоксорубицин | Миелосупрессия, выраженная кардиотоксичность, выраженная тошнота и рвота, алопеция, некроз при экстравазальном попадании |
| Этопозид | Миелосупрессия, гипотензия при быстром введении, признаки умеренной кардиотоксичности |
| Флороурацил | Миелосупрессия, мукозит, диарея, флебит, признаки умеренной кардиотоксичности |
| Метотрексат | Миелосупрессия, мукозит, нефротоксичность, светочувствительность, признаки умеренной кардиотоксичности |
| Митоксантрон | Миелосупрессия, выраженная кардиотоксичность, умеренная тошнота и рвота |
| Мустарген | Миелосупрессия, умеренная тошнота и рвота, признаки умеренной кардиотоксичности |
| Винкристин | Нейротоксичность, миелосупрессия, некроз при экстравазальном попадании, синдром неадекватной секреции антидиуретического гормона, признаки умеренной кардиотоксичности |
В зависимости от степени кардиодепрессивного действия и механизмов развития нарушений кардиальной функции химиопрепараты можно разделить на:
- препараты, вызывающие нарушение сократительной функции (систолическая или диастолическая дисфункции);
- препараты, вызывающие или обостряющие ишемические изменения в миокарде;
- препараты, влияющие на систему проводимости миокарда.
В литературе также представлена классификация ключевых химиопрепаратов, в основу которой положены механизмы нарушения функции сердечно-сосудистой системы [7] (табл. 2).
Таблица 2. Побочные эффекты основных химиопрепаратов в зависимости от механизма нарушения функций сердечно-сосудистой системы
| Кардиальные синдромы | Химиотерапевтические препапраты |
|---|---|
| СН | Антрациклины/антрахинолоны Циклофосфамид Трастузумаб и другие ингибиторы тирозинкиназы на основе моноклональных антител |
| Ишемические изменения и тромбоэмболия | Антиметаболиты (флоуроурацил, капецитабин) Препараты, нарушающие сборку микротрубочек (паклитаксел, доцетаксел) Цисплатин Сунитиниб, сорафениб |
| Другие токсические эффекты:эндомиокардиальный фиброз,геморрагический миокардит,брадиаритмия,
феномен Рейно, автономная нейропатия, удлинение интервала Q–T трепетание/мерцание желудочков, легочный фиброз |
Бусульфан, циклофосфамид Паклитаксел Винбластин, блеомицин Винкристин Триоксид мышьяка Блеомицин, метотрексат, циклофосфамид в высоких дозах |
Клинические варианты развития кардиодепрессивного действия химиопрепаратов могут выражаться острым повреждением сердечной мышцы. При этом риск его возникновения не зависит от кумулятивной дозы цитостатика и регистрируется в течение 24–48 ч после введения.
Повреждение сердечной мышцы клинически манифестируется следующими проявлениями: нарушениями сердечного ритма (чаще синусовая тахикардия), неспецифическим изменением сегмента ST и зубца T на электрокардиограмме (ЭКГ), бессимптомным снижением фракции выброса левого желудочка (ФВ ЛЖ), признаками острого миокардита или перикардита, транзиторной СН, исключительно редко — инфарктом миокарда или внезапной смертью [7].
Подострое повреждение сердечной мышцы развивается в течение 6–8 мес после завершения терапии с пиком клинической манифестации спустя 3–4 мес после введения последней дозы цитостатика. Основные ее проявления сходны с таковыми при остром повреждении миокарда.
Отсроченное повреждение сердечной мышцы (дилатационная кардиомиопатия) является основным дозозависимым осложнением цитостатиков и развивается в течение 5 и более лет после введения последней дозы цитостатика. Клиническая картина может значительно варьировать от бессимптомной дисфункции ЛЖ до прогрессирующей, в том числе фатальной, СН [7, 24, 44, 46, 47].
Наиболее значимыми кардиоваскулярными побочными эффектами противоопухолевой терапии являются поздняя СН после лечения антрациклинами и циклофосфамидом, а также поражение коронарных артерий и сердечных клапанов после лучевой терапии на область грудной клетки Основной причиной лучевого поражения сердца считают повреждение эндотелия сосудов сердца с последующим нарушением микроциркуляции, развитием ишемии и фиброзa. Фактором риска развития кардиальных нарушений считают лучевую терапию на область средостения в дозе 40 Гр и более [11, 48, 49].
В литературе встречается термин «радиационная болезнь сердца», которая проявляется утолщением перикарда до 7 мм и более, гидроперикардом, деформацией клапанного аппарата и нарушениями функции синусового и атриовентрикулярного узлов.
Лучевая терапия, по данным некоторых авторов, существенно отягощает кардиотоксические эффекты системной цитотоксической терапии [11, 48, 49]. В то же время, по результатам SEER Сancer Registries, США, риск смертности от кардиоваскулярной патологии невысок в первые 10 лет после облучения, но повышается со временем [12, 19, 31].
Антрациклины остаются базисными препаратами в лечении многих злокачественных новообразований, и кардиотоксичность этих химиотерапевтических препаратов зависит от кумулятивной дозы [2, 4, 13, 14, 17, 20, 22].
При общей дозе препарата 300 мг/м² СН регистрируют у 1–2% больных, при дозе 400 мг/м² — у 3–5%, при 450 мг/м² — у 5–8%, при 500 мг/м² и более — у 6–20% пациентов [34].
У детей, особенно младшего возраста, кардиотоксичность развивается при приеме более низких кумулятивных доз [1]. По мнению некоторых авторов, повреждение миоцитов вследствие терапии доксорубицином у детей приводит к уменьшению объема жизнеспособного миокарда, неадекватной массе ЛЖ и клинически значимой кардиальной дисфункцией в более поздние годы [7, 18, 26–28, 35, 43, 44, 48, 49]. Основным механизмом развития кардиальной дисфункции являются увеличение постнагрузки ЛЖ и, как следствие, снижение сократительной способности миокарда [26–28, 32, 33, 37].
Ряд исследователей считают, что кумулятивная доза 200 мг/м² является критической для манифестации кардиотоксичности, а снижение ФВ ЛЖ более чем на 4% после достижения данной дозы — прогностическим фактором [6–8, 21, 26–28].
К основным факторам риска развития кардиотоксичности относят:
- предшествовавшее облучение средостения;
- возраст (>70 и <15 лет);
- женский пол;
- сопутствующая патология со стороны коронарных артерий, клапанов или миокарда;
- артериальная гипертензия;
- применение нескольких кардиотоксичных препаратов (паклитаксел, доцетаксел, трастузумаб, циклофосфамид, этопозид, дакарбазин и др.) [47].
Ведущим механизмом развития кардиотоксичности под влиянием антрациклиновых препаратов является окислительный стресс. Продукты окисления индуцируют апоптоз, а в более высоких концентрациях и некроз кардиомиоцита, а также могут вызывать разрыв саркомера. Известна генетическая предрасположенность к антрациклиновой кардиотоксичности. В одной из работ [42] показано, что у пациентов с неходжкинской лимфомой риск отдаленной токсичности зависит от генетических вариантов транспортеров доксорубицина и ферментов, продуцирующих свободные радикалы. У больных, подвергшихся биопсии эндомиокарда в ранний период после завершения терапии доксорубицином, выявляли признаки разрушения и гибели клеток [8]. Из-за низких репаративных возможностей кардиомиоцитов [4] эти повреждения снижают способность сердца противостоять таким мощным стрессовым агентам, как артериальная гипертензия, ишемия. Комбинация этих факторов приводит к развитию в отдаленный период СН.
В связи с вышеизложенным особое значение приобретает диагностика ранних доклинических признаков поражения миокарда с помощью методов функциональной и лучевой диагностики. Это, прежде всего, использование стандартной электрокардиографии, холтеровского мониторирования, ЭКГ высокого разрешения, оценки вариабельности ритма сердца, эхокардиограммы, радионуклидной вентрикулографии, кардиосинхронизированной сцинтиграфии миокарда, магнитно-резонансной томографии, компьютерной томографии и анализа концентрации сердечных ферментов и других биохимических маркеров повреждения миокарда.
Вместе с тем и сегодня остаются недостаточно изученными возможности комплексного ультразвукового исследования больных онкологического профиля в диагностике нарушений функции миокарда под влиянием системной противоопухолевой терапии.
В Национальном институте рака проанализированы результаты исследований пациентов в возрасте 21–70 лет, обратившихся по поводу онкологической патологии, в частности лимфомы и рака грудной железы.
У всех больных проводили комплексное ультразвуковое исследование, включающее трансторакальную эхокардиограмму по стандартной методике, допплеровскую эхокардиограмму с использованием кардиологического датчика с частотной характеристикой 2,0–4,0 МГц.
При необходимости трансторакальную эхокардиограмму дополняли ультразвуковым исследованием органов брюшной полости (осмотр печени, нижней полой вены, печеночных вен, аорты), исследованием мягких тканей грудной стенки, межреберий, магистральных сосудов шеи с помощью линейного датчика с частотной характеристикой 5–10 МГц.
Результаты анализа позволили сформировать 2 группы пациентов, структура которых представлена в табл. 3.
Таблица 3. Распределение пациентов в зависимости от основного диагноза и фоновой кардиальной патологии
| Группы обследованных | Лимфома Ходжкина | Неходжкинская лимфома | Рак грудной железы |
|---|---|---|---|
| 1-я группа — пациенты с кардиальной патологией | 7 (46,66%) | 21 (67,1%) | 15 (55,5%) |
| 2-я группа — пациенты без признаков кардиальной патологии | 8 (53,33%) | 30 (60,8%) | 12 (44,4%) |
| Всего пациентов | 15 | 51 | 27 |
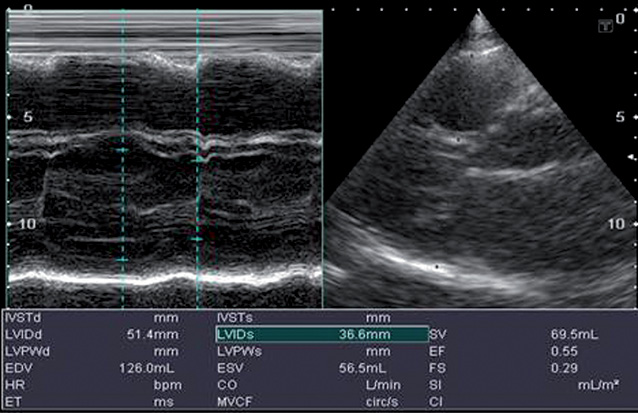
Для количественной оценки функционального состояния миокарда использовали линейные размеры и объем ЛЖ, конечно-систолический (КСР и КСО), конечно-диастолический (КДР и КДО), конечно-систолическое и конечно-диастолическое утолщение межжелудочковой перегородки (МЖП) и задней стенки (ЗС) ЛЖ, ударный объем (УО) и ФВ ЛЖ, линейные размеры левого предсердия (ЛП) и диаметр аорты (Ао). Проводили допплеровскую оценку скоростей потока трансмитрального наполнения ЛЖ.
Установлено, что у пациентов, имеющих фоновую кардиальную патологию, отмечено ухудшение основной кардиальной патологии, что сопровождалось повышением артериального давления, появлением тахикардии, различного рода аритмий, кардиалгии. При эхокардиограмме отмечали расширение полостей сердца (ЛП ≥40 мм ±2,2% при норме 38±1, увеличение КДР, КСР, КДО, КСО), наличие клапанной патологии (незначительная, умеренная, выраженная регургитация, формирование комбинированных, сочетанных пороков), выявлена гипертрофия миокарда ЛЖ (135–140±3,4% при норме индекса массы миокарда ≤120 г/м² для мужчин и женщин (R. Devereux и соавторы)); снижение ФВ до 10% (до проводимого лечения у всех пациентов систолическая функция сердца сохранена (ФВ составляла 55,4±3,6%), после проводимой терапии ФВ — 49,46±2,3%). Выявлена диастолическая дисфункция 1-го и 2-го типов.
У пациентов 2-й группы (без кардиальной патологии) основными клиническими проявлениями были тахикардия, синусовая аритмия, в редких случаях — падение артериального давления, появление кардиалгии. При эхокардиограмме отмечали незначительное снижение ФВ (до 10%), так как до проводимого лечения ФВ составляла 66,4±2,2%, после — 57,2±3,6%. Дилатации полостей предсердий и желудочков, нарушения диастолической функции миокарда выявлено не было.
Значимые изменения показателей отмечены в группе пациентов, имеющих изначально кардиальную патологию, что, возможно, обусловлено возрастными особенностями кардиодинамики и исходно низким компенсаторным резервом миокарда.
Анализ эхокардиографических данных позволил выделить наиболее характерные признаки патологии сердца у больных онкологического профиля на фоне проводимого лечения. К ним относятся, прежде всего, нарушения систолической функции ЛЖ, а именно:
- изменения миокарда (истончение, нарушение синхронности сокращения волокон миокарда, дискинезии, парадоксальные движения стенки желудочка);
- нарушения локальной сократимости (гипокинезии, акинезии), признаки асимметричной гипертрофии миокарда;
- увеличение КДО, КСО, а в результате — снижение ФВ;
- расширение камер сердца;
- при выраженной дилатации — наличие тромбов;
- возможны аневризматические изменения миокарда;
- перикардит;
- наличие тромбов в магистральных сосудах (нижняя полая вена).
Не менее значимыми являются нарушения диастолической функции ЛЖ. Феномен «незавершенной» диастолы, который формируется у этих пациентов, характеризуется увеличением скорости трансмитрального кровотока в фазу систолы предсердий (≥0,8 м∕с при норме 0,56±0,13 м∕с), уменьшением скорости трансмитрального кровотока в фазу систолы предсердий (≤0,3 м∕с при норме 0,56±0,13 м∕с), увеличением пика Е (E — скорость раннего диастолического наполнения ЛЖ) (≥1,2 м∕с при норме 0,86±0,16 м∕с), уменьшением пика Е (≤0,5 м∕с при норме 0,86±0,16 м∕с), изменением отношения Е/А (где A — пиковая скорость позднего, или предсердного, диастолического наполнения ЛЖ) (≤1,0 или ≥2,0 при норме 1,6±0,5 м∕с), удлинением времени изоволюмического расслабления (≥110 м/с при норме 73±13 м∕с), сокращением времени изоволюмического расслабления (≤60 м/с при норме 73±13 м/с), удлинением времени замедления скорости кровотока в период быстрого диастолического наполнения (≥240 м/с при норме 199±32 м/с), сокращением времени замедления скорости кровотока в период быстрого диастолического наполнения (≤150 м/с при норме 199±32 м/с).
Таким образом, малые кумулятивные дозы антрациклинов вызывают диастолическую дисфункцию по типу недостаточной релаксации. Однако при воздействии высоких доз химиопрепаратов диастолическая дисфункция усугубляется и выражается в «псевдонормализации» трансмитрального кровотока, что становится предпосылкой для систолической дисфункции ЛЖ.
Показателем диастолической функции является соотношение Е/А. Для определения скорости движения тканей (миокарда и его структур) в раннюю диастолу, деформации и скорости деформации миокарда используют режим «tissue velocity imaging». Эти современные методики позволяют получить достоверные показатели диастолической функции, поскольку они более нормализованы и способствуют избежанию вариабельности, связанной с влиянием субъективного фактора [23, 24, 38, 50, 51].
В нескольких исследованиях ранних изменений функции сердца во время и после лечения антрациклинами выявлены признаки ухудшения диастолической функции, которые предшествовали систолической [25–27, 29, 40, 41, 45]. В других исследованиях проведение допплеровской эхокардиограммы позволило диагностировать субклинические кардиальные изменения [25, 30, 31]. Ряд авторов [13] указывают на то, что использование ФВ ЛЖ в оценке степени фактического поражения миокарда недостаточно, поскольку его компенсаторный резерв позволяет обеспечивать ударный выброс ЛЖ даже при выраженном нарушении функции кардиомиоцитов. Следовательно, ухудшение диастолической функции сердца является более ранним по отношению к систолической функции, и у многих пациентов субклиническая диастолическая дисфункция предшествует выраженному снижению систолической функции [3, 14, 15, 16, 29, 36].
Клиническими иллюстрациями могут быть следующие наблюдения.
Пациентка И. (1942 года рождения) обратилась с жалобами на образование в правой грудной железе. В ходе обследования (маммография, компьютерная томография органов грудной полости, органов брюшной полости, малого таза) выявлено прогрессирование основного заболевания: метастатическое поражение легких, правой плевральной полости, лимфатических узлов средостения. На основании этого пациентке предложена неоадъювантная полихимиотерапия, включающая антрациклины.
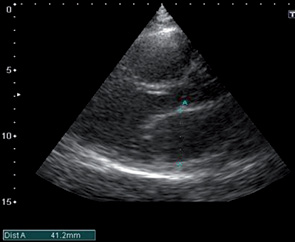
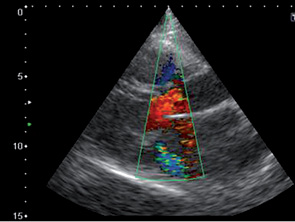
При эхокардиографическом обследовании с целью оценки функционального состояния миокарда выявлены следующие патологии: комбинированный митральный порок сердца с преобладанием стеноза (рис. 1, 2, 3), сочетанное поражение аортального клапана (недостаточность), дилатация полостей сердца, ультразвуковые признаки легочной гипертензии, гипертрофии миокарда, косвенные признаки СН (рис. 4, 5).
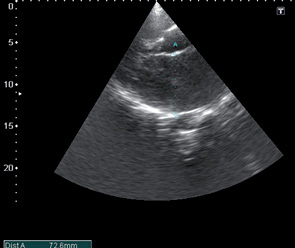
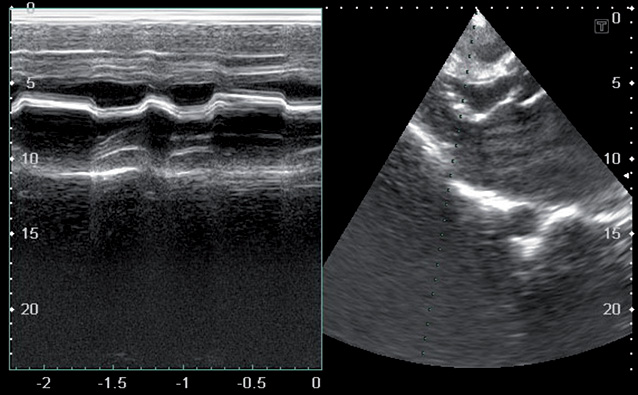
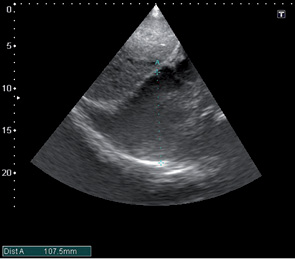
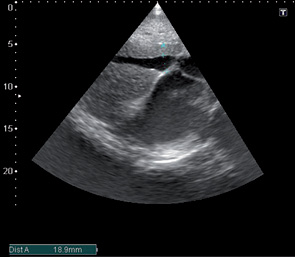
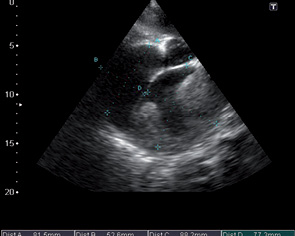
После проведения 3 курсов полихимиотерапии на фоне выраженной дилатации полостей сердца (левого, правого предсердий) (рис. 6), сохраняющейся легочной гипертензии, косвенных признаков СН, наличия свободной жидкости в правой плевральной полости отмечали появление в полости ЛП пристеночных тромботических масс (рис. 6–8).
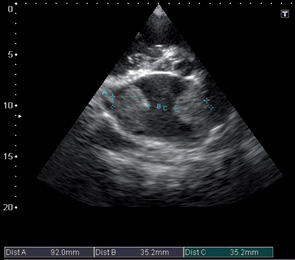
Примером хорошо переносимой полихимиотерапии у пациентов с сопутствующей кардиальной патологией может быть следующий клинический случай.
Пациентка Р., 1963 года рождения, обратилась в Национальный институт рака с жалобами на объемное образование в правой грудной железе. Пациентке предложен курс полихимиотерапии, FAC, для проведения которого необходима оценка резервных возможностей сердца до, на этапах и после курса полихимиотерапии.
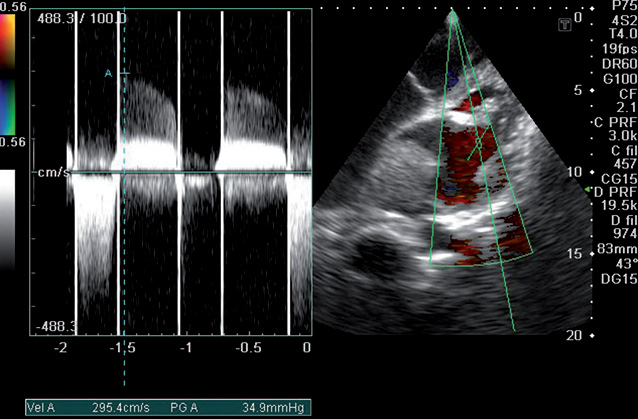
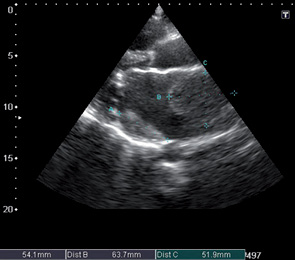
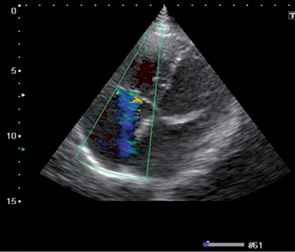
На эхокардиограмме отмечены следующие особенности: комбинированный порок митрального клапана без четкого преобладания (рис. 9, 10), дилатация предсердий (см. рис. 9), правого желудочка, наличие выраженной недостаточности трехстворчатого клапана (рис. 11), признаки умеренной легочной гипертензии, но с сохраненной хорошей сократительной функцией миокарда ЛЖ (рис. 12). После парных курсов полихимиотерапии эхокардиографическая картина существенно не изменилась. Наличие длительно существующей кардиальной патологии создает существенные компенсаторные механизмы, что приводит к хорошей адаптации проводимой терапии и снижает риск возможных кардиальных осложнений.
Заключение
Изучение проблемы возможностей эхокардиограммы в оценке кардиотоксичности свидетельствует, что в настоящее время в Украине нет стандартов обследования и мониторинга пациентов, получающих кардиодепрессивную терапию (полихимиотерапию, лучевую терапию).
В то же время с целью предотвращения развития кардиальной патологии или усугубления существующей на фоне проводимой терапии у больных онкологического профиля необходимо особое внимание уделять профилактике кардиомиопатии. Так, выявление до начала терапии факторов риска нарушения функций сердца позволит модифицировать схему химиотерапии путем изменения скорости и режима введения препарата, уменьшения его максимальной кумулятивной дозы или замены менее токсичным препаратом, выбрать оптимальный доступ, использовать новые способы фиксирования пациента и методики при лучевой терапии органов грудной полости. Для своевременного выявления сердечных осложнений следует непрерывно наблюдать за состоянием сердечно-сосудистой системы пациентов на протяжении периода лечения и после его завершения.
Большинство современных рекомендаций по выявлению кардиотоксичности, обусловленной противоопухолевым лечением, базируются на данных среднего уровня доказательности. В частности, ФВ ЛЖ является наиболее широко используемым параметром в мониторинге кардиотоксичности, но при его применении возможна недооценка истинного масштаба поражения миокарда, поскольку у пациентов с нормальными значениями ФВ ЛЖ могут быть субклинические изменения функции сердца.
Эхокардиограмма с использованием разработанных показателей для оценки диастолической функции, таких как визуализация с определением скорости движения тканей во время ранней диастолы, деформация и скорость деформации, позволяет на более раннем этапе выявлять субклинические нарушения функции сердца.
Необходимость длительного наблюдения пациентов после противоопухолевого лечения является новым аспектом в практической онкологии — злокачественные новообразования все чаще рассматривают как хронические заболевания. В связи с этим нужны надежные и чувствительные методы мониторинга для раннего выявления кардиоваскулярных токсических эффектов, что даст возможность своевременно диагностировать осложнения, обусловленные противоопухолевым лечением, без снижения эффективности последнего.
Список использованной литературы
1. Aggarwal S., Pettersen M.D., Bhambhani K. et al. (2006) B-type natriuretic peptide as a marker for cardiac dysfunction in anthracyclinetreated children. Pediatr. Blood. Cancer, 43(12).
2. Altena R., Perik P. J. (2010) Cardiovascular toxicity caused by cancer treatment: strategies for early detection. J. Lancer Oncol., 10(4): 391–9.
3. Appleton C.P., Hatle L.K., Popp R.L. (1998) Relation of transmitral flow velocity patterns to left ventricular diastolic function: new insights from a combined hemodinamic and Doppler echocardiographic study. J. Am. Coll. Cardiol., 12(2): 426–50.
4. Bergmann O., Bhardwaj R.D., Bernard S. (2009) Evidence for cardiomiocyte renewal in humans. Science, 324: 98–102.
5. Aleman B.M.P., van den Belt-Dusebout A.W., De Bruin M.L. et al. (2007) Late cardiotoxicity after treatment for Hodgkin lymphoma. Blood, 109(5): 1878–86.
6. Bovelli D., Plataniotis G., Roila F. et al. (2007) Trastusumab — related cardiotoxiti: calling into question the concept of reversibility. J. Clin. Oncol., 25: 3525–3533.
7. Bricker J.T., Green D.M. and D’Angio G.J (1994) Cardiac toxicity after treatment for childhood cancer. Br. J. Cancer., 70(3): 569.
8. Bristow M.R., Billingham M.E., Mason J.W. (1978) Clinical spectrum of antraciclin antibiotic cardiotoxicity. Cancer Neat. Rep., 62: 873–879.
9. Chaladze T., Megreladze I., Zodelava M. (2005) Early cardiotoxicity induced by treatment of hematologic malignancies and the risk factors of its manifestation. Georgian med. News., 129: 117–119.
10. Dazzi H., Kaufmann K., Follath F. (2001) Anthracycline-indused acute cardiotoxicity in adults treated for leukaemia at the Uneversity Hospital oh Zurich, Switzerland, between 1990 and1996. Ann. Oncol.,12(7): 963–966.
11. Darby S.C., McGale P., Taylor C.W., Peto R. (2005) Longterm mortality from heart disease and lung cancer after radiotherapy for early breast cancer: prospective cohort study of about 300,000 women in US SEER cancer registries. Lancet. Oncol. 6(8): 557–565.
12. Doyle J.J., Neugut A.I., Jacobson J.S. et al. (2005) Chemotherapy and cardiotoxicity in older breast cancer patients: a population- based study. J. Clin. Oncol., 23(34): 8597–8605.
13. Drimal J., Zurova-Nedelcevova J., Knezl V. et al. (2006) Cardiovascular toxicity of the first line cancer chemotherapeutic agents: doxorubicin, cyclofosphamide, streptozotocin and bevacizumab. Neur. Endocrinol. Lett., 27(suppl.12): 176–179.
14. Elbl. L., Chaloupka V., Vasova I. et al. (1999) Changes in left ventricular function during chemotherapy with doxorubicin. Vnitr. Lek., 45(7): 395–402.
15. Ewer M.S., Lenihan D.J. (2008) Left ventricular ejection fraction and cardiotoxicity. Ann. Pharmacother., 42: 99–104.
16. Feigenbaum H., Armstrong W.F., Ryan T. (2005) Feigenbaum’s echocardiography, 6th ed. Lippincott Williams & Wilkins. 876 p.
17. Floyd J.D., Nguyen D.T., Lobins R.L. et al. (2005) Cardiotoxicity of cancer therapy. J. Clin. Oncol., 23(30): 7685–7696.
18. Grenier M.A., Lipshultz S.E. (1998) Epidemiology of anthracycline cardiotoxicity in children and adults. Semin. Oncol., 25(4): 72 –85.
19. Jemel A., Siegel R., Xu J. et al. (2010) Cancer statistics. Cancer J. Clin., 60: 277–300.
20. Jensen B.V. (2006) Cardiotoxic consequences of anthracyclinecontaining therapy in patients with breast cancer. Semin. Oncol., 33(3), suppl. 8: 15–21.
21. Jensen B.V., Skovsgaard T., Nielsen S.I. (2002) Functional monitoring of anthracycline cardiotoxicity: a prospective, blinded, long-term observational study of outcome in 120 patients. Ann. Oncol., 13(5): 699–709.
22. Jones R.I., Ewer M.S. (2006) Cardiac and cardiovascular toxicity of nonanthracycline anticancer drugs. Expert. Rev. Antican. Ther., 6(9): 1249–1269.
23. Kapusta L., Thijssen J.M., Groot-Loonen J. et al. (2001) Discriminative ability of conventional echocardiography and tissue Doppler imaiging techniques for the detection of subclinical cardiotoxic effects of treatment with anthracyclines. Ultrasound. Med. Biol., 27: 1605–1614.
24. Lacko A., Wlodarska I., Zimlinski R. et al. (2002) Cardiac toxicity in cancer therapy. Pol. Merkur. Lekarski, 13(73): 79–85.
25. Lester S.J., Tajik A.J., Nishimura R.A. et al. (2008) Unlocking the mysteries of diastolic function: deciphering the Rosetta Stone 10 years later. J. Am. Coll. Cardiol., 51: 679–689.
26. Lipshultz S.E., Lipshitz S.R., Mone S.M. et al. (1995) Femalese and drug dose as risk factors for late cardiotoxic effects of doxorubicin therapy for childhood cancer. N. Engl. J. med., 332(26): 1738–1743.
27. Lipshultz S.E., Colan S.D., Gelver R.D. et al. (1991) Late cardiac effects of doxorubicin therapy for acute lymphoblastic leukemia in childhood. N. Engl. Med., 324(12): 808–815.
28. Lipshultz S.E., Lipshitz S.R., Sallan S.E. et al. (2005) Chronic progressive cardiac dysfunction years after doxorubicin therapy for childhood acute lymphoblastic leukemia. J. Clin. Oncol., 23(12): 2629–2636.
29. Marchandise B., Schroeder E., Bosly A. et al. (1989) Early detection of doxorubicin cardiotoxicity: interet of Doppler echocardiographic analysis of left ventricular filling dynamics. Am. Heart. J., 22(118): 92–98.
30. Nagy A.C., Tolnay E., Nagykalnai T. et al. (2006) Cardiotoxicity of anthracycline in young breast cancer female patients: the possibility of detection of early cardiotoxicity by TDI. Neoplasma, 53: 511–517.
31. National Cancer Institut. (2009) SEER Cancer Statistics Review 1975–2006, Table 1.21 (online).
32. Pai V.B., Nahata M.C. (2000) Cardiotoxicity of chemotherapeutic agents: incidence, treatment and prevention. Drug. Saf., 22(4): 263–302.
33. Perez E.A., Suman V.J., Davidson N.E. et al. (2004) Effects of doxorubicin plus cyclophosphamide on left ventricular ejection fraction in patients with breast cancer in the North Central Cancer Treatment Group. J. Clin. Oncol., 22(18): 3700–3704.
34. Postma A., Bink-Boelkens M. et al. (1996) Late cardiotoxicity after treatment for a malignant bone tumor. Med. Pediatr. Oncol., 26(4): 230–7.
35. Simbre V.C., Duffy S.A., Daldani G.H. et al. (2005) Cardiotoxicity of cancer chemotherapy: implications for children. Paediatr. Drugs., 7(3): 187–202.
36. Sohn D.V., Chai I.H., Lee D.J. et al. (1997) Assessment of mitral annulus velocity by Doppler tissue imaging in the evaluation of left ventricular diastolic function. J. Amm. Coll. Cardiol., 30: 474–480.
37. Suzuki Y.I., Tokuda Y. (2003) Cardiovascular complications in oncology patients. Nippon Rinsho, 61(6): 984–989.
38. Tassan-Mangina S., Codorean D., Metivier M. et al. (2006) Tissue Doppler imaging and conventional echocardiography after anthracycline treatment in adults: early and late alterations of left ventricular function during a prospective study. Eur. J. Echocardiogr.,7: 141–146.
39. Telli M.L., Hunt S.A., Carlson R.W. et al. (2007) Trastuzumab-related cardiotoxicity: calling into question the concept of reversibility. J. Clinic. Oncol., 25: 3525–3533.
40. Tjeerdsma G., Meinardi M.T., van der Graaf W.T. et al. (1999) Early detection of anthracycline induced cardiotoxicity in asymptomatic patients with normal left ventricular systolic function: automatic versus echocardiographic variables. Heart., 81: 419–423.
41. Wang J., Khoury D.S., Thohan V et al. (2007) Global diastolic strain rate for the assessment of left ventricular relaxation and filling pressures. Circulatrion., 115: 1376–1383.
42. Woinivski L., Kulle B., Schirmer M. et al. (2005) NAD (P) H oxidase and multidrug resistance protein genetic polimorphisms are associated with doxorubicin-induced cardiotoxicity. Circulation., 112: 3754–3762.
43. Yeh E.T. (2006) Cardiotoxicity induced by chemotherapy and antibody therapy. Annu. Rev. Med., 57: 485–98.
44. Yeh E.T., Tong A.T., Lenigan D.J. et al. (2004) Cardiovascular complications of cancer therapy: diagnosis, pathogenesis, and management. Circulation., 109(25): 3122–3131.
45. Алан П.Л., Даббінс П.А., Позняк М.А. та ін. (2001) Клінічна доплерівська ультрасонографія. Львів: Медицина світу: 293 с.
46. Кардиоваскулярные побочные эффекты противоопухолевых препаратов. Официальная позиция Ассоциации сердечной недостаточности Европейского общества кардиологов (2012) Здоровье Украины, 1(20).
47. Руководство по химиотерапии опухолевых заболеваний (2005) / Под ред. Н.И. Переводчиковой. Москва, 698 с.
48. Тарасевич Р.А. (2005) Проблема антрациклиновой кардиотоксичности противоопухолевой терапии в детском возрасте. Вопросы гематологии, онкологии и иммунопатологии в педиатрии, 4(1): 58–64.
49. Тимаков А.М. (1994) Поздние кардиотоксические эффекты химиолучевой терапии у детей с гемобластозами и другими злокачественными заболеваниями: автореф. дис. канд. мед. наук. Москва.
50. Хоффер М., Антох Г., Дитц А. и др. (2007) Цветовая дуплексная сонография: метод. реком. Москва, 110 с.
51. Шиллер Н., Осипов А. (2005) Клиническая эхокардиография: Москва, 344 с.
Можливості ехокардіографії в оцінці кардіотоксичності хіміотерапевтичного лікування хворих онкологічного профілю (стан проблеми в літературі, результати власних досліджень)
Резюме. Ретроспективно проаналізовано моніторинг результатів ехокардіографії пацієнтів, що проходили лікування в клініці Національного інституту раку з приводу різних онкологічних захворювань. Ехокардіографію проводили з метою оцінки кардіотоксичного впливу хіміотерапевтичного лікування. Застосування ехокардіографії дозволило виявити ранні, субклінічні прояви кардіотоксичності, що має значення для застосування схем поліхіміотерапії з кардіотоксичною дією.
Ключові слова: кардіотоксичність, поліхіміотерапія, променева терапія, методи діагностики, ехокардіографія.
Echocardiography capability in assessment of chemotherapy’s cardiotoxicity of oncologic patients (literature review, results of own examinations)
Summary. Results of echocardiography monitoring of patients who underwent treatment in National Cancer Institute because of different oncologic diseases were retrospectively analyzed. Echocardiography was performed in order to assess cardiotoxic impact of chemotherapeutic treatment. Usage of echocardiography has let to reveal early, subclinical manifestations of cardiotoxicity, what is important in usage of chemotherapeutic schemes’ with cardiotoxicity.
Key words: cardiotoxicity, polychemotherapy, radiologic treatment, echocardiography, diagnostics’ methods.














Leave a comment