Мониторинг больных после удаления пузырного заноса
Резюме. Рассматривается целесообразность выделения групп риска малигнизации пузырного заноса наряду с контролем уровня хорионического гонадотропина в сыворотке крови при наблюдении больных после удаления пузырного заноса.

Пузырный занос (ПЗ) — наиболее часто встречаемая в клинической практике трофобластическая опухоль, являющаяся результатом патологического оплодотворения [1].
Отсутствие в Украине четкой системы регистрации и мониторинга больных после удаления ПЗ часто приводит к неадекватной химиотерапии в клиниках, не имеющих опыта лечения, с последующими развитием резистентных опухолей и гибелью молодых (потенциально излечимых) женщин.
В последние годы активно дискутируются целесообразность классификации ПЗ как 0 стадии трофобластических опухолей и выделение клинических прогностических факторов агрессивности течения ПЗ наряду с определением уровня хорионического гонадотропина (ХГ) в сыворотке крови [2].
Цель исследования: изучить целесообразность использования клинических прогностических факторов агрессивности течения ПЗ наряду с определением уровня ХГ в сыворотке крови больных после удаления опухоли.
Материалы и методы
Обследованы 172 женщины с ПЗ, которые находились на диспансерном наблюдении в поликлиническом отделении Национального института рака (НИР) с 2003 по 2011 г. Возраст пациенток колебался от 16 до 44 лет и составил в среднем 23,7+3,1 года.
Морфологическое исследование опухоли проводилось в соответствии с гистологической классификацией ВОЗ (2003 г.):
- полный ПЗ 9100/0;
- частичный ПЗ 9103/0;
- инвазивный ПЗ 9100/1;
- метастатический ПЗ 9100/1.
Морфологический код указан в соответствии с Международной классификацией болезней для онкологии; биологическое поведение опухоли закодировано следующим образом: 0 — доброкачественные опухоли; 1 — пограничные опухоли.
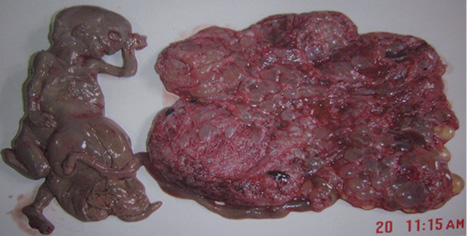
Основной жалобой у женщин данной группы были кровянистые выделения различной интенсивности из половых путей (75,4% случаев), 19,2% женщин отмечали боли внизу живота, 30% больных жалоб не предъявляли. В большинстве случаев (94,8%) диагностирован клинически менее благоприятный полный ПЗ (рис. 1, 2).

В 1 случае (0,6%) методом FISH (fluorescence in situ hybridization) и GTG-окраски диагностирована редкая форма мозаичного ПЗ — фенотипически полный ПЗ (рис. 3).
![Рис. 3. Кариотип: mos47, XXX, +16[80] /46, XX[20]](http://www.clinicaloncology.com.ua/uploads/2012/12/wpid-181_03_fmt.jpeg)
У 3 больных диагностирован метастатический ПЗ (в 2 случаях — депортация ворсин хориона в легкие, у 1 пациентки — во влагалище).
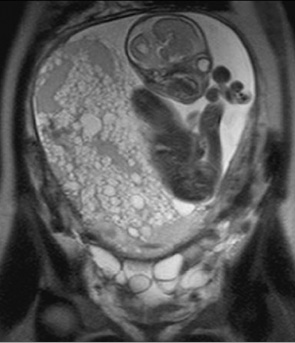
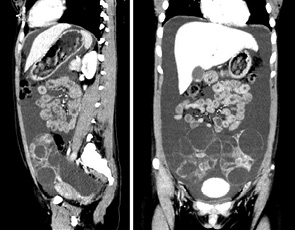
В 5 случаях определялась двойня, состоящая из полного ПЗ и жизнеспособного плода (рис. 4). Патологические беременности диагностированы во время планового ультразвукового исследования в женской консультации. В НИР женщины были направлены для консультации и решения вопроса о дальнейшей тактике лечения. Эпизод кровомазанья отмечался у 1 больной (20%), другие женщины жалоб не предъявляли.
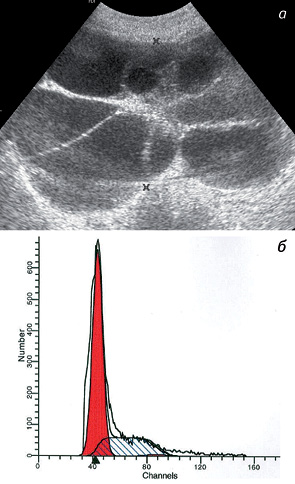
У 107 пациенток (62,2%) c ПЗ диагностированы кисты яичников. В большинстве (64,5%) случаев — односторонние. У 99,1% больных на эхограммах кисты имели вид многокамерных образований от 5 до 11 см в диаметре (рис. 5). Содержимое кист было однородным и анэхогенным; толщина стенок — 1–1,4 мм. Средний размер кист составил 11,2±0,7 см в диаметре. У 1 пациентки (0,9%) выявлены кисты, выполняющие всю брюшную полость (рис. 6).
Высокие дозы ХГ при трофобластической болезни беременности, как правило, приводят только к увеличению яичников с формированием в них множества лютеиновых кист. Повышение сосудистой проницаемости и формирование полисерозитов не характерно [3, 4]. В доступной литературе описаны лишь единичные случаи развития синдрома гиперстимуляции яичников (СГЯ) при ПЗ. Массивная лютеинизация, происходящая в ответ на высокие дозы гонадотропинов, сопровождается интенсивным выбросом провоспалительных вазоактивных медиаторов, которые и приводят к повышению сосудистой проницаемости, формируя клиническую картину СГЯ [5, 6].
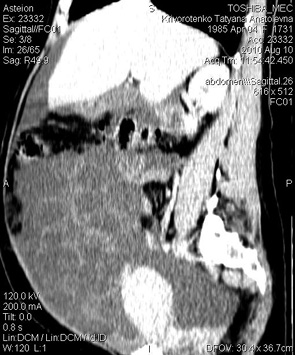
В обследованной группе у 1 больной при полном ПЗ наблюдалась клиника спонтанного СГЯ (нарушений функции щитовидной железы не диагностировано) (рис. 7).
В представленном клиническом случае имел место асцит, манифестация синдрома наблюдалась на 9–10-й неделе беременности. Уровень ХГ в сроке 10 нед беременности в 2 раза превышал нормативные показатели и мог явиться триггером развития СГЯ в спонтанном цикле (согласно данным литературы симптомы спонтанного СГЯ начинают проявляться на 8-й неделе беременности и достигают пика к концу I триместра). Компьютерная томография выполнена на 10-е сутки после эвакуации ПЗ. Клинический исход благоприятный — спонтанная регрессия. Через 6 мес констатирована беременность, протекавшая без осложнений, которая закончилась физиологическими родами.
В соответствии с клиническими прогностическими факторами агрессивности течения ПЗ (табл. 1) обследованные больные разделены на 2 группы: группу высокого риска малигнизации и группу низкого риска малигнизации.
Таблица 1. Прогностические факторы малигнизации
| № п/п | Прогностический фактор | Риск малигнизации | |
|---|---|---|---|
| Низкий | Высокий | ||
| 1. | Уровень ХГ после удаления ПЗ, мМЕ/л | <100 000 | >100 000 |
| 2. | Срок беременности | <16 нед | >16 нед |
| 3. | Размер матки превышает норму в данный срок | – | + |
| 4. | Лютеиновые кисты яичников, см | <6 см | >6 см |
| 5. | Возраст матери, лет | 20–40 | <20; >40 |
| 6. | Трофобластическая болезнь беременности в анамнезе | – | + |
| 7. | Депортация ворсин хориона | – | + |
| 8. | Гипертиреоидизм | – | + |
Диагноз «злокачественная трофобластическая опухоль» (ЗТО) после эвакуации ПЗ устанавливали на основании критериев, принятых FIGO-ВОЗ (2002) (FIGO — Federation of International of Gynecologists and Obstetricians):
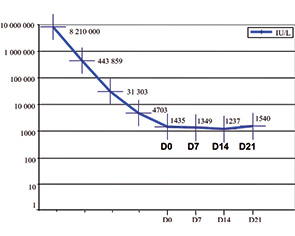
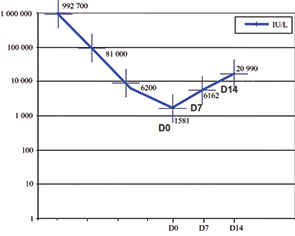
- плато уровень ХГ при четырехкратном исследовании в течение 3 нед (в 1; 7; 14 и 21-й день) после эвакуации ПЗ;
- повышение уровня ХГ на 10% и более при трехкратном исследовании в течение 2 нед (в 1; 7; 14-й день) после эвакуации ПЗ;
- выявление ХГ через 6 мес после эвакуации ПЗ;
- гистологически верифицированная хориокарцинома, инициированная ПЗ (рис. 8, 9).
Результаты и их обсуждение
В обследуемой группе ЗТО, инициированные ПЗ, диагностированы в 15,7% случаев, что не противоречит данным литературы [1, 7–9]. Диагноз установлен на основании критериев, принятых FIGO-ВОЗ. Все больные ЗТО, инициированными ПЗ, отнесены к группе низкого риска развития резистентности к метотрексату (≤6 баллов).
В настоящее время единственный общепринятый маркер агрессивности течения ПЗ — уровень ХГ в сыворотке крови больной после удаления ПЗ. Целесообразность использования клинических прогностических факторов, влияющих на течение заболевания после удаления ПЗ, обсуждается.
Для изучения значимости предлагаемых факторов обследованные пациентки c ПЗ разделены на 2 группы:
- группа низкого риска малигнизации (105 женщин);
- группа высокого риска малигнизации (67 женщин).
Как видно из табл. 2, в большинстве случаев для излечения больных группы низкого риска малигнизации достаточно удалить пузырную ткань из полости матки. Злокачественное течение диагностировано лишь у 2,9% пациенток данной группы, во всех случаях имела место доклиническая форма заболевания (повышение уровня ХГ в сыворотке крови).
Таблица 2. Клинический исход ПЗ низкого риска малигнизации
| Группа низкого риска малигнизации | |||
|---|---|---|---|
| Количество больных | Спонтанная ремиссия | ЗТО, инициированные ПЗ | |
| n=105 | 102 (97,1%) | Доклиническая форма (только ХГ) | Метастатическая форма |
| 3 (2,9%) | – | ||
Вместе с тем у больных группы высокого риска малигнизации (табл. 3) спонтанная ремиссия зарегистрирована лишь у 64,2% женщин. В 35,8% случаев наблюдалось злокачественное течение с развитием доклинической формы заболевания — у 21 (31,3%) больной и метастатической формы — у 3 (4,5%) пациенток. У больных с метастатической формой заболевания метастазы локализовались в легких у 2 женщин, во влагалище — у 1 (все 3 случая — у пациенток подросткового возраста).
Таблица 3. Клинический исход ПЗ высокого риска малигнизации
| Группа высокого риска малигнизации | |||
|---|---|---|---|
| Количество больных | Спонтанная ремиссия | ЗТО, инициированные ПЗ | |
| n=67 | 43 (64,2%) | Доклиническая форма (только ХГ) | Метастатическая форма |
| 21 (31,3%) | 3 (4,5%) | ||
В настоящее время в литературе не прослеживается единого мнения: существуют ли отличия в клиническом течении ПЗ у пациенток подросткового возраста и взрослых женщин. Полученные результаты позволяют согласиться с мнением E.K. Pires и соавторов [10], что в этой группе больных риск медицинских осложнений выше, так как зачастую беременности являются неплановыми. Вместе с тем нет достоверных отличий в количестве ЗТО, инициированных ПЗ, среди подростков и взрослых женщин, что подтверждают данные A. Braga и соавторов [11].
В случае двойни, осложненной ПЗ, при желании женщины и отсутствии аномалий развития плода возможно вынашивание беременности [9, 12] согласно принятому алгоритму (рис. 10). Послед подлежит обязательному гистологическому исследованию. Среди наблюдавшихся в НИР женщин только 1 приняла решение сохранять беременность. На 35-й неделе — физиологические роды; ребенок (женского пола) здоров. После завершения беременности констатирована спонтанная ремиссия, срок наблюдения — 5 лет. У остальных 4 женщин, прервавших двуплодную беременность, осложненную ПЗ, также диагностирована спонтанная ремиссия (сроки наблюдения от 7 мес до 2 лет).
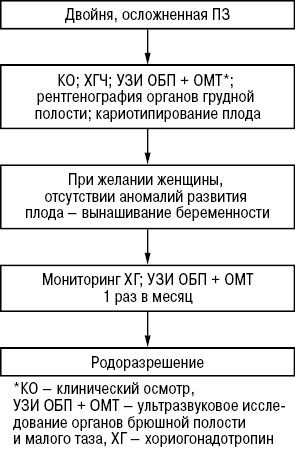
Собственный опыт подтверждает данные литературы последних лет об отсутствии повышенного риска развития ЗТО в этой группе пациенток [9, 12].
Таким образом, основной критерий диагностирования ЗТО, инициированной ПЗ, — уровень ХГ в сыворотке крови. Вместе с тем использование клинических прогностических факторов агрессивности течения ПЗ целесообразно, так как позволяет отдифференцировать больных группы высокого риска малигнизации в 1-е сутки после удаления ПЗ.
Своевременная и точная диагностика ЗТО, инициированных ПЗ, позволяет излечить больных с минимальными экономическими затратами, сохранив абсолютному большинству из них высокое качество жизни и возможность деторождения. Основное условие положительного результата — четкое соблюдение алгоритма обследования и наблюдения больных после удаления ПЗ.
Список использованной литературы
1. Berkowitz R.S., Goldstein D.P. (2009) Clinical practice. Molar pregnancy. N. Engl. J. Med., 360: 1639–1645.
2. Kohorn E. (2011) Problems with the nomenclature, staging and risk factor scoring of gestational trophoblastic disease. CME J. Gynecol. Oncol., 91 p.
3. Suzuki S. (2004) Comparison between spontaneous ovarian hyperstimulation syndrome and hyperreactio luteinalis. Arch. Gynecol. Obstet., 269: 227–229.
4. Haimov-Kochman R., Yanai N., Yagel S. (2004) Spontaneous ovarian hyperstimulation syndrome and hyperreactio luteinalis are entities in continuum. Ultrasound Obstet. Gynecol., 24: 675–678.
5. Avecillas J.F., Falcone T., Arroliga A.C. (2004) Ovarian hyperstimulation syndrome . Crit. Care Clin., 20: 679–695.
6. Назаренко Т.А., Корнеева И.Е., Сароян Т.Т., Веряева Н.А. (2009) Спонтанный синдром гиперстимуляции яичников при одноплодной беременности (описание случая). Проблемы репродукции, 1: 72–75.
7. Soper J., Creasman W.T. (2012) Гестационная трофобластическая болезнь. Клиническая онкогинекология / Под. ред. Ф. Дж. Дисаи, У.Т. Крисмана, перевод с англ. под ред. Е.Г. Новиковой. М.: Практ. мед., 2: 180–221.
8. Berkowitz R.S., Goldstein D.P. (2009) Current management of gestational trophoblastic diseases. Gynecol. Oncol., 112: 654–662.
9. Seckl M.J., Sebire N.J., Berkowitz R.S. (2010) Gestational trophoblastic disease. Lancet, 376: 717–729.
10. Pires E.K., Maesta I., Giraldo H.P. (2011) Gestational trophoblastic disease: still a life threatento teenagers in developing countries. CME J. Gynecol. Oncol., 92.
11. Braga A., Growdon W., Bernstein M. (2011) Is adolescence a risk factor for postmolar gestational trophoblastic neoplasia? CME J. Gynecol. Oncol., 94.
12. Sebire N.J., Foskett M., Paradinas F.J. et al. (2002) Outcome of twin pregnancies with complete hydatidiform mole and healthy co-twin. Lancet, 359: 2165–2166.
Моніторинг хворих після видалення міхурового заносу
Резюме. Розглядається доцільність виділення груп ризику малігнізації міхурового заносу поряд з контролем рівня хоріонічного гонадотропіну в сироватці крові при спостереженні за хворими після видалення міхурового заносу.
Ключові слова: міхуровий занос, групи ризику малігнізації, злоякісні трофобластичні пухлини.
Monitoring of patients after hydatidiform mole evacuation
Summary. We consider the feasibility of using hydatidiform mole risk group of malignization along with level of hCG in observation after molar evacuation.
Key words: hydatidiform mole, risk group of malignization, malignant trophoblastic tumours.














Leave a comment