Результаты комплексного лечения больных раком грудной железы в возрасте более 70 лет с метастазами в регионарных лимфатических узлах
Чешук В.Е.1, Зайчук В.В. 1, Клюсов А.Н. 2, Сидорчук О.И.1, Мотузюк И.Н.1, Щепотин И.Б.3
- 1Національний медичний університет ім. О.О. Богомольца, Київ
- 2Київський міський клінічний онкологічний центр, Київ
- 3Національний інститут раку, Київ
Резюме. Авторы провели ретроспективное сравнение разных видов специального лечения больных раком грудной железы с Т2N1М0 стадией в возрасте более 70 лет. 293 больных были разделены на 4 группы. В первой группе после хирургического лечения проводили только гормонотерапию, во второй — гормонотерапию и химиотерапию в послеоперационный период, в третьей группе после операции применяли лишь лучевую терапию и гормонотерапию, а в четвертой группе лечение включало все четыре метода терапии. По результатам сравнения 5-летней виживаемости больных раком грудной железы в возрасте более 70 лет выявили тенденцию к ее увеличению у пациентов четвертой группы, что свидетельствует о целесообразности проведения комплексного лечения.

Рак грудной железы занимает одно из лидирующих мест в структуре заболеваемости злокачественными новообразованиями женского населения практически во всех странах мира. Для этой патологии характерны 2 пика: пременопаузальный — у пациенток в возрасте 40–45 лет, постменопаузальный — после 55 лет. Считают, что риск развития рака грудной железы после 65 лет превышает таковой в возрасте 30 лет в 150 раз [1–4].
Однако до настоящего времени отсутствует единая общепринятая точка зрения относительно клинико-биологических особенностей и прогноза течения рака грудной железы, а также лечебной тактики у пациенток разных возрастных групп. В частности, существующие стандарты адъювантной химиотерапии (ХТ) у пациенток в возрасте более 70 лет, имеющих рак грудной железы c метастазами в лимфатических узлах, подразумевают необходимость ее применения в условиях индивидуализированного одхода [5–8]. Речь идет о том, что при наличии метастазов в аксилярных лимфатических узлах необходима послеоперационная терапия: адъювантная ХТ, лучевая (ЛТ) или химиолучевая (ХЛТ), — однако ее побочные эффекты могут в значительной мере ограничивать возможность проведения, а в некоторых случаях быть фатальными для пациенток, у которых присутствует выраженная сопутствующая патология.
По сути, задачей индивидуализированного подхода является идентификация пациенток с противопоказаниями для назначения адъювантного лечения. Кроме этого, индивидуализированный подход учитывает рецепторный статус опухоли (люминальный, базальный, и HER-2/neu-положительный типы) для выбора варианта адъювантной ХТ, гормонотерапии (ГТ) и подключения таргетной терапии [9, 10].
Наличие метастазов в подмышечных лимфатических узлах является наиболее неблагоприятным прогностическим фактором риска развития рецидивов и метастазов, и необходимость ХЛТ в этой группе пациенток доказана результатами многочисленных рандомизированных исследований [11–13]. Однако выраженная сопутствующая патология и осложнения ХЛТ у пациенток пожилого возраста в ряде случаев затрудняют ее проведение. Как известно, ЛТ может сопровождаться развитием лучевого перикардита (до 29,3%), пневмонита (9,6%) и пневмофиброзов (70,0%), когда в поле облучения частично или полностью попадает сердце и/или легочная ткань, что, в свою очередь, может привести к нежелательным исходам проводимого лечения.
Что касается химиопрепаратов, то, обладая кардио-, гепато-, нейро-, а также миелотоксичностью (фактор риска III–IV степени — возраст более 60 лет), они также могут вызывать фатальные осложнения [14].
Следует отметить, что возрастные классификации, приводимые в разных научных публикациях, варьируют. Согласно градации Европейского регионарного бюро Всемирной организации здравоохранения (Киев, 1963 г.), пожилой возраст — 60–74 года, старческий — 75–89 лет, 90 лет и старше — долгожители. В клинической онкологии к категории лиц пожилого возраста относят пациентов, которым исполнилось 70 и более лет. В целом считают, что понятия пожилой, старческий возраст должны базироваться скорее на физиологическом состоянии организма, чем на хронологических данных [15]. В последних стандартах NCCN (National Comprehensive Cancer Network), ESMO (European Society for Medical Oncology) нет указания на возрастные ограничения проведения адъювантной ХТ, хотя их предыдущие версии отмечали необходимость ограниченного назначения ХТ у пациенток пожилого возраста (старше 70 лет).
В большинстве исследований метастазы рака грудной железы в регионарных лимфатических узлах чаще выявляли у пациенток пожилого возраста [2, 3, 16], хотя есть сообщения и о том, что количества больных этой патологией с регионарными метастазами практически одинаковы в возрасте до и после 67 лет [17]. Добавим также, что удельный вес впервые выявленных пациенток с местно-распространенным раком грудной железы (включая стадию ІІБ Т2N1M0) составляет 22–28% в Украине и 25–30% в России [18, 19]
Конечно, возраст в каждом конкретном случае имеет относительное значение, определяющим фактором является риск развития сердечно-сосудистых осложнений, нарушения мозгового кровообращения, тромбоэмболических осложнений, нарушения функции печени и почек. Известно, что нужно стремиться к «золотой середине», то есть достижению максимального лечебного эффекта при минимуме осложнений.
Учитывая изложенное, цель нашей работы — определение эффективности адъювантной химио- и лучевой терапии путем сравнительного ретроспективного исследования результатов лечения больных раком грудной железы стадии ІІБ (Т2N1M0) в возрасте более 70 лет с и без адъювантной ХТ, АЛТ, АХЛТ.
Объект и методы исследования
По материалам статистического отдела Киевского городского клинического онкологического центра за период с 2001 по 2010 г. мы провели анализ результатов лечения 293 пациенток старше 70 лет с раком грудной железы в стадии ІІБ (Т2N1M0), из них в возрасте 70–74 лет было 162 (55,3%), 75–79 — 84 (28,78%), 80–85 — 47 (16,0%). Всем пациенткам проведено хирургическое лечение, включавшее стандартные методы оперативных вмешательств: секторальную резекцию грудной железы с подмышечной лимфаденэктомией, мастэктомию. Распределение по виду оперативного вмешательства не принималось во внимание, так как во всех случаях операция проведена в радикальном объеме.
Учитывая, что одним из существенных независимых прогностических признаков рака грудной железы, определяющих лечебную тактику, является экспрессия рецепторов стероидных гормонов, в частности эстрогеновых рецепторов, критериями включения в проведенный анализ было наличие этих рецепторов в клетках опухоли. Соответственно, всем пациенткам проводили адъювантную ГТ тамоксифеном (20 мг/сут) в течение 5 лет. Адъювантную ХТ проводили по схемам CMF, AC, FAC; ЛТ — по стандартным послеоперационным методикам.
Пациентки были распределены на четыре группы. Первую группу (1) составили больные, которым провели хирургическое лечение (Х+ГТ), воздержавшись от назначения ЛТ и ХТ из-за сопутствующей патологии. Данная группа насчитывала 41 пациентку: в возрасте 70–74 лет — 11, 75–79 лет — 7, 80–85 лет — 23.
Во вторую группу (2) вошли пациентки, которым хирургическое лечение комбинировали с адъювантной ХТ (Х+ХТ+ГТ). ЛТ не назначали из-за локализации опухоли в левой грудной железе на фоне выраженной сопутствующей сердечно-сосудистой патологиии. В этой группе было 12 больных: в возрасте 70–74 лет — 3, 75–79 лет — 3, 80–85 лет — 6.
В третьей группе (3) были пациентки, которым провели хирургическое лечение с послеоперационной ЛТ (Х+ЛТ+ГТ). В этой группе применение ХТ было нежелательным из-за наличия у больных сахарного диабета, хронического нарушения мозгового кровообращения, хронических заболеваний сердечно-сосудистой системы, печени и почек в стадии субкомпенсации. Всего в этой группе было 129 больных: в возрасте 70–74 лет — 58, 75–79 лет — 58, 80–85 лет — 13.
Четвертую группу (4) формировали пациентки, которым, несмотря на возраст, были проведены все виды лечения в соответствии со стандартами (Х+ХТ+ЛТ+ГТ). В этой группе было 111 больных: в возрасте 70–74 лет — 90, 75–79 лет — 16, 80–85 лет — 5. Распределение пациенток по возрасту и методам лечения представлено в табл. 1.
Таблица 1. Распределение больных раком грудной железы по возрасту и методам лечения
| Возраст (годы) | Методы лечения | ||||
|---|---|---|---|---|---|
| Х + ГТ | Х + ХТ + ГТ | Х + ЛТ + ГТ | Х + ХТ + ЛТ + ГТ | Всего | |
| 70–74 | 11 | 3 | 58 | 90 | 162 |
| 75–79 | 7 | 3 | 58 | 16 | 84 |
| 80–85 | 23 | 6 | 13 | 5 | 47 |
| Всего | 41 | 12 | 129 | 111 | 293 |
Оценивали общую 5-летнюю выживаемость в каждой группе, независимо от причин смерти; дополнительно дифференцировали летальность от прогрессирования рака грудной железы и иных (сопутствующих) заболеваний.
Математическую обработку проводили методами описательной статистики, используя критерий c2 Пирсона с поправкой Йейтса, а также использовали методику Бонферрони для определения уровня значимости различий (р) при множественных сравнениях [20].
Результаты
Сравнительные результаты лечения пациенток представлены в табл. 2 и 3. Наибольшая 5-летняя выживаемость (56,76%) отмечена в группе 4, где использовали весь комплекс специальных методов лечения, наименьшая — в группе 2 (50,00%). Однако различия между группами были статистически недостоверными (см. табл. 3).
Таблица 2. Анализ 5-летней выживаемости пациенток в зависимости от вида лечения
| Категория | Х+ГТ | Х+ХТ+ГТ | Х+ЛТ+ГТ | Х+ХТ+ЛТ+ГТ | ||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| Живы 10 лет | 22 | 53,66 | 6 | 50,00 | 71 | 55,04 | 63 | 56,76 |
| Умерли | 19 | 46,34 | 6 | 50,00 | 58 | 44,96 | 48 | 43,24 |
| Всего | 41 | 100 | 12 | 100 | 129 | 100 | 111 | 100 |
Таблица 3. Результаты попарного сравнения групп пациенток по видам лечения с использованием критерия c2 Пирсона c поправкой Йейтса
| Види лечения, которые сравниваются | χ2 Пирсона с поправкой Йейтса | р | |
|---|---|---|---|
| Х +ГТ | Х + ХТ + ГТ | 0,011 | 0,916 |
| Х + ЛТ + ГТ | 0,010 | 0,980 | |
| Х + ХТ + ЛТ + ГТ | 0,025 | 0,875 | |
| Х +ХТ + ГТ | Х + ЛТ + ГТ | 0,001 | 0,974 |
| Х + ХТ + ЛТ + ГТ | 0,020 | 0,877 | |
| Х + ЛТ + ГТ | Х + ХТ + ЛТ + ГТ | 0,019 | 0,891 |
При рассмотрении причины смерти (табл. 4) — от продолжения болезни или неонкологических причин (например сердечно-сосудистых заболеваний) — выявлено, что во всех группах, независимо от проведенного лечения, онкологическая смертность превышала таковую от других причин (в группе 1 — в 1,2 раза, 2 — в 5 раз, 3 — в 2,9 раза, в 4 — в 3 раза). Общая и онкологическая смертности были наиболее высокими в группе 2 (соответственно 50,00 и 41,67%). Смертность от сопутствующей патологии была наиболее очевидна в группе 1 (17,07%), где применяли только хирургическое лечение; объяснением этому может являться тот факт, что в группу 1 уже исходно распределялись пациентки с сильно выраженной сопутствующей патологией. Следует отметить, что отличия между группами проявлялись лишь на уровне тенденции (при всех вариантах сравнения р>0,05).
Таблица 4. Анализ летальности пациенток в течение наблюдения в зависимости от вида лечения и причин смерти
| Категория | Х+ГТ | Х+ХТ+ГТ | Х+ЛТ+ГТ | Х+ХТ+ЛТ+ГТ | ||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| Умерли от прогрессирования РГЖ | 12 | 29,27 | 5 | 41,67 | 43 | 33,33 | 36 | 32,43 |
| Умерли от других причин | 7 | 17,07 | 1 | 8,33 | 15 | 11,63 | 12 | 10,81 |
| Всего | 19 | 46,34 | 6 | 50,00 | 58 | 44,96 | 48 | 43,24 |
Учитывая данные литературы [2–4] различной выживаемости пожилых пациенток с раком грудной железы І–ІІІ стадии в зависимости от возраста (70–74 года, 75 и старше), мы провели дополнительный анализ общей пятилетней выживаемости и смертности от разных причин в возрастных подгруппах 70–74, 75–79 и 80–85 лет.
Как видно из табл. 5, в целом наблюдалась тенденция к снижению выживаемости с увеличением возраста: 70–74 года — 56,8%, 75–79 лет — 55,9%, 80–85 лет — 48,9%. Более низкая выживаемость при проведении лечения по схемам Х+ГТ, Х+ХТ+ГТ, Х+ ЛТ+ГТ отмечена в подгруппе пациенток в возрасте 80–85 лет. В то же время при проведении комплексного лечения Х+ХТ+ЛТ+ГТ подобная зависимость не выявлена (в подгруппе 80–85 лет выживаемость 60,0% против 57,3 и 56,2% в подгруппах 70–74 и 75–79 лет).
Таблица 5. Анализ общей 5-летней выживаемости пациенток в зависимости от вида лечения и возраста
| Возраст (лет) | Х+ГТ | Х+ХТ+ГТ | Х+ЛТ+ГТ | Х+ХТ+ЛТ+ГТ | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | |
| 70–74 | 6 | 54,5 | 2 | 66,6 | 33 | 56,9 | 51 | 57,3 | 92 | 56,8 |
| 75–79 | 4 | 57,1 | 2 | 66,6 | 32 | 55,1 | 9 | 56,2 | 47 | 55,9 |
| 80–85 | 12 | 52,2 | 2 | 33,3 | 6 | 46,2 | 3 | 60,0 | 23 | 48,9 |
| Всего | 22 | 53,7 | 6 | 50,0 | 71 | 55,0 | 63 | 56,8 | 162 | 55,33 |
Анализ летальности пациенток разных возрастных подгрупп, получавших различные виды лечения, в зависимости от причин смерти (рис. 1–3) показал, что соотношение частоты случав смерти от прогрессирования рака грудной железы и других причин зависело скорее от возраста и наличия выраженной сопутствующей патологии, чем от проведенного лечения. Это соответствует приведенным выше результатам (см. табл. 4), полученным при анализе данных всей когорты пациенток, включенных в исследование.
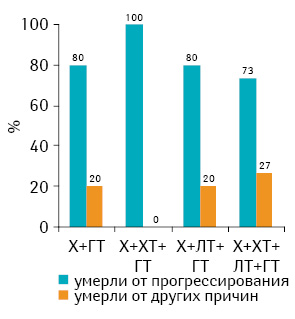
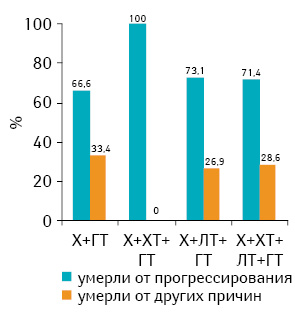
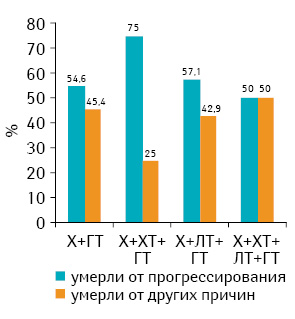
Выводы
1. Отмечена тенденция к увеличению 5-летней выживаемости пациенток в возрасте 70 лет и старше с раком грудной железы стадии ІІБ (Т2N1M0) при использовании всего комплекса специальных методов лечения — хирургии, лучевой, ХТ и ГТ.
2. Пожилой возраст не является помехой для проведения комплексного лечения при раке грудной железы, ограничивать применение ХЛТ может наличие выраженной сопутствующей патологии.
Список использованной литературы
1. Имянитов Е.Н., Хансон К.П. (2007) Молекулярная онкология: клинические аспекты. С-Пб: ИД СПбМАПО, 212.
2. Gennari R., Curigliano G., Rotmensz N. (2004) Breast carcinoma in elderly women: features of disease presentation, choice of local and systemic treatments compared with younger postmenopausal patients. Cancer; 101(6): 1302–10.
3. Karanikolic A., Djordjevic N., Pesic M. (2004) Breast cancer in elderly women. Arch. Gerontol. Geriatr., 39(3): 291–9.
4. Franceschi S., La Vecchia C. (2001) Cancer epidemiology in the elderly. Crit. Rev. Oncol. Hematol., 39(3): 219–26.
5. Goldhirsch A., Ingle J.N., Gelber R.D. et al. (2009) Thresholds for therapies: highlights of the St Gallen International Expert Consensus on the primary therapy of early breast cancer. Ann. Oncol., 20: 1319–29.
6. Goldhirsch A., Ingle J.N., Gelber R.D. et al. (2009) Thresholds for therapies: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer. Ann. Oncol. (doi:10.1093/annonc/mdp322).
7. Aebi S., Davidson T., Gruber G., Cardoso F. (2011) Primary breast cancer: ESMO Clinical Practice. Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 22 (Suppl. 6): vi12–vi24 (10.1093/annonc/ mdr371).
8. Brest Cancer (2012) NCCN Clinical Practice Guidelines in Oncology, Version 1.
9. Oakman C., Santarpia L., Di Leo A. (2010) Breast assessment tools and optimizing adjuvant therapy. Nat. Rev. Clin. Oncol., 7: 725–32.
10. Berry D.A., Cirrincione C., Henderson I.C. et al. (2006) Estrogen-receptor status and outcomes of modern chemotherapy for patients with node-positive breast cancer. JAMA, 295: 1658–67.
11. Mook S., Schmidt M.K., Viale G. et al. (2009). The 70-gene prognosis-signature predicts disease outcome in breast cancer patients with 1–3 positive lymph nodes in an independent validation study. Breast Cancer Res. Treat., 116: 295–302.
12. Saghatchian M., Mook S., Pruneri G. et al. (2009) Combining genomic profiling (70 Gene-Mammaprint) with nodal status allows to classify patients with primary breast cancer and positive lymph nodes (1–9) into very distinct prognostic subgroups that could help tailor treatment strategies. Cancer Res., 69 (Suppl. 3): 102.
13. Bedard Ph.L., Cardoso F. (2011) Can Some Patients Avoid Adjuvant Chemotherapy for Early-stage Breast Cancer? Nat. Rev. Clin. Onc., 8(5).
14. Терапевтическая радиология. (2010) Под ред. А.Ф. Цыба, Ю.С. Мардынского. М.: Медицинская книга, 552.
15. Balducci L. (2001) The geriatric cancer patients: equal benefit from equal treatment. Cancer control, (8): 27–8.
16. Pappo I., Karni T., Sandbank J. et al. (2011) Breast cancer in elderly: histological, hormonal and surgical characteristics. Oncologist, 16(1): 61–70.
17. Kaunitz A.M. (1991) Breast cancer after age 80: diagnosis, treatment and outcomes. Int. J. Breast cancer, 20: 151–6.
18. Лігірда О.Ф., Галахін К.О., Смоланка І.І. та ін. (2007) Модифікована хіміотерапія хворих на місцево-поширений рак грудної залози. Онкология, 9 (3): 208–16.
19. Летягин В.П. (2004) Первичные опухоли грудной железы. Практическое руководство по лечению. Москва: Миклош, 331.
20. Лапач С.Н., Чубенко А.В., Бабич П.Н. (2002) Статистика в науке и бизнесе. К.: МОРИОН, 195–207.
Результати комплексного лікування хворих на рак грудної залози віком понад 70 років з метастазами в регіонарних лімфатичних вузлах
Резюме. Автори провели ретроспективне порівняння різних видів спеціального лікування хворих на рак грудної залози з Т2N1М0 стадією віком понад 70 років. 293 хворих розподілили на 4 групи. У першій групі після хірургічного лікування проводили лише гормонотерапію, у другій групі — гормонотерапію та хіміотерапію в післяопераційний період, в третій групі після операції застосовували лише променеву терапію та гормонотерапію, а в четвертій групі лікування включало всі чотири методи терапії. За результатами порівняння 5-річної виживаності хворих на рак грудної залози віком понад 70 років виявили тенденцію до її збільшення у пацієнтів четвертої групи, що свідчить про необхідність проведення комплексного лікування.
Ключові слова: рак грудної залози, метастази в регіонарних лімфатичних вузлах, хворі на РГЗ віком понад 70 років, хіміотерапія, променева терапія, супутні захворювання.
The results of combine treatment breast cancer patients in the age more then 70 years with metastases in regional lymph nodes
Summary. Authors conducted retrospective comparison of different types of the special medical treatment of breast cancer patients with the T2N1M0 stage in age more than 70 years. 293 patients were parted on 4 groups. In the first group after surgical medical treatment hormonotherapy was conducted only, in the second group after operative treatment, hormonotherapy and chemotherapy, in a postoperative period were conducted, in the third group after the operation applied only radiotherapy and hormonotherapy, and in a fourth group medical treatment included all four methods of therapy. On results the comparison of five-years survival of breast cancer patients in age more than 70 years exposed a tendency to its increase at the patients of fourth group, that testifies the necessity of conducting of complex medical treatment.
Key words: breast cancer, metastases in regional lymphatic nodes, BC patients in the age more than 70 years, chemotherapy, radiotherapy, concomitant diseases.














Leave a comment