Влияние криодеструкции, локальной СВЧ-гипертермии и их комбинации на показатели иммунной системы у мышей с саркомой 37
Самедов В.Х. 1, Захаричев В.Д.1, Кузьменко А.П.2, Диденко Г.В. 2
- 1Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
- 2Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
Резюме. Установлено, что после проведенной криодеструкции или комбинации ее с локальной СВЧ-гипертермией экспериментальной модели опухоли саркомы 37 проявляется повышение как прямой, так и антителозависимой цитотоксичности лимфоцитов, но не перитонеальных макрофагов у животных. Эти изменения особенно выражены в ранний период (4-е сутки после криовоздействия). Стимуляция клеточного и гуморального звеньев иммунной системы в ответ на проведенную криодеструкцию или комбинацию ее с локальной гипертермией может усиливать противоопухолевую резистентность организма, по-видимому, за счет продуктов крионекроза опухолевых клеток, поступающих в общий кровоток.

Введение
Одной из важных задач современной медицины является повышение эффективности широко используемых и поиск новых методов лечения злокачественных заболеваний, так как традиционные виды (хирургический, лучевой, химиотерапевтический и их комбинации) не всегда достаточно эффективны.
В настоящее время в лечении злокачественных новообразований, в частности рака кожи, губы, полости рта и языка, используют различные методы в зависимости от размеров и локализации опухоли. Широко применяется близкофокусная рентгенотерапия (фракционное облучение), локальная криодеструкция (КД) и гипертермия (ГТ). Криогенный метод показал свою высокую эффективность при лечении целого ряда доброкачественных и злокачественных опухолей кожи и слизистых оболочек [1], головного мозга [2], паренхиматозных органов [3] и др.
Однако проведение низкотемпературной деструкции опухолей большого размера не всегда является радикальным [4]. Причина неудач, как правило, состоит в недостаточно полном разрушении всех опухолевых клеток, находящихся в области воздействия [5, 6]. Это побудило к дальнейшему поиску путей совершенствования криогенного метода лечения, направленных на повышение степени деструкции злокачественных клеток.
Одним из способов улучшения эффективности криогенного метода является его комбинированное применение с локальной СВЧ-ГТ (СВЧ — сверхвысокочастотный). Такое сочетание двух физических факторов позволяет значительно увеличить степень деструкции первичного очага, снизить частоту рецидивирования и тем самим повысить радикальность лечения [7]. Известно, что система иммунитета оказывает значительное влияние на течение опухолевого процесса [8, 9]. Низко- и высокотемпературные воздействия на опухолевый очаг также сопровождаются изменениями реактивности иммунной системы [10–13]. Однако влияние комбинированного криогенного воздействия с последующей ГТ опухоли на показатели иммунитета практически не изучено.
Поэтому целью настоящих исследований явилось изучение комбинированного влияния КД и локальной СВЧ-ГТ на некоторые показатели клеточного и гуморального иммунитета в эксперименте.
Материалы и методы исследований
Исследования проведены на 40 мышах линии BALB/c массой тела 25–30 г, полученных из вивария Киевского государственного университета им. Т.Г. Шевченко. Содержание животных и работа с ними осуществлялись согласно Международным правилам проведения работ с экспериментальными животными. В качестве модели опухолевого роста использовали солидную форму саркомы 37. Трансплантацию опухолевых клеток проводили в количестве 106 клеток на животное по стандартной методике в объеме 0,2 мл изотонического раствора NaCl под кожу наружной поверхности нижней трети голени. На 14-е сутки после трансплантации (средний размер опухоли составлял 0,9±0,3 см в диаметре) животных распределяли на группы по 10 мышей. Первая группа — контроль опухолевого роста (контроль); вторая — опухоли животных подвергали локальной СВЧ-ГТ; третья — проводили КД опухоли; четвертую группу составили животные, опухоли которых подвергали КД с последующей (через 24 ч) локальной СВЧ-ГТ (КД+ГТ).
Криогенное воздействие осуществляли с помощью аппликатора «Криотон-3» (Украина) с температурой на поверхности аппликатора -160 °C. Температурный контроль в цикле замораживания-оттаивания проводили с помощью медь-константановых термопар в инъекционных иглах (термодатчики), введенных на границу нормальной и опухолевой ткани. Регистрацию показаний термопар осуществляли потенциометром КСП-4 и коммутатором Ф-240. Процесс замораживания-оттаивания опухолей прекращали по достижении на термодатчиках температур -10 – -15 °С. Использование таких температур обусловлено тем, что при более низких температурах (-20–-30 °С), особенно у мышей, во многих случаях наблюдался некроз всей конечности с последующим (через 3–5 сут) ее отторжением. Продолжительность КД составляла от 1 до 3,5 мин, в зависимости от размеров опухоли. Замораживание проводили однократно с последующим естественным оттаиванием ткани.
Гипертермию осуществляли с применением СВЧ-генератора «Ромашка» (Россия). Выходная мощность излучения на антенне составляла 10 Вт при частоте 460 МГц. Температура нагрева конечности с опухолью составляла 42–43 °С. Регистрацию температуры осуществляли при отключенном СВЧ-генераторе, для того чтобы избежать влияния СВЧ-поля на термодатчики. Экспозиция локальной СВЧ-ГТ зависела от размера опухоли и продолжалась 15–30 мин.
Через 4 и 14 сут после КД, ГТ или их комбинации проводили умерщвление животных методом эвтаназии согласно нормам, установленным законом Украины № 3447-1V «Про захист тварин від жорстокого поводження», для дальнейших иммунологических исследований. Такие временные интервалы выбраны с учетом формирования и резорбции коагуляционного крионекроза [6]. Все виды действий испоняли под этаминал-натриевым наркозом (40 мг/кг внутрибрюшинно).
Для иммунологического исследования лимфоциты получали методом градиентного центрифугирования суспензии клеток селезенки на фиколл-верографине (d=1,077 г/см3), а макрофаги перитонеального экссудата получали у мышей без предварительного стимулирования [14, 15]. Количество жизнеспособных эффекторных клеток (лимфоциты или макрофаги) подсчитывали в гемоцитометре с использованием окрашивания 0,4% раствором трипанового синего. Количество живых клеток после выделения составляло не менее 95%. Выделенные эффекторные клетки и клетки-мишени (клетки саркомы 37) ресуспендировали в среде RPMI-1640 без красителя с добавлением 10% эмбриональной телячьей сыворотки и 40 мкг/мл гентамицина.
Цитотоксическую активность лимфоцитов, макрофагов, а также антителозависимую цитотоксичность лимфоцитов и макрофагов оценивали в МТТ-тесте с определением цитотоксического индекса (ЦИ) [16]. Соотношение эффекторных клеток и клеток мишени составляло 5:1. Инкубацию проводили в СО2 инкубаторе при температуре 37 °С на протяжении 24 ч. По окончании времени инкубации в исследуемые пробы вносили МТТ и инкубировали с красителем на протяжении 4 ч. ЦИ лимфоцитов и макрофагов рассчитывали по формуле:
ОГе + ОГм + ОГе+м
ЦИ = ———————————×100%, где
ОГе + ОГм
ЦИ — цитотоксический индекс;
ОГе— оптическая плотность в пробах с лимфоцитами/макрофагами;
ОГм — оптическая плотность в пробах с клетками-мишенями;
ОГе+м — оптическая плотность в исследовательских сериях.
Величину оптического поглощения раствора измеряли с помощью микроплейтфотометра «Лаботек» (Латвия) при длине волны 545 и 630 нм. Результаты экспериментальных исследований обрабатывали с использованием пакетов компьютерных программ Origin 7.5 та Statistica 6.0 (критерии Стьюдента — Фишера и χ2 ) [17].
Результаты и их обсуждение
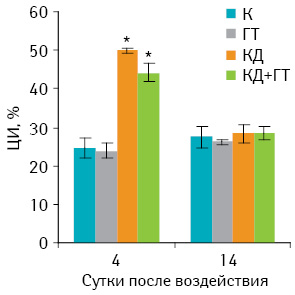
Результаты проведенных исследований показали, что комбинированное применение КД+ГТ или использование КД у мышей с саркомой 37 сопровождается значительным (р<0,05) повышением ЦИ лимфоцитов на 4-е сутки после воздействия по сравнению с другими группами (рис. 1). После воздействия ГТ на опухоль показатель ЦИ лимфоцитов в этот период наблюдений практически не отличался от такового в контрольной группе животных. Однако к 14-м суткам после воздействий наблюдалось значительное снижение ЦИ у животных, опухоли которых были подвергнуты одной КД или КД+ГТ, по сравнению с этими показателями на 4-е сутки. На 14-е сутки у животных всех опытных групп ЦИ практически не отличался от контроля.
Таким образом, не только самостоятельное применение КД опухоли, но и использование данного метода с локальной ГТ существенно повышает цитотоксическую активность лимфоцитов, особенно на ранних сроках наблюдения (4-е сутки после деструкции опухоли), по сравнению с контролем или ГТ. В более поздние периоды наблюдения (14-е сутки) эффект стимуляции цитотоксической активности лимфоцитов после низкотемпературных воздействий практически нивелируется.
На рис. 2 представлены результаты влияния изучаемых методов на антителозависимую цитотоксичность лимфоцитов мышей с саркомой 37. На 4-е сутки значительное повышение ЦИ (р<0,05) наблюдали в группе животных, получавших КД либо КД+ГТ. Этот показатель у животных после КД или КД+ГТ составлял 53,0±3,8 и 61,0±0,7% соответственно против 28,4±0,5% в группе контрольных животных (р<0,05).
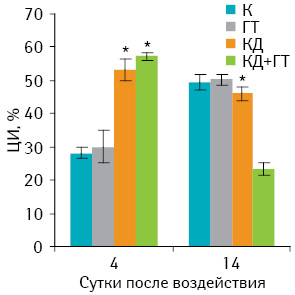
На 14-е сутки отмечали повышение ЦИ во всех опытных и контрольных группах животных до одинаковых значений и лишь у животных, получавших КД+ГТ, этот показатель снижался до 20,4±2,0% против 50,8±2,2% в контроле (р<0,05). Значительное повышение антителозависимой цитотоксичности лимфоцитов у животных после КД опухоли или в комбинации с локальной СВЧ-ГТ (КД+ГТ) в ранние сроки наблюдения (4-е сутки) может свидетельствовать о стимуляции гуморального звена иммунитета по сравнению с контрольными животными или мышами после ГТ. На более поздних этапах наблюдения (14-е сутки) во всех группах отмечалось увеличение ЦИ по сравнению с ранними сроками (4-е сутки), и только в группе животных с КД+ГТ опухоли наблюдалось существенное снижение этого показателя.
Результаты влияния КД, ГТ и их комбинации у мышей с саркомой 37 на цитотоксическую активность макрофагов представлены на рис. 3. В ранние сроки наблюдений (4-е сутки после воздействия) ЦИ во всех группах животных существенно не отличался.
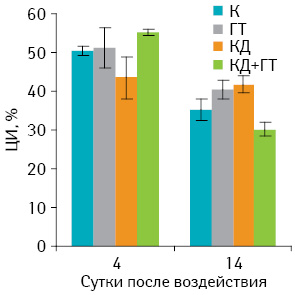
В более поздние сроки (14-е сутки) у контрольных и подопытных животных отмечалась тенденция к снижению ЦИ по сравнению с ранними сроками, независимо от типа исследуемых факторов воздействия.
Исходя из этих данных, можно предположить, что исследуемые воздействия не вносят существенного вклада в цитотокситескую активность перитонеальных макрофагов.
На рис. 4 представлены результаты исследования влияния комбинированного применения КД+ГТ или их раздельного использования у животных с саркомой 37 на показатели антителозависимой цитотоксичности макрофагов в ранние (4-е сутки после воздействия) и более поздние сроки (14-е сутки после воздействия).
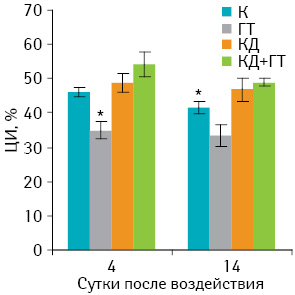
Установлено, что только в группе животных, получавших ГТ, ЦИ на 4-е и 14-е сутки составлял 35,3±2,4 и 33,8±2,2%, то есть был значительно ниже (р<0,05), чем в других опытных и контрольной группах. Вместе с тем отмечается тенденция к снижению антителозависимой цитотоксичности макрофагов в более поздний период наблюдений в остальных группах животных. Столь специфическое угнетение этого показателя в ответ на СВЧ-ГТ пока объяснить мы не можем.
Таким образом, полученные результаты могут свидетельствовать о том, что самостоятельное использование КД или в комбинации с ГТ не вызывает угнетения клеточноопосредованных и гуморальных иммунных реакций у мышей с перевивной саркомой 37. Возникновение и последующая постепенная резорбция крионекроза способны увеличивать не только цитотоксическую активность, но и антителозависимую цитотоксичность лимфоцитов, особенно в ранние сроки после деструкции опухоли, что может свидетельствовать о стимуляции как клеточных, так и гуморальных реакций иммунной системы.
Полученные нами данные согласуются с результатами и других авторов [10, 12, 13], которые указывали на возможность стимуляции крионекрозом клеточного и гуморального звена иммунной системы с их участием в реализации противоопухолевого эффекта криохирургии. В тоже время низкотемпературная деструкция опухоли, по результатам наших исследований, существенно не влияла на цитотоксическую активность перитонеальных макрофагов.
Выводы
1. Комбинированное применение КД опухоли с последующей локальной ГТ существенно увеличивает как клеточное, так и гуморальное звено иммунитета в результате стимуляции прямой и антителозависимой цитотоксичности лимфоцитов в ранние сроки (4-е сутки) после воздействия на опухоль. Этот эффект, вероятно, связан с выходом в систему циркуляции клеточного детрита биологически активных факторов и антигенного материала из разрушенной низкими температурами опухолевой ткани.
2. Существенного влияния исследуемых методов воздействия на прямую или антителозависимую цитотоксичность перитонеальных макрофагов животных не установлено.
3. Исследованные методы воздействия на саркому 37 у мышей не вызывают угнетения клеточного и гуморального иммунитета в указанные сроки наблюдения.
Список использованной литературы
1. Письменный В.И., Осокин О.В. (2006) Криохирургический метод в комплексном и самостоятельном варианте лечения злокачественных опухолей головы и шеи. Сиб. онкол. журн., 1: 85 с.
2. Васильев С.А., Песня-Прасолов С.Б. (2009) Применение криохирургического метода в нейрохирургии. Нейрохирургия, 4: 63–70.
3. Альперович Б.И., Мерзилькин Н.В., Сало В.Н. и др. (2011) Криохирургия очаговых поражений печени. Бюл. сиб. мед., 10(1): 143–49.
4. Королев Ю.В. (2010) Криохирургическое лечение радиорезистентных рецидивных форм базальноклеточного рака кожи. Медицинский альманах, 2: 294–6.
5. Момджян Б.К., Борсуков А.В., Коваленко Е.С. (2008) Современные возможности в лечении метастатических злокачественных опухолей печени . Вопросы онкологии, 54(6): 684–9.
6. Gage A.A., Baustb J.M., Baustb J.G. (2009) Experimental cryosurgery: investigations in vivo. 59(3): 229–43.
7. Шафранов В.В., Таганов А.В., Гладько В.В. и др. (2010) Оценка эффективности лечения пациентов с келоидными рубцами методами низкотемпратурной деструкции с использованием показателей дерматологического качества жизни. Детская хирургия, 6: 39–41.
8. Гриневич Ю.А., Каменец Л.Я. (1986) Основы клинической иммунологии опухолей. Киев: Здоров’я, 158 с.
9. Бережная Н.М., Чехун В.Ф. (2005) Иммунология злокачественного роста. Киев: Наукова думка, 786 с.
10. Ablin R.J. (2007) Cryoimmunology: wandering in the desert for 40 years. Proceedings XIV World Congress, 146.
11. Цуцаева A.A., Гольцев А.Н., Попов Н.Н. (1988) Криоиммунология. Киев: Наукова думка, 174 с.
12. Sabel M. (2009) Cryoimmunology: a review of the literature and proposed mechanisms for stimulatory versus suppressive immune responses. Cryobiology, 58(1): 1–11.
13. Sabel M.S., Gang Su., Griffith K.A. et al. (2010) Rate of freeze alters the immunologic response after cryoablation of breast cancer. Division of Surgical Oncology, 17(4): 1187–93.
14. Sashchenko L.P., Lukyanova T.I., Kabanova O.D. et al. (1996) Different pathways of the release of cytotoxic proteins in LAK cells. Immunol. Lett., 53(1): 25–29.
15. Клаус Дж. (1990). Лимфоциты. Методы. Москва: Мир, 395 с.
16. Репина В.П., Ставинская О.А., Добродеева Л.К. (2010) Активность пролиферации и апоптоза иммунокомплементных клеток при злокачественных опухолях эпителиального происхождения. Экология человека, 3: 50–53.
17. Гланц С. (1998) Медико-биологическая статистика. Москва: Практика, 459 с.
18. Matin S.F., Sharma P., Gill I.S. et al. (2010) Immunological response to renal cryoablation in an in vivo orthotopic renal cell carcinoma murine model. J. Urol.: 183(1): 333–8.
Вплив кріодеструкції, місцевої НВЧ-гіпертермії та їх комбінації на показники імунітету в мишей із саркомою 37
Резюме. Встановлено, що після проведеної кріодеструкції або комбінації з локальною НВЧ-гіпертермією саркоми 37 відбувається підвищення як прямої, так і антитілозалежної цитотоксичності лімфоцитів, але не перитонеальних макрофагів у тварин. Ці зміни особливо виражені в ранній період (4-та доба після кріодеструкції). Стимуляція клітинної та гуморальної ланок імунної системи у відповідь на кріодеструкцію або комбінацію з гіпертермією може посилювати протипухлинну резистентність організму, ймовірно, за рахунок продуктів кріонекрозу пухлинної тканини.
Ключові слова: місцева НВЧ-гіпертермія, кріодеструкція, саркома 37, лімфоцити, макрофаги, імунологічна реактивність.
Impact of cryosurgery, local microwave hyperthermia, and their combination on immunological parameters in mice with sarcoma 37
Summary. It was established that under the action of one cryodestruction or in combination with local microwave hyperthermia sarcoma 37 is an increase in both direct and antibody dependent cytotoxic activity of lymphocytes, but not peritoneal macrophages in animals. These changes are particularly pronounced in the early period (4th day after exposure). Stimulation of cellular and humoral immune system in response to a cryodestruction or in combination with hyperthermia may exacerbate antitumor resistance, probably due to products cryonekrosis tumor tissue.
Key words: local microwave hyperthermia, cryosurgery, sarcoma 37, lymphocytes, macrophages, immune reactivity.














Leave a comment