Застосування магнітотермії у хворих на рак грудної залози з множинними метастазами в печінку
Сивак Л.А., Кліманов М.Ю., Орел В.Е., Лялькін С.А., Аскольський А.В., Касап Н.В., Майданевич Н.М., Лаврик Г.В.
Резюме. У статті проаналізовано результати лікування 46 хворих на рак грудної залози з множинними метастазами в печінку (25 отримали поліхіміотерапію з магнітотермією, 21 — тільки поліхіміотерапію за стандартними схемами). Визначено, що поєднання хіміотерапії з магнітотермією більш ефективне. Застосування магнітотермії не призводило до ускладнень та не впливало на прояви токсичності хіміотерапії.

Незважаючи на досягнення науки й техніки, основи терапії в онкології за останні десятиліття принципово не змінилися, проте єдиним радикальним методом лікування більшості злоякісних новоутворень залишається хірургічний, для ефективності якого застосовують променеву і/або хіміотерапію (ХТ).
Сучасна онкологія може запропонувати цілий комплекс малоінвазивних технологій, що при невеликій кількості ускладнень має високий терапевтичний потенціал, — це хіміо- і радіоемболізація пухлинних судин, різні види абляції, фотодинамічна й протонна терапія, гіпертермія (ГТ) [1].
Абляція (від латинського ablatio — відняття) — це методика прямого спрямованого руйнування тканини шляхом термічної або хімічної/електрохімічної дії на пухлинні тканини. Для хімічної/електрохімічної абляції використовують ін’єкції етанолу, оцтової кислоти або електрохімічний лізис. Термічна абляція передбачає застосування лазерного, мікрохвильового, радіочастотного, ультразвукового опромінення та кріодеструкції [1].
Протонна терапія — це дія на пухлинні тканини пучка протонів, прискореного в циклотроні до величезних швидкостей (60% від швидкості світла).
За останні 20 років загальновизнаним і досить поширеним методом лікування пухлин вважається локальна ГТ, яку застосовують у поєднанні з ХТ або променевим лікуванням при резистентних формах злоякісних новоутворень. За даними авторів, у тканинах організму при температурі 38–42 °С збільшується мікроциркуляція біологічних рідин. У разі застосування магнітотермії (МТ) (індуктотермії) внаслідок дії електричної компоненти електромагнітного поля (ЕМП) в тканинах ініціюється не лише помірний тепловий фактор впливу, а й дія магнітної компоненти [2].
Для лікування пухлин також використовують просторово неоднорідне магнітне поле, яке ініціює орієнтацію іонів та диполів біологічних тканин. Відомо, що в середині клітин у стані спокою поле однорідне, а у клітин, що діляться, — неоднорідне. Дія електромагнітних сил селективно збільшує швидкість активного транспорту препаратів через мембрану в середину злоякісної клітини. Внаслідок цього підсилюється руйнування цитоскелета клітини та її органоїдів, зростає вірогідність селективної загибелі злоякісних клітин [3].
Нині в клінічній онкології широко застосовують помірну МТ (індуктотермію), яка поєднує нагрівання пухлини до 37–42 °С з дією електричної компоненти ЕМП, що ініціює не лише помірний тепловий ефект, а й дію магнітної компоненти — МТ на електронно-транспортні мережі біологічних мембран злоякісних пухлин, що суттєво знижує хіміорезистентність пухлинних клітин до протипухлинних препаратів. За даними авторів, в експерименті опромінення неоднорідним ЕМП більш суттєво знижує резистентність пухлини до доксорубіцину та цисплатину порівняно з надвисокочастотною ГТ [4].
Відомо, що основними ефектами ЕМП радіохвиль на злоякісні пухлини є фізико-хімічні, біологічні та фізіологічні. Фізико-хімічні ефекти поділяються на нетеплові й теплові. Внаслідок дії нетеплових ефектів виникає поляризація й деполяризація біологічних структур, змінюється кінетика вільнорадикальних і ферментативних реакцій, відбувається розрив водневих зв’язків. Підвищення температури тканини більше 41–43 °С відносять до теплових ефектів ЕМП, що ініціює цитотоксичну дію МТ на клітинні компоненти, змінюючи клітинний гомеостаз, кінетику ферментативних реакцій, збільшує накопичення медичних препаратів у клітинах. До біологічних ефектів відносять індукцію апоптозу й некрозу пухлинних клітин, індукцію синтезу білків теплового шоку, зміну клітинного циклу пухлинних клітин. Під дією фізіологічних ефектів виникає посилення кровотоку, збільшення насичення пухлини киснем [5].
З огляду на вищезазначене та враховуючи обмежену кількість робіт, присвячених визначенню доцільності застосування МТ, метою нашої роботи було розроблення нового методу комплексної терапії хворих на рак грудної залози (РГЗ) з множинними метастазами в печінку для підвищення ефективності лікування та якості життя хворих.
Матеріали та методи
Проліковано 46 хворих на РГЗ з множинними метастазами в печінку. Пацієнтки, включені в дослідження, були у віці від 32 до 65 років, середній вік становив 55,3±2,1 року. До основної групи дослідження увійшли 25 пацієнток, які при комплексному лікуванні отримали поліхіміотерапію (ПХТ) на тлі МТ. Контрольну групу утворила 21 хвора, пацієнтки цієї групи отримували комплексне лікування за стандартними схемами. У всіх хворих діагноз верифікований на основі гістологічного дослідження тканини пухлини. Застосовували загальноклінічне обстеження, мамографію, комп’ютерну томографію органів грудної клітки, черевної порожнини та малого таза.
Усім пацієнткам проводили стандартну ХТ у першій лінії за протоколом FAC (циклофосфамід 500 мг/м2, фторурацил 500 мг/м2, доксорубіцин 50 мг/м2). У другій лінії застосовували паклітаксел 175 мг/м2 та карбоплатин AUC-5. Проведено від 4 до 8 курсів ХТ, в середньому 5,5, що залежало від термінів спостереження за пацієнтами. МТ проводили в перший день ХТ, не пізніше ніж через 30 хв після завершення введення цитостатичних препаратів, аплікатор розміщували на ділянці проекції печінки. Початкова потужність опромінення становила 75 Вт. Сеанс МТ тривав упродовж 30 хв. Використовували апарат «Магнітерм» («Радмір», Україна) на базі прототипу розробленого і експериментально апробованого в Національному інституті раку. Оцінку ефективності проводили за допомогою спіральної комп’ютерної томографії з внутрішньовенним підсиленням за критеріями RECIST (версія 1.1, 2009). Токсичність лікування оцінювали за критеріями ВООЗ. Досліджували результати загального аналізу крові, функцію печінки та нирок за біохімічними показниками крові (білірубін, АлАТ, АсАТ, сечовина, креатинін) до початку, у процесі та після завершення лікування.
Згідно з критеріями RECIST (версія 1.1, 2009) виділяли часткову регресію (ЧР) — зменшення на 30% суми найбільших діаметрів пухлинних вогнищ; прогресування хвороби — збільшення на 20% суми найбільших діаметрів пухлинних вогнищ або поява нового вогнища (вогнищ); стабілізація — недостатнє зменшення пухлини для визначення ЧР або недостатнє збільшення пухлини для констатації прогресування. Ефективність паліативного лікування оцінювали у 46 хворих на РГЗ з метастазами в печінку.
Результати та їх обговорення
Розподіл хворих залежно від морфологічної структури був наступним: у всіх пацієнтів діагностовано аденокарциному, усі хворі мали множинні метастази в печінку. Крім того, віддалені метастази в легені спостерігали у 5% хворих, у кістки — в 9%, лімфатичні вузли — у 13%. Безпосередні результати дослідження свідчать про те, що всього було проведено 110 курсів ХТ в основній групі та 95 — в контрольній. Усі пацієнтки отримали курси ХТ в зазначені терміни без перерви в лікуванні на фоні гепатопротекторів. При аналізі показників крові, починаючи з другого курсу ХТ, у хворих обох груп спостерігалися помірне зниження рівня гемоглобіну до І–ІІ ступеня (CTC NCCT) та короткочасне зменшення кількості лейкоцитів до І–ІІ ступеня лейкопенії (CTC NCCT).
Cеред гастроінтестинальних ускладнень ХТ найчастіше спостерігали нудоту — у 42 (91,3%) і блювання — у 20 (43,4%) хворих. Нудоту ІІІ ступеня відзначали в 5 (10,8%) пацієнток, блювання ІІІ ступеня — в 4 (8,6%).
Прояви гепатотоксичності виявили у 16 (34,7%) з 46 хворих: I ступеня — у 9 (19,5%), ІІ ступеня — у 5 (10,8%) пацієнток, ІІІ ступеня — у 1 пацієнтки. Підвищення рівня білірубіну та гіперферментемія спостерігалися у хворих, які в анамнезі мали вірусний гепатит В (r=0,37; p<0,07), у прооперованих з приводу жовчнокам’яної хвороби (r=0,29; р>0,05), а також у тих, що мали алергічні реакції на лікарські препарати (r=0,32; p<0,05).
Серед 25 пацієнток основної групи ЧР пухлини виявлено у 5 (27,7%) хворих та у 4 (25,5%) із 21 пацієнтки контрольної групи (р>0,05). Стабілізацію процесу констатовано у 10 (55,5%) пацієнток основної групи та у 6 (37,5%) контрольної (р<0,05). Прогресування пухлинного процесу виявлено у 3 (16,6%) основної та у 6 (37,5%) хворих контрольної групи (p<0,05).
Отже, меншу токсичність та кращі результати лікування відзначено в групі хворих, у яких поєднували хіміотерапевтичне лікування з МТ на ділянку печінки. Результати наших досліджень збігаються з результатами, отриманими авторами [6], що свідчить про ефективність методу МТ у комбінації з ХТ у хворих онкологічного профілю.
Наведемо приклад
Хвора Д., 1954 р.н., лікувалася у відділенні ХТ солідних пухлин з діагнозом «рак лівої грудної залози, стадія IV, Т2N0M1, метастази в печінку, клінічна група 2». Пацієнтка вперше звернулася до Національного інституту раку в лютому 2012 р. зі скаргами на наявність ущільнення в лівій грудній залозі, яке виявила близько 3 міс до того. До початку лікування хворій виконано КТ-дослідження внутрішніх органів, виявлено метастази в печінку (рис. 1).
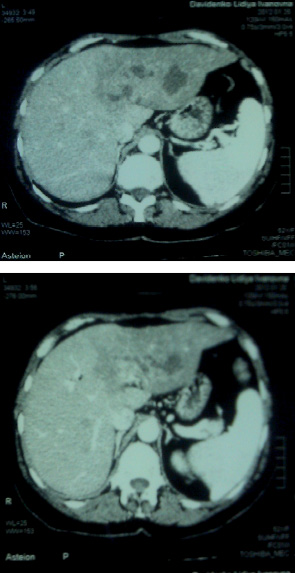
Хвора отримала 6 курсів ПХТ за схемою FAC на фоні МТ, що проводилася безпосередньо протягом 30 хв після внутрішньовенного введення цитостатиків. Після 3-го курсу виконано контрольну комп’ютерну томографію (рис. 2), при проведенні якої не виявлено пухлинного процесу в печінці.
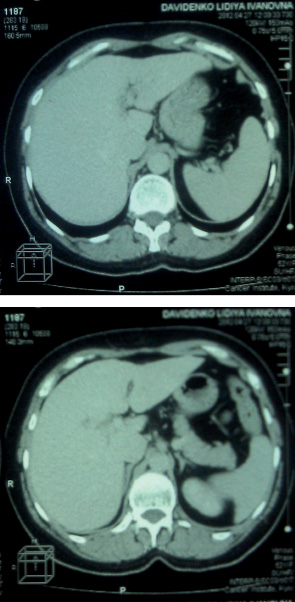
ВИСНОВКИ
Таким чином, за попередніми результатами нашого дослідження, поєднання МТ з ПХТ при комплексному лікуванні хворих на РГЗ з метастазами в печінку сприяє поліпшенню результатів лікування (дозволяє збільшити на 18% кількість випадків стабілізації процесу та на 2,2% — кількість ЧР), не впливає на прояви токсичності ПХТ та є актуальним і перспективним методом лікування пацієнтів даного профілю.
Література
1. Долгушин Б.И., Косырев В.Ю., Рампрабанант С. (2007) Радиочастотная аблация в онкологии. Практическая онкология, 8(4): 219.
2. Brada M., Pijls-Johannesma M. (2007). Proton Therapy in Clinical Practice: Current Clinical Evidence. J. Clin. Oncol., 25(8): 965–70.
3. Смоланка І.І., Скляр С.Ю. (2007) Шляхи підвищення ефективності комплексного лікування хворих на рак грудної залози. Київ, 191 с.
4. Смоланка І.І., Черниш В.О., Орел В.Е. та ін. (2008) Використання апарата «Магнітерм» в комплексній терапії хворих на рак грудної залози. Матер. науково-практичної конференції «Актуальні питання діагностики та лікуванні хворих на гормонозалежні злоякісні новоутворення», 27–28 листопада 2008 р., Черкаси. Здоровье женщины, 3(36): 134–136.
5. Орел В.Е., Смоланка И.И., Коровін А.Ю. та ін. (2005) Електромагнітне поле радіохвиль в онкології. Книга плюс: Київ.
6. Смоланка И.И., Орел В.Э., Скляр С.Ю., Досенко И.В (2011) Використання радіочастотної гіпертермії для підвищення ефективності комплексного лікування хворих на місцево-поширений рак грудної залози. Практическая онкология, 2(2): 25.
Применение магниотермии у больных раком грудной железы с множественными метастазами в печень
Резюме. В статье проанализированы результаты лечения 46 больных раком грудной железы с множественными метастазами в печень (25 получили полихимиотерапию с магнитотермией, 21 — только полихимиотерапию по стандартным схемам). Определено, что сочетание химиотерапии с магнитотермией эффективнее. Применение магнитотермии не приводило к осложнениям и не влияло на проявления токсичности химиотерапии.
Ключевые слова: рак грудной железы, химиотерапия, магнитотермия.
Magnitothermia in patients with breast cancer with multiple liver metastases
Summary. In the article the results of treatment of 46 patients with the breast cancer with multiple liver metastases are analysed (25 patients received chemotherapy with magnitothermia, 21 — only chemotherapy on standard protocols). Patients received combination of chemotherapy with magnitothermia had better results. The application of magnitothermia did not have complications and did not increase the toxicity of chemotherapy.
Key words: breast cancer, chemotherapy, magnitothermia.














Leave a comment