Супратенториальные примитивные нейроэктодермальные опухоли у детей
Орлов Ю.А., Шаверский А.В. , Зябченко В.И.
Резюме. Примитивные нейроэктодермальные опухоли головного мозга являются одними из наиболее распространенных среди злокачественных новообразований центральной нервной системы у детей. Стандартными методами лечения примитивных нейроэктодермальных опухолей признаны хирургическое удаление опухоли, лучевая и химиотерапия. Статья посвящена результатам лечения, прогнозированию и оценке качества жизни 53 детей с супратенториальными примитивными нейроэктодермальными опухолями. Полученные результаты ретроспективного исследования свидетельствуют о необходимости применения в отношении этих злокачественных опухолей более агрессивной лечебной тактики. Радикальность операции, использование лучевой и химиотерапии оказывают значительное влияние на качество и продолжительность жизни детей с супратенториальными примитивными нейроэктодермальными опухолями головного мозга.
Введение
Гистологически все эмбриональные опухоли центральной нервной системы (ЦНС), независимо от локализации и происхождения, относятся к примитивным нейроэктодермальным опухолям [23]. В группе супратенториальных примитивных нейроэктодермальных опухолей (СПНЭО) выделяют опухоли с отчетливым нейрональным компонентом — нейробластомы, содержащие клетки ганглиев — ганглионейробластомы. Все СПНЭО отнесены ВОЗ к опухолям IV степени злокачественности [20]. В настоящее время известно, что СПНЭО отличаются от инфратенториальных ПНЭО (медуллобластомы) прогнозом, молекулярно-генетическими особенностями и должны рассматриваться отдельно от последних [8]. СПНЭО составляют от 1 до 2% всех опухолей головного мозга у детей [6, 11]. Пик заболеваемости СПНЭО приходится на трехлетний возраст, а ⅔ случаев встречаются у детей до 5 лет [2, 22]. Прогноз для этих опухолей долгое время оставался крайне плохим, однако внедрение клинических протоколов лечения злокачественных новообразований у детей, созданных на базе протокола HIT-2000, несколько улучшило показатели безрецидивной и 5-летней выживаемости больных [20]. Тем не менее частота возникновения рецидивов остается высокой [21].
Целью настоящей работы является ретроспективный анализ наблюдений СПНЭО головного мозга у детей, лечившихся в отделе нейрохирургии детского возраста ГУ «Институт нейрохирургии им. акад. А.П. Ромоданова НАМН Украины» за период с 1998 по 2011 год.
Материалы и методы исследования
За период 1998–2011 гг. находились на лечении 53 ребенка с СПНЭО головного мозга: 30 (56,6%) мальчиков и 23 (43,4%) девочки. По половому признаку доминировали мальчики — 1,3:1. Средний возраст пациентов составлял 5 лет (от 1 мес до 17 лет). Дети до 3 лет (17 наблюдений) составили 32,1%. Компьютерная томография (КТ) выполнена 53 больным, магнитно-резонансная томография (МРТ) — 45 пациентам, нейросонография — 8 больным и 1 — ангиография сосудов головного мозга.
Результаты
Период от первых проявлений заболевания до госпитализации составил в среднем 6 мес (от 1 нед до 48 мес). При поступлении 29 (54,7%) детей находились в удовлетворительном состоянии, 18 (33,9%) — в состоянии средней тяжести и 5 (5,4%) — в тяжелом состоянии. У 36 (68%) детей отмечены признаки внутричерепной гипертензии. В 68% наблюдений выявлены изменения на глазном дне (51% — отек зрительных нервов различной степени и 17% — атрофия зрительных нервов). В 21 (39,6%) случае наблюдался гемипарез и в 9 (16,9%) — судорожный синдром. Статокоординаторные нарушения обнаружены у 10 (18,8%) больных.
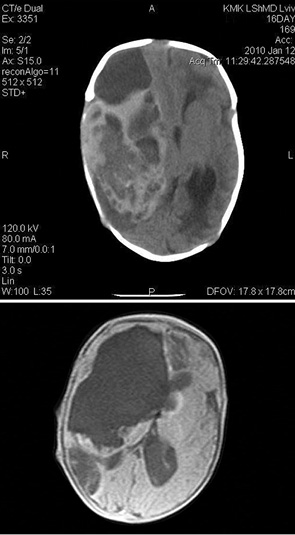
При КТ-исследовании определялось повышенной плотности объемное образование, обычно больших размеров, которое гетерогенно усиливалось после введения контрастного вещества (рис.1 а, б). У 20 (37,7%) больных обнаружена киста, у 6 (11,3%) — геморрагии и у 2 (3,8%) — кальцинаты в ткань опухоли. Смещение срединных структур отмечено в 36 (67,9%) наблюдениях, а сопутствующая гидроцефалия — в 14 (26,4%) случаях.
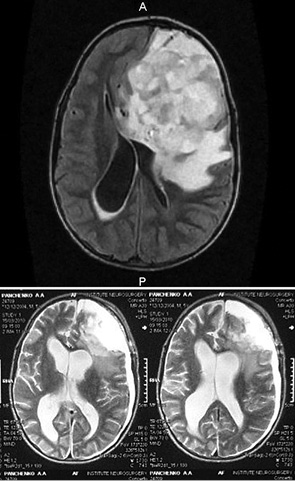
На МРТ у больных определялся хорошо отграниченный гетерогенный гипоинтенсивный сигнал на Т1-взвешенных изображениях. При Т2-взвешенных изображениях визуализировался гиперинтенсивный сигнал гетерогенного характера (рис. 2 а, б). Средние размеры опухолей были 71×61×67 мм.
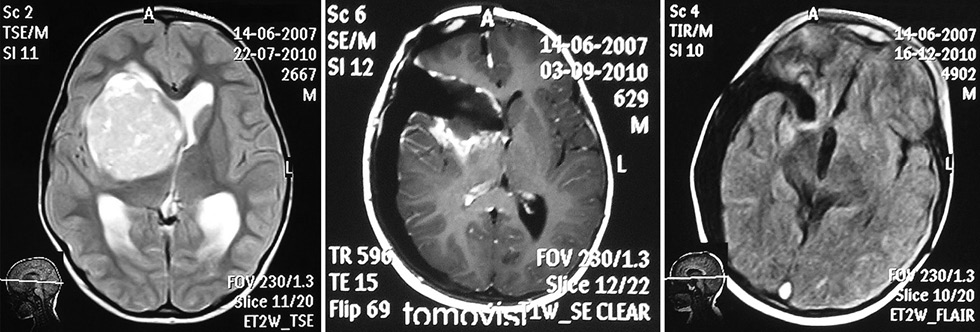
Мультифокальное поражение ЦНС диагностировано в 6 (11,3%) случаях, количество очагов — от 2 до 4. Метастатические очаги располагались в пределах головного мозга (3 наблюдения) и в спинном мозгу (3 наблюдения). В 27 (50,9%) наблюдениях опухоль занимала проекцию нескольких отделов большого мозга, чаще всего лобную и височную долю. Опухоль смещала срединные структуры и/или распространялась на противоположную сторону. Учитывая размеры опухоли, можно условно говорить о локализации образования в проекции определенной анатомической структуры мозга. Преимущественно в лобной области новообразование локализовалось в 8 (15,1%) наблюдениях, в височной доле — в 4 (7,5%) случаях. Значительно реже СПНЭО обнаруживались в теменной и лобно-каллезной области — по 2 и по 1 наблюдению соответственно, когда опухоль выявлена в прозрачной перегородке и затылочной доле. Оперативное вмешательство проведено у всех детей. Тотальное удаление опухоли выполнено в 33 (62,3%), субтотальное — в 16 (30,2%), частичное — в 2 (3,8%) и биопсия в 2 (3,8%) наблюдениях. У 2 больных удаление опухоли было дополнено ликворошунтирующей операцией. Опухоли хорошо кровоснабжались, и часто удаление сопровождалось значительной потерей крови. В 26 случаях кровопотеря превышала 500 мл, что расценивалось нами как осложнение оперативного вмешательства.
Гистологический диагноз «супратенториальная примитивная нейроэктодермальная опухоль» установлен в 28 (52,8%) случаях. В 21 (39,7%) наблюдении опухоли имели нейрональную дифференцировку и классифицированы как нейробластомы, а в 4 (7,5%) — как ганглионейробластомы. Эпендимарной дифференцировки мы не наблюдали.
Послеоперационная смертность составила 7,5%. Основной причиной летального исхода было нарушение мозгового кровообращения в диэнцефально-стволовых отделах на фоне фалькс-тенториального вклинения височной доли и отека гипоталамуса. Во всех наблюдениях смерть наступила в течение 1-й недели после операции.
С целью выявления метастазирования в послеоперационный период детям проводились МРТ головного и спинного мозга с внутривенным усилением, цитологическое исследование «люмбального» ликвора через 12 дней после операции. Наличие опухолевых клеток в спинномозговой жидкости обнаружено в 13 (24,5%) случаях (в 2 наблюдениях цитологическое исследование не производилось). Метастазирование, как уже отмечено, в другие отделы нервной системы диагностировано в 6 (11,4%) наблюдениях: в 3 (5,7%) — в другие отделы головного мозга, в спинной мозг — также в 3 (5,7%) случаях. Экстраневральных метастазов на момент оперативного вмешательства не обнаружено.
Таким образом, согласно стадированию по C. Chang [7] наши наблюдения распределились следующим образом: М0 (отсутствие метастазирования) — 34 (64,1%) наблюдения, М1 (опухолевые клетки в ликворе) — 13 (24,5%), М2 (метастазирование в головной мозг) — 3 (5,7%), М3 (метастазирование в спинной мозг) — 3 (5,7%), М4 (экстраневральное метастазирование) — не отмечалось. Наличие метастазов, не удаленная основная масса опухоли или возраст до 3 лет позволяли отнести 29 пациентов (54,7%) в группу высокого риска, результаты лечения которых значительно хуже, как и при медуллобластомах мозжечка [2, 7, 15, 21].
Всем больным повторяли МРТ головного и спинного мозга через 2 мес, когда можно достоверно говорить о радикальности удаления опухоли (рис. 3 а, б, в). После удаления опухоли детей направляли к онкологу для продолжения лечения. Адъювантная терапия проведена в 43 из 49 наблюдений (отказ от ее проведения был связан с тяжестью состояния пациентов). Химиотерапия проведена у 18 детей, использованы клинические протоколы лечения злокачественных новообразований у детей, созданные на базе протоколов НIT-1991, HIT-2000. Курсы лучевой и химиотерапии прошли 25 детей. После прохождения химиотерапии и/или лучевой терапии больные продолжали наблюдаться у нейрохирурга и онколога с периодическим проведением нейровизуализирующих исследований.
Катамнез известен в 49 (92,5%) наблюдениях. Средняя длительность наблюдения составила 21,8 мес — от 2 мес до 10 лет. В различные сроки после операции (от 2 мес до 5 лет) умерли 8 детей (15,1%). Дети, не получавшие лучевую и химиотерапию после операции, умерли в ближайшие 2–4 мес. Общая 5-летняя выживаемость составила 53,7% с медианой выживаемости 28 мес. В 7 (14,3%) наблюдениях детям выполнялось повторное удаление опухоли из-за ее продолженного роста. Отмечена прямо пропорциональная зависимость возраста пациентов и показателей их выживаемости. Отрицательное влияние на показатель выживаемости также оказывает нерадикальное удаление опухоли. В возрастной группе до 3 лет 5-летней выживаемости не наблюдали, в старшей возрастной группе она достигала 50,6%. При частичном удалении или биопсии выживаемость не достигала 3 лет.
Оценка качества жизни проведена после окончания комплексного лечения. У 19 (38,8%) детей качество жизни было хорошее (100–80 баллов), в 18 (36,7%) наблюдениях — удовлетворительное (75–50 баллов) и в 4 (8,2%) случаях — плохое (45–30 баллов). Для оценки качества жизни мы использовали «Шкалу качества жизни детей с поражением нервной системы» Ю.А. Орлова [1].
Обсуждение
В 1925 г. P. Bailey и H. Cushing первыми применили термин «медуллобластома» для описания плохо дифференцируемой опухоли мозжечка [4]. M. Hart и K. Earle в 1973 г. назвали медуллобластомы и схожие по строению опухоли большого мозга термином «примитивные нейроэктодермальные опухоли» [14]. Гистологически медуллобластома и ПНЭО состоят из недифференцируемых или плохо дифференцируемых нейроэпителиальных клеток. Эти опухоли могут дифференцироваться по неврональному, глиальному, эпендимарному или фоторецепторному пути. Супратенториально расположенные примитивные нейроэктодермальные опухоли обозначают как СПНЭО, они составляют от 1 до 2% всех опухолей мозга у детей [6, 11].
По данным литературы, СПНЭО в основном располагаются в гемисферах большого мозга (80%), вокруг III желудочка (10%) и в мозолистом теле [5]. В наших наблюдениях 94,3% опухолей располагались в гемисферах мозга, 3,8% — в области мозолистого тела и 1,9% — в области III желудочка.
Средний возраст на момент установления диагноза СПНЭО — 3 года. Также при этих опухолях в отличие от медуллобластом отсутствует половое доминирование [2]. По данным литературы, метастазирование при СПНЭО встречается в 5–39% случаев, в отличие от медуллобластом, где диссеминация процесса составляет 40–60% [7–9, 15]. Метастазирование выявлено у 35,9% наблюдаемых нами больных.
Хирургическое удаление опухоли является первым этапом в лечении СПНЭО. Операция преследует цели уменьшения объема опухоли для проведения дальнейшего лечения, снижения интенсивности неврологической симптоматики, возникшей от воздействия объемного образования на структуры мозга, получения образца опухоли для проведения гистологического и иммуно-гистохимического исследования. Перед удалением опухоли детям с повышенным внутричерепным давлением назначается гормональная терапия, а при сопутствующей гидроцефалии накладывается временный вентрикулярный дренаж. После удаления опухоли вентрикулярный дренаж удаляется или заменяется на ликворошунтирующую систему. На следующий день после операции проводится нейровизуализирующее исследование с целью послеоперационного контроля и определения резидуальных фрагментов опухоли.
Высокая радиочувствительность СПНЭО подчеркивает важность проведения лучевой терапии, которую, как правило, назначают детям в возрасте старше 3 лет [13]. Учитывая склонность опухоли метастазировать по ликвороносным путям, облучают как ложе удаленной опухоли, так и весь головной и спинной мозг. Проведенные исследования эмбриональных опухолей доказали, что общая и безрецидивная выживаемость значительно ниже, если лучевая терапия не проводится, или доза облучения уменьшается [8, 10]. Возраст, в котором можно относительно безопасно проводить лучевую терапию, не установлен; большинство авторов считают, что радиотерапия показана после 3 лет, другие исследователи склонны рекомендовать облучение после 5 лет [15, 17].
СПНЭО менее чувствительны к химиотерпии и считаются биологически более агрессивными, чем инфратенториальные опухоли. После радикального удаления, химиотерапии и лучевой терапии 3-летняя выживаемость при СПНЭО составляет от 45 до 47%; для сравнения: выживаемость для медуллобластом — более 80% [3, 8, 19]. Прогноз для СПНЭО хуже, чем при медуллобластомах. Плохими прогностическими факторами при СПНЭО считаются ранний возраст больного, неполное удаление опухоли и очаги некроза в опухоли [15]. Учитывая способность опухоли к диссеминации, даже при радикальном удалении опухоли невозможно гарантировать длительной выживаемости. Использование лучевой терапии у пациентов младшего возраста приводит к задержке развития и значительным эндокринным нарушением, что делает ее применение нежелательным. Тотальное удаление опухоли коррелирует с длительной выживаемостью. Так, 1-летняя безрецидивная выживаемость после тотального удаления составляет 50% против 8% у пациентов с нерадикально удаленной опухолью [15]. Для детей младшей возрастной группы даже после использования протоколов с агрессивным лечением уровень общей выживаемости — менее 20% в течение года от установления диагноза [20]. Если у детей старшего возраста общая 5-летняя выживаемость составляет 34%, то у пациентов в возрасте младше 2 лет прогноз значительно хуже [19, 20]. В большинстве случаев в течение года диагностируются рецидив опухоли и/или метастазирование, и ребенок погибает [16, 20].
Анализируя результаты хирургического лечения в наших наблюдениях, мы выявили, что при тотальном удалении опухоли летальность составила 3%, а выживаемость в среднем — 24,5 мес. Смертность после субтотального удаления — 18,7%, а выживаемость — 10,7 мес. Частичное удаление проводили в 2 наблюдениях, и в обоих обнаружены метастазы: в одном — М1, втором — М2. В обоих случаях через 2 и 22 мес диагностирован продолженный рост опухолей, и больные умерли; один — после повторной операции. Мы считаем, что агрессивная хирургическая тактика оправдана и ассоциируется с более низким уровнем послеоперационной смертности и длительной выживаемостью.
Лучевая терапия проведена в 25 (47,1%) случаях нашего исследования. Все эти больные получали также химиотерапию, так что мы можем судить только о совместном влиянии адъювантной терапии. Длительность катамнеза в среднем составила 19,2 мес. У детей, получавших лучевую и химиотерапию, 5-летняя выживаемость составила 41,5%, безрецидивная — 28,3%. На момент окончания исследования известно о смерти 3 детей. Рекомендуется проводить дальнейшие исследования в определении влияния химиотерапии на ПНЭО [12], но учитывая схожесть строения данной опухоли с медуллобластомой, в основные протоколы лечения СПНЭО включают химиотерапию [18].
Заключение
СПНЭО у детей встречаются относительно редко и являются одними из наиболее злокачественных опухолей головного мозга. Агрессивная хирургическая тактика ассоциируется с низким уровнем послеоперационной смертности и более высокой выживаемостью. Результаты хирургического лечения примитивных нейроэктодермальных опухолей нельзя признать удовлетворительными. Послеоперационная летальность составляет 7,5%, а средняя выживаемость — 21,8 мес. Включение в комплекс лечебных мероприятий лучевой и химиотерапии повышает выживаемость. Возраст больных старше 3 лет, М0 стадия опухолевого процесса, а также комплексный подход в лечении достоверно являются положительными факторами прогноза выживаемости.
ЛИТЕРАТУРА
1. Орлов Ю.А. (2007) Качество жизни детей, оперированных по поводу нейрохирургической патологии. Український нейрохірургічний журнал, 3: 63–65.
2. Albright A.L., Wisoff J.H., Zeltzer P. et al. (1995)Prognostic factors in children with supratentorial (nonpineal) primitive neuroectodermal tumors. A neurosurgical perspective from the Children’s Cancer Group. Pediatr. Neurosurg., 22: 1–7.
3. Albright A.L., Wisoff J.H., Zeltzer P.M. et al. (1996) Effects of medulloblastoma resections on outcome in children: a report from the Children’s Cancer Group. Neurosurgery, 38: 265–271.
4. Bailey P., Cushing H. (1925) Medulloblastoma cerebelli: a common type of midl-cerebellar glioma of childhood. Arch. Neurol. Psychiatry, 14: 192–223.
5. Becker L.E., Hinton D. (1986) Primitive neuroectodermal tumors of the central nervous system / In: Bennington J.L. (ed.) Pathology of neoplasia in children and adolescents. Saunders. Philadelphia, London, Toronto, 18: 347–418.
6. Berger M.S., Magrassi L., Geyer R. (1995) Medulloblastoma and primitive neuroectodermal tumors /in Kaye A.H., Laws E.R. Jr. (eds). Brain Tumors. An Encyclopedic Approach. Edinburgh: Churchill Livingstone: 561–574.
7. Chang C.H., Housepian E.M., Herbert C. Jr. (1969) An operative staging system and a megavoltage radiotherapeutic technique for cerebellar medulloblastoma. Radiology, 93: 1351–1359.
8. Cohen B.H., Zeltzer P.M., Boyett J.M. et al. (1995)Prognostic factors and treatment results for supratentorial primitive neuroectodermal tumors in children using radiation and chemotherapy: a Children’s Cancer Group randomized trial. J. Clin. Oncology, 13: 1687–1696.
9. Dirks P.B., Harris L., Hoffman H. et al. (1996) Supratentorial primitive neuroectodermal tumors in children. J. Neuro-Oncol., 29: 75–84.
10. Duffner P.K., Horowitz M.E., Krischer J.P. et al. (1993) Postoperative chemotherapy and delayed radiation in children less than three years of age with malignant brain tumors. N. Engl. J. Med., 328: 1725–1731.
11. Gaffney C.C., Slone J.P., Bradley N.J. et al. (1985)Primitive neuroectodermal tumours on the cerebrum. Pathology and treatment. J. Neurooncol., 3: 23–33.
12. Gentet J.C., Bouffet E., Doz F. et al. (1995) Preirradiation chemotherapy including «eight drugs in 1 day» regimen and high-dose methotrexate in childhood medulloblastoma: results of the M7 French Cooperative Study. J. Neurosurg., 82: 608–614.
13. Gold D., Packer R., Cohen B. (1999) Treatment strategies for medulloblastoma and primitive neuroectodermal tumors. Neurosurg. Focus, 7(2): 3.
14. Hart M.N., Earle K.M. (1973) Primitive neuroectodermal tumors of the brain in children. Cancer, 32: 890–897.
15. Marec-Berard P., Jouvet A., Thiesse P. et al. (2000) Supratentorial embryonal tumors in children under 5 years of age: an SFOP study of treatment with postoperative chemotherapy alone. Med. Pediatr. Oncol., 38: 83–90.
16. MacDonald T., Rood B., Santi M. et al. (2003) Advances in the diagnosis, molecular genetics, and treatment of pediatric CNS embryonal tumors. Oncologist, 8: 174–186.
17. Nashio S., Morioka T., Suzuki S. et al. (1998) Supratentorial primitive neuroectodermal tumours: a report of four cases with an unusual clinical course in one patient. Acta Neurochir., 140: 207–213.
18. Packer R.J., Sutton L.N., Goldwein J.W. et al. (1991) Improved survival with the use of adjuvant chemotherapy in the treatment of medulloblastoma. J. Neurosurg., 74: 433–440.
19. Reddy A.T., Janss A.J., Phillips P.C. et al. (2000)Outcome for children with supratentorial primitive neuroectodermal tumors treated with surgery, radiation, and chemotherapy. Cancer, 88: 2189–2193.
20. Fangusaro J. et al. (2008) Intensive chemotherapy followed by consolidative myeloablative chemotherapy with autologous hematopoietic cell rescue (AuHCR) in young children with newly diagnosed supratentorial primitive neuroectodermal tumors (sPNETs): report of the Head Start I and II experience. Pediatr. Blood Cancer, 50(2): 312–318.
21. Li M.H., Bouffet E., Hawkins C.E. et al. (2005) Molecular genetics of supratentorial primitive neuroectodermal tumors and pineoblastoma. Neurosurg. Focus, 19: 1–17.
22. Mehrotra N., Shamji M.F., Vassilyadi M., Ventureyra E.C.G. (2009) Intracranial tumors in first year of life: the CHEO experience. Child’s Nervous System, 25 (12): 1563–1569.
23. Rosemberg S., Fujiwara D. (2005) Epidemiology of pediatric tumors of the nervous system according to the WHO 2000 classification: a report of 1,195 cases from a single institution. Child’s Nervous System, 21(11): 940–944.
Супратенторіальні примітивні нейроектодермальні пухлини у дітей
Резюме. Примітивні нейроектодермальні пухлини головного мозку є одними із найпоширеніших серед злоякісних новоутворень центральної нервової системи у дітей. Стандартними методами лікування примітивних нейроектодермальних пухлин визнані хірургічне видалення пухлини, променева та хіміотерапія. Стаття присвячена результатам лікування, прогнозуванню й оцінці якості життя 53 дітей із супратенторіальними примітивними нейроектодермальними пухлинами. Отримані результати ретроспективного дослідження свідчать про необхідність застосування стосовно цих злоякісних пухлин більш агресивної лікувальної тактики. Радикальність операції, застосування променевої та хіміотерапії мають значний вплив на якість і тривалість життя дітей із супратенторіальними примітивними нейроектодермальними пухлинами головного мозку.
Ключові слова: примітивні нейроектодермальні пухлини, ембріональні пухлини центральної нервової системи, діагностика, лікування, результати, діти.
Supratentorial primitive neuroectodermal tumors in children.
Summary. Primitive neuroectodermal tumors of the brain are of the most common cancers of the central nervous system in children. Standard methods of treatment of primitive neuroectodermal tumors is surgical resection, radiotherapy and chemotherapy. This article is devoted to results of treatment, prognosis and assessment of life quality of 53 children with supratentorial primitive neuroectodermal tumors. The results of a retrospective study show the need to apply for these cancers more aggressive treatment strategy. Radical surgery, using radiotherapy and chemotherapy have a significant impact on the quality and life expectancy of children with supratentorial primitive neuroectodermal tumors of the brain.
Key words: primitive neuroectodermal tumors, embryonal tumors of the central nervous system, diagnostics, treatments, results, children.














Leave a comment