Системна протипухлинна терапія у хворих на рак грудної залози. Сучасні аспекти лікування
Резюме. Наведено принципи сучасного підходу до планування комплексного лікування хворих на рак грудної залози. Стаття включає огляд матеріалів ХI та XII Міжнародних конференцій з питань раку грудної залози (St. Gallen — 2009, 2011), які уточнюють та доповнюють сучасні стандарти прогнозування перебігу захворювання та лікування хворих з урахуванням молекулярно-біологічних підтипів пухлини.
Вступ
Однією з найбільш характерних особливостей поширення злоякісних пухлин серед жінок економічно розвинених країн є значне підвищення частоти раку грудної залози (РГЗ), який займає перше місце у структурі онкологічної патології. Рівень захворюваності на РГЗ в Україні за останні 50 років (1962–2011) зріс з 17,6 до 65,0 на 100 тис. жіночого населення, щорічно реєструється більше 16 тис. нових випадків РГЗ, із них 12% помирають протягом 1-го року після встановлення діагнозу. За даними Національного канцер-реєстру на обліку онкологічних закладів України, на початок 2010 р. налічували 125 тис. жінок, хворих на РГЗ, у 2011 р. зареєстровано ще 16 507 нових випадків захворювання, загальна кількість померлих від РГЗ становила за останній рік 7969. Показники захворюваності та смертності від РГЗ по Україні за останні роки поступово підвищуються [1].
Встановлено, що серед захворілих більше 37%, а серед померлих — більше 30% становлять особи працездатного віку, що призводить до значних втрат життєвого потенціалу жіночої популяції України. Враховуючи кількість осіб, які захворіли у репродуктивному (38,2%) та працездатному віці (39,4%), (рисунок), важливим на сьогодні є не тільки підвищення ефективності комплексного лікування хворих на РГЗ, а й покращення якості їх життя. Актуальними в сучасній клінічній онкології стають питання ранньої реабілітації та розробки методів заощадливого лікування, яке дозволяє скоротити термін перебування хворих на інвалідності, значно підвищити якість життя оперованих.
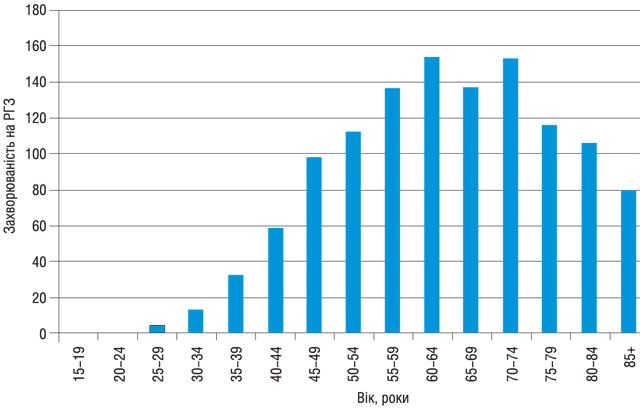
Широке впровадження мамографічного скринінгу дозволяє виявляти пухлини малого розміру, що у свою чергу створює умови для проведення заощадливого лікування, а у жінок репродуктивного віку — ставити питання про збереження репродуктивної функції. Якщо ще 10 років тому серед осіб, що захворіли на РГЗ кількість пацієнтів із занедбаними стадіями перевищувала 50%, то за останні 5 років відсоток із I–II стадією захворювання становить більше 75% (табл. 1).
Таблиця 1 Розподіл хворих на РГЗ за стадіями з числа вперше захворілих в Україні у 2004–2009 рр.(%)
| Стадія | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 |
|---|---|---|---|---|---|---|
| І–ІІ | 71,7 | 73,1 | 72,4 | 74,1 | 75,1 | 75,5 |
| ІІІ | 17,0 | 16,3 | 16,9 | 15,7 | 15,3 | 14,3 |
| IV | 8,2 | 8,2 | 7,9 | 7,7 | 7,6 | 7,5 |
З урахуванням того, що у теперішній час у більшості хворих при встановленні діагнозу РГЗ первинна пухлина має невеликі розміри або виявляється лише рентгенологічно, можливість виключення із загального комплексу лікування хіміотерапії (ХТ) та проведення тільки гормональної терапії може підвищити якість життя пацієнтів без зниження ефективності лікування в цілому.
Після проведення хірургічного етапу лікування у пацієнтів з операбельними формами РГЗ найбільш важливим є оцінка факторів ризику рецидивування захворювання та вибір ефективної ад’ювантної терапії. Зараз стає очевидним, що доцільність ад’ювантної терапії при РГЗ залежить від молекулярно-біологичних властивостей пухлини. Вибір методу протипухлинного лікування визначається стадією процесу, клінічною формою РГЗ, ступенем ураження регіонарних лімфовузлів, віком та загальним станом хворих, гістологічною структурою пухлини (ступенем злоякісності), рівнем рецепторів гормонів (ЕR та PgR в пухлині), її проліферативною активністю та іншими імуногістохімічними показниками. Відомо, що пухлини з високими рівнями експресії гормональних рецепторів та без експресії HER2/neu в основному мають низький гістологічний ступінь злоякісності та низький ступінь клітинної проліферації, а за результатами мультигенних аналізів характеризуються низькою шкалою рецидивування. Ретроспективні дослідження свідчать про те, що хворі з такими пухлинами не мають суттєвої користі від ад’ювантної цитотоксичної терапії.
Експерти XII Міжнародної конференції з питань раку грудної залози (St. Gallen, 2011) прийняли нову стратегію лікування з урахуванням біологічних підтипів захворювання, а саме — лікування за індивідуальним планом (Tailored therapy). Для цього за допомогою аналізу даних генної експресії пухлин ідентифіковані наступні підтипи РГЗ (табл. 2)
Таблиця 2 Критерії виділення підтипів РГЗ (St. Gallen, 2011)
| Біологічний підтип РГЗ | Характеристика підтипів | Частота виявлення |
|---|---|---|
| Люмінальний А | ЕR (+) та/або PgR (+) HER2/neu-негативний Ki-67-низький (≤14%) |
42–59%* |
| Люмінальний В | 1. HER2/neu-негативний: ЕR(+) та/або PgR(+), відсутність експресії HER2/neu, Ki-67-підвищений**; 2. HER2/neu-позитивний: ЕR (+) та/або PgR (+), будь-який Ki-67, підвищена експресія, ампліфікація HER2/neu |
6–19% |
| Erb-B2-позитивний | ЕR(-), PgR(-), підвищена експресія, ампліфікація HER2/neu | 7–12% |
| Базальноподібний*** | «Тричі негативний» (дуктальний): ЕR(-), PgR(-), відсутність експресії HER2/neu | 15–20% |
*http://ww5.komen.org/Brest Cancer/Subtypesof.html; **якщо немає можливості дослідити рівень Ki-67, взяти до уваги оцінки пухлинної проліферації (G); ***базальноподібний та «тричі негативний» збігаються на 80%, але «тричі негативний» також включає деякі гістологічні типи РГЗ (медулярна карцинома, залозисто-кістозна карцинома тощо).
Належність до будь-якого підтипу РГЗ розглядається першочергово при виборі комплексу протипухлинної терапії, особливо це стосується системного лікування (ХТ, гормонотерапії, таргетної терапії), молекулярно-генетичне типування також дозволяє прогнозувати перебіг і завершення захворювання та адекватно призначати необхідний комплекс лікування.
Комплексне лікування РГЗ складається з місцевого (хірургичне та променеве лікування) та системного (хіміотерапевтичне, гормональне, таргетне). Останнє, з урахуванням розуміння злоякісної трансформації тканини грудної залози як загального системного процесу (Fisher 1995), у сучасній клінічній онкології виходить на ключове місце. Враховуючи те, що близько 80% хворих на РГЗ (а це 13 000 жінок в Україні щорічно) є чутливими до гормонотерапії (див. табл. 2), цей аспект комплексного лікування є дуже важливим.
Основною метою проведення гормонотерапії є зміна фону, на якому виникає пухлинний процес, що важливо для досягнення максимального лікувального ефекту. Факторами індивідуалізації протипухлинної терапії є показники, які належать до категорії клітинних маркерів, — це рецептори стероїдних гормонів — білки, які зв’язують стероїди після їх проникнення у клітину (ER — рецептори естрогенів и PgR — рецептори прогестерону). Кількісне дослідження рівнів ER и PgR, а не їх наявність або відсутність взагалі є важливим прогностичним та провісним фактором при виборі схеми лікування РГЗ. При наявності позитивних рецепторів естрогенів у пухлинних клітинах (більше 10%) ефективність гормонотерапії становить до 80%, при меншому відсотку — тільки до 10%. Наявність позитивних рецепторів гормонів свідчить про сприятливий перебіг захворювання та дозволяє сподіватися на кращі віддалені результати лікування.
За даними ХI консенсусного мітингу експертів (St. Gallen, 2009), підходи до лікування РГЗ ґрунтуються також на визначенні категорій ризику (табл. 3) та чутливості до гормонотерапії (Goldhirsch A. et al. 2009).
Таблиця 3 Визначення категорій ризику рецидивування та метастазування хворих на РГЗ
| Категорія ризику | Показники |
|---|---|
| Низький |
Відсутність ураження лімфовузлів (рNo) та усі наступні:
|
| Проміжний |
Відсутність ураження лімфовузлів (рNo) та один із наступних:
Наявність ураження лімфовузлів (рN+, 1–3 лімфовузли) та:
|
| Високий |
Наявність ураження лімфовузлів (рN+, 1–3 лімфовузли) та:
Наявність ураження лімфовузлів (рN+, 4 та більше) |
Категоріями чутливості пухлин грудної залози до гормонотерапії є наступні:
- чутливість до гормонотерапії висока — високі рівні рецепторів стероїдних гормонів (за даними біохімічного або імуногістохімічного методів); гормонотерапія з вищим ступенем ймовірності призведе до збільшення загальної та безрецидивної виживаності.
Ендокринний компонент терапії повинен вибиратися залежно від стану менструальної функції.
- Чутливість до гормонотерапії сумнівна — низькі рівні рецепторів стероїдних гормонів (менше 10% позитивних клітин), відсутність рецепторів прогестерону (PgR) незалежно від рівня експресії рецепторів естрогену (ER), наявність іншого маркера, що вказує на нечутливість до окремих видів гормонотерапії (наприклад гіперекспресія HER2/neu), велика кількість уражених метастазами лімфатичних вузлів, визначений в пухлині високий рівень активатора плазміногена урокіназного типу, інгібітора активатора плазміногена 1-го типу (uPA/PAI-1) і підвищені маркери проліферації. Наявність експресії рецепторів стероїдних гормонів з тим або іншим ступенем ймовірності свідчить про чутливість пухлини до гормонотерапії, такі хворі повинні отримувати гормонотерапію, частина пацієнтів із сумнівною гормоночутливістю та проміжним або високим ризиком потребують також призначення ХТ. Ад’ювантна програма для таких хворих передбачає проведення 4–6 курсів ХТ на додаток до гормонотерапії. Ендокринний компонент терапії повинен вибиратися залежно від стану менструальної функції.
- Нечутливі до гормонотерапії — експресія рецепторів стероїдних гормонів у клітинах не визначається. Гормонотерапія хворим цієї групи не призначається, перевага при виборі системного лікування надається ХТ.
Гормонотерапія займає одне з центральних місць у комплексному лікуванні хворих на РГЗ. Естрогени вважають головними чинниками в онкогенезі пухлин грудної залози. Більшість злоякісних пухлин для підтримки свого росту потребують естрогенів і за їх відсутності гинуть. Завданням гормонотерапії є зниження продукції естрогенів або нормалізація ії балансу та блокування впливу естрогенів на клітини пухлини. У менопаузі основним джерелом естрогенного синтезу стають жирова клітковина, м’язи, шкіра. Біосинтез естрогенів відбувається шляхом конверсії андрогенів в естрогени за допомогою ферменту ароматази.
Захворюваність жінок на РГЗ зростає починаючи з 45 років, що збігається із гормональними змінами, які відбуваються в організмі жінки. У результаті численних експериментальних та клінічних досліджень було доведено, що порушення обміну та балансу естрогенів може призводити до розвитку злоякісної трансформації в органах репродуктивної системи. Традиційно стратегія гормонотерапії при РГЗ базується на обмеженні стимулюючої дії естрогенів на пухлинні клітини. Для зниження їх концентрації або блокування дії естрогенів застосовують:
- оваріоектомію або супресію яєчників агоністами гонадотропін-рилізинг-гормону (LH-RH), які знижують методом зворотнього зв’язку синтез статевих гормонів і пролактину (у репродуктивному віці в сукупності з антиестрогенами), або за допомогою антиестрогенів та інгібіторів ароматази — для зниження залишкових естрогенів (у менопаузальному віці);
- конкуруючий захват рецепторів естрогенів антиестрогенами (тамоксифен);
- руйнування рецепторів естрогенів за допомогою «чистих» антиестрогенів (фулвестран).
Відомо, що у паціенток з рецептор-позитивними пухлинами зменшення рецидивування хвороби на 30–40% та підвищення виживаності на 25% після 5-річного застосування гормонотерапії фіксується через 10 років спостереження [2, 3, 7]. З урахуванням таких позитивних результатів було рекомендовано (St. Gallen, 2009) призначення гормонотерапії всім хворим, у яких пухлини мають будь-яку ендокринну чутливість (вважається, що експресія ER и PgR навіть у 1% пухлинних клітин уже ассоціюється з чутливістю пухлини до гормонотерапії) [6].
У пацієнток менопаузального віку з чутливими до гормонотерапії пухлинами початкових стадій ад’ювантна системна терапія може бути обмежена тільки гормонотерапією, стандартом якої залишається тамоксифен [5–7]. Для жінок репродуктивного віку з чутливими до гормонотерапії пухлинами оптимальним є пригнічення оваріальної функції (OFS — ovarian function suppression) в сукупності із застосуванням антиестрогенів. Оптимальна тривалість пригнічення функції яєчників у хворих на РГЗ репродуктивного віку не встановлена, але більшість авторів говорять про доцільність її застосування не менше 2 років. Відомо, що у деяких хворих агоністи LH-RH у самостійному варіанті можуть не повністю пригнітити оваріальну функцію, що потребує додаткового застосування антиестрогенів, тому призначення аналогів гонадотропін-рилізинг-гормону часто супроводжується додаванням антиестрогенної терапії, стандартом якої є тамоксифен. Присутність небажаних реакцій та ускладнень при застосуванні хірургічної та променевої кастрації сприяло пошуку та широкому застосуванню лікарських препаратів, які створюють умови для фармакологічної кастрації. Головним позитивним моментом цього методу є його зворотність, а саме — функція яєчників відновлюється після закінчення специфічної протипухлинної терапії, що важливо при досягненні позитивного результату лікування у молодих пацієнток, які бажають зберегти репродуктивну функцію.
Слід зазначити, що гормонотерапії ніколи не відводилася роль самостійного методу лікування, при операбельних формах РГЗ вона отримала загальне визнання лише в якості складової комплексної терапії. Оптимальним рішенням досягнення ефективного результату лікування хворих на РГЗ на сучасному етапі вважається індивідуальний підхід до планування терапії з урахуванням ризику захворювання та імуногістохімічної оцінки пухлини (див. табл.2, 4). У хворих на РГЗ з ЕR(+) та/або PgR(+) з низьким ризиком прогресування в ад’ювантному режимі перевага надається гормонотерапії, при проміжному або високому ризику застосовують ХТ (самостійно — при ЕR(-), PgR(-), або в комбінації з гормонотерапією — при ЕR(±), PgR(±) та трастузумабом — при НЕR2/neu (3+)). На сучасному етапі основний акцент при плануванні лікування хворих на РГЗ робиться на застосуванні «target treatment» — цільового лікування. Позитивним результатом (HER2/neu) вважається забарвлення більш ніж 30% інвазивних пухлинних клітин при імуногістохімічному дослідженні або позитивний FISH-тест (флюоресцентна in situ гибридизація більш ніж 6 копій на ядро пухлинної клітини).
Таблиця 4 Загальні схеми системної протипухлинної терапії для хворих на РГЗ
| Гормоночутливі | Відносно гормоночутливі | Гормононечутливі * | |||
|---|---|---|---|---|---|
| Група ризику | Репродуктивнийперіод | Менопауза | Репродуктивний період | Менопауза | Репродуктивний період або менопауза |
| N(-) Низький ризик | Таm ± OFS | Таm або ІА. Можливо переключення на ІА після Таm | Таm ± OFS | Таm; можливо ІА або нічого | — |
| N(-) та N(+) Середній або проміжний ризик | ХТ + OFS ± Таm або ХТ + OFS | Таm або ІА; або ХТ + Таm, або ХТ+ ІА; або ХТ + Таm + ІА після 2–3 років Таm | ХТ + Таm ± OFS або ХТ; або ХТ + OFS + ІА | ХТ + Таm або ХТ + ІА; або ХТ + Таm з подальшим переключенням на ІА (ІА після 2–3 років Таm) | ХТ (AC, FAC, FEC, CAF, АТ) |
| N(+) Високий ризик | ХТ + OFS ± Таm або ХТ + OFS ± ІА | ХТ + Таm або ХТ + ІА; або ХТ + ІА після 2–3 років Таm | ХТ + Таm ± OFS, або ХТ ±OFS + ІА замість Таm | ХТ + Таm або ХТ + ІА; ІА після 2–3 років Таm | ХТ (AC, FAC, FEC, CAF, ТАС, РТ, VP) |
ІА — інгібітори ароматази; Таm — тамоксифен; OFS — супресія оваріальної функції; C — циклофосфамід; M — метотрексат, F — 5-фторурацил; А — антрацикліни; E — епірубіцин; Т — таксани.
*Доповнення NCCN 2010 [5] — можливо при RE(-), RП(-) також призначення гормонотерапії (враховується можливість похибки при визначенні рецепторів або дискордантність між статусом первинної пухлини та її метастазами).
Таким чином, при лікуванні хворих на РГЗ репродуктивного віку в якості стандартів ад’ювантної ендокринотерапії прийнято пригнічення оваріальної функції у сполученні з антиестрогенами (тамоксифеном). Вибір методу «виключення» оваріальної функції є індивідуальним. Вважається, що хворим з ЕR+ та високим ризиком прогресування та/або з НЕR 2/neu-позитивним РГЗ «виключення» оваріальної функції за допомогою LH-RH доцільно проводити агоністами рилізинг-гормону на фоні проведення хіміо- або таргетної терапії. При високочутливих до ендокринотерапії пухлинах, низькому ризику прогресування та відсутності експресії НЕR2/neu ефективним може бути застосування тільки гормонотерапії. На ХII Міжнародній конференції з питань раку грудної залози (St. Gallen, 2011) підтверджено доцільність 5-річного застосування в ад’ювантному режимі у хворих менопаузального віку антиестрогенів (тамоксифен), а також доведено перевагу «послідовної» ендокринотерапії, а саме — переключення на інгібітори ароматази після 2–3 років терапії тамоксифеном. Першочергове (up front) застосування інгібіторів ароматази доцільно тільки у хворих з високим ризиком прогресування хвороби або з НЕR 2/neu-позитивним РГЗ. Загальна тривалість оптимальної ад’ювантної ендокринотерапії може коливатися до 5 років, але необхідним етапом до призначення інгібіторів ароматази є оцінка мінеральної щільності кісткової тканини.
Визначення підтипу пухлини при РГЗ є основою для призначення системної протипухлинної терапії. Нараховується більше 30 різних схем поліхіміотерапії (ПХТ), які ґрунтуються на органотропності препаратів та на індивідуальній чутливості пухлин до лікування. При неможливості визначення індивідуальної чутливості у схеми ПХТ включають препарати, які діють на різні фази клітинного циклу. Головною причиною неефективності лікування (відсутність істотних змін у підвищенні виживаності хворих) вважається резистентність пухлини до протипухлинних препаратів. Підвищення ефективності ПХТ полягає як у подоланні множинної лікарської резистентності, так і у підвищенні чутливості клітин пухлини до цитостатиків. При застосуванні ПХТ потрібно виключити можливість розвитку резистентності, тому що таке лікування становить небезпеку з позицій імовірності стимуляції росту резистентних клонів і швидкого розвитку віддалених метастазів. Отже, вибір адекватного системного протипухлинного лікування (оптимальної схеми та режиму ПХТ) розглядається зараз як один із головних шляхів підвищення ефективності лікування РГЗ [4].
Особливого поширення при лікуванні РГЗ останнім часом набула неоад’ювантна ПХТ, яка дозволяє розширити показання до виконання органозберігаючих операцій. Беручи до уваги системний характер РГЗ, більшість онкологів відводять ХТ перше місце серед інших методів неоад’ювантного лікування. При її застосуванні можна досягти максимальної девіталізації пухлини, що дозволяє знизити проліферативний потенціал ракових клітин, підвищити абластику хірургічних втручань, знизити ризик розвитку рецидивів та метастазування. Потенційними перевагами неоад’ювантної ПХТ вважають: зменшення біологічної активності пухлинних клітин як у пухлинному осередку, так і в його мікро- та макрометастазах, створення сприятливих умов для проведення операції, зниження вірогідності генералізації РГЗ. Важливим є також можливість за допомогою неоад’ювантної ПХТ визначити чутливість пухлини до ХТ з метою в подальшому індивідуалізації ад’ювантної системної терапії, відмови від неефективного лікування та призначення більш доцільного з подовженням ефективних схем в післяопераційному режимі в якості ад’ювантного лікування [4]. Неоад’ювантна ПХТ показана перш за все хворим з місцево-поширеними, первинно неоперабельними, набряково-інфільтруючими та запальними формами РГЗ. Але її все частіше застосовують і при операбельному РГЗ з метою «зниження стадії» пухлинного процесу для радикалізації виконання органозберігаючих операцій. Сучасний стандарт лікування РГЗ полягає у застосуванні 3–6 курсів неоад’ювантної ХТ за схемами FAC, FEC, AC, EC, AT або РТ чи Т в метрономному режимі (при «тричі негативному» РГЗ).
Дуже актуальним залишається і ад’ювантна системна ПХТ (протипухлинне післяопераційне лікування) [4–6]. Вихід пухлинних клітин внаслідок хірургічного втручання у циркулюючу кров вважається одним із важливих факторів, здатних погіршити результати лікування РГЗ, та потребує застосування методів знищення гематогенних мікрометастазів. Теорія «мінімальної післяопераційної залишкової хвороби» має на увазі збереження в організмі хворих злоякісних клітин після видалення основної пухлини, які не визначаються за допомогою клінічних та інструментальних методів і можуть бути причиною подальшого утворення метастазів. Застосування ад’ювантної системної терапії призводить до зниження ризику прогресування захворювання. До ознак, які свідчать про необхідність застосування ад’ювантної системної ПХТ, належать: низька експресія рецепторів гормонів ЕR та PgR, високий ступінь злоякісності або високий рівень «проліферативних» маркерів, великі розміри пухлини та поширена перитуморальна судинна інвазія. Залишаються доцільними схеми ПХТ, які включають застосування антрациклінів, а також ДНК-руйнівних препаратів (схеми САF, СЕF, АС), особливо при лікуванні хворих з «тричі негативними» пухлинами — ЕR (-), PgR(-), НЕR2/neu(-) [3]. Оптимізація цитотоксичної терапії РГЗ є одним з найперспективніших напрямків покращення результатів лікування. Розробки, що ведуться у цій галузі, дають можливість потенціювати ефективність ПХТ за рахунок: по-перше, створення нових хіміопрепаратів; по-друге, удосконалення методів транспорту препаратів до пухлини; по-третє, використання модифікаторів ХТ та, по-четверте, призначення індивідуалізованих хіміотерапевтичних режимів. Застосування високодозових хіміотерапевтичних режимів, які потребують використання колонієстимулюючих препаратів та стовбурових клітин периферичної крові при лікуванні РГЗ, визнано категорично недоцільним та таким, що підвищує ризик розвитку лейкозів [4].
Аналіз ефективності ад’ювантної ендокринотерапії та ХТ підтвержує думку про те, що, коли одна з них набуває більшої ваги в лікуванні, значення другої такою ж мірою знижується. Вибір адекватного системного лікування при РГЗ є особливо важким та важливим у хворих з проміжним ризиком за генетичною шкалою ризику, коли необхідно зробити правильний вибір та вирішувати, яким пацієнтам ад’ювантна ХТ буде корисною, а яким — ні. РГЗ є молекулярно та клінічно гетерогенним захворюванням, уніфікований підхід до лікування якого може призвести до призначення недоцільних та невиправдано токсичних препаратів. Пацієнти через це можуть недоотримувати лікування або отримувати потенційно небезпечну терапію. Персоналізовані рекомендації ASCO відображують рекомендації St.Gallen, 2011 та NCCN, 2012, які стосуються ад’ювантної системної терапії операбельних форм РГЗ. Отримана інформація про профіль генної експресії, який може охарактеризувати відповідь пухлини на лікування та за яким можна прогнозувати перебіг захворювання, підтверджує значення індивідуалізації планування та проведення адекватної ад’ювантної терапії.
Для хворих на РГЗ з високогормоночутливими пухлинами, але з високим ризиком прогресування або недостатньо гормоночутливими та негативним НЕR 2/neu-статусом визнано доцільним застосування 4 курсів ПХТ за схемою АС. Схеми АТ або ТС також є можливими для цих пацієнтів за наявності матеріального забезпечення. Доцільним також є проведення стандартних курсів ПХТ у хворих похилого віку, де очікується достатньо тривалий термін життя, однак у хворих цих вікових груп рекомендовані до застосування менш тривалі курси ПХТ або курси з вибором індивідуальної дози цитостатиків [5].
Висновки
Протипухлинне системне лікування при РГЗ на сучасному етапі може бути охарактеризоване як «індивідуалізація в межах стандартизації». Принцип індивідуалізації включає отримання максимального обсягу інформації про клінічні, патоморфологічні, молекулярно-генетичні ознаки та маркери, що дозволяє розподілити хворих на РГЗ до певних типологичних підгруп і призначити кожній пацієнтці стандартне регіонарне та системне протипухлинне лікування, найбільш ефективне для неї. Визначення фенотипічних характеристик та оптимизація лікування з їх урахуванням визнаються найбільш перспективним напрямком сучасної онкологіі.
Література
1. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2011) Рак в Україні, 2009–2010. Бюлетень Національного канцер-реєстру України №12, Київ, 116 с.
2. Дискуссионные вопросы гормональной терапии при лечении больных раком молочной железы и рекомендации, принятые на конференции в Сан-Галлене (2009) Обзор. Lancet Oncology, 1: 38–41.
3. Влияние адъювантной терапии анастрозолом и тамоксифеном при лечении больных с ранними стадиями рака молочной железы: анализ результатов исследования АТАС через 100 месяцев (2008) Обзор. Lancet Oncology, 2: 23–32.
4. Семиглазов В.В.,Топузов Э.Э. (2009) Рак молочной железы, Москва: Медпресс-информ, 176 с.
5. Goldhirsch A., Ingle J.N., Gelber R.D. et al. (2009) Thresholds for therapies: Highlights of the St Gallen International Expert Consensus on the primary therapy of early breast cancer 2009. Ann Oncol., 20: 1319–1329.
6. National Comprehensive Cancer Network (2010) NCCN: Clinical practice guidelines in oncology ( http://www.nccn.org.).
7. Albain K.S., Barlow W.E., Shack S. et al. (2010) Prognostic and predictive value of the 21-gene recurrence score assay in postmenopausal women with node-positive, oestrogen-receptor-positive breast cancer on chemotherapy: A retrospective analysis of a randomized trial. Lancet Oncol., 11: 55–65.
Системная противоопухолевая терапия у больных раком грудной железы. Современные аспекты лечения.
Резюме. Приведены принципы современного подхода к планированию комплексного лечения больных раком грудной железы. Статья содержит обзор материалов XI и XII Международных конференций по вопросам рака грудной железы (St. Gallen,2009, 2011), которые дополняют и уточняют современные стандарты прогнозирования течения заболевания и лечения больных с учетом молекулярно-биологического профиля опухоли.
рак грудной железы, группы риска, комбинированное лечение, гормонотерапия, полихимиотерапия, индивидуализация лечения.














Leave a comment