Оцінка ефективності передопераційної променевої терапії первинно-операбельного раку грудної залози
Щепотин И.Б.1, Зотов А.С.1, Любота Р.В.1, Любота И.И.2, Аникусько Н.Ф.2, Синюшкина Л.Н.2, Нейман А.М.2
- 1Національний медичний університет ім. О.О. Богомольца, Київ
- 2Київський міський клінічний онкологічний центр, Київ
Резюме. Застосування променевої терапії для лікування раку грудної залози (РГЗ) має майже 100-річну історію. При цьому передопераційна променева терапія (ППТ) сприяє підвищенню резектабельності пухлини і створює несприятливі умови для імплантації та росту клітин пухлини під час хірургічного втручання. У дане дослідження включено 346 хворих на РГЗ у віці від 27 до 82 років (середній вік 56±12 років), які проходили лікування в клініці онкології Національного медичного університету імені О.О. Богомольця на базі хірургічного відділення Київського міського клінічного онкологічного центру в 2005–2006 рр. Хворих розділили на 5 груп. Чотири з них дослідні, які відрізнялися між собою методикою передопераційної променевої терапії, і одна контрольна, яку становили хворі, які не отримували ППТ. Оцінювали загальну і безрецидивну виживаність хворих.
Резюме. Применение лучевой терапии для лечения рака грудной железы (РГЖ) имеет почти 100-летнюю историю. При этом предоперационная лучевая терапия (ПЛТ) способствует повышению резектабельности опухоли и создает неблагоприятные условия для имплантации и роста клеток опухоли во время хирургического вмешательства. В данное исследование включено 346 больных РГЖ в возрасте от 27 до 82 лет (средний возраст 56±12 лет), которые проходили лечение в клинике онкологии Национального медицинского университета имени А.А. Богомольца на базе хирургического отделения Киевского городского клинического онкологического центра в 2005–2006 гг. Больных разделили на 5 групп. Четыре из них опытные, которые отличались между собой методикой предоперационной лучевой терапии, и одна контрольная, которую составили больные, не получавшие ПЛТ. Оценивали общую и безрецидивную выживаемость больных.
 Введение
Введение
Применение лучевой терапии для лечения рака грудной железы (РГЖ) имеет почти 100-летнюю историю. При этом предоперационная лучевая терапия (ПЛТ) способствует повышению резектабельности опухоли и создает неблагоприятные условия для имплантации и роста клеток опухоли во время хирургического вмешательства. Первая публикация, посвященная результатам использования ПЛТ для лечения РГЖ, датирована 1925 г. [1]. Однако техническое несовершенство и малая обеспеченность рентгенотерапевтическими аппаратами лечебных учреждений в первой половине ХХ века существенно ограничивали широкое использование лучевой терапии для лечения онкологических заболеваний в целом и РГЖ в частности. Тем не менее к 60-м годам прошлого столетия были накоплены данные, свидетельствующие о положительном терапевтическом эффекте ПЛТ (суммарная доза в пределах 40 Гр, подведенных конвенциальным режимом фракционирования) у больных РГЖ [2, 3]. Последующие достижения в клинической дозиметрии позволили количественно учитывать поглощенную дозу и ее пространственное распределение. Эти технические достижения значительно улучшили условия подведения лечебных доз к опухолям внутренних органов, чем способствовали более широкому применению ионизирующего излучения для лечения злокачественных опухолей как в предоперационный период, так и в адъювантном режиме, используя режим мелкого фракционирования дозы (классический).
Начиная с 60-х гг., наряду с классической схемой фракционирования для проведения ПЛТ начинают использовать крупнофракционное облучение (разовая доза 4–6 Гр в течение 3–5 дней) с коротким интервалом между последним сеансом лучевой терапии и оперативным вмешательством [4–9]. Экспериментально было показано, что однократное облучение первичной опухоли в дозе 13±1 Гр вызывает гибель большей части ее клеток, а по биологическому эффекту она эквивалентна 24 Гр, подведенным за 5 фракций, и 40 Гр — за 22 фракции, подведенных ежедневно [6].
В последующем камнем преткновения среди сторонников ПЛТ стал метод фракционирования предоперационного облучения. При мелком фракционировании облучение продолжается в течение 4–5 нед, а хирургическое вмешательство выполняют еще через 3 нед. При этом эффект лучевого воздействия, выражающийся дегенеративными изменениями, имеет место не только в опухоли, но и в окружающих ее нормальных тканях, что осложняет проведение операции и послеоперационный период. Интервал между окончанием облучения и операцией создает определенные трудности при проведении последней. Вызванные ЛТ структурные повреждения стенок кровеносных, лимфатических сосудов и соединительной ткани облученной области наиболее выражены на 4–5-й неделе после завершения ПЛТ. В этот же период времени происходит не только регрессия опухоли за счет некроза летально поврежденных клеток, но и репарация, и рост сублетально поврежденных опухолевых клеток. Все это ставит под сомнение целесообразность применения данного метода фракционирования в предоперационный период. Продолжительность курса ПЛТ должна быть сведена к минимуму, без уменьшения его терапевтической эффективности. Обсуждение проблемы предоперационного облучения на рентгенологическом конгрессе в Германии в 1970 г. показало, что метод мелкого фракционирования дозы перед операцией клинически не оправдан [10].
Сторонники крупнофракционного облучения ссылаются на данные, которые свидетельствуют о том, что сохранение радиобиологического эффекта при сокращении продолжительности облучения возможно за счет повышения дозы каждой фракции [11]. Это мнение подтверждает номограмма Бернса, демонстрирующая корреляцию величины между разовой дозой и количеством фракций, и свидетельствующая, что эквивалентный радиобиологический эффект при уменьшении количества фракций может быть получен при соответствующем увеличении значения каждой фракции и уменьшении суммарной дозы [12].
Целью данного ретроспективного исследования было определить влияние ПЛТ на результаты комплексного лечения больных РГЖ.
Материалы и методы
Пациенты
В исследование включено 346 больных РГЖ в возрасте от 27 до 82 лет (средний возраст 56±12 лет), которые проходили лечение в клинике онкологии Национального медицинского университета имени А.А. Богомольца на базе хирургического отделения Киевского городского клинического онкологического центра в 2005–2006 гг.
Методы лечения
ПЛТ проводили по одной из описанных ниже методик.
1-дневный курс ЛТ: при I стадии — на грудную железу 13 Гр с двух встречных полей; при II стадии — на грудную железу 13 Гр, на подмышечную область 10 Гр.
3-дневный курс ЛТ: при I стадии — на грудную железу разовая очаговая доза (РОД) 7 Гр, суммарная очаговая доза (СОД) 21 Гр; при II стадии — на грудную железу РОД 7 Гр, СОД 21 Гр, на подмышечную область РОД 6 Гр, СОД 18 Гр.
5-дневный курс ЛТ: при I стадии — на грудную железу РОД 5,4 Гр, СОД 27 Гр; при II стадии — на грудную железу РОД 5,4 Гр, СОД 27 Гр, на подмышечную область РОД 4,5 Гр, СОД 22,5 Гр.
ПЛТ по радикальной программе — на грудную железу РОД 2 Гр, СОД 50 Гр, на подмышечную область РОД 2 Гр, СОД 40 Гр, на шейно-над-, подключичную область РОД 2 Гр, СОД 40–44 Гр — проводится только при IIB стадии.
Пациентки, получавшие предоперационную лекарственную (химио-, гормонотерапию), в данное исследование не включены.
У всех больных проведены хирургические вмешательства в объеме радикальной мастэктомии.
Адъювантное лечение назначалось согласно национальным стандартам лечения РГЖ.
Статистические методы
Для расчета общей и безрецидивной выживаемости больных использовали метод Каплана — Мейера. Для оценки статистической достоверности полученных данных использовали лоранговый критерий. Данные анализировали с помощью программы MS Exсel.
Результаты
В результате проведенного исследования больных разделили на 5 групп. Четыре из них опытные, которые отличались между собой методикой ПЛТ, и одна контрольная, которую составили больные, не получавшие ПЛТ. Распределение больных исследуемых групп в зависимости от стадии РГЖ представлено в табл. 1.
Таблица 1. Распределение больных в зависимости от стадии РГЖ
| Исследуемые группы | Стадия РГЖ | Всего | |
|---|---|---|---|
| I стадия (T1N0M0) | II стадия (TisN1M0, T1N1M0, T2N0M0, T2N1M0, T3N0M0) | ||
| Без ЛТ | 64 (73%) | 99 (38%) | 163 (47%) |
| 1-дневный курс ЛТ | 17 (19%) | 72 (28%) | 89 (26%) |
| 3-дневный курс ЛТ | 7 (8%) | 55 (21%) | 62 (18%) |
| 5-дневный курс ЛТ | 0 | 5 (2%) | 5 (1,5%) |
| ПЛТ по радикальной программе | 0 | 27 (11%) | 27 (7,5%) |
| Всего | 88 (100%) | 258 (100%) | 346 (100%) |
73% больных с I стадией РГЖ, которым планировалась радикальная мастэктомия, не получали ПЛТ. Пациентки, у которых была диагностирована II стадия заболевания, получили ПЛТ в 62% случаев.
Общая выживаемость больных с I стадией РГЖ представлена на рис. 1 и в табл. 2.
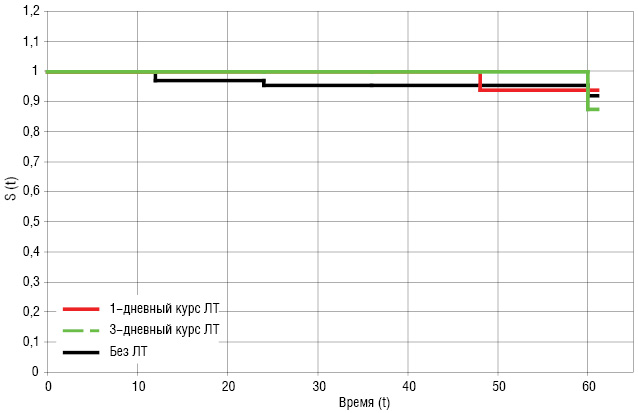
Таблица 2. Общая выживаемость больных с I стадией РГЖ
| Исследуемые группы | Общая выживаемость | ||||
|---|---|---|---|---|---|
| 12 мес | 24 мес | 36 мес | 48 мес | 60 мес | |
| Без ЛТ | 97% | 95% | 95% | 95% | 92% |
| 1-дневный курс ЛТ | 100% | 100% | 100% | 94% | 94% |
| 3-дневный курс ЛТ | 100% | 100% | 100% | 100% | 86% |
5-летняя общая выживаемость больных с I стадией РГЖ, не получавших ПЛТ, составила 92%, а также 94 и 86% у пациенток, которым проводили 1-дневный и 3-дневный курс ПЛТ соответственно. Различия между исследуемыми группами статистически не достоверны (р>0,05).
Общая выживаемость пациенток исследуемых групп со II стадией РГЖ представлены на рис. 2 и в табл. 3.
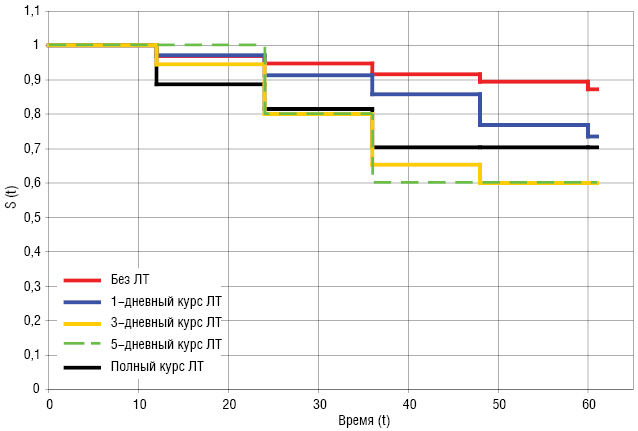
Таблица 3 Общая выживаемость больных со II стадией РГЖ
| Исследуемые группы | Общая выживаемость | ||||
|---|---|---|---|---|---|
| 12 мес | 24 мес | 36 мес | 48 мес | 60 мес | |
| Без ЛТ | 97% | 95% | 92% | 90% | 87% |
| 1-дневный курс ЛТ | 97% | 92% | 86% | 77% | 74% |
| 3-дневный курс ЛТ | 95% | 80% | 66% | 60% | 60% |
| 5-дневный курс ЛТ | 100% | 80% | 60% | 60% | 60% |
| ПЛТ по радикальной программе |
89% | 82% | 70% | 70% | 70% |
5-летняя общая выживаемость больных со II стадией РГЖ наибольшая (87%) у больных, которые не получали ПЛТ. У пациенток, которые в предоперационный период получали ЛТ, общая 5-летняя выживаемость составила 74% у больных после 1-дневного курса ЛТ, 60% — после 3- и 5-дневного курса лучевой терапии, и 70% — в группе больных, которые проходили ПЛТ по радикальной программе. Различия между исследуемыми группами статистически достоверны (р
Безрецидивная выживаемость больных с I стадией РГЖ представлена на рис. 3 и в табл. 4.
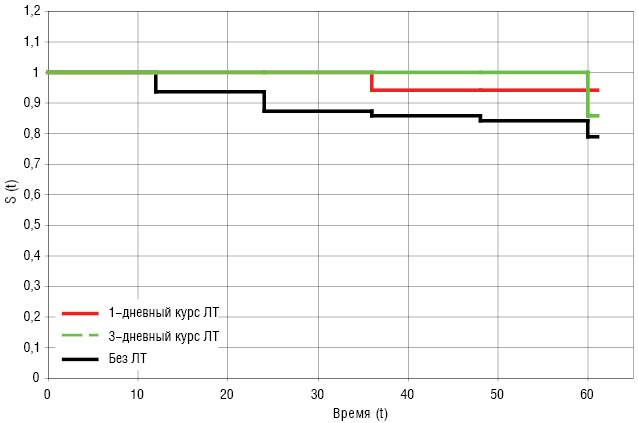
Таблица 4 Безрецидивная выживаемость больных с I стадией РГЖ
| Исследуемые группы | Безрецидивная выживаемость | ||||
|---|---|---|---|---|---|
| 12 мес | 24 мес | 36 мес | 48 мес | 60 мес | |
| Без ЛТ | 94% | 88% | 86% | 84% | 79% |
| 1-дневный курс ЛТ | 100% | 100% | 94% | 94% | 94% |
| 3-дневный курс ЛТ | 100% | 100% | 100% | 100% | 86% |
5-летняя безрецидивная выживаемость больных с I стадией РГЖ равнялась 94 и 86% у пациентов, соответственно прошедших в предоперационный период 1- и 3-дневный курс ЛТ, против 79% больных, не получавших ЛТ. При проведении анализа полученных данных статистически достоверными являются отличия между группами без ЛТ и группой, получившей 1-дневный курс ЛТ (р
Безрецидивная выживаемость больных со II стадией РГЖ представлена на рис. 4 и в табл. 5.

Таблица 5 Безрецидивная выживаемость больных со II стадией РГЖ
| Исследуемые группы | Безрецидивная выживаемость | ||||
|---|---|---|---|---|---|
| 12 мес | 24 мес | 36 мес | 48 мес | 60 мес | |
| Без ЛТ | 93% | 88% | 79% | 70% | 67% |
| 1-дневный курс ЛТ | 92% | 83% | 78% | 69% | 63% |
| 3-дневный курс ЛТ | 76% | 65% | 56% | 54% | 52% |
| 5-дневный курс ЛТ | 80% | 60% | 60% | 60% | 30% |
| ПЛТ по радикальной программе |
82% | 67% | 67% | 63% | 63% |
5-летняя безрецидивная выживаемость пациенток со II стадией РГЖ равнялась 67% у больных, которые не получали ПЛТ, и 63% у пациентов после 1-дневного и полного курса ЛТ. Различия между описанными выше группами статистически не достоверны (р>0,05). При этом 5-летняя выживаемость пациенток, получивших предоперационный 3- и 5-дневный курс ЛТ, составила 52 и 30% соответственно. При сравнении данных 5-летней безрецидивной выживаемости больных без ПЛТ и пациенток после предоперационного 3- или 5-дневного курса ЛТ выявлено, что различия между данными группами статистически достоверно (р
Выводы
1. ПЛТ у больных с I стадией РГЖ не влияет на 5-летнюю общую выживаемость.
2. У больных с I стадией РГЖ 1-дневный курс ПЛТ увеличивает 5-летнюю безрецидивную выживаемость на 15%.
3. Проведение ПЛТ у больных со II стадией РГЖ снижает 5-летнюю общую выживаемость: на 13% — при проведении 1-дневного курса ЛТ, на 27% — при 3- и 5-дневном курсе ПЛТ и на 17% — при проведении ПЛТ по радикальной программе.
4. Предоперационный курс лучевой терапии по радикальной программе так же, как и 1-дневный курс ЛТ, не влияют на 5-летнюю безрецидивную выживаемость больных со II стадией РГЖ. Однако проведение 3- и 5-дневного курса ПЛТ уменьшает 5-летнюю безрецидивную выживаемость пациенток со II стадией РГЖ на 15 и 37% соответственно.
5. Применение ПЛТ для лечения больных с I, II стадией РГЖ оправдано лишь в случае использования 1-дневного курса лучевой терапии.
Литература
1. Lee B.J., Herendeen N.E. (1925) Pre-operative and post-operative X-ray treatment. Ibid., Ixxxii, p. 404.
2. Kohler A.K. (1950) Hnische Erfahrungen mit der Pendelbestrahlung von Geschwiilsten. Strahlentherapie, 81: 315–324.
3. Rohler A. (1952) 10 Jahr preoperative Bestrahlung des Mammacarcinom Strahlentherapie, 88: 150–157.
4. Nakajama K. (1964) Preoperative irradiation in the treament of petients with carcinoma of the oesophagus and some other sites. Clinical Radiologi, 15: 232–241.
5. Powers W.E., Palmer L. (1968) Biologic Basis of preoperative radiation treatment. Am. J. Roentgen., 102(1): 176–192.
6. Голдобенко Г.В. (1980) Предоперационная лучевая терапия операбельных форм злокачественных новообразований (клинико-экспериментальное исследование) Докт. дисс. Обнинск, 305 с.
7. Павлов А.С., Симакина Е.П., Хрущев М.М., Смирнова Е.С. (1970) Комбинированное лечение рака прямой кишки. Хирургия, 5: 67–73.
8. Симбирцева Л.П., Снешко Л.И., Смирнов Н.М. (1975) Результаты концентрированного комбинированного лечения больных раком прямой кишки. Вопросы онкологии, 4: 7–12.
9. Черниченко В.А. (1975) Интенсивный метод облучения онкологических больных в предоперационном периоде. Автореф. докт. дисс. Киев, 44 с.
10. Zuppinger A., Frank G., Renfer H. et al. (1957) Fraherfahrungen mit dem 31 Mev Betatron. Strahlentherapie, Bd.,102(3): 407–418.
11. Cohen M., Martin S.J. (1966) Multiple field isodose charts. In Atlas of Radiation Dose Distributions. Vol. II International Atomic Energy Agency, Vienna.
12. Burns J.E. (1965) Nomograms for radiobiologycally-equivalent fractionated X-ray doses. Br. J. Radiol., 38: 545.














Leave a comment