Застосування модифікаторів — шлях до підвищення ефективності лікування хворих на первинно неоперабельний рак грудної залози
Смоланка І.І., Іванкова В.С., Скляр С.Ю., Іванкова О.М.
Резюме. У статті представлено дані дослідження ефективності методу неоад’ювантної комплексної протипухлинної терапії з використанням хіміорадіомодифікатора фторпіримідинового ряду і проаналізовано безпосередні результати лікування з використанням стандартних та розроблених методів лікування хворих на місцево-поширений рак грудної залози. У ході дослідження встановлено, що проведення неоад’ювантної хіміопроменевої терапії (ХПТ) на фоні модифікатора дозволило збільшити на 27,5% кількість відповідей первинної пухлини на лікування, а саме випадків часткової та повної регресії, та розширило показання до виконання хірургічних втручань. Додаткове введення в схему неоад’ювантної терапії фторпіримідинів не підсилювало токсичність лікування. При вивченні показників безрецидивної виживаності виявлено тенденцію до вірогідного її збільшення у хворих основної групи, яким проводили ХПТ на фоні фторпіримідинів.
Вступ
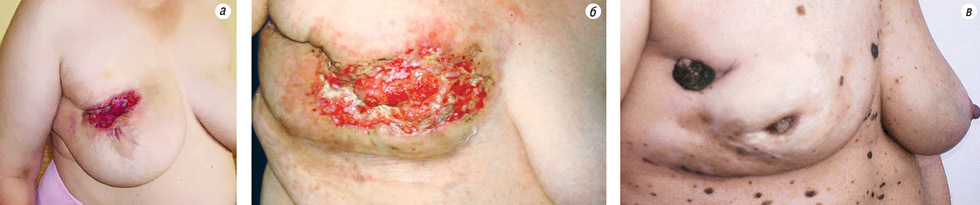
Рак грудної залози (РГЗ) займає перше місце серед жіночої онкопатології не лише в Україні, а й у всьому світі. Щороку в Україні більше 16 тис. жінок захворюють на РГЗ, а показники захворюваності та смертності на РГЗ невпинно зростають. У кожної четвертої пацієнтки на момент встановлення діагнозу реєструють місцево-поширені форми (МП) РГЗ, до яких відносять: поширення пухлини на шкіру грудної залози та на підлеглу грудну стінку (рис. 1), наявність метастатичного ураження іпсилатеральних надключичних та підключичних лімфатичних вузлів, аксилярних метастазів, фіксованих до оточуючих структур, або у вигляді конгломератів, набряково-інфільтруючу форму, а також наявність великої пухлини в маленькій залозі. Ці форми захворювання підпадають під рак IIБ–IIIБ стадії (за класифікацією TNM 6-ої редакції).
На першому етапі лікування МП первинно неоперабельного РГЗ використовують системну протипухлинну терапію, однак результати лікування залишаються невтішними, що спонукає до пошуку нових та вдосконалення існуючих схем комплексного лікування цього захворювання [2, 4, 10, 12].
У значної кількості хворих на первинно неоперабельні форми РГЗ цитотоксичний вплив системної (поліхіміотерапії) та локальної (променевої) протипухлинної терапії виявляється недостатнім, що обумовлено відносною радіорезистентністю більшості гістологічних форм пухлин [11, 14, 15]. У зв’язку з цим виникає необхідність пошуку додаткових факторів, здатних підсилювати променеве ушкодження пухлини та долати первинну та набуту резистентність злоякісних клітин грудної залози. Такі фактори називають хіміо- та радіомодифікаторами [3, 9], а поєднання кількох видів модифікації — полірадіомодифікацією [6]. Серед модифікаторів променевого ушкодження широко відомі методи фізичної та хімічної природи: гіпертермія, нетрадиційні режими фракціонування, гіпербарична оксигенація, гіперглікемія, використання електроноакцепторних сполук, цитостатиків. Хіміорадіомодифікатори підсилюють променеву деструкцію пухлинних клітин шляхом порушення механізмів репарації ДНК, впливу на кінетичні процеси (синхронізація клітинного циклу), девіталізації резистентних до променевого впливу гіпоксичних клітин пухлини. Рандомізовані дослідження з вивчення фармакокінетики 5-фторурацилу (5-ФУ) та його протипухлинної дії показали, що ефективність променевої терапії може бути значно підсилена за допомогою пролонгованих інфузій цього препарату [13]. Досягнення сучасної клінічної фармакології сприяли створенню препаратів фторпіримідинового ряду з можливістю перорального прийому. Їх фармакокінетичні властивості дозволяють підтримувати такі ж концентрації в плазмі, як і при внутрішньовенних пролонгованих інфузіях 5-ФУ, а завдяки впливу тимідин- та уридинфосфорилази утворення активного метаболіту 5-ФУ відбувається в значно більших концентраціях саме в пухлинних клітинах, що зменшує токсичний вплив на організм в цілому [7, 8].
Матеріали та методи дослідження
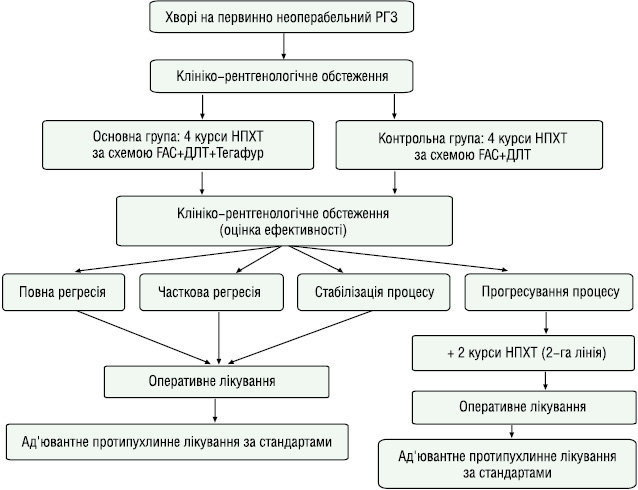
У Національному інституті раку (директор — професор Щепотін І.Б.) розроблено метод неоад’ювантної протипухлинної терапії при первинно неоперабельних формах РГЗ з використанням хіміорадіомодифікатора фторпіримідинового ряду (Патент № 63089, u201102768, 2011 р.). Під час дослідження проводили спостереження за 74 хворими на МП РГЗ (IIБ–IIIБ стадії захворювання) у віці від 45 до 72 років. Дизайн дослідження приведено на рис. 2. До I групи (основна) увійшло 36 пацієнток, котрим проводили комплексне лікування з використанням традиційної хіміопроменевої терапії (ХПТ) на фоні радіомодифікаторів (фторпіримідинів), при цьому пацієнтки отримали 4 курси неоад’ювантної поліхіміотерапії (НПХТ) за схемою FAC (циклофосфамід 500 мг/м, 5-ФУ 500 мг/м, доксорубіцин 50 мг/м) після чого — курс дистанційної променевої терапії (ДПТ) за радикальною програмою: грудна залоза (разова вогнищева доза (РВД) — 2 Гр, сумарна вогнищева доза (СВД) 40–45 Гр) пахвинні лімфатичні вузли (РВД — 2 Гр, СВД — 40 Гр) парастернальна та надключична області (РВД — 2 Гр, СВД — 40–45 Гр). Курс ДПТ проводили на фоні цитостатичного препарату тегафур (800 мг зранку і 400 мг увечері) з метою радіомодифікації. До II групи (контрольна) увійшли 38 пацієнток, для лікування яких використовували традиційну ХПТ, при цьому хворим було проведено 4 курси НПХТ за схемою FAC та 1 курс ДПТ за радикальною програмою. Розподіл хворих на РГЗ в залежності від віку та стадії захворювання був однорідним в обох групах.
Ефективність ХПТ у хворих на РГЗ визначали за ступенем регресії пухлини за критеріями RECIST (Response evaluation criteria in solid tumor) та ступенем вираженості лікувального патоморфозу. Моніторинг ефективності лікування проводили за допомогою клінічних обстежень, сонографічних та мамографічних досліджень у динаміці (до лікування, після першого етапу ХПТ та після її завершення). Дані ультразвукового дослідження (УЗД) та мамографії (ММГ) давали змогу об’єктивно оцінити розміри пухлини та її структуру. Застосування комплексного УЗД в режимах кольорового допплерівського картування (енергетичного та імпульсного) надавало додаткову інформацію про стан регіонарних лімфатичних вузлів та особливості васкуляризації пухлини. У ході дослідження вивчали токсичність протипухлинного лікування при стандартних та модифікованих схемах терапії.
Ефективність проведеного неоад′ювантного лікування оцінювали за допомогою визначення ступеня вираженості лікувального патоморфозу на підставі кількісного підрахунку залишкового пухлинного компонента згідно з критерієм часткового вмісту життєздатного резидуального пухлинного компонента (ЖРПК). Вираженість лікувального патоморфозу в пухлині, що був індукований неоад’ювантною протипухлинною терапією, є важливим прогностичним фактором рецидивування та подальшого перебігу захворювання [1, 5].
Отримані результати та їх обговорення
Нами проведено спостереження за перебігом захворювання всіх досліджених пацієнток від 6 міс до 2 років. Оцінку ефективності неоад’ювантної ХПТ проводили за допомогою ММГ у фронтальній і сагітальній проекціях та УЗД у динаміці після кожного етапу лікування. Залежно від відсотка відповіді регресію пухлини оцінювали як повну чи часткову. Також оцінювали стабілізацію процесу або його прогресування. Ефект від цитостатичної терапії, згідно з даними моніторінгових досліджень, був більш вираженим у хворих основної групи, яким проводили неоад’ювантну ХПТ на фоні радіомодифікаторів (фторпіримідинів). У 26 (72,22%) хворих спостерігали часткову або повну регресію пухлини грудної залози. У пацієнток контрольної групи, де застосовували традиційні курси ХПТ, повну та часткову регресію було зареєстровано лише у 17 (44,74%) хворих (табл. 1). Різниця між цими показниками є статистично вірогідною і демонструє кращий контроль над пухлиною при включенні в схему комплексного лікування фторпіримідинів, а саме препарату тегафур.
Таблиця 1 Безпосередні результати лікування хворих на МП РГЗ
| Ступінь регресії пухлини | I група (n=36) | II група (n=38) | p | ||
|---|---|---|---|---|---|
| абс. | % | абс. | % | ||
| Стабілізація | 10 | 27,78±7,47 | 21 | 55,26±8,07 | p<0,05 |
| Часткова регресія | 19 | 72,22±7,47 | 14 | 44,74±8,07 | p<0,05 |
| Повна регресія | 7 | 3 | |||
Токсичність лікування за розробленою та традиційною схемами оцінювали за критеріями ВООЗ. У табл. 2 представлено дані, що характеризують гематологічну токсичність у досліджуваних групах хворих. У хворих обох груп спостерігалося помірне зниження рівня гемоглобіну та короткочасне зменшення кількості лейкоцитів у периферичній крові, що не перевищувало ІІ ступеня токсичності. Випадків тромбоцитопенії не відзначено. Різниця показників гемопоезу у хворих дослідної та контрольної груп не була вірогідною. Корекцію анемії в обох групах реалізували призначенням препаратів заліза (Сорбіфер дурулес, Ферум-лек). Зниження доз хіміопрепарату при виявленні анемії І–ІІ ступеня не проводили. При подовженні термінів лікування у пацієнток обох груп збільшувалася кількість проявів анемії І ступеня, яку коригували застосуванням терапії супроводу. Прояви анемії ІІ ступеня при збільшенні терміну лікування було виявлено у 2 пацієнток основної та 3 контрольної групи. Найчастішим проявом гематологічної токсичності була лейкопенія (див. табл. 2). При порівнянні відповідних показників виявлено лейкопенію І та ІІ ступеня у пацієнток обох груп (61,11±8,12 та 55,26±8,07% відповідно), при цьому лейкопенія І ступеня зустрічалася у 47,22±8,32% випадків у хворих основної та у 42,11±8,01% контрольної групи, а лейкопенія ІІ ступеня — у 16,67±6,21 та 13,16±5,48% відповідно. Випадків лейкопенії ІІІ та IV ступеня тяжкості відзначено не було. При вивченні динаміки частоти лейкопеній, яка, як правило, виникає при лікуванні хворих на первинно неоперабельний РГЗ, можна зазначити, що її відсоток зростає у міру збільшення кількості проведених курсів цитостатичної терапії. Виникнення лейкопенії ІІ ступеня зі збільшенням тривалості курсів хіміотерапії було частішим (до 16,67±6,21%), але при адекватному застосуванні терапії супроводу (фенілкарбетоксиметилтіазолідинкарбонова кислота, метилурацил, дексаметазон та ін.) не виявлено впливу на подальше лікування. Кореляційний аналіз хворих обох груп показав, що суттєвої різниці у частоті побічних дій немає. Також при порівнянні результатів у пацієнток різного віку (до і після 65 років) відзначено, що гематологічні ускладнення у хворих виникали з однаковою частотою.
Таблиця 2 Показники гематологічної токсичності у хворих на РГЗ у процесі неоад’ювантного лікування
| Токсичність | I група (n=36) | II група (n=38) | p | |||
|---|---|---|---|---|---|---|
| Зміни показників гемопоезу | ||||||
| Анемія | 16 | 44,44±8,28% | 17 | 44,74±8,07% | p>0,05 | |
| І ступінь | 14 | 38,89±8,12% | 14 | 36,84±7,83% | p>0,05 | |
| ІІ ступінь | 4 | 11,11±5,24% | 3 | 7,89±4,37% | p>0,05 | |
| Лейкопенія | 22 | 61,11±8,12% | 21 | 55,26±8,07% | p>0,05 | |
| І ступінь | 17 | 47,22±8,32% | 16 | 42,11±8,01% | p>0,05 | |
| ІІ ступінь | 6 | 16,67±6,21% | 5 | 13,16±5,48% | p>0,05 | |
| Тромбоцитопенія | – | – | – | – | ||
Серед ускладнень з боку шлунково-кишкового тракту найчастіше спостерігалися нудота, блювота, діарея. Відзначено, що у хворих обох груп ступінь вираженості цих побічних явищ був тільки першим, вони проявлялися переважно на початку лікування, після прийому супровідної терапії (ондансетрон, домперидон та ін.) швидко зникали та негативного впливу на продовження лікування не мали. До закінчення протипухлинної терапії не зауважено суттєвих клінічно значущих відхилень, які б зумовили припинення подальшого лікування пацієнтів. Порушення функції печінки та нирок нами зареєстровано не було.
Порівняння даних аналізу частоти негативних явищ у хворих обох груп вказує на однакову адекватність обох режимів лікування за профілем токсичності. Застосування сучасних симптоматичних лікарських засобів при проведенні протипухлинної терапії зменшує глибину та тривалість токсичних ускладнень, що значно покращує загальний стан хворих на РГЗ та дозволяє проводити комплексне лікування у повному обсязі, без обмеження терміну.
Таким чином, у всіх випадках токсичність при застосуванні методу неоад’ювантної ХПТ із використанням фторпіримідинів за розробленою схемою не перевищувала ІІ ступеня і не чинила значного впливу на якість життя пацієнтів, що свідчить про безпечність застосування модифікованого режиму при лікуванні первинно неоперабельних хворих на РГЗ.
Наводимо конкретні приклади комплексного лікування хворих на РГЗ за розробленим методом.
Приклад №1
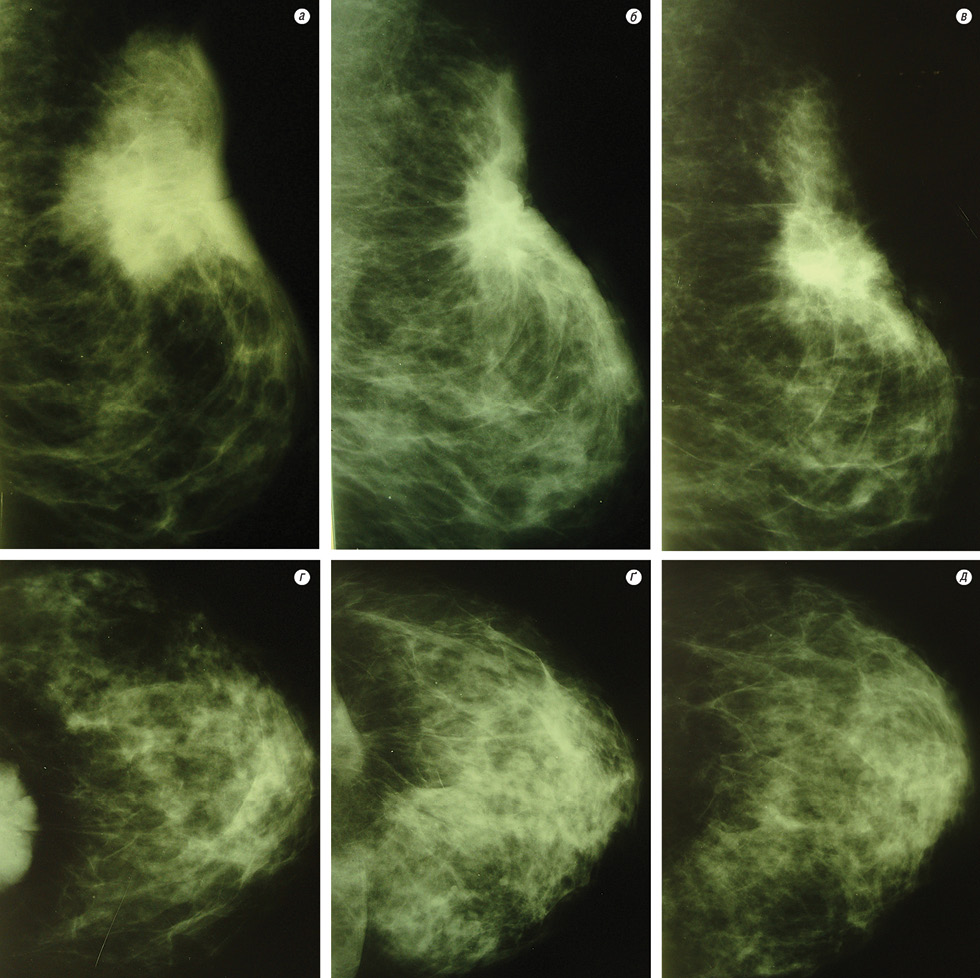
Хвора А.В.М., 1956 р.н., з діагнозом: рак обох грудних залоз T4bN2aM0, стадія ІІІБ, клінічна група II — отримала спочатку 4 курси НПХТ за схемою FAC, після чого при виконанні контрольного мамографічного дослідження виявлено позитивну динаміку (зменшення пухлини на 30% в правій та на 40% в лівій грудній залозі). Таким чином, після проведення 4 курсів ПХТ за схемою FAC у хворої встановлено часткову регресію пухлин. Після цього у пацієнтки застосовували курс ДПТ за радикальною програмою на тлі цитостатичного препарату тегафур (800 мг зранку і 400 мг увечері) з метою радіомодифікації. У процесі проведення ХПТ токсичних ускладнень не виявлено. Після лікування на контрольній ММГ встановлено часткову регресію пухлини правої грудної залози (75%) та повну регресію пухлини лівої грудної залози (рис. 3).
Приклад №2
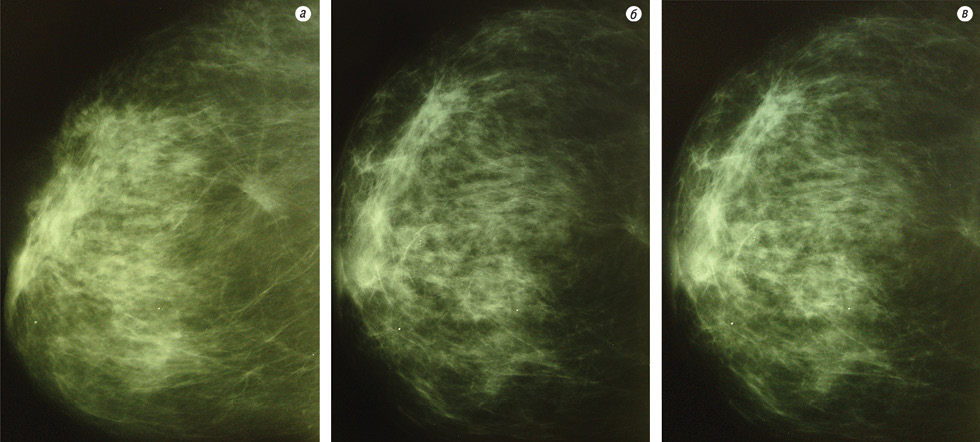
Хвора Д.Н.І., 1942 р.н., проходила лікування з приводу раку лівої грудної залози T4bN2aM0, мультицентричний ріст, стадія ІІІБ, клінічна група II. Після проведення 4 курсів НПХТ за схемою FAC (циклофосфамід 500 мг/м, 5-ФУ 500 мг/м, доксорубіцин 50 мг/м) на контрольній ММГ зафіксовано зменшення розмірів пухлин на 25% — стабілізація процесу. Після цього проведено курс ДПТ за радикальною програмою на тлі цитостатичного препарату тегафур та виконано контрольну ММГ. Зафіксовано часткову регресію пухлини лівої грудної залози (65%) (рис. 4).
Таким чином, включення до комплексного лікування хворих на МП РГЗ модифікованої ХПТ із застосуванням цитостатичного препарату тегафур дозволило збільшити на 27,5% кількість позитивних відповідей первинної пухлини, а саме випадків часткової та повної регресії, на неоад’ювантне протипухлинне лікування.
У процесі дослідження відзначено, що застосування ХПТ за розробленою технологією при комплексному лікуванні хворих на МП РГЗ не супроводжується розвитком післяопераційних ускладнень, не має протипоказань, не вимагає великих економічних витрат, легко переноситься хворими. Виявлені зміни показників гемопоезу, функції печінки не є лімітувальними факторами для застосування разом із стандартним лікуванням променевої терапії на фоні радіомодифікаторів.
Проведення НПХТ у всіх хворих на первинно неоперабельний РГЗ основної групи (із застосуванням модифікаторів) дозволило виконати радикальні операції, у тому числі й органозберігаючі та реконструктивно-відновні. 3 пацієнтки з контрольної групи не були прооперовані з причини наявності набряку тканини грудної залози. Інші хворі контрольної групи після неоад’ювантного лікування були також визнані операбельними, їм були виконані радикальні хірургічні втручання.
Таким чином, хірургічне лікування було проведено: в основній групі — у 36 хворих (100%), в контрольній — у 35 (92,1%). Із них: органозберігаючі операції — у 6 пацієнток основної групи (16,7%) та у 4 — контрольної (10,5%). Підшкірна мастектомія з одночасним ендопротезуванням виконана у 1 пацієнтки основної групи.
При вивченні лікувального патоморфозу відзначено, що в дослідній групі частковий вміст ЖРПК становив 13,02±2,3%, в контрольній групі — 31,44±2,9%. Доведено, що неоад’ювантна модифікована терапія сприяє погіршенню васкулярно-трофічного та метаболічного забезпечення життєдіяльності пухлинної паренхіми, дозволяє первинно неоперабельні пухлини перевести в резектабельні за рахунок їх редукції, сприяє створенню умов для зниження обсягу оперативного втручання, знижує стадію захворювання, знищує субклінічні мікрометастази та визначає доцільність продовження ПХТ в ад’ювантному режимі. Морфометрична оцінка ефективності лікувального патоморфозу МП РГЗ після неоад’ювантної терапії дає об’єктивну змогу на операційному матеріалі морфологічно визначити антибластомну ефективність її застосування, допомогає планувати та коригувати наступні етапи лікування. Доведено, що хворі з невиразним лікувальним патоморфозом первинної пухлини мають поганий прогноз, їх подальше лікування не покращує результатів, виникає велика ймовірність розвитку віддалених метастазів.
Отримані результати вивчення лікувального патоморфозу свідчать про ефективність та перспективність даного методу лікування для хворих МП РГЗ. Але тільки морфологічний аналіз пухлинного процесу як локального прояву захворювання не дає цілісного уявлення про ефективність лікування онкологічного хворого на рівні всього організму. Тому результати оцінювання терапевтичного патоморфозу пухлини необхідно співвідносити із віддаленими результатами виживаності.
Вивчено та проаналізовано частоту і термін виникнення рецидивів та віддалених метастазів після комплексного лікування з використанням неоад’ювантної ХПТ на фоні радіомодифікаторів (фторпіримідинів) порівняно з традиційними методами лікування на підставі аналізу історій хвороби та амбулаторних карт хворих, а також результатів їх об’єктивного та фізикального обстежень протягом всього спостереження (рис. 5).
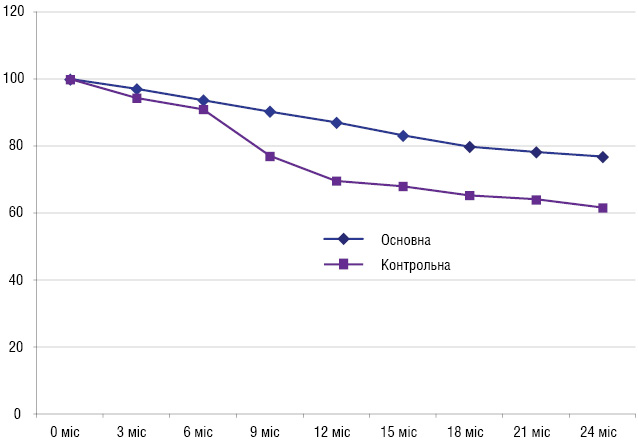
Максимальний термін спостереження за хворими на первинно неоперабельний РГЗ, які входили в основну та контрольну групи, становив 24,0±2,4 міс, середній строк спостереження — 12,6±4,1 міс, мінімальний — 6 міс. Різниця показників 2-річної загальної виживаності хворих обох груп не була статистично вірогідною і становила: в основній групі — 94,3±11,8%, а в контрольній — 94,6±10,4%. При вивченні показників 2-річної безрецидивної виживаності виявлено тенденцію до вірогідного збільшення її у пацієнтів основної групи, яким проводили ХПТ на фоні фторпіримідинів (показники виживаності в основній групі — 76,9±7,1%), у контрольній — 61,8±7,9%). Дані щодо віддалених результатів лікування є попередніми, детальний їх аналіз буде проведено в подальшому, вірогідність результатів залежить від кількості хворих, термін спостереження за якими становитиме 3 та більше роки.
Висновки
Підвищення ефективності комплексного лікування хворих на МП РГЗ можливе за умови поєднаного використання цитостатичних засобів, які посилюють деструктивні процеси у пухлині та взаємно доповнюють один одного.
Застосування ХПТ у поєднанні з тегафуром в якості модифікатора призводить до достовірного підвищення відсотка регресій пухлини, порівняно із застосуванням традиційної ХПТ, покращуючи таким чином контроль над пухлиною.
Додаткове введення в схему неоад’ювантної терапії фторпіримідинів, без підсилення токсичності лікування, призводить до покращення безрецидивної виживаності хворих на МП РГЗ.
Визначення лікувального патоморфозу, індукованого неоад’ювантною протипухлинною терапією, є необхідним критерієм прогнозування ефективності лікування, виживаності та ймовірності виникнення рецидивів захворювання.
ЛІТЕРАТУРА
1. Бондарь Г.В., Седаков И.Е., Балашова О.И., Хоменко А.В. (2011) Оценка патоморфологических изменений и выживаемости при селективной внутриартериальной полихимиотерапии местно-распространенного рака молочной железы. Морфологія, 1(5): 13–23.
2. Ввозный Э.К., Добровольская Н.Ю., Гуров С.Н. (2000) Некоторые аспекты неоадъювантной терапии местно-распространенного рака грудной железы. Этюды химиотерапии: Юбилейный сборник, М.: 90–98.
3. Гродзинський Д.М. (2000) Радіобіологія, К.: Либідь, 447 с.
4. Гуров С.Н. (1999) Неоадъювантная лучевая и лекарственная терапия при местно-распространенном раке грудной железы: Дис. канд. мед. наук: 14.00.19, 14.00.14., М.: 151 с.
5. Иванов С.Д., Ямшанов В.А., Корытова Л.И. и др. (2003) Прогнозирование гематотоксичности при лучевой и химиотерапии у больных раком грудной железы. Вопр. онкологии, 5(49): 601–607.
6. Козин С.В. (1992) Полирадиомодификация при экспериментальной лучевой терапии опухолей с использованием гипергликемии и локальной гипертермии: Автореф. дис. д-ра биол. наук, М.: 38 с.
7. Летягин В.П. (2004) Первичные опухоли грудной железы: Практическое руководство по лечению, М.: Миклош, 332 с.
8. Манзюк Л.В., Преводчикова Н.И., Горбунова В.А. и др. (2001) Фторафур — первый пероральный фторпиримидин в терапии метастатического колоректального рака. Современ. онкология, 4 (3): 1–5.
9. Мечов Д.С., Івчук В.П. (2005) Радіомодифікація пухлин — реальна перспектива підвищення ефективності променевого лікування. Променева діагностика, променева терапія, 4: 58–61.
10. Сивак Л.А., Лялькін С.А., Майданевич М.М. и др. (2011) Сучасні аспекти неоад’ювантної поліхіміотерапії у лікуванні хворих на рак молочної залози. Онкология, 2(13): 100–102.
11. Тимовська Ю.О., Поліщук Л.З., Новак О.Є., Чехун В.Ф. (2011) Можливі причини варіабельності безпосередньої ефективності неоад’ювантної поліхіміотерапії у хворих на місцево-поширений рак молочної залози. Онкология, 2(13): 104–108.
12. Bonadonna G., Zambetti M., Bumma C. et al. (2002)Multimodal treatment with primary single-agent epirubicin in operable breast cancer: 5-year experience of the Michelangelo Cooperative Group. Ann. Oncology,. 7(13): 1049–1058.
13. Endo M., Shinbori N., Fukase Y. et al. (1999) Induction of thymidine phosphorylase expression and enhancement of efficacy of capecitabine or 5’deoxy-5-fluorouridine by cyclophosphamide in mammary tumor models. Int. J. Cancer, 83: 127–134.
14. Jameel J.K., Rao V.S., Cawkwell L., Drew P.J. (2004) Radioresistance in carcinoma of the breast. Breast., 6(13): 452–460.
15. Peacock J., Ashton A., Bliss J. et al. (2000) Cellular radiosensitivity and complication risk after curative radiotherapy. Radiother. Oncology, 3(55): 173–178.
Использование модификаторов — путь к повышению эффективности лечения больных первично неоперабельным раком грудной железы
Резюме. В статье представлены данные исследования эффективности метода неоадъювантной комплексной противоопухолевой терапии с использованием химиорадиомодификатора фторпиримидинового ряда и проанализированы непосредственные результаты лечения с использованием стандартных и разработанных методов лечения больных местно-распространенным раком грудной железы. В ходе исследования установлено, что проведение неоадъювантной химиолучевой терапии (ХЛТ) на фоне модификатора позволило увеличить на 27,5% количество ответов первичной опухоли на лечение, а именно случаев частичной и полной регрессии, и расширило показания к выполнению хирургических вмешательств. Дополнительное введение в схему неоадъювантной терапии фторпиримидинов не усиливало токсичность лечения. При изучении показателей безрецидивной выживаемости выявлено тенденцию к вероятному увеличению ее у больных основной группы, которым проводили ХЛТ на фоне фторпиримидинов.
рак грудной железы, химиолучевая терапия, радиомодификаторы, фторпиримидины, лечебный патоморфоз, безрецидивная выживаемость.














Leave a comment