ІНТРАОПЕРАЦІЙНА ПРОМЕНЕВА ТЕРАПІЯ В КОМПЛЕКСНОМУ ЛІКУВАННІ РАКУ ГРУДНОЇ ЗАЛОЗИ (огляд літератури)
Щепотін І.Б.1, Зотов О.С.2, Жежерун М.О.2
Резюме. Проведено огляд літератури та аналіз досліджень щодо застосування інтраопераційної променевої терапії (ІОПТ) при раку грудної залози. Отримані результати свідчать, що застосування ІОПТ не погіршує показників виживаності й тривалості безрецидивного періоду, косметичний ефект, а також має економічну доцільність. Застосування ІОПТ потребує подальших досліджень.
 За даними Національного канцер-реєстру України, у 2010 році зареєстровано 16 165 випадків злоякісних новоутворень грудної залози. Кількість зареєстрованих смертей становила 7662 випадків. З числа тих, хто захворів вперше, 75,6% мали стадію І–ІІ (згідно з TNM) [8]. Удосконалення основних методів лікування раку на І–ІІ стадії сьогодні є пріоритетним завданням сучасної онкології. У цьому аспекті актуальним є дослідження методу інтраопераційного променевого лікування, застосування якого може бути доцільним на ранніх стадіях розвитку раку грудної залози (РГЗ).
За даними Національного канцер-реєстру України, у 2010 році зареєстровано 16 165 випадків злоякісних новоутворень грудної залози. Кількість зареєстрованих смертей становила 7662 випадків. З числа тих, хто захворів вперше, 75,6% мали стадію І–ІІ (згідно з TNM) [8]. Удосконалення основних методів лікування раку на І–ІІ стадії сьогодні є пріоритетним завданням сучасної онкології. У цьому аспекті актуальним є дослідження методу інтраопераційного променевого лікування, застосування якого може бути доцільним на ранніх стадіях розвитку раку грудної залози (РГЗ).
Інтраопераційна променева терапія (ІОПТ) — особлива технологія променевого лікування, що полягає у підведенні одноразової дози іонізуючого випромінювання під час хірургічної операції на ложе видаленої пухлини, а також на зони найбільш ймовірного розвитку рецидивів.
Вперше спробу застосування ІОПТ було описано в 1915 році: у відкритій операційній рані було опромінено рентгенівськими променями неоперабельні пухлини шлунка та товстої кишки, після чого ця техніка мала невелику популярність як метод паліативного лікування у випадках неоперабельних пухлин. У 30-х рр. було розроблено технічне обладнання для «контактної» рентгенотерапії з потужністю 50–100 кВ. Проте дуже низька проникаюча здатність тогочасної техніки перешкоджала розповсюдженню ІОПТ. Дослідження з цього приводу до 80-х рр. не мали великого наукового та практичного значення.
Новий етап застосування ІОПТ розпочався з публікацій японських авторів М. Абе та М. Такахаши, які оприлюднили інформацію про лікування 727 пацієнтів (1964–1981 рр.). У своїх роботах вони зазначили, що ІОПТ дає позитивні результати для місцевого контролю росту пухлин [9]. У роботах того часу розглядали єдиний варіант ІОПТ — у каньйоні прискорювача. Для цього під час хірургічного втручання необхідно організувати переміщення пацієнта з операційної під наркозом при збереженні стерильності, що було складною організаційною задачею.
На початку 90-х рр. нові технології дозволили проводити опромінення безпосередньо в операційній, і проблему щодо переміщення пацієнта було ліквідовано. Останні розробки у цій галузі дозволяють встановлювати апарати для опромінення у стандартній операційній, оскільки вони не потребують спеціального радіаційного захисту [5]. Хоча ця технологія є більш перспективною, обидва варіанти (опромінення в каньйоні прискорювача та безпосередньо в операційній) використовуються дотепер.
Застосування ІОПТ швидко розповсюджується. Сьогодні більше 150 медичних закладів по всьому світу активно використовують цю методику, зареєстровано більше 700 публікацій за останні 10 років [17]. На кінець 2009 р. налічується близько 57 програм, в яких пацієнти можуть отримати експериментальну ІОПТ. У Зальцбурзі (Австрія) в такій програмі протягом 1998–2009 рр. взяли участь 1840 пацієнтів, з них 1630 — з раннім РГЗ.
Метою ІОПТ є збільшення абластики оперативних втручань, зменшення кількості рецидивів, підвищення показників загальної виживаності пацієнтів [3]. Найголовнішою перевагою ІОПТ є підведення високої дози до ложа видаленої пухлини з одночасною мінімізацією опромінення сусідніх тканин. Застосування цього методу змушує переглянути оптимальні межі дозування та розподілу цієї дози. Біологічна ефективність разової дози при ІОПТ відповідає дозі при далекодистанційній гамма-терапії (ДГТ), яка у 1,5–2,5 раза вища. Для розрахунку дозування при ІОПТ застосовують лінійно-квадратичну модель, модель «час-доза-фракціонування» та мультитаргетну модель клітинної виживаності. Для порівняння ІОПТ та стандартного фракціонування (по 2 Гр) можна застосувати формулу (за лінійно-квадратичною моделлю):
DIORT = (½)([α⁄β] + 4D2Gy [α⁄β+2] − α⁄β),
де D — сумарна доза, α та β — параметри моделі. Відношення α⁄β є характерним для кожного типу тканин (нормальної тканини чи пухлини) [15]. Графічне зображення еквівалентних доз при ІОПТ та ДГТ подано на графіку (рис. 1).
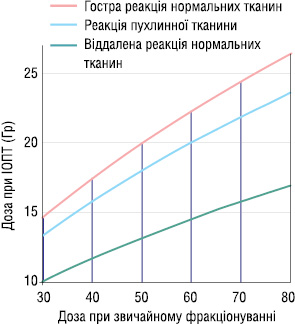
Рис. 1. Приблизний біологічний ефект від дози ІОПТ порівняно зі стандартним фракціонуванням (по 2 Гр) для пухлинної та нормальної тканини (гостра та віддалена реакція)
Ще однією перевагою ІОПТ є можливість доставки радіосенсибілізуючих препаратів прямо на місце опромінення, що дає поштовх для наступних досліджень.
Існує декілька варіантів застосування ІОПТ: застосування ІОПТ як єдиного методу променевого лікування або поєднання ІОПТ та ДГТ. Поєднання ІОПТ та ДГТ можливе у двох варіантах: ІОПТ після перерви (приблизно 2 тиж) доповнюється ДГТ, або спочатку проводять передопераційну ДГТ, після якої відбувається операція з використанням ІОПТ.
Обґрунтуванням для застосування ІОПТ є наступні фактори: по-перше, хірургічна операція не дає необхідного рівня місцевого контролю, по-друге, доза при ДГТ перевищує толерантну для шкіри, по-третє, ІОПТ сама собою або з подальшою ДГТ дає кращі результати у співвідношенні «лікування — ускладнення», ніж лише ДГТ. Використання ІОПТ є доцільним лише за відсутності віддалених метастазів.
ІОПТ застосовують при комбінованому лікуванні таких злоякісних новоутворень, як РГЗ, рак шлунка, легень, ободової та прямої кишки [1], стравоходу, підшлункової залози [16], рак матки, шийки матки [7], пухлини опорно-рухового апарату. Також є дані про використання даного методу при пухлинах щитоподібної залози, навколоносових пазух тощо [2] (рис. 2).
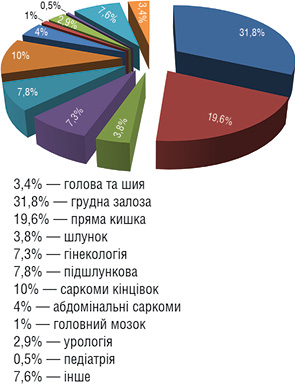
Рис. 2. Частота використання ІОПТ для лікування раку різної локалізації у європейських медичних закладах
Застосування ІОПТ для лікування РГЗ є одним з провідних напрямів цього методу сьогодні, проте використання методу, згідно з проведеними дослідженнями, має значні обмеження: вік хворих >40 років, наявність одного вогнища розміром не більше 2,5 см, «чисті» краї резекції, гістологічна форма — протокова аденокарцинома, без ураження лімфатичних вузлів.
Стандарти лікування РГЗ на ранніх стадіях (T1-2N0M0) при проведенні органозберігаючого хірургічного втручання включають застосування ад’ювантної променевої терапії (СВД 50 Гр на всю грудну залозу та 10–20 Гр — місцеве опромінення ложа видаленої пухлини («буст»)). Тривалість курсу в середньому становить 5 тиж [21]. ІОПТ як альтернативний метод променевого лікування дозволяє скоротити курс в середньому на 2–3 тиж або взагалі уникнути післяопераційного опромінення.
Сама процедура складається з декількох етапів: підготовка, калібровка апарата, підбір аплікаторів. Остаточне рішення про проведення ІОПТ приймається безпосередньо після видалення пухлини, гемостазу та вивчення операційного поля. Гемостаз є вкрай важливим моментом, оскільки накопичення рідини під час опромінення може суттєво знизити дозу опромінення та негативно вплинути на кінцевий результат. Після видалення пухлини визначається порожнина, що опромінюється, при терміновому гістологічному дослідженні вивчаються краї резекції, сторожовий лімфатичний вузол. Опромінення ложа видаленої пухлини та шляхів лімфовідтоку проводять у дозі 10–20 Гр. Під час опромінення персонал має залишити операційну, спостереження ведеться за допомогою відеонагляду (при контактній рентгенотерапії допускається знаходження персоналу за рентгенівською ширмою). Для захисту здорових тканин використовують вольфрамовану гуму, а також додаткове екранування алюмінієвими пластинками товщиною 7 мм, які знижують променеве навантаження на 96%.
Залежно від типу опромінення виділяють такі види ІОПТ: електронне випромінювання за допомогою лінійних прискорювачів, радіонуклідне випромінювання (брахітерапія) та контактну рентгенотерапію (табл. 1).
Таблиця 1. Порівняльна характеристика основних видів ІОПТ [14]
| Електронне опромінення | Радіонуклідне опромінення | Рентгенівське опромінення | |
|---|---|---|---|
| Джерело опромінення | Лінійні прискорювачі, бетатрони | Радіоактивне джерело (Ir, Yb) | Рентгенівська трубка |
| Час опромінення | 2–4 хв | 5–30 хв | 30–45 хв |
| Загальний час процедури | 30–45 хв | 45–120 хв | 45–120 хв |
| Область опромінення | Максимальна доступність, глибина проникнення регулюється | Область, при якій зона ризику знаходиться на відстані 0,5–1 см від поверхні аплікатора | Область, при якій зона ризику знаходиться на відстані 0,5–1 см від поверхні аплікатора; тільки якщо маленьке ложе пухлини |
| Поверхнева доза | 75–93% | 200% | 300% |
| Доза на глибині 2 см | 70–100% | 30% | 20% |
| Захист від радіації в операційній | Є необхідність у захисті | Максимально високий рівень захисту | Немає необхідності у захисті (за рахунок невисокої енергії — 50 кВ) |
Основною перевагою радіонуклідного методу є його можливість застосування у важкодоступних місцях, на нерівних анатомічних поверхнях, де стандартні аплікатори не можуть точно опромінити необхідну ділянку (тазова порожнина, грудна порожнина). У всіх інших аспектах (рівень захисту, загальний час процедури тощо) цей метод не має особливих переваг, тому застосування його при лікуванні РГЗ є менш доцільним.
Метод контактної рентгенотерапії має велику перевагу за рахунок того, що не потребує спеціального захисту. Під час опромінення радіаційний фон не перевищує норму поза межами операційної. Використовують низьковольтні апарати Intrabeam та Xoft Axxent. Основні дослідження, проведені за даною методикою, стосуються саме Intrabeam (табл. 2). Потрібно також зауважити, що результати дослідження для одного апарата не можуть бути застосовані для іншого, оскільки вони мають різні технічні характеристики (табл. 3).
Таблиця 2. Дослідження, проведені щодо використання ІОПТ при РГЗ (метод контактної рентгенотерапії)
| Назва дослідження | Методи | Результати | Висновки |
|---|---|---|---|
| Vaidya J., Joseph D., Tobias S. et al. Targeted intraoperative radiotherapy versus whole breast radiotherapy for breast cancer (TARGIT-A trial: an international, prospective, randomized, non-inferiority phase 3 trial) [26]. | У дослідження включено 2232 пацієнтки віком ≥45 років з інвазивною протоковою карциномою грудної залози (І–ІІ стадія). 1113 пацієнток отримали ІОПТ (контактна рентгенотерапія, 5–20 Гр), з них 14% ІОПТ та ДГТ. Контрольна група (1119 пацієнток) отримала ДГТ. | Термін спостереження за пацієнтами — 4 роки. Різниця у виникненні місцевих рецидивів у 2 групах становила 0,25% (6 у групі, що отримала ІОПТ, та 4 —у контрольній). Частота ускладнень була однаковою. Загальна інтоксикація від променевої терапії була нижчою у групі, що одержала ІОПТ (6 пацієнток), ніж у контрольній (23 пацієнтки). | Для пацієнток з інвазивною протоковою карциномою грудної залози разова доза променевої терапії під час операції може замінити подальший курс ДГТ. |
| Belletti B., Vaidya J., D’Andrea S. et al. Targeted Intraoperative Radiotherapy Impairs the Stimulation of Breast Cancer Cell Proliferation and Invasion Caused by Surgical Wounding [10]. | Досліджено рідину, взяту з хірургічних ран після оперативного втручання з приводу РГЗ. Досліджувана група — 45 пацієнток, з них 20 отримали ІОПТ, 25 — контрольна група. | Рідина з рани стимулює інвазію та проліферацію ракових клітин. У пацієнтів, що отримали ІОПТ, такого ефекту не спостерігали, експресія декількох цитокінів була змінена, що завадило активізації внутрішньоклітинних шляхів передачі сигналу. | ІОПТ на ложе пухлини змінює молекулярний склад та біологічну активність ранової рідини. Тому принцип дії тут інший, ніж при ДГТ. Цим частково можна пояснити дуже низький рівень рецидивів, описаних в експериментальному дослідженні Targit . |
| Tiefenbacher U., Scheda A., Steil V. et al.Intraoperative radiotherapy for breast cancer using the Intrabeam TM system [24]. | 57 пацієнток з карциномою грудної залози (діаметр на більше 3 см) отримали ІОПТ (контактна рентгенотерапія). Середній вік — 63 роки. 33 пацієнтки отримали лише ІОПТ, 24 — ІОПТ та ДГТ. | Спостереження — 18 міс. Післяопераційні ускладнення: гематоми (3%) — у групі, що отримала ІОПТ з ДГТ. Серома — у 3 пацієнток із групи ІОПТ з ДГТ і у 1 з групи, що отримали лише ІОПТ. 1 випадок місцевого рецидиву з віддаленими метастазами через 10 міс (у групі, що отримали ІОПТ з ДГТ). 2 випадки віддалених метастазів. | Використання ІОПТ не викликає збільшення кількості післяопераційних ускладнень, знижує негативний вплив променевої терапії на здорові тканини. |
Таблиця 3. Порівняльна характеристика Intrabeam та Xoft Axxent [11, 12]
| Джерело випромінення | Доза на поверхні | Доза на глибині 1 см | Тип аплікатора | Час опромінення | |
|---|---|---|---|---|---|
| Intrabeam™ | Рентгенівські промені (50 кВ) | 20 Гр | 5 Гр | Сферичний | 20–45 хв |
| Xoft™ | Рентгенівські промені (50 кВ) | 20 Гр | 9–10 Гр | Катетер | 17–26 хв |
Щодо дослідження TARGIT-A необхідно зазначити, що сумарна доза опромінення з використанням ІОПТ є набагато нижчою, ніж при звичайній ДГТ, з однаковим результатом. Таке дослідження змушує переглянути основні принципи лікування злоякісних пухлин, що полягають не тільки в знищенні пухлинних клітин, а й у зміні самого мікрооточення пухлини, яке не дозволяє їй в подальшому розвиватися.
Апарат Xoft Axxent був представлений лише у 2008 році, тому клінічних випробувань фактично ще не пройшов, його використання не поширене сьогодні. Перш за все, його перевага полягає у більшій гнучкості аплікаторів.
Дослідження щодо косметичного ефекту при використанні контактної рентгенотерапії представлено в табл. 4.
Таблиця 4. Косметичний ефект після ІОПТ (метод контактної рентгенотерапії)
| Назва дослідження | Методи | Результати | Висновки |
|---|---|---|---|
| Keshgar M., Williams N., Corica T. et al. Cosmetic outcome 1, 2, 3, and 4 years after intraoperative radiotherapy or external beam radiotherapy for early breast cancer: An objective assessment of patients from a randomized controlled trial [18] | 114 пацієнток, 2 групи: після ІОПТ та після ДГТ, оцінювання за фотографіями (симетрія, колір, шрам) | Оцінювання протягом 4 років. Виділено 4 групи (відмінний результат, добрий, задовільний, незадовільний). В групі, що отримала ІОПТ, в 1 рік добрий та відмінний результат отримало в 2,35 раза більше пацієнтів. | Через 1 рік після оперативного втручання косметичний ефект кращий після ІОПТ, ніж після ДГТ. |
| Kraus-Tiefenfacher U. et al. IORT with low-energy x-rays for breast cancer [19]. | 133 пацієнтки, із них 71 отримала ІОПТ, інші — ІОПТ та ДГТ. | Строк спостереження — 28 міс. Основні побічні ефекти: еритема (5%), погане загоєння рани (4%), мастит (1%), серома (4%). Через 2 роки фіброзні ущільнення у 25%. | Післяопераційні ускладнення помірні. |
| Elliott R. et al. Accelerated partial-breast irradiation with the Intrabeam intraoperative radiotherapy system [20]. | 94 пацієнтки, із них 90 отримали тільки ІОПТ, 4 — ІОПТ і ДГТ. | Косметичний ефект оцінювали за Гарвардськими критеріями (відмінний результат, хороший, задовільний, незадовільний). У всіх пацієнток результат було оцінено як хороший і відмінний. | Контактна рентгенотерапія дає хороший косметичний результат. |
Метод електронного випромінювання є не менш розповсюдженим, ніж контактна рентгенотерапія [22]. При цьому використовують лінійні прискорювачі та бетатрони (Novac7, Mobetron). Основні дослідження за даним методом представлено в табл. 5.
Таблиця 5. Дослідження, проведені щодо використання електронної ІОПТ при РГЗ
| Назва дослідження | Методи | Результати | Висновки |
|---|---|---|---|
| Veronesi U., Orecchia R., Luini A. et al. Full-Dose Intraoperative Radiotherapy With Electrons During Breast-Conserving Surgery. Experience With 1822 Cases [27]. | 1822 пацієнтки з часточковою карциномою грудної залози (діаметр пухлини до 2,5 см) отримали ІОПТ у разовій вогнищевій дозі 21 Гр (еквівалентно 58–60 Гр при ДГТ) | Спостереження протягом 10 років. У 1,8% розвився післяопераційний фіброз,у 4,2% — ліпонекроз. Через 3 роки у 2,3% пацієнток — місцеві рецидиви, у 1,4% розвинулася іпсилатеральна карцинома, у 1,4% — віддалені метастази. 5- та 10-річна виживаність становила 97,4 та 89,7% відповідно. | ІОПТ — безпечний метод променевої терапії, що дозволяє уникнути післяопераційного курсу ДГТ, скорочує променеве лікування від 6 тиж до 1 процедури. Зменшує навантаження на здорові тканини. Має економічну доцільність. |
| Слонимская Е.М., А.В.Дорошенко, Е.Ю. Гарбуков.Интраоперационная лучевая терапия в органосохраняющем раке грудной железы. Ближайшие и отдаленные результаты [6]. | 131 пацієнтка з РГЗТ1-2N0-3M0, вік 20–69 років. Для ІОПТ був використаний малогабаритний бетатрон МІБ-6Е (у дозі 10 Гр). ДГТ в післяопераційний період в сумарній вогнищевій дозі становив 45–48 Гр. | Максимальні строки спостереження — 40 міс. Гіперемію та набряк шкіри І ступеня спостерігали у 48,8% пацієнтів, ІІ — у 9,1%, ІІІ — у 5,3%. Віддалені метастази — 3%. Місцеві рецидиви не діагностовано. Показники 3-річної загальної виживаності становили 96,5%, безметастатичної — 96%, безрецидивної — 100%. | Використання ІОПТ не має негативного впливу на хід операції, частоту та характер післяопераційних ускладнень. Косметичні результати відзначено як хороші. Проведення ІОПТ не погіршує віддалених онкологічних показників. |
| Lemanski C. Intraoperative radiothepary given as a boost for early breast cancer: long-term clinical and cosmetic results [20] | 50 пацієнток отримали ІОПТ у дозі 10 Гр та післяопераційну ДГТ у дозі 50 Гр. | Протягом 9,1 року виникло 8 місцевих рецидивів (16%). Фіброз спостерігався в 6 випадках. 5 пацієнток померли.Якість життя та косметичний ефект оцінювався за різними критеріями і був відзначений як відмінний та хороший. | ІОПТ при органозберігаючих операціях при РГЗ — надійна альтернатива постопераційній променевій терапії. |
| Assessment of Pulmonary Fibrosis after Radiotherapy (RT) in Breast Conserving Surgery: Comparison between Conventional External Beam RT (EBRT) and Intraoperative RT with Electrons (ELIOT) [23]. | 178 пацієнток, із них 83 отримали ДГТ (50 Гр на всю грудну залозу та 10 Гр буст), 95 — ІОПТ (21 Гр). Дослідження щодо впливу променевої терапії на виникнення легеневого фіброзу. Вік — не молодші 48 років, пухлина в діаметрі не більше 2,5 см. | Легеневий фіброз був діагностований у 23% пацієнток, з них 90% — пацієнтки, що отримали ДГТ, 10% — пацієнтки, що отримали ІОПТ. Ризик розвитку леневевого фіброзу I ступеня після ІОПТ менший за такий при ДГТ у 19 разів, II ступеня — у 6 разів. | Ризик розвитку леневевого фіброзу після ІОПТ набагато менший за такий при ДГТ. ІОПТ менше пошкоджує оточуючі здорові тканини. |
Відома також спроба групи авторів проводити ІОПТ до видалення пухлини [24]. Така послідовність дає можливість оцінити реакцію пухлини і здорової тканини на опромінення при вивченні біопсійного матеріалу, отриманого до і після проведення ІОПТ [4].
Розроблено рекомендації щодо використання ІОПТ на лінійних прискорювачах для вагітних жінок: застосування ІОПТ у I триместр допустиме у повній дозі (21 Гр), у II та III триместр — у дозі 12 Гр з подальшою ДГТ, після 30 тиж вагітності застосування ІОПТ не рекомендоване [13].
Групою вчених також було підраховано, що застосування ІОПТ має суттєву економічну доцільність: лише за людино-годинами ІОПТ скорочує витрати на 66% [25].
Існує також декілька спірних моментів щодо застосування ІОПТ. Перш за все, це проведення самої процедури до вивчення країв резекції та дослідження лімфатичних вузлів [4], а також невизначеність з віддаленою клінічною ефективністю, вивченою недостатньо в силу обмеженості в часі більшості досліджень.
Підсумовуючи дані літератури можна зробити наступні висновки:
1) Для пацієнток, старших 50 років, з РГЗ T1-T2N0M0 низької диференціації ER +, HER2 + застосування ІОПТ є ефективною альтернативою ДГТ.
2) Якщо пацієнтка з РГЗ (T1-T2N0M0) не підходить під дану категорію, то використання ІОПТ також можливе у поєднанні з подальшою ДГТ. У такому випадку ІОПТ скорочує курс ДГТ на 2–3 тиж.
3) Показники загальної виживаності, тривалості безрецидивного періоду при ІОПТ не нижчі, ніж такі при ДГТ.
4) ІОПТ не погіршує косметичний ефект оперативного втручання.
5) ІОПТ має економічну доцільність.
6) Дана методика потребує подальших досліджень, на сьогодні не існує єдиної точки зору з приводу підбору доз та чіткого відбору пацієнтів для ІОПТ.
Література
1. Бердов Б.А., Евдокимов Л.В. (2011) Возможности лучевой терапии в комбинированном лечении рака ободочной кишки. Материалы VII Российской онкологической конференции: 50-–52.
2. Завьялов А.А., Мусабаева Л.И, Лисин В.А. (2004) Пятнадцатилетний опыт применения интраоперационной лучевой терапии. Сибирский онкологический журнал, 2: 75–84.
3. Лядов К.В., Синякин С.Ю., Крымский А.В. (2007) Первый опыт применения интраоперационной контактной рентгенотерапии установкой Intrabeam в лечении местно-распространенного колоректального рака, Zeiss, 42: 1–2.
4. Мусабаева Л.И., Старцева Ж.А. (2011) Интраоперационная электронная и дистанционная гамма-терапия рака молочной железы I–II стадий заболевания (обзор литературы). Сибирский онкологический журнал, 2: 79–85.
5. Павлов А.С., Фадеева М.А., Карякина Н.Ф. и др. (2005) Линейно-квадратичная модель в расчетах изоэффективных доз, в оценке противоопухолевого эффекта и лучевых реакций и осложнений при лучевой терапии злокачественных опухолей: пособие для врачей. Медицинская физика, 28(4): 67–68
6. Слонимская Е.М., Дорошенко А.В., Гарбуков Е.Ю. и др. (2008) Интраоперационная лучевая терапия в органосохраняющем раке молочной железы. Ближайшие и отдаленные результаты. Сибирский онкологический журнал, 2: 78–79.
7. Тец-Арутюнанц С.В. Интраоперационная лучевая терапия у больных раком шейки матки: Дис. канд. мед. наук: Москва, 2005. 91с.
8. Федоренко З.П., Гулак Л.О., Горох Є.Л. (2011) Рак в Україні 2009–2010. Бюлетень Національного канцер-реєстру України, №12.
9. Abe M., Takahashi M. et al. (1981) Intraoperative radiotherapy: the Japanese experience. International Journal of Radiation Oncology, 7: 863–868
10. Belletti B., Vaidya J., D’Andrea S. et al. (2008) Targeted Intraoperative Radiotherapy Impairs the Stimulation of Breast Cancer Cell Proliferation and Invasion Caused by Surgical.Clinical Cancer Research, 14: 1–2.
11. Dickler A., Ivanova O., Francescatti D et al. (2009) Intraoperative radiation therapy in the treatment of early-stage breast cancer utilizing xoft axxent electronic brachytherapy. World Journal of Surgical Oncology, 7: 1–6.
12. Elliott R., Deland M., Head J. (2011) Accelerated partial-breast irradiation with the Intrabeam intraoperative radiotherapy system. Journal of Clinical Oncology, 29: 45–49
13. Galimberti V., Ciocca M., Leonardi M. et al. (2009) Is electron beam intraoperative radiotherapy (ELIOT) safe in pregnant women with early breast cancer? In vivo dosimetry to assess fetal dose. Annals of Surgery Oncology, 16: 100–105.
14. Gunderson L., Willett C., Calvo F. (2011) Intraoperative irradiation: techniques and results, 2 edition: New York, 548 p.
15. Halperin E.C., Perez C.A., Brady L.W. (2008) Perez and Brady’s Principles and Practice of Radiation Oncology, 5 edition. Philadelphia, 2070 p.
16. Hensley F., Biggs P, Krempien R. et al. (2007) Overview of IORT activities in Europe.Radiotherapy Oncology, 83(1): 78–83.
17. International society of intraoperative radiation therapy. 7 international conference. Available at http://www.isiortmeeting2012.org/Index.html.
18. Keshtgar M., Williams N. R., Corica T. et al (2011) Cosmetic outcome 1, 2, 3, and 4 years after intraoperative radiotherapy or external beam radiotherapy for early breast cancer: An objective assessment of patients from a randomized controlled trial. Journal of Clinical Oncology, 29: 56–58.
19. Kraus-Tiefenbacher U., Herskind C., Bauer L. et al (2007) Intraoperative radiotherapy (IORT) with low-energy x-rays for breast cancer. Journal of Clinical Oncology, 25: 67–69.
20. Lemanski C., Azria D., Thezenas S. et al (2006) Intraoperative radiothepary given as a boost for early breast cancer: long-term clinical and cosmetic results. Int. J. Rad. Onc. Biol. Phys, 64: 1410–1415.
21. National Cancer Institute of the USA. Breast cancer treatment. Available at http://www.cancer.gov/ cancertopics/pdq/treatment/breast/health professional.
22. Olilla D., Klauber-DeMore N., Tesche L. et al (2007) Feasibility of Breast Preserving Therapy with Single Fraction In Situ Radiotherapy Delivered Intraoperatively, Annals of Surgical Oncology, 14: 660–669.
23. Rampinelli C., Bellomi M., Ivaldi G. et al. (2011) Assessment of Pulmonary Fibrosis after Radiotherapy (RT) in Breast Conserving Surgery: Comparison between Conventional External Beam RT (EBRT) and Intraoperative RT with Electrons (ELIOT), Technology in cancer research and treatment, 10: 323–329.
24. Tiefenbacher U. , Scheda A. , Steil V. et al. (2005) Intraoperative radiotherapy for breast cancer using the Intrabeam system. Tumori, 91: 339–345.
25. Tobias J., Vaidya J., Keshtgar M. et al. (2004) Reducing radiotherapy dose in early breast cancer: the concept of conformal intraoperative brachytherapy. The British Journal of Radiology, 77: 279–284.
26. Vaidya J.S., Joseph D.J., Tobias J.S. (2010) Targeted intraoperative radiotherapy versus whole breast radiotherapy for breast cancer (TARGIT-A trial): an international, prospective, randomised, non-inferiority phase 3 trial. The Lancet, 376: 91–102.
27. Veronesi U. , Orecchia R., Luini A. et al. (2010) Full-Dose intraoperative radiotherapy with electrons during breast-conserving surgery. Experience with 1822 cases. Breast Cancer Research and Treatment, 124: 141–151.
Интраоперационная лучевая терапия в комплексном лечении рака грудной железы (обзор литературы)
Резюме. Проведен обзор литературы и анализ исследований касательно применения интраоперационной лучевой терапии при раке грудной железы. Полученные результаты свидетельствуют, что применение интраоперационной лучевой терапии не ухудшает показатели выживаемости и длительности безрецидивного периода, косметический эффект, а также имеет экономическую целесообразность. Применение интраоперационой лучевой терапии требует дальнейших исследований.
интраоперационная лучевая терапия, контактная рентгенотерапия, дальнедистанционная гамма-терапия, рак грудной железы.














Leave a comment