Модифікація реконструктивного етапу панкреатодуоденальної резекції — методика фізіологічної реконструкції
Щепотин И.Б., Лукашенко А.В., Колесник Е.А., Васильев О.В., Приймак В.В., Шептицький В.В., Зелинский А.И.
Резюме. Основним ускладненням панкреатодуоденальної резекції є неспроможність панкреатодигестивного анастомозу (5–40%), у зв’язку з чим розроблено велику кількість різноманітних методик реконструктивного етапу панкреатодуоденальної резекції, проте жодна з них не є фізіологічною. Запропонована авторська модифікація панкреатодуоденальної резекції — фізіологічна реконструкція (була застосована у 14 хворих), 10 хворих становили контрольну групу, в якій проводилась стандартна панкреатодуоденальна резекція. Неспроможність панкреатоєюноанастомозу була зареєстрована в 1 (7%) хворого основної групи та в 3 (30%) — контрольної. В обох групах не було післяопераційної летальності. Середній час перебування в стаціонарі становив відповідно 14,2 та 19,5 діб. Наведена модифікація реконструктивного етапу панкреатодуоденальної резекції показала свою початкову ефективність.
Резюме. Основное осложнение панкреатодуоденальной резекции — несостоятельность панкреатодигестивного анастомоза (5–40%), в связи с чем разработано большое количество различных методик реконструктивного этапа панкреатодуоденальной резекции, однако, ни одна из них не является физиологической. Предложена авторская модификация панкреатодуоденальной резекции — физиологическая реконструкция (была применена у 14 больных), 10 больных составили контрольную группу, в которой выполняли стандартную панкреатодуоденальную резекцию. Несостоятельность панкреатоеюноанастомоза была зарегистрирована у 1 (7%) пациента основной группы и 3 (30%) — контрольной. В обеих группах не было послеоперационной летальности. Средняя продолжительность пребывания в стационаре составила соответственно 14,2 и 19,5 сут. Разработанная модификация реконструктивного этапа панкреатодуоденальной резекции показала свою начальную эффективность.

Введение
Панкреатодуоденальная резекция (ПДР), или операция Whipple, является стандартом лечения злокачественных и доброкачественных новообразований головки поджелудочной железы, периампулярной зоны, дистальных отделов общего желчного протока [1–4].
«Классическая» операция Whipple, впервые описанная в 1935 г., подразумевает дистальную резекцию желудка, холецистэктомию с резекцией общего желчного протока, удаление головки поджелудочной железы, двенадцатиперстной кишки с последующим реконструктивным этапом: панкреатоеюностомия, гепатикоеюностомия и гастроеюностомия [5–7]. На протяжении всей истории развития хирургии поджелудочной железы основной причиной летальности и главной неразрешимой проблемой остается несостоятельность панкреатодигестивного анастомоза [8–11]. Общая летальность после ПДР составляет 3–20% в зависимости от опыта клиники [12–16], однако, количество осложнений даже в специализированных центрах остается значительным — 18–54% [17–19]. Несостоятельность панкреатодигестивного анастомоза — одно из наиболее распространенных осложнений ПДР (5–40%), наряду с такими осложнениями, как эрозивные кровотечения, стрессорные язвы, несостоятельность билиодигестивного анастомоза, острый холангит, которые являются причинами летальности пациентов в ранний послеоперационный период [20–25]. При неэффективности консервативной терапии несостоятельность панкреатодигестивного анастомоза приводит к развитию осложнений, требующих срочной релапаротомии (разлитой перитонит, септический шок, кровотечение). Релапаротомии по поводу осложнений ПДР сопровождаются летальностью от 40 до 80% [26–28].
Основным патогенетическим механизмом развития несостоятельности панкреатоеюноанастомоза является местно-деструктивное действие активированных ферментов поджелудочной железы в зоне линии шва. Дальнейшее просачивание панкреатического секрета и скопление в зоне культи поджелудочной железы приводит к образованию обширных очагов воспаления с последующим развитием зон некроза как в самой поджелудочной железе, так и в окружающих органах [33].
При выполнении стандартных методик реконструктивного этапа ПДР активация протеолитических ферментов поджелудочной железы является следствием нарушения физиологической последовательности продвижения пищевого комка, а также пассажа желчи и панкреатического сока. Смешение вышеуказанных сред и воздействие их в зонах швов сформированных анастомозов является основной причиной осложнений. В настоящее время существует более 200 различных модификаций операции Whipple, касающихся как реконструктивного этапа в целом, так и методик формирования каждого из анастомозов. Консенсус относительно выбора оптимального способа реконструкции пока не достигнут [29].
С целью повысить надежность панкреатоеюноанастомоза путем минимализации воздействия таких агрессивных сред, как желчь и желудочный сок, на ткань поджелудочной железы, а также снизить риск других осложнений, связанных с нарушением последовательности пассажа пищеварительных соков, нами была разработана методика физиологической реконструкции при ПДР.
ОБЪЕКТ и методы исследования
Исследование проводили с января 2009 г. по декабрь 2010 г. Всего в исследование были включены 24 пациента, которым выполнялась ПДР. Участники были рандомизированы на две группы. В группе стандартного лечения реконструктивный этап проводили последовательно на одной петле согласно методике Whipple. Новый метод был применен у 14 пациентов (8 мужчин, 6 женщин, средний возраст — 59,4 года; возрастной интервал — 37–76 лет) (табл. 1 и 2).
| Показатель | Раздельная реконструкция, % |
Контроль, % |
|---|---|---|
| Возраст, лет | 60,9 (47–79) | 56,5 (45–68) |
| Пол | ||
| Мужчины | 8 (57) | 6 (60) |
| Женщины | 6 (43) | 4 (40) |
| Диабет | 4 (28) | 7 (70) |
| Ишемическая болезнь сердца | 10 (71) | 8 (80) |
| Нарушения периферического кровообращения | 2 (14) | 1 (10) |
| Панкреатит | 2 (14) | 1 (10) |
| Желтуха | 11 (78) | 7 (70) |
| Показатель | Раздельная реконструкция, % |
Контроль, % |
|---|---|---|
| Аденокарцинома поджелудочной железы | 5 (36) | 7 (70) |
| Аденокарцинома папиллы | 3 (21) | 1 (10) |
| Опухоль дистального отдела холедоха | 1 (7) | 0 |
| Аденокарцинома двенадцатиперстной кишки | 2 (14) | 1 (10) |
| Хронический панкреатит | 1 (7) | 1 (10) |
| Нейроэндокринная опухоль | 1 (7) | 0 |
| Саркома поджелудочной железы | 1 (7) | 0 |
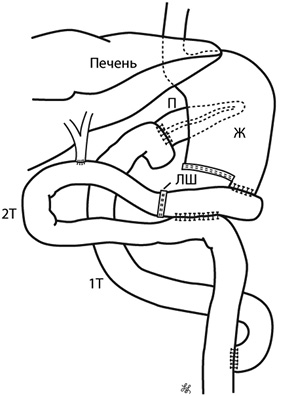
Реконструктивный этап ПДР согласно разработанной методики проводился следующим образом (рис. 1 и 2):
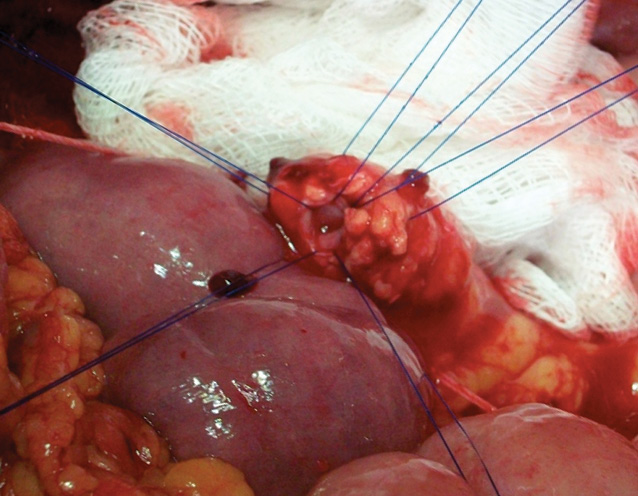
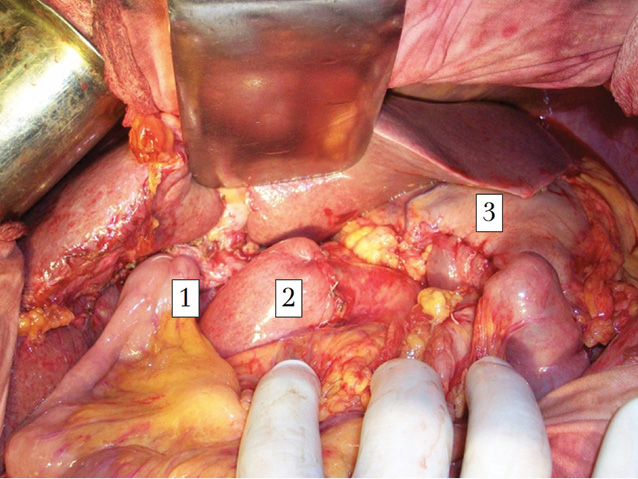
- панкреатоеюноанастомоз по принципу проток-мукоза (конец в бок) отдельными швами, внутренний ряд швов нитью пролен 4–0 по Blumgart [35], на отдельной изолированной петле тонкой кишки длиной 50 см от связки Трейца позадиободочно, без стентирования панкреатического протока. Второй ряд швов — серозная оболочка кишки с капсулой поджелудочной железы (пролен 4–0);
- гастроэнтеро- и гепатикоеюноанастомоз формировались на второй петле тонкой кишки на расстоянии 40 см друг от друга впередиободочно (конец в бок), двухрядным и однорядным швами соответственно (рис. 3 и 4).
- гепатикоеюноанастомоз «отключали» от гастроэнтероанастомоза путем формирования межкишечного соустья с заглушкой приводящей петли. Дистальнее гепатикоеюноанастомоза на 50 см «включали» в пассаж петлю кишки от панкреатоеюноанастомоза по Ру.
![Рис. 1. Анастомоз Blumgart [35]: единичные циркулярные швы изнутри панкреатического протока сквозь всю толщу поджелудочной железы](http://www.clinicaloncology.com.ua/uploads/2011/05/wpid-07_02_fmt.jpeg)
![Рис. 1. Анастомоз Blumgart [35]: единичные циркулярные швы изнутри панкреатического протока сквозь всю толщу поджелудочной железы](http://www.clinicaloncology.com.ua/uploads/2011/05/wpid-07_02a_fmt.jpeg)
Результаты
Среднее время операции составило 6,40±1,20 ч в основной и 6,10±1,10 ч — в контрольной группе. Значительная продолжительность операций в обеих группах обусловлена тем, что более чем у половины пациентов выполнялись реконструктивные операции, в том числе комбинированные с резекциями сосудов портальной системы, также стандартом для всех операций являлась региональная, аорто-кавальная лимфодиссекция, мезодуоденумэктомия. Доля осложнений была меньше в основной группе (табл. 3). Основным осложнением была несостоятельность панкреатоеюноанастомоза (7% в основной группе и 30% — в контрольной), с последующим формированием абсцессов брюшной полости. Необходимость в выполнении релапаротомии в основной группе возникла у 1, в контрольной группе — у 2 пациентов. В обеих группах не зарегистрировано послеоперационной летальности. Пациентов начинали поить с первых суток операции. На 4-е сутки проводилось исследование пассажа контрастного препарата по желудочно-кишечному тракту. С 4-х суток начинали питаться адаптированными пищевыми смесями, на 8-е сутки пациентов переводили на стандартную диету. Медиана послеоперационного пребывания в стационаре пациентов основной группы составила 14,2 (9–22) дня, контрольной группы — 19,5 (8–32) дня. Осложнения — см. табл. 3.
| Показатель | Раздельная реконструкция, % | Контроль, % |
|---|---|---|
| Летальность | 0 | 0 |
| Релапаротомия | 1 (7) | 2 (20) |
| Необходимость в пункции под ультразвуковым контролем | 5 (36) | 6 (60) |
| Замедление эвакуации из культи желудка | 0 | 4 (40) |
| Инфицирование раны | 1 (7) | 3 (13) |
| Пневмония | 1 (7) | 1 (10) |
| Кровотечение | 1 (7) | 0 |
| Несостоятельность панкреатоеюноанастомоза | 1 (7) | 3 (30) |
| Интраабдоминальный абсцесс | 1 (7) | 2 (20) |
Медиана последующего наблюдения составила 8,9 мес. В процессе последующего наблюдения все пациенты основной группы не отмечали тошноты, рвоты, изжоги, эпигастральной боли, отрыжки после приема пищи. Все пациенты контрольной группы отмечали от 1 до 2 из вышеперечисленных жалоб.
Обсуждение
Внутриклеточная активация ферментов обусловлена развитием панкреатита в послеоперационный период, пусковым механизмом которого является травма поджелудочной железы в процессе мобилизации, на этапе резекции, а также при формировании панкреатодигестивного анастомоза [30]. В ранний послеоперационный период развитие панкреатита обусловлено активацией проформ ферментов поджелудочной железы вследствие нарушения физиологии секреции панкреатического сока, рефлюкса содержимого анастомозированной кишки в панкреатический проток (основные факторы агрессии — желчь, энтерокиназа, низкий pH) [31, 32].
Факторы предрасположенности к развитию несостоятельности панкреатодигестивного анастомоза в литературе были разделены на насколько групп: антропоморфные факторы (возраст, пол, конституция и т.п.), анатомо-физиологические факторы (консистенция поджелудочной железы, ширина панкреатического протока, интенсивность секреции поджелудочной железы), дооперационные (степень механической желтухи, использование билиарных стентов либо методики наружного дренирования желчных протоков), хирургические факторы (последовательность реконструкции, техника формирования анастомоза, методы дренирования брюшной полости, использование стентов панкреатического протока) и послеоперационные (назначение аналогов соматостатина, сроки извлечения дренажей и назогастрального зонда, начало энтерального питания). Согласно вышеперечисленным группам факторов на сегодняшний день установлено, что наибольшую роль в развитии несостоятельности играют анатомо-физиологические факторы [36]. Антропоморфные факторы практически не связаны с риском несостоятельности, остается неясной и продолжается оценка основных — хирургических факторов, методик предоперационной подготовки [37, 38] и послеоперационной терапии [39–41].
За более чем 75-летнюю историю применения ПДР были разработаны различные хирургические способы повышения надежности панкреатодигестивного анастомоза. Среди методов реконструкции после ПДР в настоящее время можно выделить два наиболее распространенных: панкреатоеюностомия и панкреатогастростомия [42, 43].
Классический вариант реконструкции подразумевает последовательное формирование панкрэтоеюно- и гепатикоеюноанастомозов на одной петле позадиободочно, далее гастроэнтероанастомоза впередиободочно. Второй распространенный вариант реконструкции — панкреатогастростомия с формированием гепатикоеюно- и гастроэнтероанастомозов на одной петле. В рандомизированных исследованиях оба типа реконструкции не показали отличий как по количеству послеоперационных осложнений, так и по характеристикам технического выполнения [44].
На наш взгляд, недостатками данных методик формирования панкреатодигестивного анастомоза является агрессивное воздействие желчи и желудочного сока на ткань поджелудочной железы в ранние послеоперационные сроки. Удаление двенадцатиперстной кишки с ампулой во время ПДР и последующая реконструкция со свободным впадением панкреатического протока обусловливает беспрепятственное проникновение желчи либо желудочного сока (в зависимости от типа реконструкции) в культю поджелудочной железы.
Механизм развития желчного рефлюкс-панкреатита изучается более 100 лет и на сегодняшний день представлен большим количеством клинических и экспериментальных исследований [45–48]. Наибольшего внимания заслуживают следующие работы:
- G.J. Wang и cоавторы в эксперименте доказали деструктивное действие желчных кислот (тауролитохолиевой, таурохолиевой и тауродезоксихолиевой) на ацинарные клетки поджелудочной железы путем смены распределения ионов кальция с апикальной на базальную [49]. Ранее установлено, что внутриклеточное распределение ионов кальция напрямую связано с регуляцией секреции панкреатических ферментов [50, 51]. Согласно данным других исследователей подобные анормально длительные повышения концентрации кальция в ацинарных клетках поджелудочной железы приводят к внутриклеточной активации трипсиногена в трипсин — критическому моменту в индукции острого панкреатита [52, 53].
- T. Nakamura и соавторы установили, что желчь активирует А2-фосфорилазу, фермент поджелудочной железы, приводящий к развитию панкреатита [54].
- A.D. McCutcheon на модели закрытой дуоденальной петли у собак в 100% случаев отмечал развитие острого панкреатита как следствие рефлюкса желчи и дуоденального содержимого в панкреатический проток [55].
Таким образом, методика изоляции панкреатоеюноанастомоза от попадания желчи и желудочного содержимого является достаточно обоснованной с патофизиологической точки зрения. Дополнительным преимуществом разработанной операции является предотвращение попадания желчи и панкреатического сока в культю желудка (в отличие от других методик реконструкции). Изолированное формирование анастомозов препятствует развитию щелочных рефлюкс гастрита и эзофагита, которые могут быть связаны со значительными осложнениями в отдаленные послеоперационные сроки [56, 57]. Следует также принимать во внимание то, что в группу распространенных осложнений ПДР входит замедление эвакуации пищи из культи желудка (ЗЭП), что значительно снижает качество жизни пациентов. При классических методах реконструкции ЗЭП может возникать у 15–40% пациентов [15, 16]. Одним из механизмов данного осложнения является раздражающее воздействие желчи на слизистую оболочку культи желудка. Согласно полученным результатам (в основной группе — отсутствие клиники ЗЭП как в ранние, так и в поздние сроки после операции) разработанная методика предупреждает развитие второго по частоте осложнения ПДР, повышая качество жизни пациентов.
Выводы
Предложенная модификация реконструктивного этапа ПДР показала свою эффективность — снижение частоты послеоперационных осложнений, необходимости выполнения релапаротомий, позволила улучшить качество жизни пациентов за счет устранения послеоперационного застоя пищи в культе желудка.
Разработанный метод физиологической реконструкции является патофизиологически обоснованным, поскольку восстанавливает природный путь пассажа пищевого комка, предотвращает перекрестные рефлюксы желчи, панкреатического сока, желудочного содержимого.
Рекомендованы дальнейшие рандомизированные исследования для подтверждения эффективности предложенной методики.
Литература
- 1. Grace P.A., Pitt H.A., Longmire W.P. (1990) Pylorus preserving pancreatoduodenectomy: an overview. Br. J. Surg., 77: 968–974.
- 2. Peters J.H., Carey L.C. (1991) Historical review of pancreaticoduodenectomy. Am. J. Surg., 161: 219–225.
- 3. Moossa A.R. (1987) Surgical treatment of chronic pancreatitis: an overview. Br. J. Surg., 74: 661–667.
- 4. Rossi R.L. Rothschild J., Braasch J.W. et al. (1987) Pancreatoduodenectomy in the management of chronic pancreatitis. Arch. Surg., 122: 416–420.
- 5. Bachellier P., Nakano H., Oussoultzoglou P.D. et al. (2001) Is pancreaticoduodenectomy with mesentericoportal venous resection safe and worthwhile? Am. J. Surg., 182(2): 120–129.
- 6. Tseng J.F., Raut C.P., Lee J.E. et al. (2004) Pancreaticoduodenectomy with vascular resection: margin status and survival duration. J. Gastrointest. Surg., 8: 935–949.
- 7. Yeo C.J., Cameron J.L., Lillemoe K.D. et al. (2002) Pancreaticoduodenectomy with or without distal gastrectomy and extended retroperitoneal lymphadenectomy for periampullary adenocarcinoma, part 2: randomized controlled trial evaluating survival, morbidity, and mortality. Ann. Surg., 236: 355–366.
- 8. Aranha G.V., Aaron J.M., Shoup M. et al. (2006) Current management of pancreatic fistula after pancreaticoduodenectomy. Surgery, 140(4): 561–568.
- 9. Goonetilleke K.S., Siriwardena A.K. (2007) Nationwide questionnaire survey of the contemporary surgical management of pancreatic cancer in the United Kingdom & Ireland. Int. J. Surg, 5: 147–151.
- 10. Lygidakis N.J., Jain S., Sacchi M. et al. (2005) Reappraisal of a method of reconstruction after pancreatoduodenectomy. Hepatogastroenterology, 52: 1077–1082.
- 11. Shrikhande S.V., Qureshi S.S., Rajneesh N. et al. (2005) Pancreatic anastomoses after pancreaticoduodenectomy: do we need further studies? World J. Surg., 29(12): 1642–1649.
- 12. Wayne M.G., Jorge I.A., Cooperman A.M. (2008) Alternative reconstruction after pancreaticoduodenectomy. World J. Surg. Oncol., 28: 6–9.
- 13. Izbicki J.R., Bloechle C., Knoefel W.T. et al. (1999) Surgical treatment of chronic pancreatitis and quality of life after operation. Surg. Clin. North Am., 79: 913–944.
- 14. Cameron J.L., Pitt H.A., Yeo C.J. et al. (1993) One hundred and forty-five consecutive pancreaticoduodenectomies without mortality. Ann. Surg., 217: 430–435.
- 15. Buchler M.W., Wagner M., Schmied B.M. et al. (2003) Changes in morbidity after pancreatic resection: toward the end of completion pancreatectomy. Arch. Surg., 138:1310–1314.
- 16. Halloran C.M., Ghaneh P., Bosonnet L. et al. (2002) Complications of pancreatic cancer resection. Dig Surg., 19(2): 138–146.
- 17. Yeo C.J., Cameron J.L., Sohn T.A. et al. (1997) Six hundred fifty consecutive pancreaticoduodenectomies in the 1990s: pathology, complications, and outcomes. Ann Surg., 226: 248–257.
- 18. van Berge Henegouwen M.I., Allema J.H., van Gulik T.M. et al. (1995) Delayed massive haemorrhage after pancreatic and biliary surgery. Br. J. Surg., 82: 1527–1531.
- 19. Tien Y.W., Lee P.H., Yang C.Y. et al. (2005) Risk factors of massive bleeding related to pancreatic leak after pancreaticoduodenectomy. J. Am. Coll. Surg., 201: 554–559.
- 20. Munoz-Bongrand N., Sauvanet A., Denys A. et al. (2004) Conservative management of pancreatic fistula after pancreaticoduodenectomy with pancreaticogastrostomy. J. Am. Coll. Surg.,199(2): 198–203.
- 21. Alghamdi A.A., Jawas A.M., Hart R.S. (2007) Use of octreotide for the prevention of pancreatic fistula after elective pancreatic surgery: a systematic review and meta-analysis. Can. J. Surg., 50(6): 459–466.
- 22. Balcom J.H., Rattner D.W., Warshaw A.L. et al. (2001) Ten-year experience with 733 pancreatic resections: changing indications, older patients, and decreasing length of hospitalization. Arch. Surg., 136: 391–398.
- 23. Schmidt C.M., Powell E.S., Yiannoutsos C.T. et al. (2004) Pancreaticoduodenectomy: a 20-year experience in 516 patients. Arch. Surg., 139: 718–727.
- 24. DeOliveira M.L., Winter J.M., Schafer M. еt al. (2006) Assessment of complications after pancreatic surgery: A novel grading system applied to 633 patients undergoing pancreaticoduodenectomy. Ann. Surg., 244(6): 931–937.
- 25. Poon R.T., Lo S.H., Fong D. et al. (2002) Prevention of pancreatic leakage after pancreaticoduodenectomy. Am. J. Surg., 183(1): 42–52.
- 26. Farley D.R., Schwall G., Trede M. (1996) Completion pancreatectomy for surgical complications after pancreaticoduodenectomy. Br. J. Surg., 83(2): 176–179.
- 27. Balzano G., Zerbi A., Cristallo M. et al. (2005) The unsolved problem of fistula after left pancreatectomy: the benefit of cautious drain management. J. Gastrointest. Surg., 9: 837–842.
- 28. Gouma D.J., van Geenen R.C., van Gulik T.M. et al. (2000) Rates of complications and death after pancreaticoduodenectomy: risk factors and the impact of hospital volume. Ann. Surg., 232: 786–795.
- 29. Winter J.M., Cameron J.L., Campbell K.A. et al. (2006) Does pancreatic duct stenting decrease the rate of pancreatic fistula following pancreaticoduodenectomy? Results of a prospective randomized trial. J. Gastrointest Surg.,10: 1280–1290.
- 30. Marcus S.G., Cohen H., Ranson J.H. (1995) Optimal management of the pancreatic remnant after pancreaticoduodenectomy. Ann. Surg., 221(6): 635–645.
- 31. Grobmyer S.R., Hollenbeck S.T., Jaques D.P. et al. (2008) Roux-en-Y reconstruction after pancreaticoduodenectomy. Arch. Surg., 143(12): 1184–1188.
- 32. Kamisawa T., Kurata M., Honda G. et al. (2009) Biliopancreatic reflux-pathophysiology and clinical implications. J. Hepatobiliary Pancreat Surg., 16(1): 19–24.
- 33. Bassi C., Falconi M., Pederzoli P. (1994) Role ofsomatostatin and somatostatin analogues inthetreatment ofgastrointestinaldiseases: prevention of complications after pancreatic surgery. Gut, 3: 20–22.
- 34. Catel R.B. (1948) A technic for pancreatoduodenal resection. Surg. Clin. North. Am., 28: 761–775.
- 35. Blumgart L.H. (2007) Surgery of the Liver, Biliaru Tract, and Pancreas. 4 ed. Saunders Elsevier, Philadelphia, PA, 1838 р.
- 36. Bassi C., Falconi M., Molinari E. et al. (2005) Reconstruction by pancreaticojejunostomy versus pancreaticogastrostomy following pancreatectomy: results of a comparative study. Ann. Surg., 242(6): 767–771.
- 37. Marcus S.G., Dobryansky M., Shamamian P., et al. (1998) Endoscopic biliary drainage before pancreaticoduodenectomy for periampullary malignancies. J. Clin. Gastroenterol., 26: 125–129.
- 38. Heslin M.J., Brooks A.D., Hochwald S.N. et al. (1998) A preoperative biliary stent is associated with increased complications after pancreatoduodenectomy. Arch. Surg., 133: 149–154.
- 39. Sagar P.M., Kruegener G., MacFie J. (1992) Nasogastric intubation and elective abdominal surgery. Br. J. Surg.,79: 1127–1131.
- 40. Heslin M.J., Harrison L.E., Brooks A.D. et al. (1998) Is intra-abdominal drainage necessary after pancreaticoduodenectomy? J. Gastrointest Surg., 2: 373–378.
- 41. Moon H.J., Heo J.S., Choi S.H. et al. (2005) The efficacy of the prophylactic use of octreotide after a pancreaticoduodenectomy. Yonsei Med. J., 46(6): 788–793.
- 42. Sakorafas G.H., Friess H., Balsiger B.M. et al. (2001) Problems of reconstruction during pancreatoduodenectomy. Dig. Surg., 18: 363–369.
- 43. Hamanaka Y., Nishihara K., Hamasaki T. et al. (1996) Pancreatic juice output after pancreatoduodenectomy in relation to pancreatic consistency, duct size, and leakage. Surgery, 119: 281–287.
- 44. Shrikhande S.V., D’Souza M.A. (2008) Pancreatic fistula after pancreatectomy: evolving definitions, preventive strategies and modern management. World J. Gastroenterol., 14(38): 5789–5796.
- 45. Opie E.L. (1901) The etiology of acute hemorrhagic pancreatitis. Johns Hopkins Hospital Bulletin, 12: 182–188.
- 46. Niederau C., Niederau M., Lüthen R. et al. (1990) Pancreatic exocrine secretion in acute experimental pancreatitis. Gastroenterology, 99(4): 1120–1127.
- 47. Senninger N. (1992) Bile-induced pancreatitis. Eur Surg Res., 24(1): 68–73.
- 48. Arendt T., Nizze H., Monig H. et al. (1999) Biliary pancreatic reflux-induced acute pancreatitis-myth or possibility? Eur. J. Gastroenterol. Hepatol., 11: 329–335.
- 49. Wang G.J., Gao C.F., Wei D. et al. (2009) Acute pancreatitis: etiology and common pathogenesis. World J. Gastroenterol., 15(12): 1427–1430.
- 50. Bolender R.P. (1974) Stereological analysis of the guinea pig pancreas. I. Analytical model and quantitative description of nonstimulated pancreatic exocrine cells. J. Cell. Biol.,61(2): 269–287.
- 51. Williams J.A. (2001) Intracellular signaling mechanisms activated by cholecystokinin-regulating synthesis and secretion of digestive enzymes in pancreatic acinar cells. Annu Rev. Physiol., 63: 77–97.
- 52. Raraty M., Ward J., Erdemli G. et al. (2000) Calcium-dependent enzyme activation and vacuole formation in the apical granular region of pancreatic acinar cells. Proc. Natl. Acad. Sci USA, 97(24): 13126–13131.
- 53. Krüger B., Albrecht E., Lerch M.M. (2000) The role of intracellular calcium signaling in premature protease activation and the onset of pancreatitis. Am. J. Pathol., 157(1): 43–50.
- 54. Nakamura T., Okada A., Higaki J. et al. (1996) Pancre- aticobiliary maljunction-associated pancreatitis: an experimental study on the activation of pancreatic phospholipase A2. World J. Surg., 20: 543–550.
- 55. McCutcheon A.D. (1968) A fresh approach to the pathogenesis of pancreatitis. Gut, 9(3): 296–310.
- 56. Klaus A., Hinder R.A., Nguyen J.H. et al. (2003) Small bowel transit and gastric emptying after biliodigestive anastomosis using the uncut jejunal loop. Am. J. Surg., 186: 747–751.
- 57. Pescio G., Cariati E. (1996) A new reconstructive method after pancreaticoduodenectomy: the triple Roux on a «P» loop. Rationale and radionuclide scanning evaluation. HPB Surg., 9(4): 223–227.














Leave a comment