Клапті басейну підлопаткової артерії в реконструктивній хірургії голови та шиї. Огляд медичної літератури та власний досвід
- 1Національний медичний університет ім. О.О. Богомольця, Київ, Україна
- 2Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
Резюме. Сучасні досягнення реконструктивної хірургії дозволили значно покращити функціональні та естетичні результати лікування злоякісних пухлин голови та шиї. Пластичне усунення обширних післяопераційних дефектів голови та шиї потребує застосування реґіонарних та вільних васкуляризованих тканинних клаптів. Дотепер вибір васкуляризованого тканинного клаптя для заміщення різних типів дефектів голови та шиї залишається предметом обговорення, оскільки універсального клаптя не існує, а кожен з описаних трансплантатів має як переваги, так і недоліки. Мета цієї роботи — провести аналіз наукової літератури та представити власний клінічний досвід використання клаптів басейну підлопаткової артерії (КБПА) в реконструктивній хірургії голови та шиї.
Одержано 24.02.2025
Прийнято до друку 10.03.2025
DOI: 10.32471/clinicaloncology.2663-466X.34190
ВСТУП
Сучасні досягнення реконструктивної хірургії дозволили значно покращити функціональні та естетичні результати лікування злоякісних пухлин голови та шиї. На сьогодні описано близько 30 різних васкуляризованих тканинних клаптів, які використовують для пластичного заміщення післяопераційних дефектів ротової порожнини, глотки, гортані, кісткових структур лицевого черепа, основи черепа та м’яких тканин голови та шиї [1–3].
Хірургічне лікування місцево-поширеного раку голови та шиї, рецидивів пухлин після комбінованого лікування, остеорадіонекрозу щелеп часто призводить до формування складних тривимірних дефектів, що включають кісткові та м’якотканинні структури, а також можуть залучати декілька епітеліальних поверхонь (наприклад слизову оболонку та шкіру) [4–5].
Пластичне усунення обширних післяопераційних дефектів голови та шиї потребує використання реґіонарних та вільних васкуляризованих тканинних клаптів. Дотепер вибір васкуляризованого тканинного клаптя для заміщення різних типів дефектів голови та шиї залишається предметом обговорення, оскільки універсального клаптя не існує, а кожен з описаних трансплантатів має як переваги, так і недоліки [6–8].
КБПА мають тривалу історію використання в реконструктивній хірургії. Уперше I. Tansini у 1896 р. описав реґіонарний шкірно-мʼязовий клапоть найширшого мʼяза спини (КНМС) для усунення дефекту після мастектомії. Лише через століття C.G. Quillen та співавт. успішно використали КНМС для заміщення післяопераційного дефекту голови та шиї [9].
Поглиблене вивчення судинної анатомії, реґіонарного кровопостачання та концепції ангіосом значно сприяло розвитку та вдосконаленню модифікацій клаптів. Це зумовило еволюцію реконструктивних підходів — від використання реґіонарних клаптів до вільних химерних трансплантатів, які дозволяють ефективно усувати складні тривимірні дефекти голови та шиї [10].
На сьогодні тканинні КБПА можуть бути виділені, як мʼязові, шкірні, шкірно-фасціальні, шкірно-мʼязові та шкірно-мʼязово-кісткові [11].
Перевагами тканинних КБПА є довга судинна ніжка; належна судинна перфузія, що сприяє високій виживаності трансплантата та мінімізує ризик некрозу; велика кількість модифікацій клаптя, що дозволяє одночасно включати різні типи тканин; низька схильність судин до атеросклеротичних змін.
Попри численні переваги, використання клаптів підлопаткової артерії має й певні недоліки: використання лопаткового сегмента в навантажених конструкціях, таких як реконструкція нижньої щелепи, може виявитися менш ефективним порівняно з малогомілковим трансплантатом; необхідність зміни положення пацієнта під час операції, що збільшує тривалість хірургічного втручання [2, 12–14].
Мета роботи: провести аналіз наукової літератури та представити власний клінічний досвід застосування КБПА в реконструктивній хірургії голови та шиї.
Анатомічні особливості підлопаткової артерії та їх значущість у реконструктивній хірургії голови та шиї
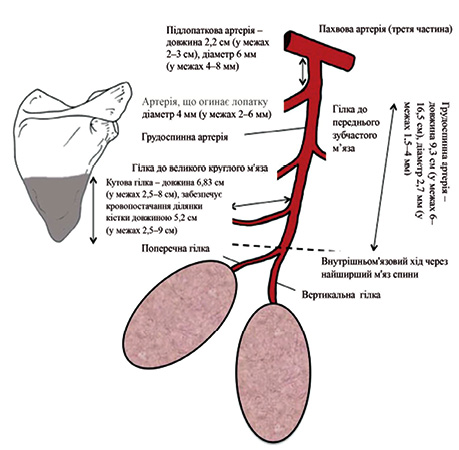
КБПА широко використовуються в реконструктивній хірургії голови та шиї, забезпечуючи надійне кровопостачання, необхідне для аутологічної трансплантації складних тканинних комплексів. Підлопаткова артерія є найбільшою гілкою пахвової артерії, середній діаметр якої становить 6 мм (4– 8 мм) [15]. Артерія з однойменною веною відходять від задньої поверхні пахвової артерії та вени, проходячи паралельно нижньому краю підлопаткового м’яза на відстань 2,2 см (2–3 см). Артерія поділяється на 2 кінцеві гілки — артерія, що огинає лопатку, та грудоспинну артерію, які супроводжуються відповідними венами. У більшості випадків підлопаткова артерія та вена проходять поруч, однак, якщо вони проходять окремо, артерія знаходиться більш проксимально в пахвовій ділянці, у середньому на 4,2 см [16–17].
Варто зазначити, що грудоспинна артерія у 0,8–3% випадків може відходити безпосередньо від пахвової артерії, а в окремих випадках — навіть від латеральної грудної артерії [15, 18]. Грудоспинна артерія та вена проходять уздовж латерального краю лопатки в товщі жирової клітковини та входять у товщу найширшого м’яза спини. Довжина ніжки грудоспинної артерії від місця її відходження до точки проникнення в м’яз становить у середньому 9,3 см (6–16,5 см). Діаметр грудоспинної артерії в місці її відгалуження від підлопаткової артерії становить у середньому 2,7 мм (1,5–4 мм), тоді як середній діаметр грудоспинної вени — 3,4 мм (1,5–4,5 мм) [16].
Грудоспинна артерія віддає гілки до нижнього краю лопатки, а також кровопостачає підлопатковий, великий круглий і передній зубчастий м’язи. Кутова гілка грудоспинної артерії має середню довжину 6,83 см (2,5–8 см) [19]. Водночас у близько 5% випадків кутова гілка підлопаткової артерії може бути відсутньою або недорозвиненою.
Однією з головних переваг підлопаткової артерії є її низька схильність до атеросклеротичних змін, що робить її більш надійним варіантом порівняно із судинами нижніх кінцівок і таза, які зазвичай використовуються для трансплантації клаптів з кістковими структурами [12, 15, 17].
Анатомічні дослідження на кадаврах свідчать, що у 92% випадків підлопаткова артерія та вена проходять через пахвову ділянку разом. У решти 8% випадків їх злиття відбувається лише після відгалуження гілок до переднього зубчастого м’яза. Більш того, у 54% випадків підлопаткова артерія віддає лише 1 гілку до переднього зубчастого м’яза, тоді як 2 або 3 гілки відмічаються рідше. У близько 1% випадків ця артерія взагалі не має гілки, що живить передній зубчастий м’яз (рис. 1) [15, 20].
КНМС
КНМС був уперше описаний I. Tansini у 1896 р. як реґіонарний для усунення великого дефекту після мастектомії. У 1978 р. C.G. Quillen та співавт. вперше застосували КНМС для реконструкції дефектів голови та шиї, зокрема для заміщення дефектів лівої щоки, нижньої щелепи, бічної поверхні язика та глотки [9, 21]. Того ж року G.P. Maxwell та співавт. описали використання КНМС як вільного клаптя для усунення дефекту скальпа [22].
Згідно з дослідженнями G.I. Taylor та J. Palmer, проведеними на кадаврах, КНМС має 3 ангіосоми, що забезпечують кровопостачання м’яза та шкірної частини клаптя [23]:
- проксимальний сегмент — живиться від грудоспинної артерії;
- середня частина — отримує кровопостачання від задніх міжреберних артерій;
- дистальний сегмент — живиться від поперекових артерій, що робить використання шкірних клаптів, розташованих над дистальним перфорантом, менш надійним.
Ці анатомічні особливості впливають на вибір методу пересадки клаптя та його життєздатність залежно від локалізації дефекту.
У дослідженнях F.C. Wei та співавт. і B.-H. Li та співавт. встановлено, що використання вільного КНМС у реконструктивній хірургії голови та шиї має високу успішність — у межах 92–100% [24–25].
Крім того, можливість використання КНМС з 2 окремими шкірними частинами, що базуються на поперечних та вертикальних гілках грудоспинної артерії, дозволяє усувати багатокомпонентні дефекти ротової порожнини [26–27]. Це суттєво підвищує його ефективність у реконструкції складних анатомічних структур.
За даними J.E. O’Connell, основними показаннями до використання КНМС є заміщення великих дефектів шкіри голови, середньої зони обличчя та основи черепа. Він може використовуватися як ізольовано, так і у вигляді химерного клаптя, що включає фрагмент лопатки. Такий підхід підтримується також іншими дослідниками [11, 28–29].
Клапоть кінчика лопатки
У 1986 р. W.M. Swartz та співавт. уперше описали свій досвід використання шкірно-мʼязово-кісткового клаптя лопатки для заміщення дефектів верхньої та нижньої щелеп. Відзначено, що лопатка завдяки її анатомічній формі є оптимальним варіантом для заміщення дефектів твердого піднебіння та дна орбіти [30].
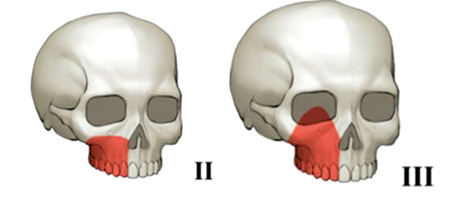
У подальших дослідженнях J.E. O’Connell та співавт. [31] виявлено можливість використання клаптя кінчика лопатки (ККЛ) у 2 площинах:
- у вертикальній площині — для усунення дефекту орбіти,
- у горизонтальній площині — для заміщення дефектів верхньої щелепи класу Brown ІІ та ІІІ (рис. 2).
J.J. Coleman та M.R. Sultan запропонували концепцію використання ККЛ разом із найширшим м’язом спини на одній судинній ніжці. Дослідники звернули увагу на варіабельність анатомічної васкуляризації клаптя, зокрема можливе відходження кутової та артерії, що огинає лопатку від підлопаткової артерії, а також окреме відгалуження кутової артерії від грудоспинної артерії [32].
У 1988 р. R. Deraemaecker та співавт. підтвердили, що нижній край лопатки кровопостачається кутовою артерією, яка є гілкою грудоспинної артерії [33]. Це дослідження дало поштовх до ширшого використання ККЛ у реконструктивній хірургії, особливо у складних випадках.
Згідно з дослідженням J. Yoo та співавт., природний кут лопатки є оптимальним варіантом для реконструкції кута нижньої щелепи при дефектах до 8 см. У їхньому клінічному дослідженні, що охоплювало 20 пацієнтів, ускладнень у донорській зоні не виявлено, втрату клаптя зафіксовано лише в одному випадку [34].
У подальшому аналізі, проведеному N.A. Pegedar та співавт., зафіксовано, що анатомічна форма кінчика лопатки та тверде піднебіння мають високий ступінь подібності, що значно зменшує потребу в інтраопераційній остеотомії та скорочує час операції [35].
У своїй роботі B.A. Miles та R.W. Gilbert [36] оцінили переваги ККЛ порівняно з іншими вільними кістково-м’язовими клаптями, зокрема малогомілковим клаптем та клаптем гребня клубової кістки. Серед ключових переваг КБПА автори виокремили наступні:
- можливість створення химерного клаптя з комбінацією різних типів тканин;
- анатомічна варіативність, що дозволяє створювати 2 шкірні клапті на основі поперечних і вертикальних гілок грудоспинної артерії;
- використання переднього зубчастого м’яза з ребром або без нього;
- використання найширшого м’яза спини та латерального краю лопатки завдовжки <14 см.
Зазначені особливості обґрунтовують вибір КБПА для заміщення складних комбінованих дефектів голови та шиї.
B.A. Miles та R.W. Gilbert провели ретроспективний аналіз 39 клаптів ККЛ. За їхніми даними, у 46% пацієнтів розвинулися ускладнення, серед яких:
- некоректне формування ясенно-щічної борозни;
- піднебінна нориця — (причому у половини хворих нориці закрилися самостійно).
Цікаво, що автори не виявили статистично значущої кореляції між частотою ускладнень у пацієнтів, які проходили променеву терапію, та у осіб, які її не отримували [36].
Химерні клапті в реконструктивній хірургії голови та шиї
Однією з ключових переваг КБПА є можливість формування химерних клаптів, що дозволяє заміщувати складні багатокомпонентні дефекти. У дослідженні F.C. Wei та співавт. встановлено ефективність використання 2 окремих вільних клаптів для відновлення складних поєднаних дефектів ротової порожнини, середньої зони обличчя та тривимірних дефектів. Водночас J.E. O’Connell та співавт. зазначили, що використання 2 окремих вільних клаптів має вищий рівень ускладнень порівняно з химерним клаптем на основі підлопаткової артерії [11, 24].
Завдяки тому, що артерія, що огинає лопатку, та грудоспинна артерія найчастіше беруть початок від підлопаткової артерії, химерний клапоть може включати лопатку, м’яз та шкіру з підшкірною клітковиною, що дає змогу його використовувати як м’язовий, шкірно-мʼязовий, мʼязово-кістковий та шкірно-мʼязово-кістковий клапті для заміщення складних дефектів голови та шиї [11].
V. Uglesic та співавт. (2000) першими опублікували результати використання 16 комбінованих КНМС та кінчика лопатки для усунення дефектів після радикальних максилектомій. Лише 1 клапоть виявився нежиттєздатним, що свідчить про високу ефективність та надійність методики [37].
У 2013 р. L. L’Heureux-Lebeau описав успішний досвід використання КНМС та кінчика лопатки для реконструкції нижньої щелепи. Результати дослідження, яким охоплено 16 пацієнтів, зафіксували повне приживлення клаптів у всіх випадках, що підтверджує їхню високу ефективність і надійність у відновленні складних дефектів нижньої щелепи [38].
Заміщення дефектів нижньої щелепи
J. Yoo та співавт. у своєму дослідженні підтвердили, що ККЛ є оптимальним клаптем для реконструкції кута нижньої щелепи, з можливістю заміщення сегментів довжиною до 8 см. У дослідженні, в яке залучено 20 пацієнтів, зафіксовано низький рівень ускладнень у донорській ділянці [34].
Завдяки ретроспективному аналізу, проведеному J.S. Brown та співавт., який охоплював результати реконструктивних операцій із заміщення дефектів нижньої щелепи протягом 25 років, встановлено, що вільний клапоть гребня клубової кістки мав найвищий рівень ускладнень (6,2%) порівняно з вільними клаптями малогомілкової, променевої та лопаткової кісток [2].
J.E. O’Connell та співавт. [11] зазначили, що ККЛ ідеально підходить для реконструкції дефектів кута, гілки та тіла нижньої щелепи, а також для відновлення дефектів верхньої щелепи класу Brown І та ІІ (рис. 3).
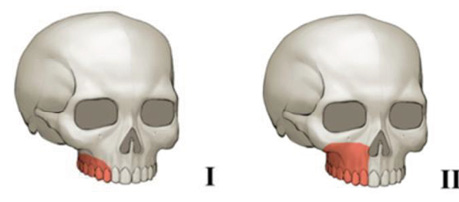
У випадках, коли необхідне відновлення короткого лінійного сегмента поєднано з великим дефектом м’яких тканин, ККЛ залишається найкращим вибором.
Підсумовуючи дані наукової літератури, слід зазначити, що вільні клапті підлопаткової артерії широко використовуються в реконструктивній хірургії голови та шиї, зумовлюючи успішність на рівні 95%. Однак подібні результати досягаються переважно у високоспеціалізованих закладах, де працюють мультидисциплінарні команди.
Наш клінічний досвід використання кБПА
У низці клінічних ситуацій реґіонарні клапті мають певні переваги, оскільки наявність таких факторів, як резекція внутрішньої яремної вени, зовнішньої сонної артерії або променево-індукований фіброз, може значно ускладнювати або унеможливлювати використання вільних аутологічних трансплантатів.
Останніми роками в нашій клінічній практиці активно впроваджуються реконструктивні втручання з використанням трансплантатів із басейну підлопаткової артерії. Вибір типу клаптя для реконструкції дефектів голови та шиї залежить від клінічної ситуації та може включати м’язові, шкірні, шкірно-м’язові, м’язово-кісткові або шкірно-м’язово-кісткові варіанти. Особливу увагу приділяємо заміщенню складних дефектів у пацієнтів, яким проведене комбіноване протипухлинне лікування. У цій роботі наведено клінічні випадки, що підтверджують ефективність застосування зазначених реконструктивних методик у складних клінічних ситуаціях.
Клінічний випадок 1
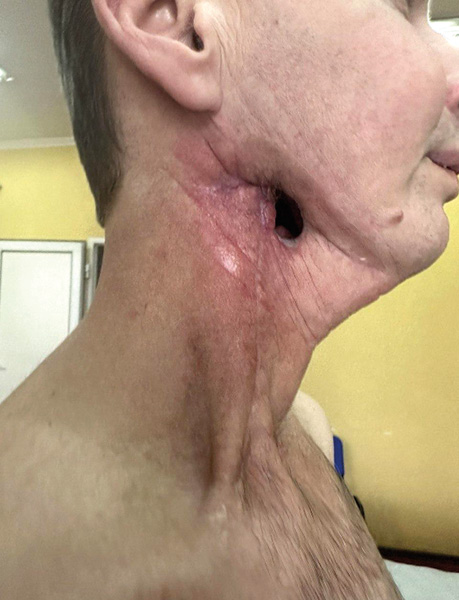
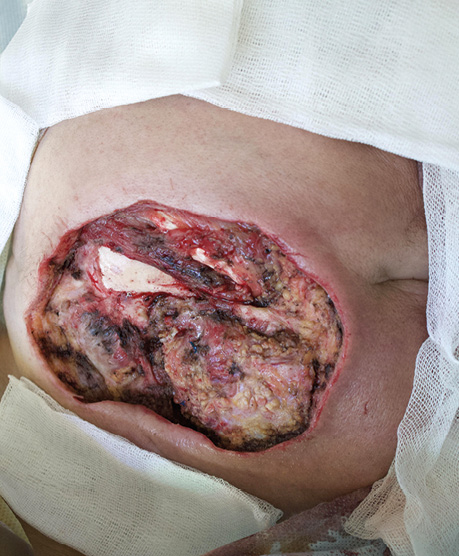
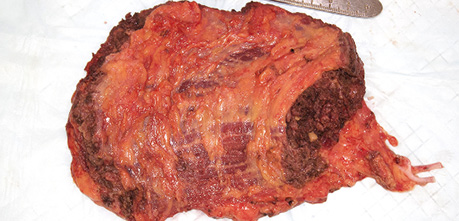
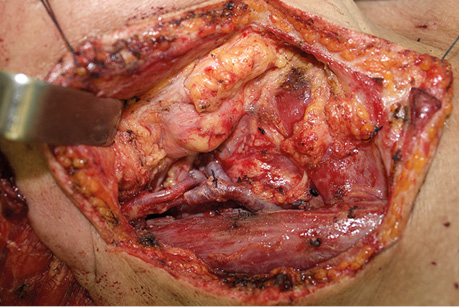
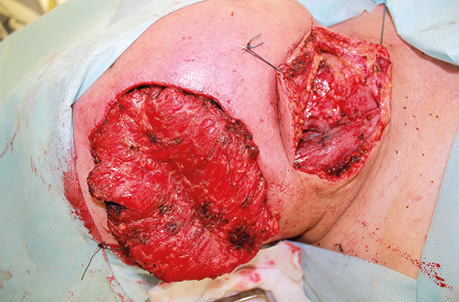
Пацієнт Б., 49 років, звернувся в клініку Державного некомерційного підприємства (ДНП) «Національний інститут раку» з орофарингостомою. В анамнезі — комбіноване лікування ВПЛ-асоційованої плоскоклітинної карциноми ротоглотки та пластичне заміщення орофарингостоми клаптем великого грудного мʼяза (повна втрата клаптя). За даними КТ-візуалізації, на боці орофарингостоми виявлено резекцію внутрішньої яремної вени та зовнішньої сонної артерії, що унеможливлює використання вільного васкуляризованого клаптя через відсутність придатних реципієнтних судин. Для пластичного усунення орофарингостоми вирішили використати реґіонарний КНМС. Етапи реконструкції представлені на рис. 4–7.
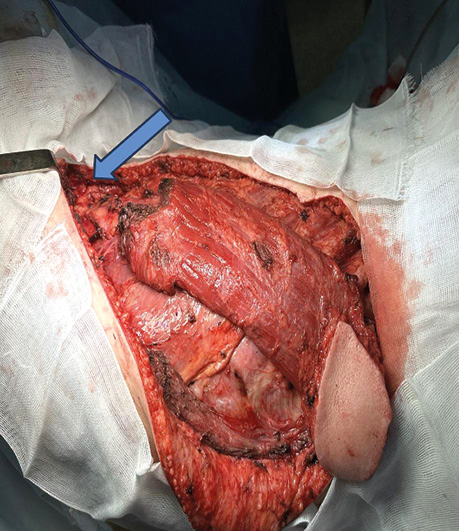
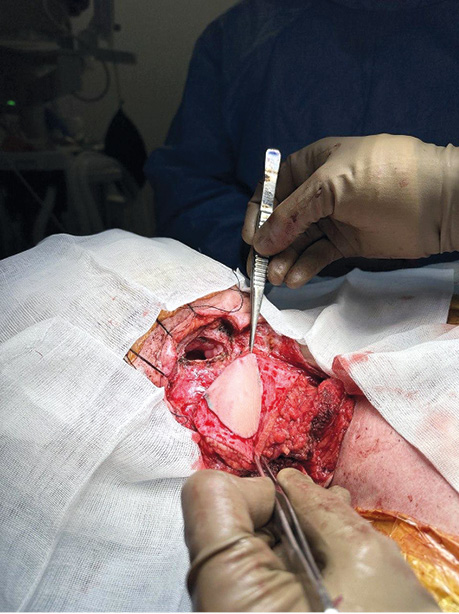
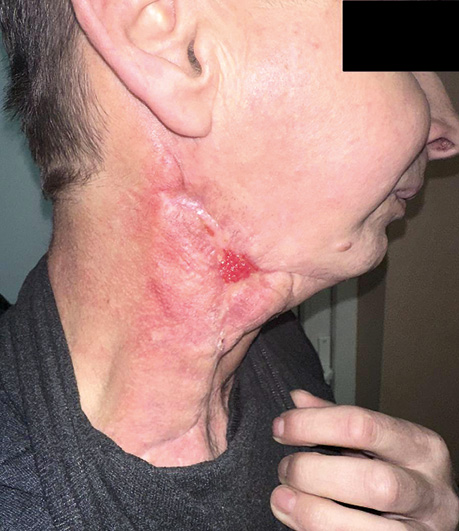
Клінічний випадок 2
Пацієнт В., 39 років. Встановлено діагноз плоскоклітинної карциноми верхньощелепного синусу зліва Т4аN0M0. Виконано максилектомію, тип ІІ, з пластичним заміщенням дефекту кістково-мʼязовим КНМС. Етапи реконструкції представлені на рис. 8–14.
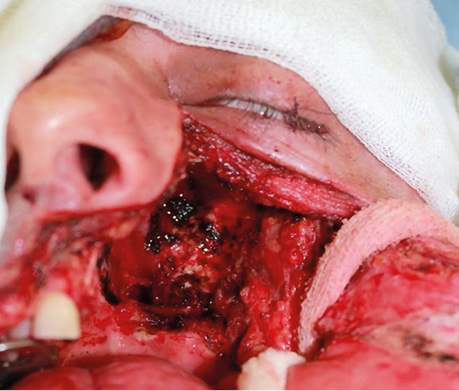
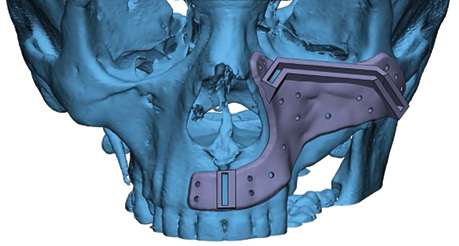
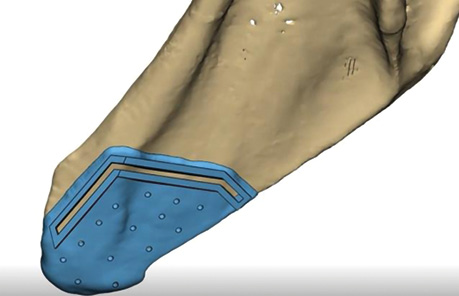
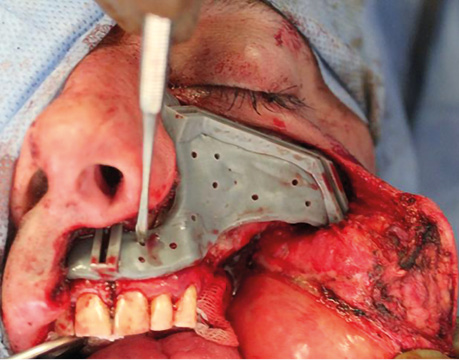
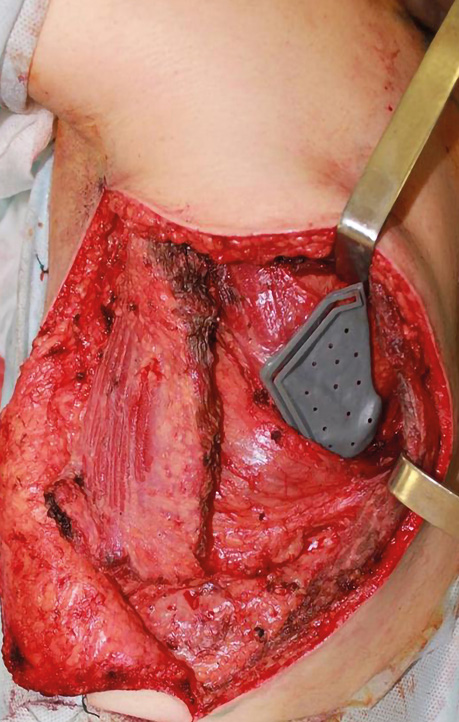
Клінічний випадок 3
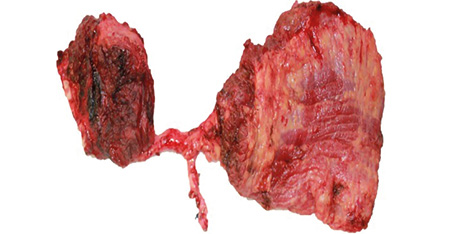
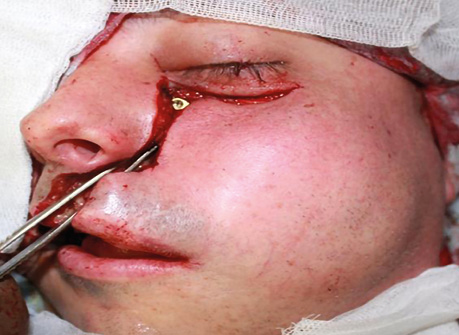
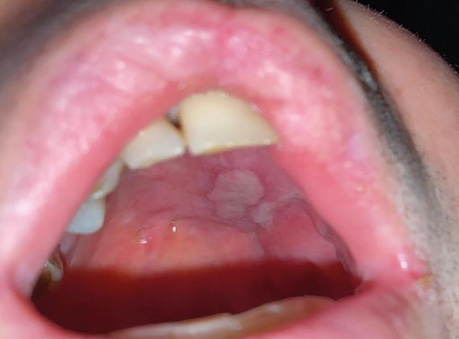
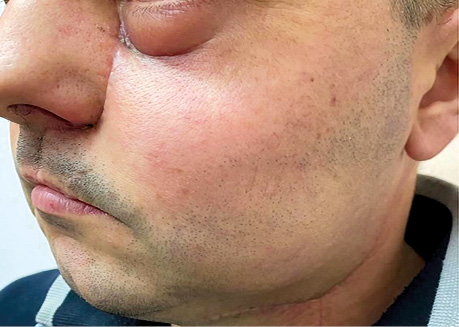
Пацієнтка Б., 40 років. Встановлено діагноз — плоскоклітинна карцинома бічної поверхні язика справа Т3N1M0. Виконано субтотальну резекцію язика з реконструкцією вільним мʼязово-шкірним КНМС. Етапи реконструкції представлені на рис. 15–20.
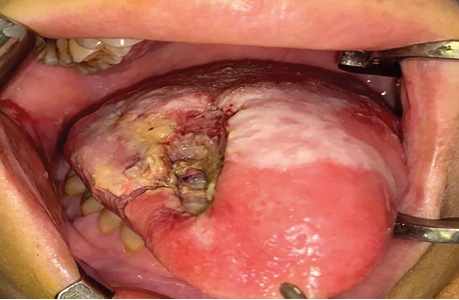
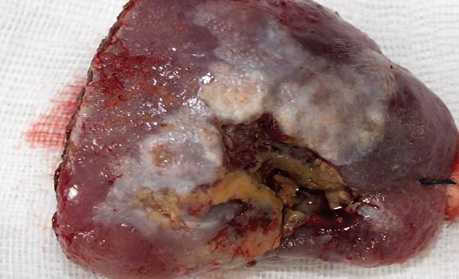
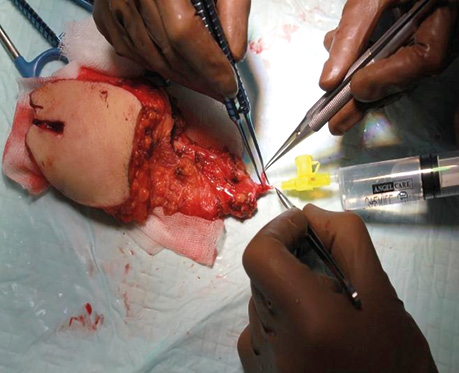
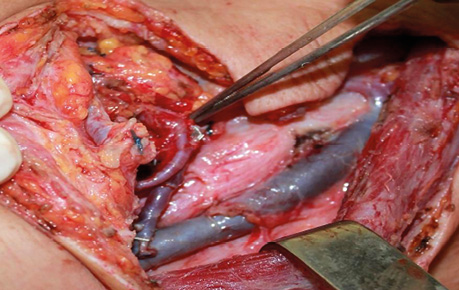
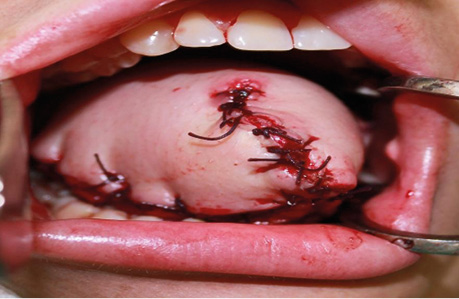
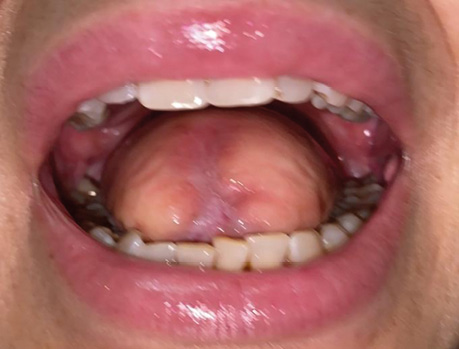
Клінічний випадок 4
Пацієнт А., 55 років. Рецидив плоскоклітинної карциноми шкіри вушної раковини справа, метастази в л/в привушної ділянки. Виконано тотальну резекцію вушної раковини з резекцією мʼяких тканин привушної, скроневої ділянок, заміщення дефекту вільним мʼязовим трансплантатом найширшого мʼяза спини. Етапи реконструкції представлені на рис. 21–27.
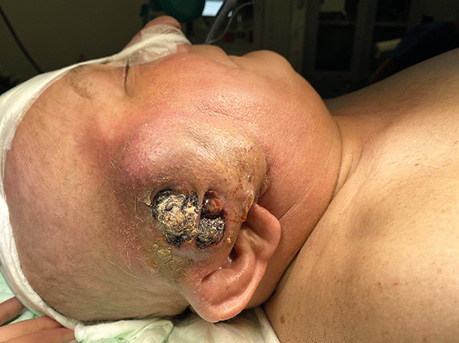
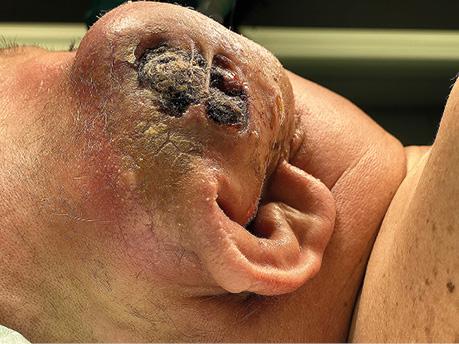
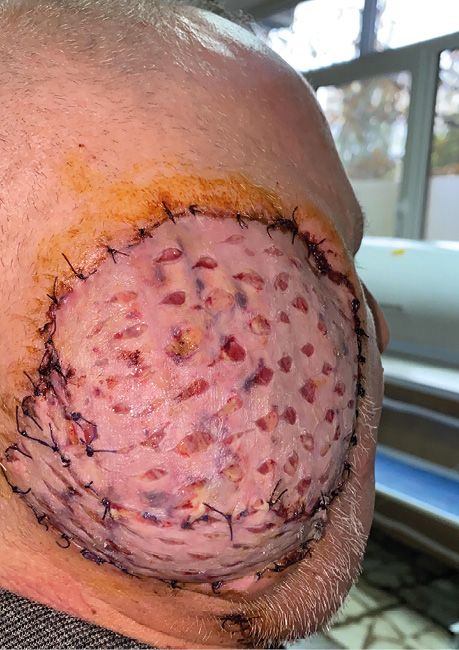
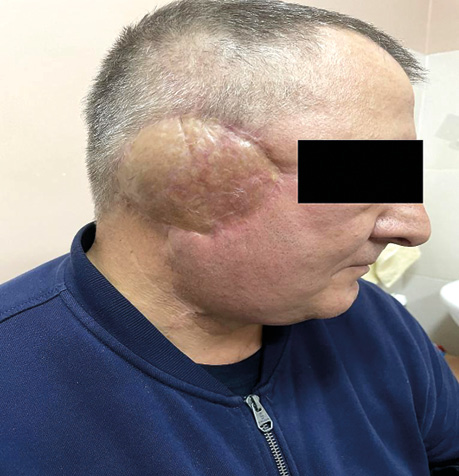
ВИСНОВКИ
Аналіз літературних даних та власний клінічний досвід свідчать про високу ефективність КБПА при пластичному заміщенні обширних та складних тривимірних дефектів голови та шиї.
Основними перевагами КБПА, що визначають перспективність їх використання в реконструктивній хірургії голови та шиї, є довга судинна ніжка, належна перфузія трансплантата, низька схильність судин до атеросклеротичних змін та анатомічна варіативність клаптів, що дозволяє формувати на одній судинній ніжці комбіновані трансплантати з різних типів тканин.
Список використаної літератури
1. Yao, M., & Salgarello, M. (2023). Impact of preoperative radiotherapy on head and neck free flap reconstruction: a report on 429 cases. Auris Nasus Larynx, 50(3), 123–130. doi: 10.1016/j.bjps.2012.12.019.
2. Brown, J. S., Bekiroglu, F., & Shaw, R. (2010). Indications for the scapular flap in reconstructions of the head and neck. British journal of oral & maxillofacial surgery, 48(5), 331–337. doi: 10.1016/j.bjoms.2009.09.013.
3. Wong, C. H., & Wei, F. C. (2010). Microsurgical free flap in head and neck reconstruction. Head & Neck Journal, 32(9), 1236–1245. doi: 10.1002/hed.21284.
4. Brinkman, J. N., Kambiz, S., & de Jong, T. (2019). Long-term outcomes after double free flap reconstruction for locally advanced head and neck cancer. Journal of Reconstructive Microsurgery, 35(1), 66–73. doi: 10.1055/s-0038-1667113.
5. Mandapathil, M., Roessler, M., & Werner, J. A. (2014). Salvage surgery for head and neck squamous cell carcinoma. European Archives of Oto-Rhino-Laryngology. European Archives of Oto-Rhino-Laryngology, 271(7), 1845–1850. doi: 10.1007/s00405-014-3043-1.
6. Guerra, A. B., Lyons, G. D., & Dupin, C. L. (2005). Advantages of perforator flaps in reconstruction of complex defects of the head and neck. Ear, Nose & Throat Journal, 84(7), 441–447.
7. Hurvitz, K. A., & Kobayashi, M. (2006). Current options in head and neck reconstruction. Plastic and Reconstructive Surgery, 118(5), 122e–133e. doi: 10.1097/01.prs.0000237094.58891.fb.
8. Largo, R. D., & Garvey, P. B. (2018). Updates in head and neck reconstruction. Plastic and Reconstructive Surgery, 141(2), 271e–285e. doi: 10.1055/s-0043-1771303.
9. Quillen, C. G., Shearin, J. C., & Georgiade, N. G. (1978). Use of the latissimus dorsi myocutaneous island flap for reconstruction in the head and neck area. Plastic and Reconstructive Surgery, 62, 113–117. doi: 10.1097/00006534-197807000-00028.
10. Englar, K., Dean, R., Segal, R. M., Leymarie, N., Honart, J. F., & Kolb, F. J. (2020). Harvest of the Latissimus Dorsi and Other Derivate Flaps from the Subscapular Angiosome in a Supine Position: A 22 Years’ Experience. Plastic and Reconstructive Surgery — Global Open, 8(9), 77–78.
11. O’Connell, J. E., Bajwa, M. S., Schache, A. G., & Shaw, R. J. (2017). Head and neck reconstruction with free flaps based on the thoracodorsal system. Oral Oncology, 75, 46–53. doi: 10.1016/j.oraloncology.2017.10.019.
12. DeGaris, C., & Swartley, W. (1928). The axillary artery in white and Negro stocks. American journal of anatomy, 4, 353.
13. Reconstruction of head and neck defects using free flaps: A review. (2013). Hindawi Publishing Corporation, 22(1), 38–44.
14. Pohlenz, P., Klatt, J., Schön, G., Blessmann, M., Li, L., & Schmelzle, R. (2012). Microvascular free flaps in head and neck surgery: complications and outcome of 1000 flaps. International Journal of Oral & Maxillofacial Surgery, 41(6), 739–743. doi: 10.1016/j.ijom.2012.02.012.
15. Rowsell, A. R., Davies, D. M., Eisenberg, N., & Taylor, G. I. (1984). The anatomy of the subscapular-thoracodorsal arterial system: study of 100 cadaver dissections. British Journal of Plastic Surgery, 37, 574–576. doi: 10.1016/0007-1226(84)90152-8.
16. Bartlett, S. P., May, J. W., & Yarernchuk, M. J. (1981). The latissimus dorsi muscle. A fresh cadaver study of the primary neurovascular pedicle. Plastic and Reconstructive Surgery, 67, 631.
17. Urken, M., Cheney, M., & Futran, N. (2012). Atlas of regional and free flaps for head and neck reconstruction: flap harvest and insetting. 2nd ed. Lippincott Williams & Wilkin.
18. Kawamura, K., Yajima, H., Kobata, Y., Shigematsu, K., & Takakura, Y. (2005). Anatomy of Y-shaped configurations in the subscapular arterial system and clinical application to har-vesting flow-through flaps. Plastic and Reconstructive Surgery, 116, 1082–1089. doi: 10.1097/01.prs.0000178791.85118.ca.
19. Coeugniet, E., Harchaoui, A., Malka, G., Pellerin, P., & Danino, A. (2007). The osteomuscular la-tissimus dorsi scapula flap: anatomical study and 3 cases. Annales de Chirurgie Plastique et Esthetique, 52, 108–113. doi: 10.1016/j.anplas.2006.12.002.
20. Halim, A. S., & Wan, Z. (2004). Anomalous arterial supply to the muscles in a combined la-tissimus dorsi and serratus anterior flap. Clinical Anatomy, 17, 358–359. doi: 10.1002/ca.10190.
21. Tansini, I. (1906). Sopra il mio nuovo processo di amputazione della mammella. Gazzetta medica italiana archivio per le scienze mediche, 57, 141.
22. Maxwell, G. P., Stueber, K., & Hoopes, J. E. (1978). A free latissimus dorsi myocutaneous flap. Plastic and Reconstructive Surgery, 62(4), 462–466. doi: 10.1097/00006534-197809000-00033.
23. Taylor, G. I., & Palmer, J. (1987). The vascular territories {angiosomes) of the body; experi-mental study and clinical applications. British Journal of Plastic Surgery, 40, 113. doi: 10.1016/0007-1226(87)90185-8.
24. Wei, F. C., Yazar, S., Lin, C. H., Cheng, M. H., Tsao, C. K., & Chiang, Y. C. (2005). Double free flaps in head and neck reconstruction. Clinics in Plastic Surgery, 32(3), 303–308. doi: 10.1016/j.cps.2005.01.004.
25. Li, B. H., Jung, H. J., Choi, S. W., Kim, S. M., Kim, M. J., & Lee, J. H. (2012). Latissimus dorsi (LD) free flap and reconstruction plate used for extensive maxillo-mandibular reconstruction after tumour ablation. Journal of Cranio-Maxillofacial Surgery, 40(8), e293–300. doi: 10.1016/j.jcms.2012.01.006.
26. Baker, S. R. (1984). Closure of large orbital-maxillary defects with free latissimus dorsi myocutaneous flaps. Head and neck surgery, 6, 828–835. doi: 10.1002/hed.2890060405.
27. Maruyama, Y., Iwahira, Y., Hashimura, C., & Ono, H. (1986). One stage total cheek reconstruction with double folded extended latissimus dorsi musculocutaneous flap. Acta chirurgiae plasticae, 28, 159–166.
28. Robson, M. C., Zachary, L. S., Schmidt, D. R., Faibisoff, B., & Hekmatpanah, J. (1989). Reconstruction of large cranial defects in the presence of heavy radiation damage and infection utilizing tissue transferred by microvascular anastomoses. Plastic and Reconstructive Surgery, 83, 438–442. doi: 10.1097/00006534-198903000-00004.
29. Hierner, R., van Loon, J., Goffin, J., & van Calenbergh, F. (2007). Free latissimus dorsi flap transfer for subtotal scalp and cranium defect reconstruction: report of 7 cases. Microsurgery, 27(5), 425–428. doi: 10.1002/micr.20386.
30. Swartz, W. M., Banis, J. C., Newton, E. D., Ramasastry, S. S., Jones, N. F., & Acland, R. (1986). The osteocutaneous scapular flap for mandibular and maxillary reconstruction. Plastic and Reconstructive Surgery, 77, 530–545. doi: 10.1097/00006534-198604000-00003.Byun, S.-H., Lim, H.-K., Yang, B.-E., Kim S.-M., & Lee, J.-H. (2020). Delayed Reconstruction of Palatomaxillary Defect Using Fibula Free Flap. Journal of Clinical Medicine, 9, 884. doi: 10.3390/jcm9030884.
31. Coleman, J. J., & Sultan, M. R. (1991). The bipedicled osteocutaneous scapula flap: a new subscapular system free flap. Plastic and Reconstructive Surgery, 87, 682–692. doi: 10.1097/00006534-199104000-00013.
32. Deraemaecker, R., Thienen, C., Lejour, M., & Dor, P. (1988). The serratus anteriorscapular free flap: a new osteomuscular unit for reconstruction after radical head and neck surgery. Proceedings of the second international conference on head and neck cancer.
33. Yoo, J., Dowthwaite, S. A., Fung, K., Franklin, J., & Nichols, A. (2013). A new angle to mandibular reconstruction: the scapular tip free flap. Head & Neck, 35(7), 980–986. doi: 10.1002/hed.23065.
34. Pagedar, N. A., Gilbert, R. W., Chan, H., Daly, M. J., Irish, J. C., & Siewerdsen, J. H. (2012). Maxillary reconstruction using the scapular tip free flap: a radiologic comparison of 3D morphology. Head & Neck, 34(10), 1377–1382. doi: 10.1002/hed.21946.
35. Miles, B. A., & Gilbert, R. W. (2011). Maxillary reconstruction with the scapular angle osteomyogenous free flap. Archives of Otolaryngology head and neck surgery, 137(11), 1130–1135. doi: 10.1001/archoto.2011.187.
36. Uglesic, V., Virag, M., Varga, S., Knezević, P., & Milenović, A. (2000). Reconstruction following radical maxillectomy with flaps supplied by the subscapular artery. Journal of Cranio-Maxillofacial Surgery, 28(3), 153–160. doi: 10.1054/jcms.2000.0137.
37. L’Heureux-Lebeau, B., Odobescu, A., Harris, P. G., Guertin, L., & Danino, A. M. (2013). Chimaeric subscapular system free flap for complex oro-facial defects. Journal of Plastic, Reconstructive & Aesthetic Surgery, 66(7), 900–905. doi: 10.1016/j.bjps.2013.02.031.
Адреса для листування:
Фокін Геннадій Геннадійович
01601, м. Київ, просп. Берестейський, 34
Національний медичний університет ім. О.О. Богомольця
E-mail: fokinhennadii@gmail.com
Correspondence:
Hennadii Fokin
34 Beresteisky avenue, Kyiv, 01601
Bogomolets National Medical University
E-mail: fokinhennadii@gmail.com














Leave a comment