Пембролізумаб у комбінації з хімієтерапією для лікування метастатичного недрібноклітинного раку легень (НДКРЛ) із рівнем експресії ліганду запрограмованої клітинної загибелі 1 (PD-L1) <1% TPS: зведений аналіз результатів після 5 років спостереження
Резюме. У цьому дослідженні представлено результати зведеного аналізу пацієнтів із раніше нелікованим метастатичним недрібноклітинним раком легень (НДКРЛ) із рівнем експресії ліганду запрограмованої клітинної загибелі 1 (PD-L1) менш ніж 1% за показником пропорції пухлини (tumor proportion score — TPS). Хворих залучено у III фазу клінічного дослідження, в якому оцінювалося застосування пембролізумабу в комбінації з хімієтерапією порівняно з плацебо поєднано з хімієтерапією. Методи. У цей зведений аналіз включені індивідуальні дані пацієнтів із міжнародного дослідження KEYNOTE-189 (NCT02578680) та розширених даних його проведення в Японії (NCT03950674), що стосувалися метастатичного неплоскоклітинного НДКРЛ без EGFR- або ALK-мутацій, а також даних дослідження KEYNOTE-407 (NCT02775435) та розширених даних його проведення в Китаї (NCT03875092), які вивчали метастатичний плоскоклітинний НДКРЛ. Хворі отримували пембролізумаб або плацебо поєднано з пеметрекседом і цисплатином або карбоплатином у дослідженні KEYNOTE-189, а також пембролізумаб або плацебо разом із карбоплатином і паклітакселом або наб-паклітакселом у дослідженні KEYNOTE-407. Рівень експресії ліганду PD-L1 оцінювався централізовано за допомогою PD-L1 IHC 22C3 pharmDx (Agilent Technologies, США). Результати. У цей аналіз залучено 442 пацієнтів (255 осіб, які отримували пембролізумаб у комбінації з хімієтерапією, та 187 пацієнтів, яким призначили хімієтерапію). Середній термін спостереження становив 60,7 міс (у діапазоні 49,9–72,0) міс. Застосування пембролізумабу і хімієтерапії супроводжувалося підвищенням загальної виживаності (ЗВ) (коефіцієнт ризику (КР) = 0,64; 95% довірчий інтервал (ДІ) 0,51–0,79) і виживаності без прогресування (ВБП) (КР=0,66; 95% ДІ 0,54–0,81) порівняно з використанням хімієтерапії. 5-річна ЗВ становила 12,5% (95% ДІ 8,6–17,3%) та 9,3% (95% ДІ 5,6–14,1%) в обох вищезазначених групах відповідно. Побічні ефекти (ПЕ) III–IV ступенів, пов’язані з лікуванням, зафіксовані у 59,1% усіх пацієнтів у групі поєднання пембролізумабу та хімієтерапії та у 61,3% хворих у групі хімієтерапії. Висновки. Результати 5-річного спостереження підтверджують, що застосування пембролізумабу в комбінації з хімієтерапією забезпечує значне та стійке підвищення показників виживаності порівняно із застосуванням хімієтерапії без пембролізумабу для пацієнтів із раніше нелікованим метастатичним НДКРЛ і рівнем експресії PD-L1 менш ніж 1% TPS. Ці результати підтверджують дані щодо застосування комбінації пембролізумабу та хімієтерапії як стандартного підходу до лікування цієї категорії пацієнтів.
DOI: 10.32471/clinicaloncology.2663-466X.34042
Вступ
 Виявлено, що пембролізумаб у комбінації з хімієтерапією значно підвищує ЗВ і ВБП порівняно з хімієтерапією поєднано з плацебо у пацієнтів із раніше нелікованим метастатичним НДКРЛ, які не мають EGFR- або ALK-мутацій. Ці переваги відмічають незалежно від рівня експресії PD-L1 TPS у межах досліджень KEYNOTE-189 (за участю хворих з неплоскоклітинним НДКРЛ) та KEYNOTE-407 (за участю осіб з плоскоклітинним НДКРЛ) [1–2]. На основі цих даних пембролізумаб у комбінації з хімієтерапією визнаний стандартом першої лінії терапії для пацієнтів із метастатичним плоскоклітинним та неплоскоклітинним НДКРЛ незалежно від рівня експресії PD-L1 TPS, зокрема для осіб із рівнем TPS <1% [3–7]. Крім того, пембролізумаб схвалений як монотерапія для пацієнтів із місцево-поширеним або метастатичним НДКРЛ, які раніше не отримували лікування, за умови, що рівень експресії PD-L1 TPS становить ≥1% і відсутні мутації генів EGFR та ALK [3–4].
Виявлено, що пембролізумаб у комбінації з хімієтерапією значно підвищує ЗВ і ВБП порівняно з хімієтерапією поєднано з плацебо у пацієнтів із раніше нелікованим метастатичним НДКРЛ, які не мають EGFR- або ALK-мутацій. Ці переваги відмічають незалежно від рівня експресії PD-L1 TPS у межах досліджень KEYNOTE-189 (за участю хворих з неплоскоклітинним НДКРЛ) та KEYNOTE-407 (за участю осіб з плоскоклітинним НДКРЛ) [1–2]. На основі цих даних пембролізумаб у комбінації з хімієтерапією визнаний стандартом першої лінії терапії для пацієнтів із метастатичним плоскоклітинним та неплоскоклітинним НДКРЛ незалежно від рівня експресії PD-L1 TPS, зокрема для осіб із рівнем TPS <1% [3–7]. Крім того, пембролізумаб схвалений як монотерапія для пацієнтів із місцево-поширеним або метастатичним НДКРЛ, які раніше не отримували лікування, за умови, що рівень експресії PD-L1 TPS становить ≥1% і відсутні мутації генів EGFR та ALK [3–4].
Отже, визначення TPS PD-L1 є стандартною клінічною процедурою для вибору оптимального лікування хворих із плоскоклітинним чи неплоскоклітинним метастатичним НДКРЛ, які не отримували попередньої терапії. Згідно з результатами реальних досліджень, близько 48% усіх пацієнтів із прогресуючим чи метастатичним НДКРЛ мають рівень експресії PD-L1 TPS <1% [8–10]. Для кращого розуміння ефективності лікування серед осіб із рівнем експресії PD-L1 TPS <1% проведено об’єднаний аналіз даних пацієнтів із поширеним або метастатичним НДКРЛ, які були залучені в дослідження KEYNOTE-189, KEYNOTE-407 та KEYNOTE-021 (когорта G), в яких порівнювали ефективність пембролізумабу та хімієтерапії з хімієтерапією [11]. Серед 444 хворих із рівнем експресії PD-L1 TPS <1%, дані яких включені в цей зведений аналіз, застосування пембролізумабу поєднано з хімієтерапією супроводжувалося підвищенням ЗВ (КР=0,63; 95% ДІ 0,50–0,79), ВБП (КР=0,68; 95% ДІ 0,56–0,83) і частоти об’єктивної відповіді (ЧОВ=50,0 проти 29,8%) порівняно з хімієтерапією [11].
Однак, незважаючи на ці дані, у дослідженнях, проведених у 5 європейських країнах, виявлено, що більшість пацієнтів із метастатичним НДКРЛ із рівнем експресії PD-L1 TPS <1% (62,4%) отримували тільки хімієтерапію як першу лінію терапії, тоді як 26,5% усіх учасників приймали комбінацію імунотерапії та хімієтерапії [9]. Подібні результати отримані в ретроспективному дослідженні в США за участю 979 пацієнтів із IV стадією НДКРЛ та рівнем експресії PD-L1 TPS <1%, де лише 28% усіх пацієнтів отримували пембролізумаб поєднано з хімієтерапією в першій лінії лікування. Ці результати свідчать, що значна частина хворих із метастатичним НДКРЛ і рівнем експресії PD-L1 TPS <1% не отримують лікування відповідно до сучасних стандартів, що може позбавляти їх досягнення оптимальних результатів.
У цьому аналізі оцінені довгострокові результати лікування пембролізумабом у комбінації з хімієтерапією порівняно з хімієтерапією поєднано з плацебо у пацієнтів із раніше нелікованим метастатичним НДКРЛ і рівнем експресії PD-L1 TPS <1% у межах досліджень KEYNOTE-189 та KEYNOTE-407.
Методи
Пацієнти
У цей зведений аналіз включені індивідуальні дані пацієнтів із раніше нелікованим метастатичним НДКРЛ з рівнем експресії PD-L1 TPS менше <1%. Пацієнти брали участь у рандомізованих подвійних сліпих дослідженнях III фази: KEYNOTE-189 (NCT02578680), що стосувалося метастатичного неплоскоклітинного НДКРЛ [1], та його розширених даних, отриманих з Японії (NCT03950674) [12], а також KEYNOTE-407 (NCT02775435), в якому вивчали метастатичний плоскоклітинний НДКРЛ [2], та його розширених даних, отриманих з Китаю (NCT03875092) [13].
Раніше опубліковані критерії залучення для KEYNOTE-189 та KEYNOTE-407 визначали, що пацієнти мають бути віком від 18 років, мати гістологічно або цитологічно підтверджений НДКРЛ IV стадії та не отримувати системного лікування для поширеного або метастатичного захворювання [1–2, 12–13]. Крім того, у KEYNOTE-189 виключали пацієнтів із активуючими (сенсибілізувальними) мутаціями EGFR або ALK. У відповідних хворих розміри пухлини були вимірюваними відповідно до Критеріїв оцінки відповіді при солідних пухлинах (RECIST) версія 1.1, функціональний статус за шкалою Східної кооперативної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) становив 0 або 1, очікувана тривалість життя становила щонайменше 3 міс та функція органів була задовільною. Усі пацієнти надали зразок пухлинної тканини для оцінки PD-L1 TPS. Протоколи досліджень схвалені етичними комітетами, а всі хворі підписали інформовану згоду.
Дизайн дослідження та лікування
Розширене японське дослідження KEYNOTE-189 та китайське KEYNOTE-407 мали аналогічний дизайн із відповідними глобальними дослідженнями, але залучали лише пацієнтів із цих країн. У KEYNOTE-189 хворих рандомізовано у співвідношенні 2:1 для отримання або пембролізумабу в дозі 200 мг внутрішньовенно кожні 3 тиж протягом до 35 циклів, що еквівалентно 2 рокам, або фізіологічного розчину плацебо. Усі пацієнти також отримували пеметрексед (500 мг/м²) поєднано з цисплатином (75 мг/м²) або карбоплатином (доза за площею під кривою — 5 мг/мл/хв) кожні 3 тиж протягом 4 циклів із подальшою підтримувальною терапією пеметрекседом.
У KEYNOTE-407 хворих рандомізовано у співвідношенні 1:1 для отримання пембролізумабу (200 мг внутрішньовенно кожні 3 тиж до 35 циклів) або фізіологічного розчину плацебо. Пацієнти також отримували карбоплатин (6 мг/мл/хв) у комбінації з паклітакселом (200 мг/м² кожні 3 тиж) або наб-паклітакселом (100 мг/м² у 1-й, 8-й і 15-й день кожного 3-тижневого циклу) протягом 4 циклів. У всіх дослідженнях лікування тривало до завершення 35 циклів, досягнення підтвердженої повної відповіді (ПВ), встановленого рентгенографічного прогресування захворювання, виникнення серйозних ПЕ, супутніх хвороб або рішення лікаря чи пацієнта припинити лікування. Хворі з групи плацебо в комбінації з хімієтерапією, у яких виявлено підтверджене сліпим незалежним центральним оглядом відповідно до критеріїв RECIST версії 1.1 прогресування захворювання, могли перейти на відкритий прийом пембролізумабу (200 мг кожні 3 тиж до 35 циклів) у випадку відповідності критеріям.
Пацієнти, які отримували пембролізумаб у складі основної групи або перейшли з групи плацебо + хімієтерапія до відкритої групи пембролізумабу через прогресування захворювання, могли отримати другий курс пембролізумабу (до 17 циклів, що приблизно відповідає 1 року). Це дозволялося за умови, що хворі припинили лікування після підтвердження ПВ, зафіксованої центральним оглядом, після отримання принаймні 8 циклів пембролізумабу та щонайменше 2 циклів пембролізумабу після встановлення початкової ПВ, або за умов, що у пацієнтів було підтверджено стабілізацію захворювання або поліпшення стану після завершення 35 циклів лікування з причин, не пов’язаних із прогресуванням захворювання або непереносимістю лікування. Крім того, хворі мали відповідати усім іншим критеріям відповідності для другого курсу терапії.
У всіх дослідженнях рандомізацію стратифікували за рівнем PD-L1 TPS (≥1% або <1%). Додатковими факторами стратифікації в KEYNOTE-189 були: тип платинової хімієтерапії (цисплатин або карбоплатин), статус куріння (ніколи не курив або курив у минулому / теперішньому). У KEYNOTE-407 враховували терапію таксанами (застосування паклітакселу проти наб-паклітакселу) та регіон залучення пацієнтів (Східна Азія проти інших регіонів).
Оцінки
У всіх дослідженнях рівень PD-L1 TPS оцінювався під час скринінгу в центральній лабораторії за допомогою методу PD-L1 IHC 22C3 pharmDx (Agilent Technologies, Карпінтерія, Каліфорнія). Для аналізу використовували зразки пухлини, зафіксовані у формаліні та отримані під час діагностики. І дослідники, і пацієнти були засліпленими щодо рівня експресії PD-L1 TPS. У KEYNOTE-189 також засліплено персонал спонсора, однак у KEYNOTE-407 цей персонал мав доступ до даних рівня експресії PD-L1 TPS. У KEYNOTE-189 візуалізацію пухлини проводили на початку дослідження, на 6-му та 12-му тижнях після рандомізації, потім кожні 9 тиж до 48-го тижня, а далі — кожні 12 тиж після цього. У KEYNOTE-407 візуалізація проводилася на початку дослідження, на 6-му, 12-му та 18-му тижнях після рандомізації, потім кожні 9 тиж до 45-го тижня, а далі — кожні 12 тиж. Відповідь на пухлину оцінювали відповідно до критеріїв RECIST версії 1.1 шляхом незалежного засліпленого центрального огляду. Виняток становила кінцева точка ВБП2, яку оцінювали дослідники за критеріями RECIST версії 1.1. ПЕ були класифіковані відповідно до Загальних термінологічних критеріїв ПЕ Державного некомерційного підприємства «Національний інститут раку» (версія 4.0).
Кінцеві точки
У всіх дослідженнях первинними кінцевими точками були ЗВ (час від рандомізації до смерті з будь-якої причини) та ВБП (час від рандомізації до першого задокументованого прогресування захворювання або смерті з будь-якої причини). Вторинні кінцеві точки включали ЧОВ (частка пацієнтів із ПВ або частковою відповіддю (ЧВ), тривалість відповіді (час від першої задокументованої ПВ або ЧВ до прогресування патології або смерті у хворих із підтвердженою ПВ або ЧВ) і безпеку. ВБП2 — це час від рандомізації до другої або наступної прогресії пухлини під час наступного лікування чи смерті. Ця точка була дослідницькою і визначена протоколом у всіх дослідженнях.
Статистичний аналіз
До цього аналізу залучали пацієнтів із глобального дослідження KEYNOTE-189 та даних його проведення в Японії, а також із глобального дослідження KEYNOTE-407 та результатів його проведення в Китайській Народній Республіці, у яких рівень експресії PD-L1 TPS становив <1%. Оцінка ефективності проводилася в об’єднаній популяції пацієнтів, які планували отримати лікування, а оцінка безпеки — в об’єднаній популяції хворих, які фактично отримували терапію. Криві ЗВ, ВБП, тривалості відповіді і ВБП2 оцінювали за методом Каплана — Меєра. КР і 95% ДІ для ЗВ, ВБП і ВБП2 розраховували за допомогою стратифікованої (за режимом хімієтерапії) регресійної моделі Кокса. Метод Ефрона застосовували для обробки зв’язків, а вид лікування розглядали як коваріату. Аналіз проводився постфактум, без заздалегідь визначеного рівня значущості (альфа).
Результати
Пацієнти та дослідження
В об’єднаному аналізі досліджень KEYNOTE-189 (зокрема їх розширених результатів проведення в Японії, n=646) і KEYNOTE-407 (також його розширених результатів проведення в Китайській Народній Республіці, n=669) охоплено 1315 пацієнтів, з яких 442 (33,6%) мали рівень експресії PD-L1 TPS <1%. До цієї групи входили 254 хворі, які отримували лікування пембролізумабом поєднано з хімієтерапією, та 186 пацієнтів, які отримували плацебо разом із хімієтерапією. На момент завершення збору даних усі хворі, окрім одного, припинили або завершили лікування. Цей пацієнт продовжував отримувати пеметрексед у групі пембролізумабу та хімієтерапії. У цій групі також 4 пацієнти розпочали другий курс пембролізумабу, а 36 отримували подальшу анти-PD-(L)1 терапію поза межами дослідження. У групі отримання плацебо в комбінації з хімієтерапією 76 осіб перейшли на монотерапію пембролізумабом у межах дослідження, а 24 отримали анти-PD-(L)1 терапію поза його межами, що забезпечило ефективний перехід до нової терапії для 53,5% усіх пацієнтів (рис. 1).
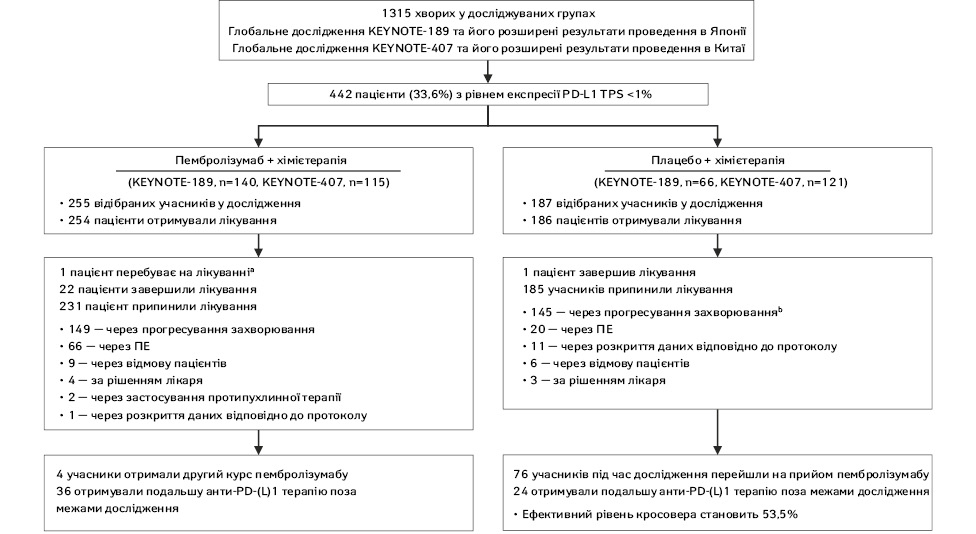
aЛікування пеметрекседом триває на момент зрізу даних.
bВключає пацієнтів із клінічним прогресуванням або прогресуванням захворювання.
Демографічні та вихідні характеристики захворювання були подібними між групами. Серед усіх хворих 74,4% становили чоловіки, 65,2% мали функціональний статус 1 за шкалою ECOG, а 14,9% мали метастази в головний мозок на початку дослідження. У зв’язку з рандомізацією пацієнтів 2:1 у клінічному дослідженні KEYNOTE-189 відмічалася більша частка пацієнтів із неплоскоклітинним НДКРЛ у групі пембролізумабу та хімієтерапії (52,5% хворих) порівняно з групою призначення лише хімієтерапії (34,2% пацієнтів). Також у групі пембролізумабу була менша частка осіб із метастазами в печінку на момент залучення в дослідження порівняно з групою призначення тільки хімієтерапії (13,7 проти 21,4%) (табл. 1). Середній час від рандомізації до завершення збору даних становив 60,7 (у діапазоні 49,9–72,0) міс.
| Характеристика | Пембролізумаб + хімієтерапія, n=255 | Плацебо + хімієтерапія, n=187 | Завершено 35 циклів пембролізумабу, n=27 |
| Вік, медіана (діапазон), роки | 65,0 (31–87) | 64,0 (43–82) | 63,0 (31–74) |
| Стать | |||
| Чоловік | 181 (71,0) | 148 (79,1) | 24 (88,9) |
| Жінка | 74 (29,0) | 39 (20,9) | 3 (11,1) |
| Функціональний статус за ECOG | |||
| 0 | 89 (34,9) | 64 (34,2) | 10 (37,0) |
| 1 | 165 (64,7) | 123 (65,8) | 17 (63,0) |
| 2 | 1 (0,4) | 0 | 0 |
| Гістологія | |||
| Неплоскоклітинна | 134 (52,5) | 64 (34,2) | 8 (29,6) |
| Плоскоклітинна | 111 (43,5) | 119 (63,6) | 18 (66,7) |
| Інша | 10 (4,0) | 4 (2,1) | 1 (3,7) |
| Статус куріння | |||
| Колишні або теперішні курці | 225 (88,2) | 175 (93,6) | 26 (96,3) |
| Ніколи не курили | 30 (11,8) | 12 (6,4) | 1 (3,7) |
| Метастази в головний мозок | 40 (15,7) | 26 (13,9) | 2 (7,4) |
| Метастази в печінку | 35 (13,7) | 40 (21,4) | 3 (11,1) |
| Попередня терапія | |||
| Променева терапія | 47 (18,4) | 34 (18,2) | 1 (3,7) |
| Торакальна променева терапія | 15 (5,9) | 13 (7,0) | 0 |
| Неоад’ювантна терапія | 4 (1,6) | 4 (2,1) | 0 |
| Ад’ювантна терапія | 14 (5,5) | 8 (4,3) | 1 (3,7) |
| Регіон участі в дослідженні | |||
| Східна Азія | 55 (21,6) | 50 (26,7) | 10 (37,0) |
| Європа | 124 (48,6) | 76 (40,6) | 15 (55,6) |
| США | 31 (12,2) | 20 (10,7) | 0 |
| Інші | 45 (17,6) | 41 (21,9) | 2 (7,4) |
Значення представлені як n (%) за винятком випадків, зазначених окремо.
Ефективність
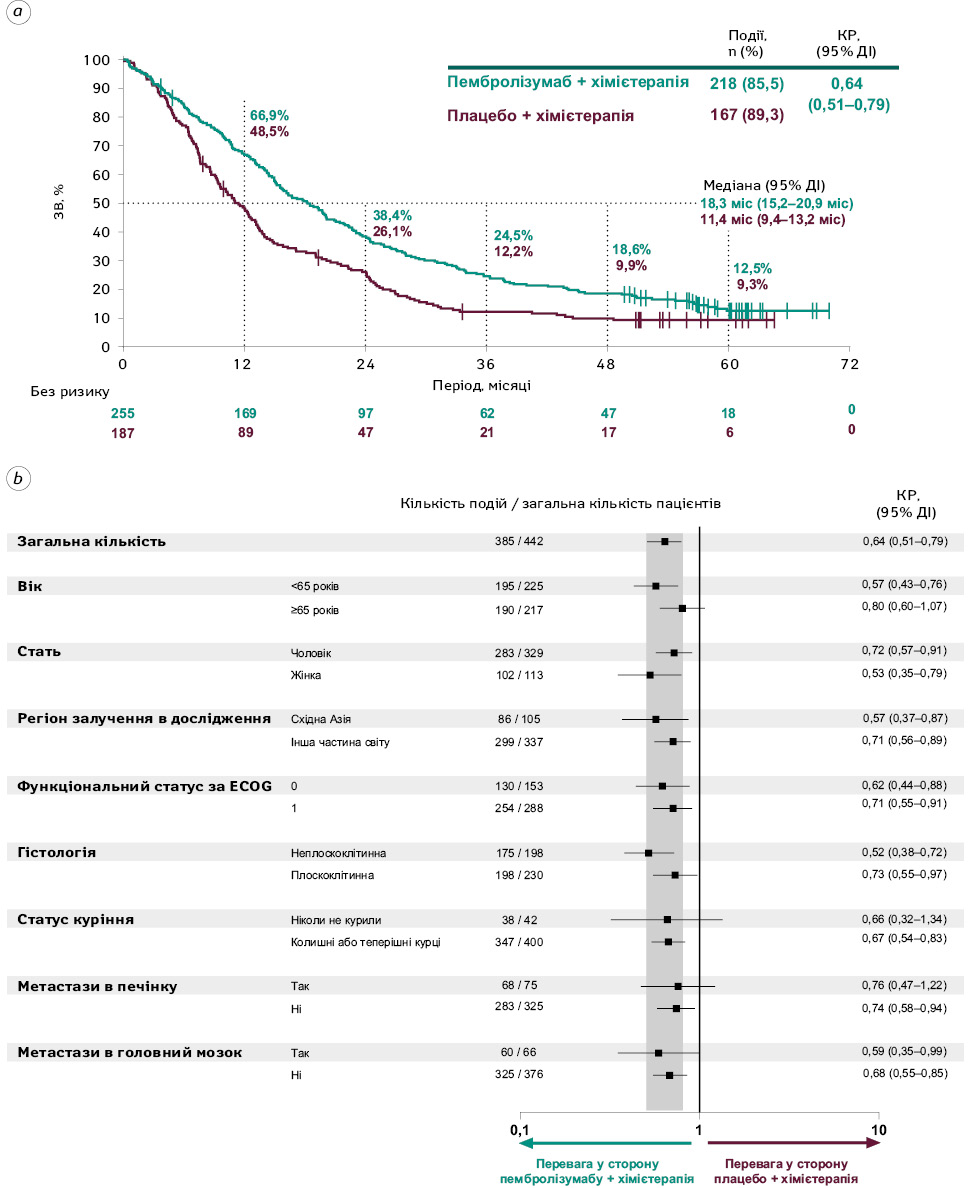
На момент завершення збору даних 218 пацієнтів (85,5%) у групі прийому пембролізумабу з хімієтерапією та 167 хворих (89,3%) у групі застосування плацебо з хімієтерапією померли. Медіана ЗВ становила 18,3 (95% ДІ 15,2–20,9) міс та 11,4 (95% ДІ 9,4–13,2) міс в обох групах відповідно (КР=0,64; 95% ДІ 0,51–0,79). Рівень 5-річної ЗВ становив 12,5% (95% ДІ 8,6%–17,3%) у групі пембролізумабу та 9,3% (95% ДІ 5,6%–14,1%) у групі плацебо (рис. 2a). КР для ЗВ у ключових підгрупах пацієнтів наведено на рис. 2b.
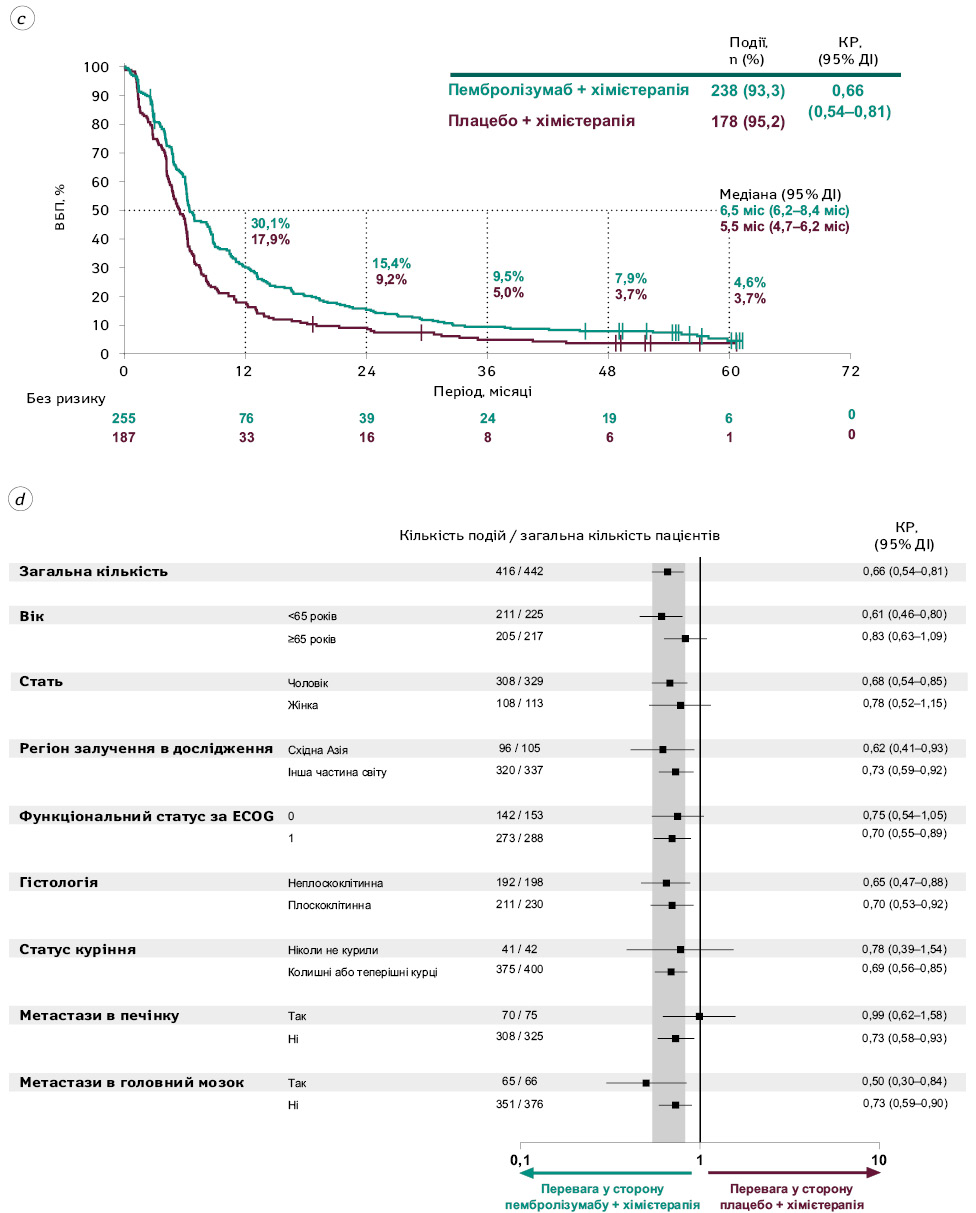
На момент завершення збору даних прогресування захворювання або смерть зафіксували у 238 пацієнтів (93,3%) групи пембролізумабу та 178 (95,2%) групи плацебо. Медіана ВБП становила 6,5 (95% ДІ 6,2–8,4) міс та 5,5 (95% ДІ 4,7–6,2) міс у групі пембролізумабу та плацебо відповідно (КР=0,66; 95% ДІ 0,54–0,81; рис. 2c). КР для ВБП у ключових підгрупах пацієнтів наведено на рис. 2d.
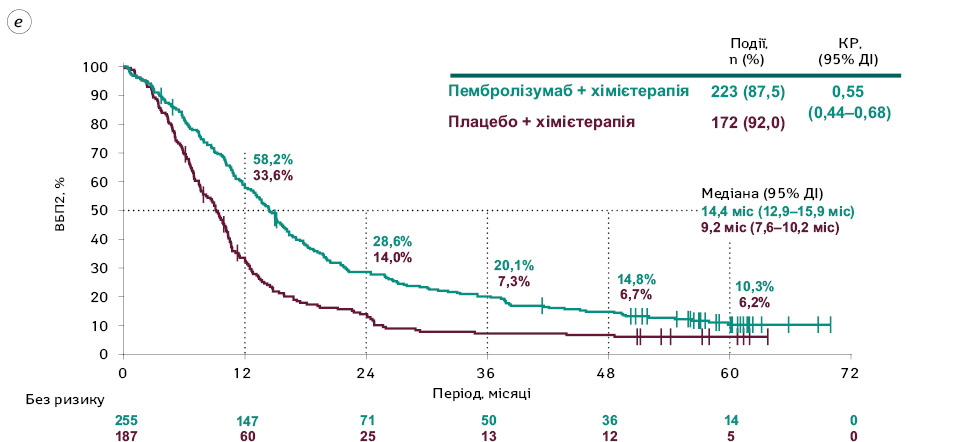
Медіана ВБП2 становила 14,4 (95% ДІ 12,9–15,9) міс у групі пембролізумабу поєднано з хімієтерапією та 9,2 (95% ДІ 7,6–10,2) міс у групі плацебо в комбінації з хімієтерапією (КР=0,55; 95% ДІ 0,44‒0,68; рис. 2e).
ЧОВ становила 50,6% (95% ДІ 44,3–56,9%) у групі застосування пембролізумабу й хімієтерапії та 33,2% (95% ДІ 26,5–40,4%) у групі застосування плацебо з хімієтерапією. Медіана тривалості відповіді становила 7,6 (діапазон 1,1+ — 59,4+) міс і 5,5 (діапазон 1,4+ — 55,8+) міс відповідно (табл. 2; рис. 3).
| Параметр відповіді | Пембролізумаб + хімієтерапія, n=255 | Плацебо + хімієтерапія, n=187 |
| ЧОВ (95% ДІ), % | 50,6 (44,3–56,9) | 33,2 (26,5–40,4) |
| Найкраща загальна відповідь, n (%) | ||
| ПВ | 4 (1,6) | 5 (2,7) |
| ЧВ | 125 (49,0) | 57 (30,5) |
| Стабілізація захворювання | 88 (34,5) | 79 (42,2) |
| Прогресування захворювання | 20 (7,8) | 31 (16,6) |
| Не підлягає оцінціa | 11 (4,3) | 6 (3,2) |
| Не оціненоb | 7 (2,7) | 9 (4,8) |
| Тривалість відповідіc, медіана (діапазон), міс | 7,6 (1,1+ — 59,4+) | 5,5 (1,4+ — 55,8+) |
| Тривалість відповіді ≥4 роківc, без ризику (%) | 14 (16,3) | 2 (14,2) |
| Час до досягнення відповіді, медіана (діапазон), міс | 1,5 (1,2–19,2) | 1,4 (0,8–10,4) |
«+» означає відсутність прогресування захворювання під час останньої оцінки патології.Примітка: BICR — Blinded Independent Central Review, незалежний центральний огляд у засліпленому режимі.
aПісля початкової оцінки були доступні подальші дані, проте вони або не підлягали оцінюванню, або відображали ПВ / ЧВ / стабілізацію захворювання менше ніж через 6 тиж після рандомізації.
bДані після початкової оцінки для оцінки відповіді відсутні.
cҐрунтуються на оцінці за методом Каплана — Меєра.
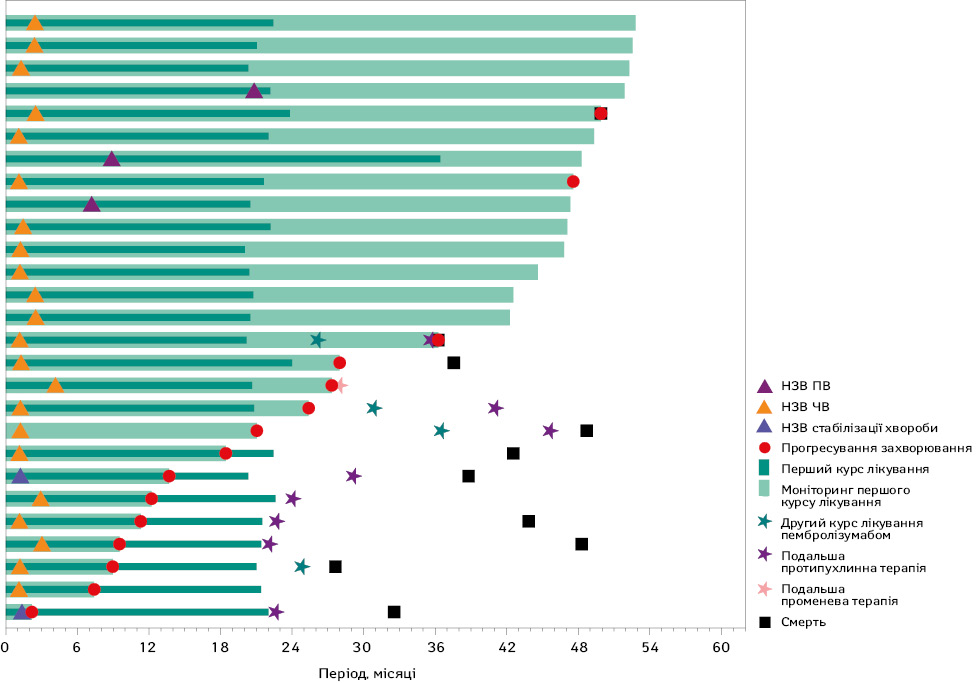
Примітка: НЗВ — найкраща загальна відповідь.
Безпека
В об’єднаній популяції пацієнтів дослідження ПЕ, пов’язані з будь-якою причиною, відмічалися у 252 із 254 осіб (99,2%) у групі пембролізумабу та у 185 із 186 хворих (99,5%) у групі плацебо. Найпоширенішими ПЕ III–IV ступенів в обох групах були анемія, нейтропенія та зменшення кількості нейтрофілів (табл. 3). ПЕ, пов’язані з лікуванням, зареєстровані у 245 пацієнтів (96,5%) групи пембролізумабу і 175 пацієнтів (94,1%) групи плацебо, а ПЕ III–IV ступенів, пов’язані з лікуванням, виникли у 150 (59,1%) і 114 пацієнтів (61,3%) відповідно. Через ПЕ, пов’язані з лікуванням, терапію припинили 72 (28,3%) пацієнти у групі пембролізумабу та 17 (9,1%) — у групі плацебо. Летальні випадки внаслідок розвитку ПЕ, пов’язаних з лікуванням, зафіксовані у 14 хворих (5,5%) у групі пембролізумабу та у 1 (0,5%) особи у групі плацебо (див. табл. 3).
| Подія, n (%) | Пембролізумаб + хімієтерапія, n=254 | Плацебо + хімієтерапія, n=186 | ||
| Будь-який ПЕ (серед усіх причин) | 252 (99,2) | 185 (99,5) | ||
| Ступінь III–V | 187 (73,6) | 142 (76,3) | ||
| Призвів до припинення будь-якого компонента лікування | 88 (34,6) | 30 (16,1) | ||
| Призвів до смерті | 28 (11,0) | 11 (5,9) | ||
| Пов’язані з лікуванням | 245 (96,5) | 175 (94,1) | ||
| Ступінь III–V | 150 (59,1) | 114 (61,3) | ||
| Призвів до припинення будь-якого компонента лікування | 72 (28,3) | 17 (9,1) | ||
| Призвів до смертіа | 14 (5,5) | 1 (0,5) | ||
| Будь-який ступінь | Ступені III–V | Будь-який ступінь | Ступені III–V | |
| Частота ПЕ (≥15% пацієнтів у будь-якій групі): | ||||
| Анемія | 139 (54,7) | 39 (15,4) | 109 (58,6) | 39 (21,0) |
| Нудота | 121 (47,6) | 5 (2,0) | 79 (42,5) | 5 (2,7) |
| Зниження апетиту | 86 (33,9) | 2 (0,8) | 59 (31,7) | 0 |
| Втома | 83 (32,7) | 15 (5,9) | 47 (25,3) | 6 (3,2) |
| Діарея | 83 (32,7) | 9 (3,5) | 45 (24,2) | 5 (2,7) |
| Запор | 74 (29,1) | 1 (0,4) | 59 (31,7) | 3 (1,6) |
| Нейтропенія | 72 (28,3) | 39 (15,4) | 52 (28,0) | 38 (20,4) |
| Алопеція | 66 (26,0) | 1 (0,4) | 58 (31,2) | 1 (0,5) |
| Тромбоцитопенія | 63 (24,8) | 21 (8,3) | 44 (23,7) | 15 (8,1) |
| Астенія | 56 (22,0) | 11 (4,3) | 39 (21,0) | 9 (4,8) |
| Блювання | 55 (21,7) | 6 (2,4) | 31 (16,7) | 4 (2,2) |
| Кашель | 51 (20,1) | 1 (0,4) | 43 (23,1) | 0 |
| Артралгія | 52 (20,5) | 2 (0,8) | 34 (18,3) | 1 (0,5) |
| Висип | 48 (18,9) | 1 (0,4) | 21 (11,3) | 2 (1,1) |
| Гарячка | 47 (18,5) | 0 | 35 (18,8) | 4 (2,2) |
| Зниження кількості лейкоцитів | 43 (16,9) | 16 (6,3) | 35 (18,8) | 16 (8,6) |
| Зниження кількості нейтрофілів | 36 (14,2) | 26 (10,2) | 30 (16,1) | 24 (12,9) |
| Задишка | 32 (12,6) | 2 (0,8) | 36 (19,4) | 2 (1,1) |
| Імуноопосередковані ПЕ та реакції на інфузіюb | 78 (30,7) | 32 (12,6) | 20 (10,8) | 6 (3,2) |
| Гіпотиреоз | 22 (8,7) | 1 (0,4) | 4 (2,2) | 0 |
| Гіпертиреоз | 16 (6,3) | 0 | 4 (2,2) | 0 |
| Пневмоніт | 16 (6,3) | 10 (3,9)с | 5 (2,7) | 2 (1,1) |
| Інфузійні реакції | 12 (4,7) | 3 (1,2) | 3 (1,6) | 0 |
| Коліт | 5 (2,0) | 3 (1,2) | 1 (0,5) | 1 (0,5) |
| Гепатит | 5 (2,0) | 4 (1,6) | 0 | 0 |
| Нефрит | 5 (2,0) | 4 (1,6) | 1 (0,5) | 1 (0,5) |
| Тяжкі шкірні реакції | 4 (1,6) | 2 (0,8) | 3 (1,6) | 3 (1,6) |
| Гіпофізит | 3 (1,2) | 1 (0,4) | 0 | 0 |
| Надниркова недостатність | 2 (0,8) | 0 | 0 | 0 |
| Панкреатит | 2 (0,8) | 2 (0,8) | 0 | 0 |
| Тиреоїдит | 2 (0,8) | 0 | 0 | 0 |
| Енцефаліт | 1 (0,4) | 1 (0,4) | 0 | 0 |
| Синдром Гієна — Барре | 1 (0,4) | 1 (0,4) | 0 | 0 |
| Міозит | 1 (0,4) | 0 | 0 | 0 |
| Цукровий діабет I типу | 1 (0,4) | 1 (0,4) | 0 | 0 |
| Васкуліт | 1 (0,4) | 0 | 0 | 0 |
aПЕ, пов’язані з лікуванням, які призвели до смерті: смерть, пневмонія та пневмоніт (по 2 випадки); гостра ниркова недостатність, зупинка серця, серцева недостатність, енцефалопатія, печінкова недостатність, нейтропенічний сепсис, легенева кровотеча, дихальна недостатність і септичний шок (по 1 випадку) у групі пембролізумабу в комбінації з хімієтерапією; септичний шок (1 випадок) у групі плацебо в комбінації з хімієтерапією.
bІмуноопосередковані ПЕ та реакції на інфузію визначені на основі списку стандартних термінів, які використовуються для відображення відомих ризиків, пов’язаних із пембролізумабом. Вони враховувалися незалежно від того, чи були вони, на думку дослідника, пов’язані з досліджуваним лікуванням.
c2 пацієнти групи пембролізумабу та хімієтерапії перенесли пневмоніт V ступеня тяжкості.
Імуноопосередковані ПЕ та інфузійні реакції виникли у 78 (30,7%) пацієнтів у групі пембролізумабу та у 20 (10,8%) хворих у групі плацебо. ПЕ III–IV ступенів зафіксовано у 32 пацієнтів (12,6%) у групі пембролізумабу та у 6 осіб (3,2%) у групі плацебо. Найпоширенішими ПЕ в обох групах були гіпотиреоз, гіпертиреоз і пневмоніт. У групі пембролізумабу 2 пацієнти (0,8%) мали пневмоніт V ступеня, тоді як у групі плацебо подібних випадків не зафіксовано (див. табл. 3).
Результати у пацієнтів, які отримали 35 циклів пембролізумабу
Серед пацієнтів, рандомізованих у групу пембролізумабу та хімієтерапії, 27 хворих (10,6%) завершили 35 циклів пембролізумабу (див. табл. 1). ЧОВ становила 92,6% (95% ДІ 75,7–99,1%), включно з досягненнями ПВ у 3 осіб (11,1%), ЧВ — у 22 хворих (81,5%) та стабілізації захворювання — у 2 учасників (7,4%) відповідно. Медіана тривалості відповіді становила 55,1 міс (у діапазоні 7,4–59,3+). На момент завершення збору даних 17 пацієнтів залишалися живими, з них 12 не отримували подальшого лікування чи хімієтерапії. Рівень 3-річної ЗВ після завершення 35 циклів пембролізумабу (тобто приблизно через 5 років після рандомізації) становив 56,7% (95% ДІ 33,4–74,6%).
Усі 27 хворих повідомили про принаймні 1 ПЕ, пов’язаний з лікуванням. ПЕ III або IV ступеня, пов’язані з терапією, зареєстровані у 15 пацієнтів (55,6%), проте летальних випадків, пов’язаних з лікуванням, не зафіксовано. Імуноопосередковані ПЕ та інфузійні реакції виникли у 8 пацієнтів (29,6%), причому тільки у 1 пацієнта (3,7%) відмічався імуноопосередкований ПЕ III ступеня (цукровий діабет I типу). Імуноопосередкованих ПЕ IV або V ступеня чи інфузійних реакцій не відмічали у жодного пацієнта.
Обговорення
Пембролізумаб у комбінації з хімієтерапією є одним із рекомендованих варіантів лікування першої лінії у пацієнтів із метастатичним НДКРЛ із рівнем експресії PD-L1 TPS <1% [3–7]. Переконливі результати досліджень KEYNOTE-189 [1, 12] і KEYNOTE-407 [2, 13] свідчать про суттєві переваги щодо показників ЗВ і ВБП при застосуванні пембролізумабу поєднано з хімієтерапією порівняно з проведенням хімієтерапії в монорежимі. Варто зазначити, що у дослідженнях, проведених в умовах реальної клінічної практики [9–10], встановлено, що особи з метастатичним НДКРЛ із рівнем експресії PD-L1 TPS <1% частіше отримують тільки хімієтерапію. Об’єднаний аналіз даних із досліджень KEYNOTE-189 (включно з глобальним дослідженням та його розширеними результатами проведення в Японії) та KEYNOTE-407 (включно з глобальним дослідженням та його розширеними результатами проведення в Китаї) дозволив отримати більший розмір вибірки для оцінки пацієнтів із рівнем експресії PD-L1 TPS <1%. Усі дослідження використовували стандартизований підхід до аналізу рівня експресії PD-L1 TPS для мінімізації варіацій [14]. У цьому об’єднаному аналізі встановлено, що після мінімального спостереження тривалістю 4 роки (медіана — 5 років) застосування пембролізумабу із хімієтерапією сприяло стійкому підвищенню ЗВ, ВБП, ЧОВ та ВБП2 порівняно з використанням плацебо поєднано з хімієтерапією, з контрольованим профілем безпеки у хворих на метастатичний НДКРЛ та рівнем експресії PD-L1 TPS <1%, які раніше не отримували лікування.
У цьому дослідженні зазначається, що застосування пембролізумабу з хімієтерапією знижує ризик смерті на 36% і майже подвоює частку пацієнтів, які залишаються живими через 4 роки після рандомізації, порівняно з проведенням хімієтерапії в монорежимі. Цей результат зафіксований, незважаючи на плато, яке відмічалося наприкінці кривої Каплана — Маєра при застосуванні хімієтерапії, що може пояснюватися високою частотою переходу хворих до монотерапії пембролізумабом, як це було відзначено в попередніх дослідженнях [15–16]. Подібним чином встановлено, що застосування пембролізумабу поєднано з хімієтерапією також знижує ризик прогресування хвороби або смерті на 34% і підвищує показник ВБП2 порівняно з хімієтерапією. Ранні розбіжності на кривих Каплана — Меєра для ЗВ, ВБП та ВБП2 додатково підтверджують ефективність цієї терапії. Дані щодо ВБП2 разом із високою частотою переходу пацієнтів від прийому плацебо поєднано з хімієтерапією до подальшої терапії анти-PD-(L)1 (зокрема пембролізумабу) додатково підтверджують ефективність комбінованого лікування пембролізумабом у комбінації з хімієтерапією як першої лінії для осіб, яким монотерапія пембролізумабом не рекомендована. Також пембролізумаб поєднано з хімієтерапією зумовив стійкий протипухлинний ефект у 27 пацієнтів, які завершили 35 циклів лікування. Понад половина цих пацієнтів залишалися живими через 3 роки після завершення першого курсу терапії пембролізумабом, що становить близько 5 років після рандомізації. Ці результати надають додаткові докази довготривалої ефективності пембролізумабу у пацієнтів із рівнем експресії PD-L1 TPS <1%.
На момент завершення збору даних усі пацієнти завершили перший курс пембролізумабу, і нових даних щодо безпеки його застосування не виявлено. Загалом ПЕ були контрольованими, а частка хворих із ПЕ III–IV ступенів, пов’язаними з лікуванням, була подібною у групах пембролізумабу в комбінації з хімієтерапією та тільки хімієтерапії (59,1 проти 61,3%). Хоча більше пацієнтів у групі пембролізумабу припинили лікування через ПЕ, пов’язані з лікуванням (72 (28,3%) проти 17 (9,1%)) і мали летальні ПЕ (14 (5,5%) проти 1 (0,5%)), профілі безпеки в обох групах відповідали результатам окремих досліджень [15–16] та встановленому профілю безпеки пембролізумабу.
Результати поточного об’єднаного аналізу доповнюють попередній аналіз рандомізованих контрольованих досліджень, які порівнювали пембролізумаб у комбінації з хімієтерапією та тільки хімієтерапію у пацієнтів із раніше нелікованим НДКРЛ із PD-L1 TPS <1% після медіани спостереження 28,0 міс (у діапазоні 14,7‒55,4 міс) [11]. Поточні результати узгоджуються з даними окремих досліджень KEYNOTE-189 і KEYNOTE-407, в яких встановлено, що після медіани спостереження 5 років КР для ЗВ становив 0,55 і 0,83 в групі пембролізумабу та плацебо відповідно, а для ВБП — 0,67 і 0,70 відповідно [15–16]. Дані 5-річного спостереження щодо розширених результатів дослідження в Японії та Китаї були недоступні на момент цього аналізу. Однак в об’єднаному аналізі 107 пацієнтів зі Східної Азії з прогресуючим або метастатичним НДКРЛ із рівнем експресії PD-L1 TPS <1% встановлено підвищення ЗВ (КР=0,55; рівень 2-річної ЗВ становив 46 проти 28%) та ВБП (КР=0,64; 2-річний рівень ВБП становив 17 проти 10%) для пембролізумабу в комбінації з хімієтерапією порівняно з лише хімієтерапією. Ці результати, отримані за медіани спостереження 33,4 міс (у діапазоні 25,3–49,2 міс), відповідають загальній тенденції, виявленій у цьому аналізі [17].
Хоча низка досліджень вивчала ефективність інших анти-PD-(L)1 терапій у пацієнтів із прогресуючим або метастатичним НДКРЛ із рівнем експресії PD-L1 TPS <1% [18–21], існує обмежена кількість довгострокових даних щодо ефективності та безпеки для великої популяції пацієнтів у цій ситуації. Для порівняння, 5-річні результати частини I дослідження CheckMate 227 свідчать, що КР для ЗВ при застосуванні ніволумабу в комбінації з хімієтерапією становив 0,80 (95% ДІ 0,64–1,00) порівняно з лише хімієтерапією у осіб з експресією PD-L1 <1%. Це значення вище, ніж КР, що фіксується в цьому об’єднаному аналізі для пембролізумабу поєднано з хімієтерапією [18]. У цьому ж дослідженні комбінація ніволумабу з іпілімумабом супроводжувалася значенням КР для ЗВ 0,65 (95% ДІ 0,52–0,81), що подібно до результатів цього аналізу [18]. Профіль безпеки ніволумабу з хімієтерапією був схожим до профілю пембролізумабу та хімієтерапії. Варто зазначити, що ні ніволумаб у комбінації із хімієтерапією, ні комбінація ніволумабу з іпілімумабом не схвалені для лікування пацієнтів із раніше нелікованим прогресуючим або метастатичним НДКРЛ із рівнем експресії PD-L1 TPS <1%. У дослідженні CheckMate 9LA виявлено, що при застосуванні комбінації ніволумабу з іпілімумабом і хімієтерапією в першій лінії порівняно з лише хімієтерапією КР для ЗВ становив 0,66 (95% ДІ 0,50–0,86) у підгрупі пацієнтів із рівнем експресії PD-L1 <1% (n=264) [22], що є схожим на результати цього дослідження.
На противагу цьому результати частини II дослідження EMPOWER-Lung 3 свідчать, що при застосуванні цеміплімабу (анти-PD-1) в комбінації з хімієтерапією порівняно з лише хімієтерапією КР для ЗВ становив 1,01 (95% ДІ 0,63–1,60) у пацієнтів із рівнем експресії PD-L1 <1% (n=139) [23]. Хоча пембролізумаб поєднано з хімієтерапією є ефективним стандартом лікування у таких випадках, існує потреба в додаткових варіантах терапії для хворих, які отримують від нього обмежену користь.
Поточний об’єднаний аналіз має певні обмеження. Це був дослідницький пост-хок-аналіз, який не був розроблений для досягнення статистичної значущості, що ускладнює інтерпретацію результатів. Також цей аналіз не враховував відносно високу частоту переходу пацієнтів із групи плацебо + хімієтерапія до пембролізумабу. Цей фактор міг вплинути на результати, зменшивши вираженість видимого ефекту від лікування пембролізумабом. Слід зазначити, що монотерапія пембролізумабом не затверджена як терапія другої лінії для осіб із метастатичним НДКРЛ із рівнем експресії PD-L1 TPS <1% [3].
На завершення, пембролізумаб поєднано з хімієтерапією продовжує зумовлювати клінічно значущі та тривалі підвищення показників виживаності та протипухлинної активності порівняно з плацебо + хімієтерапія із контрольованою токсичністю у пацієнтів із метастатичним НДКРЛ із рівнем експресії PD-L1 TPS <1% після медіани спостереження 5 років. Ці результати продовжують підтверджувати, що пембролізумаб у комбінації з хімієтерапією залишається стандартом першої лінії лікування для хворих на метастатичний НДКРЛ із рівнем експресії PD-L1 TPS <1%.
Адаптований переклад за Gadgeel, S. M., Rodríguez-Abreu, D., Halmos, B., Garassino, M. C., Kurata, T., Cheng, Y., … Paz-Ares, L. (2024). Pembrolizumab plus chemotherapy for metastatic NSCLC with programmed cell death ligand 1 tumor proportion score less than 1%: pooled analysis of outcomes after five years of follow-up. Journal of Thoracic Oncology, 19(8), 1228–1241. doi: 10.1016/j.jtho.2024.04.011.
Стаття друкується в скороченому вигляді.
Список використаної літератури знаходиться в редакції.
Ірина Неміш














Leave a comment