Тромбопрофілактика з оригінальним еноксапарином у пацієнтів з онкопатологією
Резюме. Тромбоз є частим ускладненням у хворих на рак, який пов’язаний з високим рівнем смертності. Зважаючи на серйозні наслідки тромбоемболічних ускладнень у пацієнтів з онкопатологією, профілактика тромбозу набуває критичного значення в клінічній практиці. Сучасні підходи до ведення таких хворих включають проведення антикоагулянтної терапії, яка допомагає знизити ризик тромбоутворення та поліпшити прогноз. У рекомендаціях Американського товариства з клінічної онкології (American Society of Clinical Oncology — ASCO), Європейського товариства онкологів (European Society for Medical Oncology — ESMO), Національної онкологічної мережі США (National Comprehensive Cancer Network — NCCN) розроблені сучасні настанови з тромбопрофілактики та лікування венозної тромбоемболії (ВТЕ) у хворих з онкологічними захворюваннями. Одним із найбільш ефективних і безпечних препаратів класу антикоагулянтів у осіб з онкопатологією є низькомолекулярний гепарин (НМГ), який зумовлює високу ефективність у профілактиці та лікуванні тромботичних ускладнень. Одним із найчастіше застосовуваних антикоагулянтів є оригінальний еноксапарин, який є золотим стандартом у лікуванні хворих на рак під час госпіталізації та проведення хімієтерапії для пацієнтів із гострими, інфекційними захворюваннями (наприклад COVID-19 або бактеріальним сепсисом) та гострими тромботичними подіями артеріальних / венозних судин. У цих сферах оригінальний еноксапарин зарекомендував себе як препарат високого рівня, ефективність і безпеку якого доведено в кількох дослідженнях, що проводилися протягом 25 років. Його переваги включають високу ефективність у запобіганні тромбозу та зниженні ризику рецидивів, передбачувану фармакокінетику, що не потребує рутинного лабораторного моніторингу, зручність застосування завдяки підшкірному введенню, яке не залежить від функції шлунково-кишкового тракту, меншу кількість лікарських взаємодій, що є особливо важливим для пацієнтів, які проходять хімієтерапію, а також перевагу перед пероральними антикоагулянтами у осіб із підвищеним ризиком кровотечі або проблемами зі шлунково-кишковим трактом. Так, ВТЕ залишається суттєвою причиною захворюваності та смертності пацієнтів з онкопатологією, вчасна профілактика якої є важливою складовою підвищення виживаності хворих на онкологічні захворювання.
DOI: 10.32471/clinicaloncology.2663-466X.34017
Тромбоз є частим ускладненням у хворих на рак, який пов’язаний з високим рівнем смертності. Взаємозв’язок між злоякісними новоутвореннями та тромботичними подіями вперше описано ще у 1865 р. Арманом Труссо, який встановив асоціацію між тромбозом і недіагностованим раком. Тромботичні ускладнення у таких пацієнтів можуть проявлятися в різних формах — від венозної або артеріальної тромбоемболії до дисемінованого внутрішньосудинного згортання (ДВЗ). Зокрема, ДВЗ-синдром частіше розвивається у хворих на гематологічні злоякісні новоутворення та з наявністю метастазів, тоді як ВТЕ зазвичай пов’язана із солідними пухлинами. Ризик розвитку тромбоемболічних ускладнень у пацієнтів з онкопатологією залежить від декількох груп факторів: індивідуальних характеристик хворого, специфіки захворювання та особливостей проведеного лікування (рисунок) [1].
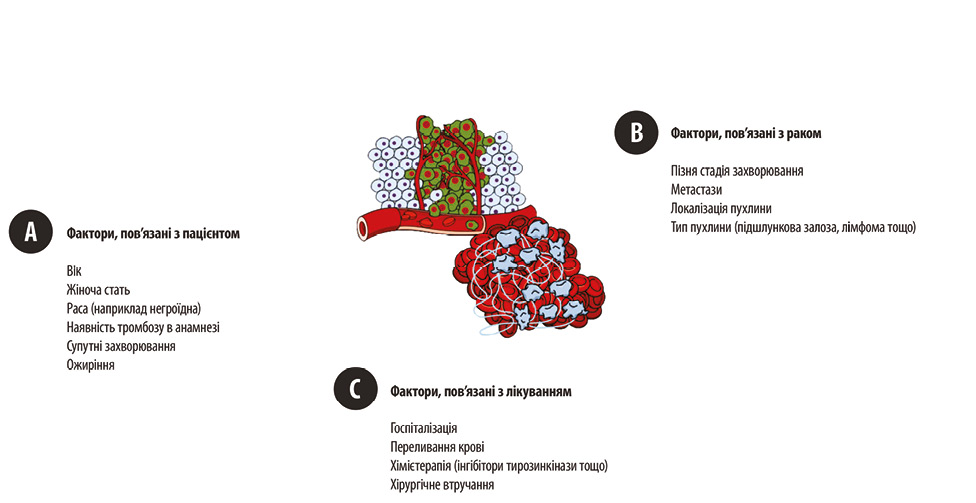
Зважаючи на серйозні наслідки тромбоемболічних ускладнень у хворих на рак, профілактика тромбозу набуває критичного значення в клінічній практиці. Сучасні підходи до ведення таких пацієнтів включають проведення антикоагулянтної терапії, яка допомагає знизити ризик тромбоутворення та покращити прогноз. У рекомендаціях ASCO, ESMO, NCCN наведені сучасні настанови з тромбопрофілактики та лікування ВТЕ у пацієнтів з онкологічними захворюваннями [2–4].
Тромбопрофілактика в амбулаторних умовах у хворих з онкопатологією
Згідно з настановами ESMO, хворим на рак в амбулаторних умовах не слід пропонувати рутинну фармакологічну тромбопрофілактику (рекомендація 2.1, рівень доказовості: середній — високий, сила рекомендацій: сильна). Однак пацієнтам із онкологічним захворюванням групи високого ризику (бал за шкалою ризику Хорана ≥2 перед початком нового режиму системної хімієтерапії, див. таблицю) може бути запропонована тромбопрофілактика НМГ за умови відсутності значущих факторів ризику кровотечі та лікарських взаємодій (рекомендація 2.2, рівень доказовості: середній, сила рекомендацій: помірна) [2]. Додатково в рекомендаціях ESMO зазначається, що у пацієнтів з онкопатологією, які проходять терапію в амбулаторних умовах, починають системне протипухлинне лікування та мають підвищений ризик тромбозу, НМГ можуть розглядатися як первинна тромбопрофілактика протягом максимум 6 міс (рівень доказовості I, B) [3].
| Характеристика пацієнта | Бали |
| Локалізація пухлини | |
| Дуже високий ризик (шлунок, підшлункова залоза) | 2 |
| Високий ризик (легені, лімфома, гінекологічні пухлини, сечовий міхур, яєчка, нирки) | 1 |
| Лабораторні показники перед початком хімієтерапії | |
| Кількість тромбоцитів ≥350 000/мкл | 1 |
| Рівень гемоглобіну <10 г/дл або застосування еритропоетин-стимулювальних агентів | 1 |
| Кількість лейкоцитів >11 000/мкл | 1 |
| Індекс маси тіла (ІМТ) ≥35 кг/м² | 1 |
| Розрахунок загального балу. Сума балів обчислюється за допомогою додавання балів за кожним критерієм |
|
| Інтерпретація результатів | |
| Високий ризик: ≥3 балів | |
| Проміжний ризик: 1–2 бали | |
| Низький ризик: 0 балів | |
 У рекомендаціях NCCN також зазначена інформація про те, що тромбопрофілактику НМГ в амбулаторних умовах варто проводити тільки у групі хворих з підвищеним ризиком [4]. Згідно із всебічним Кокранівським оглядом 2020 р., застосування НМГ у пацієнтів, які проходили хімієтерапію через злоякісні пухлини амбулаторно, було пов’язане зі зниженням ризику симптоматичної ВТЕ (коефіцієнт ризику (КР) = 0,62; 95% довірчий інтервал (ДІ) 0,46–0,83). Водночас відмічалося підвищення ризику кровотеч (КР=1,63; 95% ДІ 1,12–2,35) без суттєвого впливу на загальну смертність через рік (КР=0,94; 95% ДІ 0,83–1,07) [5].
У рекомендаціях NCCN також зазначена інформація про те, що тромбопрофілактику НМГ в амбулаторних умовах варто проводити тільки у групі хворих з підвищеним ризиком [4]. Згідно із всебічним Кокранівським оглядом 2020 р., застосування НМГ у пацієнтів, які проходили хімієтерапію через злоякісні пухлини амбулаторно, було пов’язане зі зниженням ризику симптоматичної ВТЕ (коефіцієнт ризику (КР) = 0,62; 95% довірчий інтервал (ДІ) 0,46–0,83). Водночас відмічалося підвищення ризику кровотеч (КР=1,63; 95% ДІ 1,12–2,35) без суттєвого впливу на загальну смертність через рік (КР=0,94; 95% ДІ 0,83–1,07) [5].
В огляді 12 рандомізованих контрольованих досліджень, проведеному Американським товариством гематології (American Society of Hematology — ASH), проаналізовано застосування нефракціонованого гепарину (НФГ) та НМГ у хворих на онкологічні захворювання. Результати свідчать, що ці препарати не впливали на рівень смертності або частоту розвитку серйозних кровотеч. Однак їхнє застосування сприяло зменшенню загальної кількості випадків ВТЕ (КР=0,57; 95% ДІ 0,46–0,71) [6]. Тобто сучасні європейські та американські настанови рекомендують проводити стратифікацію ризику розвитку тромбозу у хворих на рак, які проходять лікування амбулаторно, на основі валідованих методів оцінки, зокрема шкали Хорана, або з урахуванням первинної локалізації захворювання. Відповідно до цього підходу тромбопрофілактика в амбулаторних умовах показана пацієнтам із підвищеним ризиком за шкалою Хорана.
Тромбопрофілактика у пацієнтів, яким проводиться променева терапія (ПТ)
На сьогодні жодні клінічні настанови не містять чітких рекомендацій щодо тромбопрофілактики у пацієнтів, які проходять ПТ, а наявні дані для керівництва клінічною практикою є обмеженими. ВТЕ у таких хворих розвивається рідко, уражуючи близько 2% усіх осіб під час лікування або протягом 6 міс після його завершення [6]. Проте в субаналізі дослідження COMPASS-CAT встановлено, що опромінення асоціюється з підвищеним ризиком ВТЕ (КР=2,47; 95% ДІ 1,47–4,12). Цей ризик виявився більш вираженим у жінок, ніж чоловіків (10,8 проти 2,7%; p=0,03) [7]. Крім того, у великому реєстрі пацієнтів із симптоматичною ВТЕ 13% із 9284 хворих з онкопатологією отримували ПТ на момент встановлення діагнозу. Виявлено, що ці пацієнти мали підвищений ризик ТЕЛА, тоді як ризик тромбозу глибоких вен залишався таким самим, як у осіб без опромінення. Частота значних кровотеч була подібною між групами, але у пацієнтів, які проходили опромінення, частіше траплялися церебральні кровотечі [8]. На жаль, на сьогодні немає чітких настанов щодо застосування антикоагулянтів у цієї групи хворих, що свідчить про потребу виконання більш розширених досліджень у цьому напрямку.
Тромбопрофілактика при хірургічних втручаннях
У проспективному обсерваційному дослідженні RISTOS встановлено, що ВТЕ є найпоширенішою причиною смерті на 30-й день у понад 2300 пацієнтів, які перенесли онкологічні хірургічні втручання внаслідок загальних, урологічних або гінекологічних злоякісних новоутворень [9]. У рекомендаціях ASCO та NCCN зазначено, що усім хворим зі злоякісним захворюванням, яким проводять велике хірургічне втручання, слід запропонувати фармакологічну тромбопрофілактику НФГ або НМГ, якщо це не протипоказано через активну кровотечу, підвищений ризик кровотечі чи інші протипоказання [2, 4]. Профілактику ВТЕ слід розпочинати перед операцією (рекомендація 3.2, рівень доказовості: середній, сила рекомендацій: помірна) [2].
Додатково в рекомендаціях ESMO зазначено, що призначати фармакологічну тромбопрофілактику НМГ або НФГ необхідно за 2–12 год до операції (рівень доказовості II, B). Крім того, зазначено, що пацієнти, які перенесли значну операцію через пухлину, мають отримувати фармакологічну тромбопрофілактику протягом принаймні 10 днів після операції (рівень доказовості I, A). Хворим на рак, які перенесли відкриту операцію на черевній порожнині чи органах малого таза або лапароскопічну операцію на колоректальний рак, рекомендується розширена післяопераційна профілактика ВТЕ протягом 4 тиж за допомогою НМГ (рівень доказовості I, A) [3].
В іншому дослідженні за участю пацієнтів після операції на черевній порожнині або органах малого таза через онкопатологію зафіксовано, що частота ВТЕ становила 12,0% у групі плацебо та 4,8% у групі еноксапарину через 4 тиж, при цьому значна різниця між групами зберігалася через 3 міс (13,8 проти 5,5%; p=0,01) [10].
Антикоагулянтна терапія при ВТЕ
У хворих з онкопатологією та нещодавно встановленою ВТЕ, які не мають тяжкого порушення функції нирок (визначається як кліренс креатиніну <30 мл/хв) для запобігання рецидиву варто надавати перевагу НМГ порівняно з НФГ протягом перших 5–10 днів антикоагулянтної терапії (рекомендація 4.1, рівень доказовості: високий, сила рекомендацій: сильна) [2]. Проте комісія NCCN рекомендує, щоб вибір препарату ґрунтувався на наявності ниркової недостатності, захворювання печінки, стаціонарному / амбулаторному статусі, схваленні Управлінням з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA), вартості, перевагах для пацієнта, простоті введення, можливості проведення терапевтичного моніторингу та оцінці ризику кровотечі [11]. Для тривалого антикоагулянтного лікування перевагу надають НМГ, едоксабану або ривароксабану протягом принаймні 6 міс через вищу ефективність порівняно з антагоністами вітаміну К.
Існує підвищення ризику великої кровотечі при застосуванні прямих пероральних антикоагулянтів, особливо при злоякісних пухлинах шлунково-кишкового тракту та сечостатевої системи (рекомендація 4.2, рівень доказовості: високий, сила рекомендацій: сильна) [2]. У метааналізі досліджень, у якому порівнювали результати застосування антикоагулянтів (НФГ, НМГ і фондапаринукс) як початкового лікування ВТЕ у хворих на рак, НМГ був пов’язаний зі значним зниженням рівня смертності через 3 міс спостереження порівняно з НФГ (КР=0,66; 95% ДІ 0,40–1,10) [12]. У рандомізованому відкритому багатоцентровому дослідженні G. Meyer та співавт. (2002) за участю осіб з ВТЕ та новоутвореннями проведено порівняння підшкірного введення еноксапарину в дозі 1,5 мг/кг маси тіла 1 раз на добу із застосуванням варфарину протягом 3 міс. Встановлено, що застосування еноксапарину у цієї групи пацієнтів було більш ефективним порівняно з призначенням варфарину, оскільки його застосування пов’язане з вищою частотою кровотеч та рецидивом ВТЕ [13].
Тромбопрофілактика ВТЕ у хворих на рак, госпіталізованих через гостре захворювання
Згідно з рекомендаціями NCCN, перед початком тромбопрофілактики дорослі пацієнти з онкологічними захворюваннями, які перебувають у стаціонарі, мають пройти комплексне обстеження. Воно включає збір анамнезу, фізикальне обстеження, визначення рівня тромбоцитів, протромбінового часу, активованого часткового тромбопластинового часу, а також оцінку функції печінки та нирок. Крім того, початкове обстеження для профілактики ВТЕ в стаціонарі передбачає оцінку ризику ВТЕ та кровотечі [3]. Згідно із сучасними рекомендаціями ASCO 2020 р., госпіталізованим пацієнтам з активним злоякісним новоутворенням, які мають гостре захворювання або обмежену рухливість, слід запропонувати фармакологічну тромбопрофілактику за відсутності кровотечі чи інших протипоказань (рекомендація 1.1; рівень доказовості — середній; сила рекомендацій — помірна). Водночас рутинна фармакологічна тромбопрофілактика не рекомендована хворим, госпіталізованим лише для проведення незначних процедур або інфузії хімієтерапії, а також тим, хто проходить трансплантацію стовбурових клітин чи кісткового мозку (рекомендація 1.3; рівень доказовості — недостатній; сила рекомендацій — помірна) [2].
У рекомендаціях ESMO 2023 р. зазначається, що НМГ є препаратами вибору для тромбопрофілактики ВТЕ у хворих на рак, госпіталізованих через гостре захворювання. Проте призначення цієї терапії має ґрунтуватися на інструментах оцінки ризику (наприклад шкалі Падуа або шкалі Міжнародного реєстру медичної профілактики венозної тромбоемболії (International Medical Prevention Registry on Venous Thromboembolism — IMPROVE), які мають обмежену точність для пацієнтів з онкопатологією, що потребує проведення більшої кількості досліджень у такому напрямку [3].
У рекомендаціях NCCN також зазначено, що НМГ (зокрема еноксапарин) є варіантами I категорії для профілактики ВТЕ у хворих з онкологічним захворюванням, які госпіталізовані у стаціонар. Комісія NCCN рекомендує проводити тромбопрофілактику протягом усього періоду перебування в стаціонарі або протягом 6–14 днів, або поки пацієнт не стане повністю на амбулаторний режим [4]. У метааналізі 9 рандомізованих досліджень дійшли висновку про те, що під час антикоагулянтної профілактики НМГ, фондапаринуксом або НФГ у пацієнтів з онкологічними захворюваннями зафіксоване значне зниження ймовірності розвитку ТЕЛА, яке призводить до летальних наслідків (КР=0,38; 95% ДІ 0,21−0,69); абсолютне зниження ризику — 0,25% порівняно з відсутністю лікування [14]. Два великі рандомізовані дослідження оцінювали ефективність прямих оральних антикоагулянтів порівняно з еноксапарином для профілактики ВТЕ у госпіталізованих пацієнтів, включно з хворими на рак. Це дослідження MAGELLAN, в якому 7% учасників мали пухлину в активній фазі [15], та дослідження ADOPT, у якому ця частка становила 3,2% [16]. Метааналіз цих 2 досліджень [15–16], а також 3-го дослідження APEX (яке не наводило даних щодо пацієнтів онкологічного профілю) [17], свідчить, що застосування прямих оральних антикоагулянтів не знижує ризик легеневої емболії (КР=0,67; 95% ДІ 0,41–1,09), симптоматичного тромбозу глибоких вен (КР=0,62; 95% ДІ 0,36–1,05) або загальної смертності (КР=1,01; 95% ДІ 0,89–1,14) порівняно з НМГ. Однак виявлено, що застосування прямих оральних антикоагулянтів значно підвищує ризик значних кровотеч (КР=1,99; 95% ДІ 1,08–3,65). Попри обмеженість даних щодо пацієнтів з онкологічними захворюваннями, НМГ та НФГ залишаються препаратами вибору для профілактики ВТЕ у госпіталізованих хворих з онкопатологією [6].
Місце оригінального еноксапарину у тромбопрофілактиці та лікуванні у пацієнтів з онкопатологією
Одним із найбільш ефективних і безпечних класів антикоагулянтів у осіб з новоутвореннями є НМГ, які зумовлюють високу ефективність у профілактиці та лікуванні тромботичних ускладнень. НМГ — це група антикоагулянтів, які отримують із НФГ за допомогою його ферментативного або хімічного розщеплення. Одним із найбільш поширених представників цієї групи є оригінальний еноксапарин, який активно застосовується у клінічній практиці для лікування та профілактики різних станів. З біохімічної точки зору, еноксапарин є похідним слизової оболонки кишечнику свиней і здатний пригнічувати кілька протеаз, що задіяні в каскаді згортання крові. Це мукополісахарид із високим вмістом сульфатованого D-глюкозаміну та D-глюкуронової кислоти, з’єднаних сульфаміновими містками. Його молекулярна маса варіює в межах 3800–5000 Да, у середньому близько 4500 Да. Основний механізм дії еноксапарину полягає у зв’язуванні з антитромбіном III, що значно підвищує його здатність інактивувати фактори згортання крові, зокрема фактори Xa та IIa. Пригнічення фактора Xa перешкоджає утворенню тромбіну з протромбіну, а блокування фактора IIa гальмує перетворення фібриногену у фібрин, тим самим запобігаючи утворенню тромбів. Еноксапарин застосовують для профілактики ВТЕ у пацієнтів із високим ризиком, зокрема після операцій або за певних захворювань. Крім того, він ефективний у лікуванні ВТЕ, включно з тромбозом глибоких вен та легеневою емболією. Його також застосовують у складі антитромботичної терапії при гострому коронарному синдромі як у пацієнтів, що отримують медикаментозне лікування, так і у тих, хто проходить черезшкірне коронарне втручання. Окрім цього, еноксапарин показаний для профілактики тромбозу у хворих на гемодіалізі [18].
Проте важливе місце належить оригінальному еноксапарину у лікуванні осіб з онкопатологією. Для загальної популяції стандартне лікування гострої ВТЕ складається з початкової терапії НМГ з подальшим довготривалим лікуванням (3–6 міс) пероральним антагоністом вітаміну К. Хоча цей підхід може бути ефективним для багатьох пацієнтів, хворі на рак мають значний ризик рецидиву ВТЕ. Кілька досліджень повідомляли про випадки рецидиву ВТЕ до 20% у пацієнтів з раком [19]. Крім того, існують численні труднощі використання пероральної антикоагулянтної терапії у онкологічних хворих [18]. Так, взаємодія пероральних антикоагулянтів з іншими лікарськими засобами, а також побічні ефекти, такі як блювання та порушення функції печінки, можуть спричиняти коливання рівня антикоагуляції, що ускладнює контроль лікування. Хімієтерапія часто призводить до тромбоцитопенії, яка потребує тимчасового припинення антикоагулянтної терапії. Додатково ускладнений венозний доступ у таких пацієнтів може створювати труднощі при лабораторному моніторингу [20–21].
Хворі з пізньою стадією раку також можуть мати проблеми з ковтанням пероральних ліків. Більше того, не існує антидоту, який би скасував антикоагулянтну дію пероральних антикоагулянтів у випадках значної кровотечі або коли необхідне невідкладне хірургічне втручання. [19]. Усі ці фактори підвищують ризик повторної тромбоемболії та кровотеч порівняно з особами без онкологічних захворювань [20–21]. Вторинна профілактика із застосуванням НМГ є більш ефективною та зручною альтернативою антагоністам вітаміну К у хворих на рак. НМГ мають передбачувану фармакокінетику, обмежені лікарські взаємодії, дія яких не залежить від функції шлунково-кишкового тракту, оскільки вони вводяться підшкірно. Це робить їх оптимальним вибором для пацієнтів з рецидивною тромбоемболією. Дозування НМГ розраховується відповідно до маси тіла хворого і не потребує рутинного лабораторного моніторингу. Швидкий початок дії та передбачуване виведення роблять їх зручними для пацієнтів, яким необхідні тимчасові перерви в антикоагулянтній терапії [22–23]. Крім того, оригінальний еноксапарин залишається одним із найчастіше застосовуваних антикоагулянтів і є золотим стандартом у лікуванні онкологічних пацієнтів під час госпіталізації та хімієтерапії для пацієнтів із гострими захворюваннями, інфекційними захворюваннями (наприклад COVID-19 або бактеріальним сепсисом) та гострими тромботичними подіями артеріальних / венозних судин. У цих сферах оригінальний еноксапарин зарекомендував себе як препарат високого рівня, ефективність і безпека якого зафіксована в кількох дослідженнях, які проводилися протягом 25 років. Отже, оригінальний еноксапарин сприяє безпечному та ефективному контролю тромбоемболічних ускладнень у хворих на рак, що пов’язано з передбачуваним терапевтичним ефектом, унікальним молекулярним профілем, який забезпечує стабільність дії препарату, та є безпечним через високий ступінь його очищення порівняно з генериками [18].
Так, ВТЕ залишається суттєвою причиною захворюваності та смертності хворих з онкопатологією, вчасна профілактика якої є важливою складовою підвищення виживаності пацієнтів з онкологічними хворобами.
Список використаної літератури
1. Tsantes, A. G., Petrou, E., Tsante, K. A., Sokou, R., Frantzeskaki, F., Domouchtsidou, A., … Tsantes, A. E. (2024). Cancer-Associated Thrombosis: Pathophysiology, Laboratory Assessment, and Current Guidelines. Cancers, 16(11), 2082. doi: 10.3390/cancers16112082.
2. Key, N. S., Khorana, A. A., Kuderer, N. M., Bohlke, K., Lee, A. Y., Arcelus, J. I., … Falanga, A. (2020). Venous thromboembolism prophylaxis and treatment in patients with cancer: ASCO clinical practice guideline update. Journal of Clinical Oncology, 38(5), 496–520.
3. Falanga, A., Ay, C., Di Nisio, M., Gerotziafas, G., Jara-Palomares, L., Langer, F., … ESMO Guidelines Committee. (2023). Venous thromboembolism in cancer patients: ESMO Clinical Practice Guideline. Annals of Oncology, 34(5), 452–467. doi: 10.1016/j.annonc.2022.12.014.
4. Streiff, M. B., Holmstrom, B., Angelini, D., Ashrani, A., Elshoury, A., Fanikos, J., … Nguyen, M. Q. (2021). Cancer-associated venous thromboembolic disease, version 2.2021, NCCN clinical practice guidelines in oncology. Journal of the National Comprehensive Cancer Network, 19(10), 1181–1201.
5. Rutjes, A. W., Porreca, E., Candeloro, M., Valeriani, E., & Di Nisio, M. (2020). Primary prophylaxis for venous thromboembolism in ambulatory cancer patients receiving chemotherapy. Cochrane Database of Systematic Reviews, 12, CD008500. doi: 10.1002/14651858.CD008500.pub5. pmid: 33337539.
6. Guntupalli, S. R., Spinosa, D., Wethington, S., Eskander, R., & Khorana, A. A. (2023). Prevention of venous thromboembolism in patients with cancer. BMJ, 381, e072715. doi: 10.1136/bmj-2022-072715.
7. Temraz, S., Moukalled, N., Gerotziafas, G. T., Elalamy, I., Jara-Palomares, L., Charafeddine, M., & Taher, A. (2021). Association between radiotherapy and risk of cancer associated venous thromboembolism: a sub-analysis of the COMPASS—CAT study. Cancers, 13(5), 1033. doi: 10.3390/cancers13051033.
8. Guy, J. B., Bertoletti, L., Magné, N., Rancoule, C., Mahé, I., Font, C., … RIETE investigators. (2017). Venous thromboembolism in radiation therapy cancer patients: findings from the RIETE registry. Critical Reviews in Oncology/Hematology, 113, 83–89. doi: 10.1016/j.critrevonc.2017.03.006. pmid: 28427527.
9. Agnelli, G., Bolis, G., Capussotti, L., Scarpa, R. M., Tonelli, F., Bonizzoni, E., … Gussoni, G. (2006). A clinical outcome-based prospective study on venous thromboembolism after cancer surgery: the@ RISTOS project. Annals of surgery, 243(1), 89–95. doi: 10.1097/01.sla.0000193959.44677.48. pmid: 16371741.
10. Bergqvist, D., Agnelli, G., Cohen, A. T., Eldor, A., Nilsson, P. E., Le Moigne-Amrani, A., & Dietrich-Neto, F. (2002). Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer. New England Journal of Medicine, 346(13), 975–980. doi: 10.1056/NEJMoa012385.
11. Streiff, M. B., Holmstrom, B., Angelini, D., Ashrani, A., Buckner, T., Diep, R., … Sliker, B. (2024). Cancer-Associated Venous Thromboembolic Disease, Version 2.2024, NCCN Clinical Practice Guidelines in Oncology. Journal of the National Comprehensive Cancer Network, 22(7), 483–506.
12. Kahale, L. A., Matar, C. F., Hakoum, M. B., Tsolakian, I. G., Yosuico, V. E., Terrenato, I., … Akl, E. A. (2021). Anticoagulation for the initial treatment of venous thromboembolism in people with cancer. Cochrane Database of Systematic Reviews, 12(12), CD006649. doi: 10.1002/14651858.CD006649.pub8.
13. Meyer, G., Marjanovic, Z., Valcke, J., Lorcerie, B., Gruel, Y., Solal-Celigny, P., … Farge, D. (2002). Comparison of low-molecular-weight heparin and warfarin for the secondary prevention of venous thromboembolism in patients with cancer: a randomized controlled study. Archives of internal medicine, 162(15), 1729–1735. doi: 10.1001/archinte.162.15.1729.
14. Dentali, F., Douketis, J. D., Gianni, M., Lim, W., & Crowther, M. A. (2007). Meta-analysis: anticoagulant prophylaxis to prevent symptomatic venous thromboembolism in hospitalized medical patients. Annals of internal medicine, 146(4), 278–288. doi: 10.7326/0003-4819-146-4-200702200-00007.
15. Cohen, A. T., Spiro, T. E., Büller, H. R., Haskell, L., Hu, D., Hull, R., … Tapson, V. (2013). Rivaroxaban for thromboprophylaxis in acutely ill medical patients. New England Journal of Medicine, 368(6), 513–523. doi: 10.1056/NEJMoa1111096. pmid: 23388003.
16. Goldhaber, S. Z., Leizorovicz, A., Kakkar, A. K., Haas, S. K., Merli, G., Knabb, R. M., & Weitz, J. I. (2011). Apixaban versus enoxaparin for thromboprophylaxis in medically ill patients. New England Journal of Medicine, 365(23), 2167–2177. doi: 10.1056/NEJMoa1110899. pmid: 22077144.
17. Cohen, A. T., Harrington, R. A., Goldhaber, S. Z., Hull, R. D., Wiens, B. L., Gold, A., … Gibson, C. M. (2016). Extended thromboprophylaxis with betrixaban in acutely ill medical patients. New England Journal of Medicine, 375(6), 534–544. doi: 10.1056/NEJMoa1601747. pmid: 27232649.
18. Imbalzano, E., Orlando, L., Dattilo, G., Gigliotti De Fazio, M., Camporese, G., Russo, V., … Di Micco, P. (2024). Update on the Pharmacological Actions of Enoxaparin in Nonsurgical Patients. Medicina, 60(1), 156. doi: 10.3390/medicina60010156.
19. Lee, A. Y., Bauersachs, R., Janas, M. S., Jarner, M. F., Kamphuisen, P. W., Meyer, G., & Khorana, A. A. (2013). CATCH: a randomised clinical trial comparing long-term tinzaparin versus warfarin for treatment of acute venous thromboembolism in cancer patients. BMC cancer, 13, 1–13. doi: 10.1186/1471-2407-13-284.
20. Hutten, B. A., Prins, M. H., Gent, M., Ginsberg, J., Tijssen, J. G., & Büller, H. R. (2000). Incidence of recurrent thromboembolic and bleeding complications among patients with venous thromboembolism in relation to both malignancy and achieved international normalized ratio: a retrospective analysis. Journal of Clinical Oncology, 18(17), 3078–3083.
21. Prandoni, P., Lensing, A. W., Piccioli, A., Bernardi, E., Simioni, P., Girolami, B., … Girolami, A. (2002). Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis. Blood, The Journal of the American Society of Hematology, 100(10), 3484–3488. doi: 10.1182/blood-2002-01-0108.
22. Weitz, J. I. (1997). Low-molecular-weight heparins. New England Journal of Medicine, 337(10), 688–698. doi: 10.1056/NEJM199709043371007.
23. Lee, A. Y., Levine, M. N., Baker, R. I., Bowden, C., Kakkar, A. K., Prins, M., … Gent, M. (2003). Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. New England journal of medicine, 349(2), 146–153. doi: 10.1056/NEJMoa025313.
Ірина Неміш














Leave a comment