Реконструкція нижньої щелепи із використанням CAD- / CAM-технологій у хворих на рак слизової ротової порожнини та первинні кісткові пухлини
Резюме. Реконструкція нижньої щелепи (НЩ) після сегментарної резекції у хворих на злоякісні новоутворення є складним завданням, що потребує врахування функціональних, анатомічних та естетичних аспектів. Мета. Оцінити ефективність використання Computer-Aided Design / Computer-Aided Manufacture (CAD / CAM) при реконструкції НЩ малогомілковим клаптем у хворих на рак слизової ротової порожнини та первинні кісткові пухлини. Матеріали та методи. Проаналізовано результати лікування 32 хворих на місцево-поширений плоскоклітинний рак ротової порожнини та первинні кісткові пухлини, яким виконано пластичне заміщення сегментарних дефектів НЩ малогомілковим клаптем із використанням CAD- / CAM-технологій. Результати. Повну втрату малогомілкового клаптя зафіксовано у 1 (3,1%) пацієнта. Повний некроз шкірної частини клаптя розвинувся у 1 (3,1%) хворого, частковий некроз — у 3 (9,3%), крайовий некроз — у 2 (6,2%) випадках. Завершеність реконструкції НЩ становила 96,9%. Пероральне харчування відновлено у 32 (100%) пацієнтів: 64% досягнули 5-го рівня, а 36% — 7-го рівня за Функціональною шкалою перорального споживання (Functional Oral Intake Scale — FOIS). У 27 (84,3%) хворих проведено мінімальну (<2 мм) додаткову корекцію форми кісткових сегментів малогомілкового клаптя для досягнення його оптимального прилягання до збережених фрагментів НЩ та повноцінного відновлення анатомічної форми НЩ. Висновки. Використання CAD- / CAM-технологій при заміщенні сегментарних дефектів НЩ малогомілковим клаптем забезпечує високу точність реконструкції, мінімальну частоту післяопераційних ускладнень та скорочує тривалість операції.
Одержано 22.01.2025
Прийнято до друку 31.01.2025
DOI: 10.32471/clinicaloncology.2663-466X.33933
ВСТУП
Реконструкція НЩ після сегментарної резекції у хворих на злоякісні новоутворення слизової оболонки ротової порожнини та нижньощелепної кістки є однією з найскладніших задач хірургії голови та шиї. Метою сучасної реконструктивної хірургії НЩ є відновлення такої ж форми та функції, як і до операції.
При реконструкції НЩ необхідно враховувати функціональні, анатомічні та естетичні фактори. Функціональні фактори: відновлення функцій жування, мовлення, ковтання, а також підтримка губ та відновлення прикусу. Анатомічні фактори: збереження міжоклюзійної висоти та зубних контактів, відновлення зубного ряду, якщо можливе — використання зубних імплантів, а також адекватне заміщення дефекту м’яких тканин. Естетичні фактори: відновлення симетрії обличчя, контуру підборідного виступу, а також уникнення непотрібних розрізів на обличчі [1].
Для реконструкції НЩ використовують малогомілковий, клубовий та лопатковий клапті [2]. Кожен з клаптів має переваги та недоліки і може бути використаний у певних клінічних ситуаціях. Однак найбільше переваг при заміщенні дефектів НЩ має малогомілковий клапоть, а саме фрагмент бікортикальної кістки довжиною 26–28 см, що дозволяє усунути більшість дефектів нижньощелепної кістки, він має довгу судинну ніжку, великий діаметр судин, є можливість включення у склад клаптя шкіри та м’язів [3–7]. Тому, безперечно, малогомілковий клапоть вважається золотим стандартом для реконструкції НЩ [6].
Останніми роками підходи до реконструкції НЩ зазнали революційних змін завдяки впровадженню CAD- / CAM-технологій та 3D-друку. Малогомілковий клапоть для реконструкції НЩ виділяють з урахуванням передопераційного планування за допомогою CAD / CAM. Це дозволяє виділити та змоделювати малогомілковий клапоть точно та швидко. Для отримання необхідних форми, контуру та згинів клаптя, які максимально відповідають дефекту НЩ, виконуються остеотомії з урахуванням даних CAD / CAM. Крім того, технологія CAD / CAM використовується при виготовленні індивідуалізованих пластин для фіксації малогомілкового клаптя [6, 8].
Отже, використання CAD- / CAM-технологій відкриває нові можливості в реконструктивній хірургії голови та шиї, а також потребує більш широкого впровадження в клінічну практику.
Мета дослідження: аналіз власного досвіду та оцінка ефективності використання CAD- / CAM-технологій при реконструкції НЩ малогомілковим клаптем у хворих на рак слизової ротової порожнини та первинні кісткові пухлини.
Класифікація сегментарних дефектів НЩ
Для оцінки дефектів НЩ запропоновано кілька класифікацій, однак універсально прийнятої системи досі не існує. Однією з найбільш використовуваних є класифікація, розроблена D.D. Jewer та співавт. у 1989 р., яка враховує складність реконструкції НЩ (рис. 1). У цій класифікації виділено такі основні типи дефектів:
- C — центральні дефекти від ікла до ікла;
- L — латеральні дефекти від середньої лінії до суглобового відростка, не включаючи останній;
- H — половинні дефекти, що включають латеральні дефекти разом із суглобовим відростком.
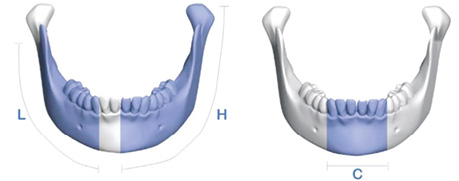
Так, можливі наступні варіанти дефектів: C, L, H, LC, HC, LHC, HCL, HH [9].
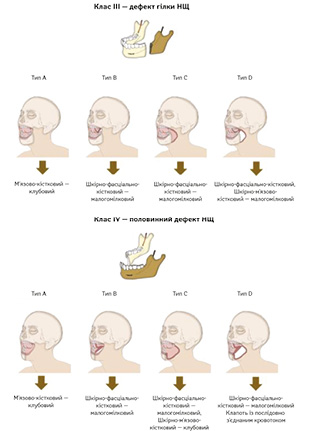
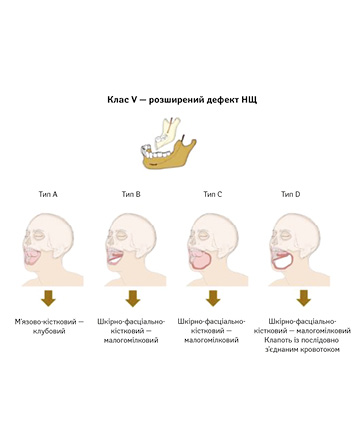
У 2023 р. H. Zenha та співавт. запропонували нову класифікацію дефектів НЩ [10]. Ця класифікація дає більш детальний анатомічний опис дефектів, що дозволяє створити точніший алгоритм реконструкції (рис. 2).
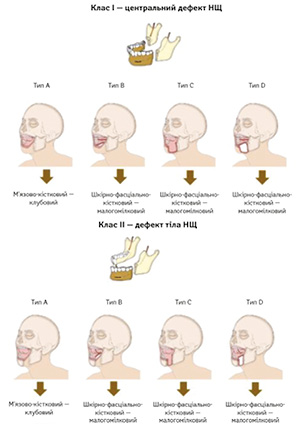
Клас I (центральний дефект НЩ): сегментарні дефекти тіла НЩ, які можуть поширюватися до ретромолярних ділянок.
Клас II (дефект тіла НЩ): сегментарні дефекти тіла НЩ від ікла до ретромолярної ділянки з однойменної сторони.
Клас III (дефект гілки НЩ): дефект гілки до ретромолярної ділянки з можливим залученням суглобового відростка.
Клас IV (половинні дефекти НЩ): дефект половини НЩ до середньої лінії з можливим залученням суглобового відростка.
Клас V (розширений дефект НЩ): дефект половини НЩ, яка поширюється за середню лінію з можливим включенням суглобового відростка.
Кожний клас розподіляється на типи залежно від збереження або резекції внутрішньоротових та/або зовнішніх м’яких тканин (A, B, C, D). Для дефектів, що включають лише кістковий компонент (тип A), автори рекомендують використання вільного клаптя з клубового гребеня, особливо для класів I та IV, а якщо потрібна реконструкція м’яких тканин (типи B і C), перевагу надають малогомілковому клаптю. У випадках обширних дефектів (тип D) рекомендується використання малогомілкового клаптя або клаптя з послідовно з’єднаним кровотоком. Ця класифікація та алгоритм сприяють більш точному плануванню реконструктивних втручань, враховуючи як кісткові, так і м’якотканинні компоненти дефекту.
CAD / CAM
Стереолітографічні моделі, створені на основі даних комп’ютерної томографії (КТ), стали одним із перших епізодів використання CAD- / CAM-технологій. Вони забезпечують високу точність копій анатомічних структур, таких як кістки обличчя або донорської ділянки (рис. 3).
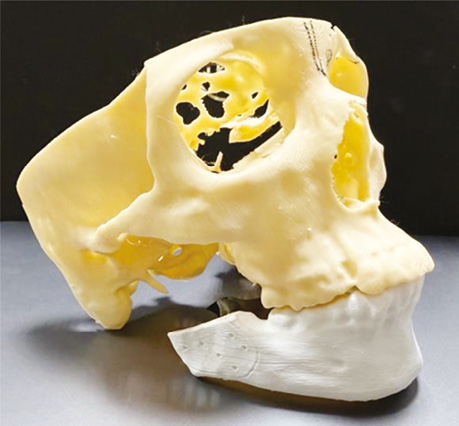
Використання стереолітографічних моделей дозволяє:
1. Провести передопераційне планування (детальне вивчення анатомічних особливостей пацієнта, планування меж резекції).
2. Провести попереднє згинання пластин, що зменшує тривалість операції і знижує ризик перелому пластин.
3. Пояснити пацієнтам особливості хірургічного втручання (освітня функція) [6–7].
Отже, використання стереолітографії підвищує точність реконструкції та скорочує тривалість операції.
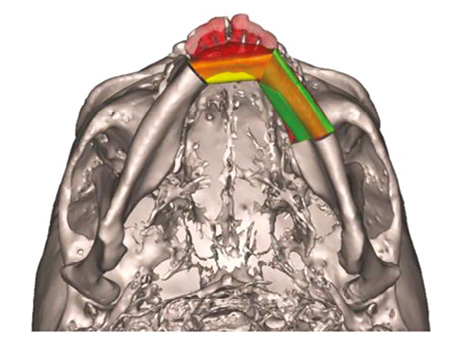
Сучасні технології віртуальної симуляції дозволяють конвертувати високороздільні скани комп’ютерної томографії (КТ) у тривимірні моделі для детального планування операції. Це дає змогу симулювати процедуру, тестувати різні підходи та оптимізувати хірургічну тактику, знижуючи ризик ускладнень (рис. 4). Передопераційні консультації між хірургами та інженерами забезпечують узгодженість і вибір оптимального плану реконструкції.
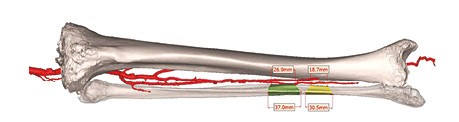
Віртуальне планування із використанням 3D-друку дозволяє виготовляти навігаційні шаблони для виконання точних остеотомій, що забезпечує правильну орієнтацію кісткових фрагментів, оптимальний кістковий контакт та високу відповідність передопераційному плану (рис. 5).
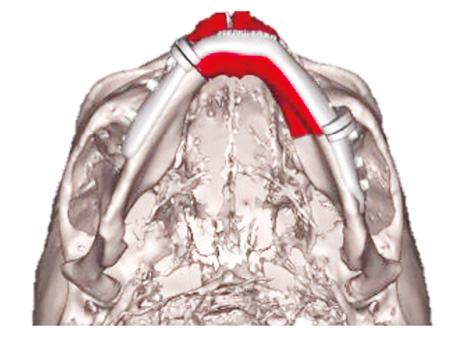

Програмне забезпечення CAD і технології віртуального планування суттєво підвищили точність хірургічних втручань і зменшили їх тривалість. Однак фіксація кісткових фрагментів універсальними (стандартними) реконструктивними пластинами дотепер залишається поширеною практикою. Адаптація таких пластин до анатомічних дефектів є складним процесом, що може призводити до концентрації напруження та ризику перелому [11–12]. Переломи пластин виникають у 2,9–10,7% випадків, зазвичай протягом перших 2 років після операції і потребують повторного хірургічного втручання [8]. Серед інших ускладнень — ослаблення гвинтів, резорбція кісткової тканини, розходження країв рани та екструзія пластин.
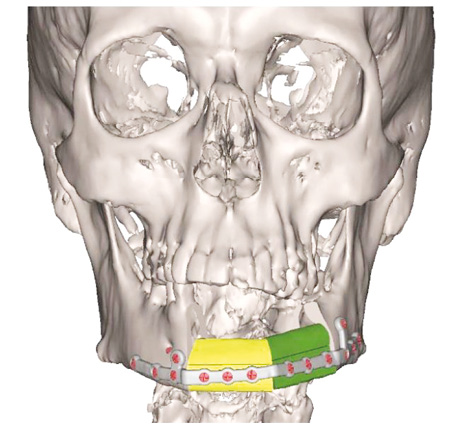
Для розв’язання зазначених проблем використовуються індивідуалізовані реконструктивні пластини, які виготовляють із використанням CAD- / CAM-технологій, зокрема 3D-друку (рис. 6).
Онкологічні межі резекції та віртуальне планування
Для створення анатомічних моделей і шаблонів остеотомії CAD- / CAM-технології потребують попереднього визначення онкологічних меж резекції. Попри початкові сумніви в онкологічній ефективності планування віртуальних меж резекції, дослідження підтвердили високий рівень точності визначення країв резекції, що співвідноситься з патогістологічними даними. В одному з досліджень середнє відхилення віртуально запланованих та патогістологічних меж резекції становило лише 0,5–1 мм [13]. Безперечно, ефективність залежить від ретельності передопераційної оцінки меж на основі сканів КТ та магнітно-резонансної томографії (МРТ), узгодження клінічних і радіологічних даних, а також співпраці хірургів, інженерів та патогістологів.
Індивідуалізовані реконструктивні пластини
Індивідуалізовані реконструктивні пластини розробляються під час передопераційного віртуального планування. Визначається кількість пластин, кути, розташування отворів для гвинтів, контур та товщина пластини. Сучасні технології, включно з фрезеруванням та 3D-друком титанових сплавів, дозволяють створювати високоточні конструкції.
У дослідженні M.M. May та співавт., що охоплювало 142 пацієнтів після сегментарної резекції НЩ з реконструкцією малогомілковим клаптем, встановлено, що у групі хворих, у якій використовували індивідуалізовані пластини, частота ускладнень була вірогідно нижчою, ніж у групі, в якій використовували стандартні пластини [14]. Використання індивідуалізованих пластин також усуває необхідність згинання, що знижує ризик переломів через надмірне механічне навантаження.
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведений ретроспективний аналіз результатів реконструктивно-відновного лікування 32 хворих на місцево-поширений плоскоклітинний рак язика, дна ротової порожнини, слизових оболонок НЩ, щоки та з первинними пухлинами НЩ, яким для пластичного заміщення сегментарних дефектів НЩ використано вільний малогомілковий клапоть поєднано з індивідуалізованою титановою пластиною у Державному некомерційному підприємстві «Національний інститут раку» за період з 2017 до 2023 р., з яких чоловіків — 20 (62,5%), жінок — 12 (37,5%); середній вік хворих становив (55,9±9,3) років.
За локалізацією захворювання розподіл хворих був наступним: рак язика встановлено у 4 (12,5%) хворих, слизових оболонок дна ротової порожнини — у 8 (25%), щоки — у 6 (18,7%), НЩ — у 12 (7,8%), первинні пухлини НЩ — у 2 (6,2%) випадках.
Стадію III діагностовано у 5 (16,6%) пацієнтів, стадію IV — у 25 (83,3%), у 2 випадках стадіювання не проводилося (саркоми НЩ). За критерієм T розподіл був наступний: T3 встановлено у 7 (21,8%), T4а — у 25 (78,1%) випадках. Розподіл за критерієм N: N0 діагностовано у 12 (37,5%) хворих, N1 — у 11 (34,3%), N2 — у 6 (18,7%), N3 — у 3 (9,3%) випадках. Ступінь злоякісності пухлини G1 встановлено у 6 (18,7%), G2 — у 4 (12,5%), G3 — у 22 (68,7%) хворих. При визначенні стадії захворювання використовували 8-ме видання класифікації TNM (T — tumor, «пухлина»; N — nodus, «вузол»; M — metastasis, «метастази») (2017).
У 30 (93,7%) пацієнтів діагностовано плоскоклітинний рак, у 2 (6,2%) — виявлено саркому: остеосаркому G2 та хондросаркому G1 НЩ.
Усім 32 (100 %) хворим виконано радикальне видалення первинної пухлини, що включало сегментарну резекцію НЩ. Реконструкцію НЩ кістковим малогомілковим клаптем виконано у 10 (31,2 %) хворих, шкірно-м’зово-кістковим — у 22 (68,7%). Надомогіоїдну шийну дисекцію виконано у 10 (31,2 %), радикальну модифіковану шийну дисекцію — у 19 (59,3%), радикальну шийну дисекцію — у 3 (9,3%) хворих. Шийну лімфодисекцію на стороні первинної пухлини проведено у 20 (62,5 %) пацієнтів, білатеральну — у 12 (37,5%).
Ад’ювантну променеву терапію (ПТ) отримали 21 (65,6 %), хімієпроменеву терапію (ХПТ) — 6 (18,7 %) хворих. Ад’ювантне лікування призначали через 5–6 тиж після хірургічного втручання. Ад’ювантну ХПТ призначали при гістологічно підтверджених факторах високого ризику рецидиву (позитивний край резекції або екстранодальне поширення пухлинних клітин у метастатичних лімфовузлах). Позитивний край резекції констатовано у 3 (9,3 %) пацієнтів, екстранодальне поширення — у 9 (28,1%) випадках.
Післяопераційні дефекти НЩ були класифіковані за D.D. Jewer. Центральні дефекти НЩ встановлені у 7 (21,8%), латеральні дефекти — у 15 (46,8%), половинні дефекти — у 15 (46,8%) хворих.
Для оцінки поширення пухлинного процесу усім пацієнтам проведено спіральну КТ голови, шиї та легень на апараті з роздільною здатністю не менше 64 зрізів з внутрішньовенним контрастуванням. Для планування моделювання забору малогомілкового клаптя, оцінки можливих судинних аномалій та визначення шкірних перфорантів виконувалася КТ-ангіографія нижніх кінцівок. Цей метод також дозволяє виявити можливі судинні аномалії, такі як відсутність або гіпоплазія перфорантних судин, домінантна перонеальна артерія, атеросклеротичні зміни чи анатомічні варіації судин.
Оцінку функціонального статусу пацієнтів проводили за FOIS, яка дозволяє визначити здатність пацієнтів до перорального прийому їжі різного ступеня — від повної залежності зондового харчування до нормального харчування без обмежень [15]. Оцінку проводили через 6 міс після завершення комбінованого лікування.
Комп’ютерне віртуальне 3D-моделювання резекції НЩ та її реконструкції малогомілковим клаптем, а також виготовлення навігаційних шаблонів для остеотомії НЩ та малогомілкового клаптя виконано для всіх 32 (100%) хворих. У 22 (68,7%) пацієнтів для фіксації малогомілкового клаптя застосовували індивідуалізовані реконструктивні пластини, а у 10 (31,2%) — титанові мініпластини (рис. 7).
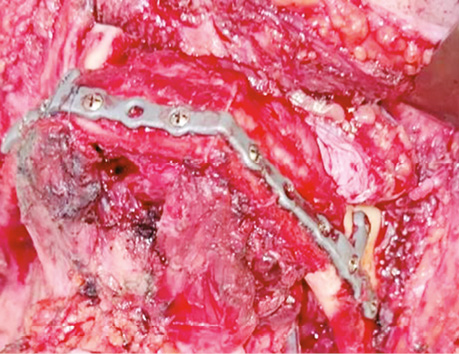
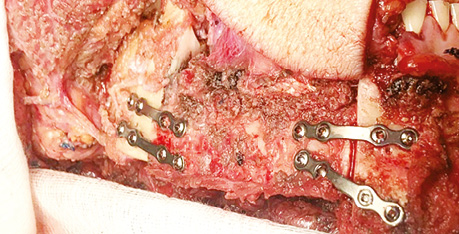
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
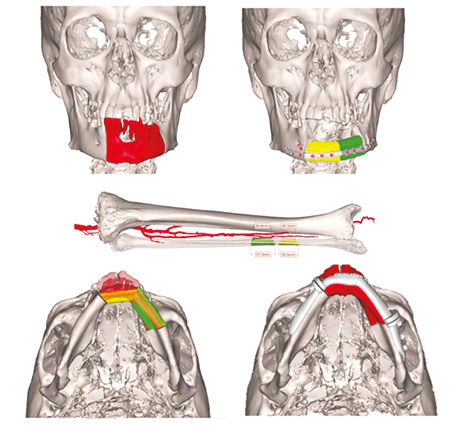
Пластичне заміщення малогомілковим клаптем C дефектів НЩ виконано у 3 (9,3%), LC — у 4 (12,5%), L — у 15 (46,8%), H — у 9 (28,1%), HC — у 4 (12,5%), LHC — у 2 (6,2%) випадках. Передопераційне планування реконструкції НЩ з допомогою CAD / CAM представлено на рис. 8–10.
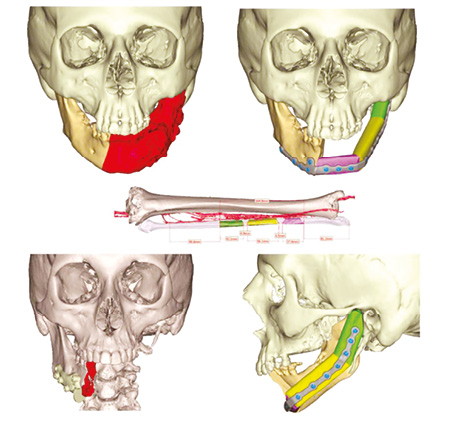
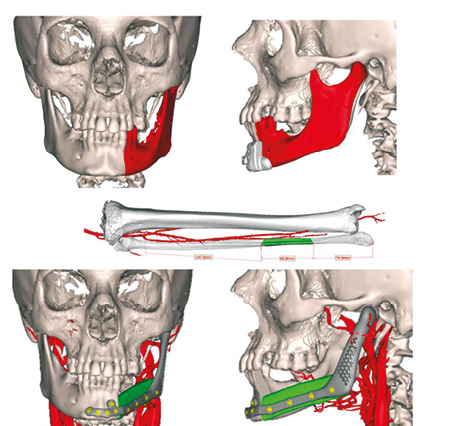
За допомогою аналізу ускладнень після реконструкції НЩ встановлено такі результати: у 1 (3,1 %) хворого розвинувся повний некроз малогомілкового клаптя, пов’язаний з венозним тромбозом мікросудинного анастомозу. У цього пацієнта виконане повторне реконструктивне втручання із використанням шкірно-м’язового клаптя великого грудного м’яза. Повний некроз шкірної частини клаптя розвинувся у 1 (3,1 %) хворого, частковий некроз — у 3 (9,3%), крайовий некроз — у 2 (6,2%). Завершеність реконструкції НЩ малогомілковим клаптем становила 96,9%.
Венозний тромбоз мікросудинного анастомозу розвинувся у 6 (18,7 %) пацієнтів. Тромбектомію та накладання реанастомозу дозволили 5 (83,3%) хворих.
У 27 (84,3%) осіб проведено мінімальну (<2 мм) додаткову корекцію форми кісткових сегментів малогомілкового клаптя для досягнення оптимального прилягання клаптя до збережених фрагментів НЩ та повноцінного відновлення анатомічної форми НЩ. У 5 (15,6%) пацієнтів додаткова корекція форми кісткових сегментів малогомілкового клаптя становила >2 мм, що, на нашу думку, пов’язано з похибкою при встановленні навігаційних шаблонів для резекції НЩ.
Експозицію індивідуалізованої титанової пластини виявлено у 1 (3,1%) хворого через 8 міс після завершення ХПТ. Післяпроменевий остеонекроз збереженого фрагмента НЩ та малогомілкового клаптя виявлено у 2 (6,2 %) пацієнтів в терміни 12–18 міс після завершення ПТ.
У 9 (28,1 %) осіб проведене зубне протезування без кісткових імплантатів, у 1 (3,1 %) пацієнта встановлено кісткові імплантати для дентальної реабілітації на малогомілковому клапті через 24 міс після операції, решта 22 (68,7 %) хворих не проходили стоматологічної реабілітації.
У 24 (64%) пацієнтів досягнуто 5-го рівня за FOIS, що відповідає можливості вживати м’яку їжу без потреби в зондовому харчуванні, а у 8 (36%) хворих досягнули 7-го рівня за шкалою FOIS, який характеризується повноцінним харчуванням без обмежень. Однак слід зауважити, що на момент опитування лише 31,2 % пацієнтів пройшли стоматологічну реабілітацію.
Завершеність реконструкції НЩ малогомілковим клаптем у нашому дослідженні становила 96,9%, що підтверджує високу ефективність методу та зіставно з результатами інших досліджень. Подібні результати наведено в систематичному огляді та метааналізі, де успішність реконструкції дефектів НЩ із використанням мікросудинного малогомілкового клаптя становила 95% [16].
Декілька досліджень порівнювали використання CAD- / CAM-технологій при реконструкції НЩ з традиційними методами. Виявлено, що використання CAD- / CAM-технологій значно зменшує тривалість операції, час ішемії клаптя та термін госпіталізації порівняно з традиційними методами [6–7, 14].
Технології CAD / CAM забезпечують високий рівень точності та індивідуалізації при реконструкції НЩ. У дослідженні E. Zavattero та співавт. зафіксовано високу відповідність між віртуальним плануванням та його реалізацією, особливо у складних випадках із використанням кількох сегментів малогомілкової кістки. У 47 пацієнтів реконструкцію виконано із використанням індивідуалізованих титанових пластин, при цьому встановлено 112 сегментів малогомілкової кістки. Для оцінки точності реконструкції проводили вимірювання 227 відстаней між анатомічними орієнтирами, що дало змогу детально проаналізувати результати. Післяопераційна похибка реконструкції, визначена за КТ через 1 міс, становила 0,5–3 мм [17].
P. Metzler та співавт. ретроспективно проаналізували 20 КТ-сканів 10 пацієнтів, яким виконано реконструкцію НЩ із використанням малогомілкового клаптя за допомогою CAD- / CAM-технологій. У дослідженні встановлено, що розміри сегментів малогомілкової кістки після остеотомії мали високу відповідність параметрам, заданим у передопераційному віртуальному плануванні. Зокрема, точність відповідності між планом і реальним результатом свідчить про ефективність цих технологій для забезпечення прецизійного хірургічного втручання. Такий підхід дозволяє мінімізувати ризик технічних помилок, оптимізувати контакт між кістковими фрагментами та покращити загальний результат реконструкції. Дослідження P. Metzler та співавт. підкреслює важливість віртуального планування для досягнення високої точності у складних випадках, що потребують реконструкції з численними остеотоміями малогомілкового клаптя [18].
Наш досвід використання CAD- / CAM-технологій при реконструкції НЩ підтверджує отримані результати E. Zavattero та P. Metzler та співавт., а саме: у переважній більшості спостережень проводили мінімальну додаткову корекцію форми кісткових сегментів малогомілкового клаптя для досягнення оптимального прилягання клаптя до збережених фрагментів НШ та повноцінного відновлення анатомічної форми НЩ. Крім того, відсутність необхідності значної корекції фрагментів малогомілкового клаптя дозволяє зменшити тривалість оперативного втручання.
ВИСНОВКИ
1. Використання малогомілкового клаптя є надійним та ефективним методом реконструкції НЩ.
2. Використання CAD- / CAM-технологій при заміщенні сегментарних НЩ малогомілковим клаптем забезпечує високу точність реконструкції, мінімальну частоту післяопераційних ускладнень та зменшує тривалість операції.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Copelli, C., Cacciatore, F., Cocis, S., Maglitto, F., Barbara, F., Iocca, O., & Manfuso, A. (2024). Bone reconstruction using CAD/CAM technology in head and neck surgical oncology. A narrative review of state of the art and aesthetic-functional outcomes. ACTA Otorhinolaryngologica Italica, 44(1), S58–S66. doi: 10.14639/0392-100X-suppl.1-44-2024-N2819.
2. Bak, M., Jacobson, A. S., Buchbinder, D., & Urken, M. L. (2010). Contemporary reconstruction of the mandible. Oral Oncology, 46, 71–76. doi: 10.1016/j.oraloncology.2009.11.006
3. Hidalgo, D. A. (1989). Fibula free flap: a new method of mandible reconstruction. Plastic and Reconstructive Surgery, 84, 71–79.
4. Roser, S. M., Ramachandra, S., Blair, H., Grist, W., Carlson, G. W., Christensen, A. M., … Steed, M. B. (2010). The accuracy of virtual sur- gical planning in free fibula mandibular reconstruction: comparison of planned and final results. Journal of Oral and Maxillofacial Surgery, 68, 2824–2832. doi: 10.1016/j.joms.2010.06.177.
5. Thankappan, K., Trivedi, N. P., Subash, P., Pullara, S. K., Peter, S., Kuriakose, M. A., & Iyer, S. (2008). Three-dimensional com- puted tomography-based contouring of a free fibula bone graft for mandibular reconstruction. Journal of Oral and Maxillofacial Surgery, 66, 2185–2192. doi: 10.1016/j.joms.2008.01.035.
6. Mahendru, S., Jain, R., Aggarwal, A., Aulakh, H. S., Jain, A., Khazanchi, R. K., & Sarin, D. (2020). CAD-CAM vs conventional technique for mandibular reconstruction with free fibula flap: a comparison of outcomes. Surgical Oncology, 34, 284–291. doi: 10.1016/j.suronc.2020.04.012.
7. Mazzola, F., Smithers, F., Cheng, K., Mukherjee, P., Hubert Low, T. H., Ch’ng, S., … Clark, J. R. (2020). Time and cost-analysis of virtual surgical planning for head and neck reconstruction: a matched pair analysis. Oral Oncology, 100, 104491. doi: 10.1016/j. oraloncology.2019.104491.
8. Nyirjesy, S. C., Heller, M., von Windheim, N., Gingras, A., Kang, S. Y., Ozer, E., … VanKoevering, K. K. (2022). The role of computer aided design/computer assisted manufacturing (CAD/CAM) and 3-dimensional printing in head and neck oncologic surgery: a review and future directions. Oral Oncology, 132, 105976. doi: 10.1016/j.oraloncology.2022.105976.
9. Jewer, D. D., Boyd, J. B., Manktelow, R. T., Zuker, R. M., Rosen, I. B., Gullane, P. J., … Freeman, J. E. (1989). Orofacial and mandibular reconstruction with the iliac crest free flap: a review of 60 cases and a new method of classification. Plastic and Reconstructive Surgery, 84, 391–403.
10. Zenha, H., Azevedo, M., Vieira, R., & Costa, H. (2023). Microsurgical reconstruction of the mandible part II: new classification system and algorithm. European Journal of Plastic Surgery, 46, 707–716. doi: 10.1007/s00238-023-02072-2.
11. Baecher, H., Hoch, C. C., Knoedler, S., Maheta, B. J., Kauke-Navarro, M., Safi, A. F., … Knoedler, L. (2023). From bench to bedside — current clinical and translational challenges in fibula free flap re- construction. Frontiers in Medicine (Lausanne), 10, 1246690. doi: 10.3389/fmed.2023.1246690.
12. Shuck, J. W., Largo, R. D., Hanasono, M. M., & Chang, E. I. (2023). Evolution of medical mod- eling and 3D printing in microvascular midface reconstruction: literature review and experience at MD Anderson Cancer Center. Medicina (Kaunas), 59, 1762. doi: 10.3390/medicina59101762.
13. Pu, J. J., Lo, A. W. I., Wong, M. C. M., Choi, W. S., Ho, G., Yang, W. F., & Su, Y. X. (2024). A quantitative comparison of bone resection margin distances in virtual surgical planning versus histopathology: a prospective study. International Journal of Surgery, 110, 111–118. doi: 10.1097/JS9.0000000000000780.
14. May, M. M., Howe, B. M., O’Byrne, T. J., Alexander, A. E., Morris, J. M., Moore, E. J., … Price, D. L. (2021). Short and long-term out- comes of three-dimensional printed surgical guides and virtual surgical planning versus conventional methods for fibula free flap reconstruction of the mandible: decreased nonunion and complication rates. Head & Neck, 43, 2342–2352. doi: 10.1002/hed.26688.
15. Crary, M. A., Carnaby-Mann, G. D., & Groher, M. E. (2005). Initial psychometric assessment of a functional oral intake scale for dysphagia in stroke patients. Archives of Physical Medicine and Rehabilitation, 86, 1516–1520. doi: 10.1016/j.apmr.2004.11.049.
16. Tahmasebi, E., Keykha, E., Hajisadeghi, S., Moslemi, H., Shafie, S., Motamedi, M. H. K., … Alam, M. (2023). Outcomes and influential factors in functional and dental rehabilitation following microvascular fibula flap reconstruction in the maxillomandibular region: a systematic review and meta-analysis. Maxillofacial Plastic and Reconstructive Surgery, 45(1), 24. doi: 10.1186/s40902-023-00392-8.
17. Zavattero, E., Bolzoni, A., Dell’Aversana, G., Santagata, M., Massarelli, O., Ferri, A., … Baj, A. (2021). Accuracy of fibula reconstruction using patient-specific CAD/CAM plates: a multicenter study on 47 patients. Laryngoscope, 131, E2169–E2175. doi: 10.1002/lary.29379.
18. Metzler, P., Geiger, E. J., Alcon, A., Ma, X., & Steinbacher, D. M. (2014). Three-dimensional virtual surgery accuracy for free fibula mandibular reconstruction: planned versus actual results. Journal of Oral and Maxillofacial Surgery, 72, 2601–2612. doi: 10.1016/j.joms.2014.07.024.
Адреса для листування:
Буртин Ольга
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: olyabyrtun@gmail.com
Correspondence:
Olga Burtyn
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: olyabyrtun@gmail.com














Leave a comment