Проведення мобілізаційних курсів та аферезу CD34+. Досвід Державного некомерційного підприємства «Національний інститут раку»
Крячок І.А.1, Райник Х.П.1,2, Шокун Н.В.1, Буртна А.С.1
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Національний медичний університет ім. О.О. Богомольця, Київ, Україна
Резюме. Мета. Провести аналіз видів мобілізаційних курсів, протоколів процедури аферезу CD34+ та факторів, які впливають на ефективність мобілізацій і подальшої колекції стовбурових клітин периферичної крові (СКПК), та розробити підходи до удосконалення цих етапів високодозової хімієтерапії (ВДХТ) + аутологічної трансплантації гемопоетичних стовбурових клітин (АТГСК). Матеріали та методи. У дослідження включено дані 65 хворих, яким проводилися мобілізаційні курси з 1.01.2023 до 1.12.2023 р. у відділенні трансплантації кісткового мозку Державного некомерційного підприємства «Національний інститут раку» (ДНП «НІР»). Результати. У дослідженні вивчено підходи до мобілізації СКПК та удосконалені практики їх збору для трансплантації у пацієнтів з гематологічними захворюваннями. Проведено аналіз видів мобілізаційних курсів, процесу аферезу, а також застосування стимулювальних препаратів. Показано, що ефективна мобілізація стовбурових клітин (СК) може бути досягнута завдяки оптимізації методів та розробці індивідуальних підходів до кожного хворого. Висновки. Перспективою є необхідність впровадження нових методів мобілізації та аферезу для підвищення продуктивності процедур і результатів лікування.
Одержано 4.12.2024
Прийнято до друку 14.12.2024
DOI: 10.32471/clinicaloncology.2663-466X.56-4.33827
ВСТУП
Мобілізація СКПК визначається як ключовий етап у процесі підготовки до трансплантації СК при низці онкологічних та гематологічних захворювань [1]. Цей важливий процес полягає у вивільненні СD34+-клітин, а його ініціація може відбуватися за допомогою спеціальних препаратів, таких як гранулоцитарний колонієутворювальний фактор (Г-КСФ), мобілізувальна хімієтерапія або їх комбінація. Головною метою цього процесу є досягнення збільшення кількості СКПК для подальшого збору та використання для забезпечення проведення високодозової хімієтерапії та трансплантації СКПК (ВДХТ та трансплантації СКПК).
Для забезпечення ефективної колекції важливе підвищення циркулювальної концентрації СКПК, яке може бути досягнуте різними методами мобілізації. Введення гемопоетичних цитокінів, зокрема Г-КСФ, сприяє тимчасовому збільшенню (мобілізації) кількості СК в периферичному кровотоці та дозволяє зібрати достатню їх кількість для трансплантації.
Навіть при використанні різноманітних мобілізаційних режимів у деяких випадках є труднощі в досягненні необхідної кількості CD34+-клітин для ініціації аферезу. Ці категорії хворих визначаються як «незадовільні мобілізатори». У таких випадках застосовується препарат плериксафор — антагоніст рецептора CXCR4. CXCR4 — це рецептор хемокіну, який зв’язується з його природним лігандом SDF-1 (CXCL12) [2]. Взаємодія між CXCR4 і SDF-1 відіграє ключову роль у затриманні СК у кістковому мозку. Коли плериксафор блокує CXCR4, це перешкоджає зв’язуванню SDF-1 з його рецептором, що знижує адгезію гемопоетичних СК до стромальних клітин у кістковому мозку. Це зумовлює вивільнення клітин у периферичну кров. Плериксафор застосовують поєднано з Г-КСФ, що дає змогу ще більше підвищити рівень СК у периферичній крові. Г-КСФ стимулює проліферацію та мобілізацію СК, а плериксафор посилює цей процес завдяки блокуванню CXCR4.
Для визначення обсягу та ефективності збору СКПК використовується визначення показника CD34+ СК. Після досягнення цільового рівня CD34+ у зібраному продукті колекція завершується. Стандартні цільові рівні можуть варіювати залежно від основного захворювання та виду трансплантації, але складають не менше ніж 2•10⁶ CD34+-клітин/кг маси тіла хворого, оптимальний рівень становить >5•10⁶ CD34+-клітин/кг маси тіла [3].
Незважаючи на наявність численних мобілізаційних протоколів, не всі пацієнти відповідають однаково на спроби мобілізації, що потребує індивідуального підходу та ретельного моніторингу для оптимізації збору СК. Удосконалення стратегій мобілізації та аферезу є критично важливими для підвищення ефективності трансплантації, тому важливо розробляти і впроваджувати нові методи, які дозволяють підвищити продуктивність цих процедур.
У статті розглядається досвід ДНП «НІР» щодо підходів до колекції СКПК, включно з етапами проведення мобілізаційних курсів, процесу аферезу. Результати проведених досліджень та аналіз власного досвіду спрямований на удосконалення практики мобілізації та підвищення результатів лікування хворих, які потребують проведення ВДХТ та АТГСК.
МЕТА ДОСЛІДЖЕННЯ
Провести аналіз видів мобілізаційних курсів, протоколів процедури аферезу CD34+ та факторів, які впливають на ефективність мобілізацій і подальшої колекції СКПК, та розробити підходи до удосконалення цих етапів ВДХТ + АТГСК.
МАТЕРІАЛИ ТА МЕТОДИ
У це дослідження включено дані 65 хворих, яким проводилися мобілізаційні курси з 1.01.2023 до 1.12.2023 р. у відділенні трансплантації кісткового мозку (ТКМ) ДНП «НІР». Загальна кількість мобілізаційних курсів становила 65, неефективних — 8 (виключені з дослідження, оскільки ці пацієнти не досягнули мінімальної кількості CD34+-клітин у периферичній крові для можливості застосування плериксафору).
У переважній більшості випадків режим мобілізації складався з призначення Г-КСФ (філграстиму) у комбінації з ендоксаном. Стандартна доза філграстиму при мобілізації СКПК становила 10 мкг/кг маси тіла/добу, але могла варіювати від 5 до 16 мкг/кг маси тіла. У всіх випадках препарат вводився підшкірно. Доза ендоксану становила 2 г/м². У деяких випадках в якості мобілізаційної ХТ застосовували цитарабін, етопозид, курси ПХТ. Доцільність проведення аферезу визначалася кількістю CD34+-клітин у периферичній крові. Оптимальна кількість лейкоцитів та СD34+-клітин зазвичай становила 4•10⁹/л та 20 кл/мкл відповідно, після чого розпочиналася підготовка до аферезу. Хворим, які не досягли оптимального рівня CD34+, для стимуляції СКПК додатково застосовували плериксафор (за умови кількості лейкоцитів >4•10⁹/л та CD34+ 10 кл/мкл у периферичній крові (10 осіб). Плериксафор вводився ввечері напередодні колекції в дозі 0,24 мг/кг маси тіла пацієнта.
Венозний доступ для проведення процедури забезпечувався периферичними катетерами (ПК) або центральними венозними катетерами (ЦВК). Перевага надавалася використанню ПК з огляду на більш високу ефективність забезпечення кровотоку, що безпосередньо впливає на якість збору СКПК. У випадках, коли це не було можливим, хворим встановлювали двоходовий ЦВК для забезпечення здатності витримувати значні зміни об’єму циркулювальної крові.
РЕЗУЛЬТАТИ
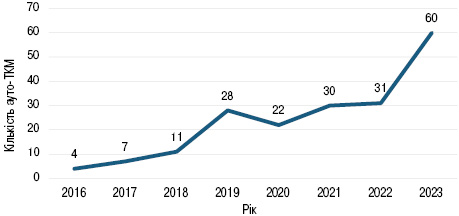
Проведення аутологічних ТКМ у ДНП «НІР» для дорослих пацієнтів розпочато у 2016 р. з підвищенням кількості щороку, а саме у 2016 р. — 4 ТКМ, 2017 р. — 7 ТКМ, 2018 р. — 11 ТКМ, 2019 р. — 28 ТКМ, 2020 р. — 22 ТКМ, 2021 р. — 30 ТКМ, 2022 р. — 31 ТКМ, 2023 р. — 60 ТКМ. Кількість аутологічних ТКМ за роками представлено на рис. 1.
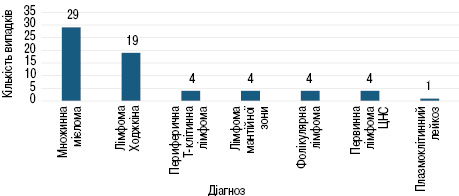
У групу дослідження залучено 65 пацієнтів, яким заплановано проведення ВДХТ + АТГСК за період (5.12.2022 — 11.12.2023), з них хворих на множинну мієлому — 29 випадків (44,6%), лімфому Ходжкіна — 19 випадків (29,2%), периферичну Т-клітинну лімфому — 4 випадки (6,15%), лімфому мантійної зони — 4 випадки (6,15%), фолікулярну лімфому — 4 випадки (6,15%), первинну лімфому центральної нервової системи (ЦНС) — 4 випадки (6,15%), плазмоклітинний лейкоз — 1 випадок (1,5%). Розподіл кількості аферезів при різних нозологіях представлено на рис. 2.
Загальна кількість аферезів становила 89 процедур, від 1 до 3 аферезів, у середньому 2 процедури на 1 хворого.Вік пацієнтів групи спостереження варіював від 20 до 69 років. Медіана віку пацієнтів становила 44,5 року.
38 пацієнтів (58%) попередньо отримали лише 1 лінію терапії, з них 25 — хворі із множинною мієломою (65,7%), 11 осіб (16,9%) — 2 лінії терапії, 12 пацієнтів (18,46%) попередньо отримали 3 лінії терапії, 2 хворі (3%) — 4 лінії терапії, 2 особи (3%) — 5 ліній терапії. Медіана кількості ліній терапії становила 1,57. Променеву терапію до початку мобілізаційних курсів отримало 10 пацієнтів (15,4%). Отже, більшість хворих (58%) отримали не більше ніж 1 лінію терапії, а 42% були передліковані (≥2 ліній терапії).
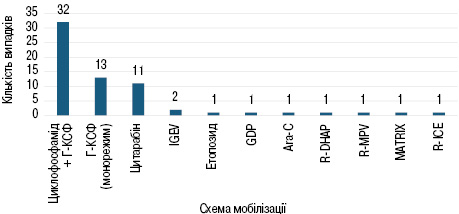
Більшість пацієнтів у якості мобілізаційного курсу отримали циклофосфамід у комбінації з Г-КСФ — 32 випадки (49%), Г-КСФ у монорежимі застосовували у 13 випадках (20%), цитарабін — 11 випадках (16,9%), IGEV — 2 випадках (3%), етопозид — 1 випадку (1,5%), GDP — 1 випадку (1,5%), Ara-C — 1 випадку (1,5%), R-DHAP — 1 випадку (1,5%), R-MPV — 1 випадку (1,5%), MATRix — 1 випадку (1,5%) та R-ICE — 1 випадку (1,5%). Розподіл випадків за обраною схемою мобілізаційного курсу представлено на рис. 3.
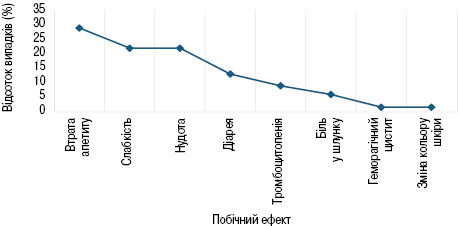
З найпоширеніших побічних ефектів, які траплялися при проведенні мобілізації за допомогою хімієпрепаратів, зафіксовано втрату апетиту (29%), слабкість (22%), нудоту (22%), діарею (13%), тромбоцитопенію (8,9%), дискомфорт або біль у шлунку (5,9%), Більш рідко виявлено геморагічний цистит (1,49%) і зміну кольору шкіри (1,49%) (рис. 4).
При мобілізації за допомогою Г-КСФ найбільш частим ускладненням відмічено біль у кістках, зумовлений збільшеним утворенням та вивільненням СК у кров. Біль найчастіше виникав у тазовій та грудній ділянках скелета.
У результаті проведення мобілізаційних курсів кількість CD34+ у периферичній крові становила від 20 до 139 кл/мкл.
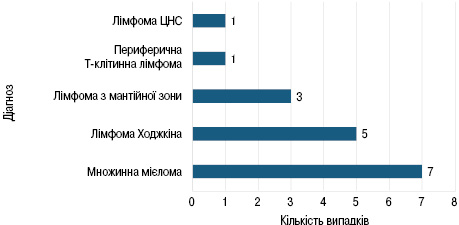
Аналізуючи найвищий результат мобілізації, можна відмітити 17 пацієнтів, які мали викид >80 клітин/мкл, множинну мієлому — 7 випадків (41,2%), лімфому Ходжкіна — 5 випадків (29,4%), лімфому з мантійної зони — 3 випадки (17,%), периферичну Т-клітинну лімфому — 1 випадок (5,9%), лімфому ЦНС — 1 випадок (5,9%) (рис. 5).
Для 43 пацієнтів (66%) процедуру проведено лише 1 раз. Діапазон кількості лейкоцитів у периферичній крові становив 4,96•10⁹/л — 103•10⁹/л, CD34+ у периферичній крові становив 21–460 кл/мкл, діапазон CD34+ у зібраному продукті становив 1,56•10⁶ — 23,47•10⁶ кл/кг маси тіла.
22 хворим проведено повторний аферез на 2-й день. Діапазон кількості лейкоцитів у периферичній крові цих пацієнтів — 9,44•10⁹/л — 115•10⁹/л, діапазон CD34+ у периферичній крові — 21–230 кл/мкл, діапазон CD34+ у зібраному продукті — 1,38•10⁶ кл/кг маси тіла — <8,48•10⁶ кл/кг маси тіла.
46 аферезів проведено на сепараторі Spectra Optia, решта — на Amicus. Встановлено, що достовірної різниці CD34+ у зібраних продуктах на тому чи іншому апараті немає.
Побічні реакції під час аферезу оцінювали за шкалою від легкого до тяжкого ступеня (таблиця).
| Ступінь | Рівень кальцію, ммоль/л | Клінічні прояви | |
| іонізованого | загального | ||
| Легкий | 1,0—1,15 | 2,0—2,1 | Відсутність симптомів або незначні парестезії (поколювання в пальцях, губах) |
| Помірний | 0,9—1,0 | 1,9—2,0 | Помітніші парестезії, м’язові спазми (особливо в руках і ногах), симтоми Труссо |
| Тяжкий | <0,9 | <1,9 | Судоми, ларингоспазм, бронхоспазм, порушення серцевого ритму, загроза життю |
При аналізі ускладнень аферезу найбільш частим була гіпокальціємія, викликана застосуванням антикоагулянту. 46% усіх пацієнтів скаржилися на незначне поколювання на обличчі та кінцівках під час аферезу, який купували пероральним та/або внутрішньовенним введенням кальцію. Рідше виявляли такі ускладнення, як артеріальна гіпотензія (1%) та нудота (2%).
Проводився кореляційний аналіз впливу на кількість CD34+-клітин у зібраному продукті таких факторів, як вік, стать, нозологія, кількість ліній попередньої терапії, CD34+-клітин у периферичній крові, за результатами якого встановлено наступне: вік, стать, схеми мобілізації не зумовили значущого кореляційного зв’язку з ефективністю мобілізації CD34+-клітин, що свідчить про їх незначний вплив на цей процес, однак при подальшому аналізі впливу ≥4 ліній лікування на кількість зібраних клітин виявлено важливу тенденцію: у пацієнтів із ≥4 лініями терапії середня кількість CD34+-клітин становила 3,53•10⁶ клітин/кг маси тіла, у хворих із <4 лініями лікування цей показник був значно вищим — 6,54•10⁶ клітин/кг маси тіла.
У дослідженні встановлено, що кількість попередніх ліній терапії впливає на ефективність мобілізації CD34+-клітин. Зокрема, пацієнти, які отримали <4 ліній лікування, мають значно ліпші результати колекції СКПК.
Також варто зазначити важливість застосування плериксафору у осіб із низькою здатністю до мобілізації СКПК, так званих незадовільних мобілізаторів.
Введення плериксафору в комбінації з Г-КСФ є стандартним підходом для збільшення мобілізації у пацієнтів, у яких застосування лише Г-КСФ виявилося неефективним. Такий комбінований підхід дозволяє не лише забезпечити необхідну кількість клітин для трансплантації, але й зменшити кількість аферезних процедур, знижуючи загальний дискомфорт для пацієнта.
ОБГОВОРЕННЯ
Мобілізація СКПК є важливим етапом процесу ВДХТ + АТГСК і запорукою успіху подальшої трансплантації. Цей етап включає декілька складових, а саме вибір мобілізаційного режиму на основі аналізу попереднього лікування з урахуванням нозології, а також інших складових, таких як кількість лейкоцитів, CD34+-клітин у периферичній крові, венозний доступ, вибір клітинного сепаратора та ін. Мінімальною кількістю СКПК, необхідною для трансплантації, є 2•10⁶ CD34+, оптимальною є 5•10⁶ [3].
Базовим препаратом для стимуляції СКПК є Г-КСФ, однак у певних випадках він не зумовлює викид достатньої кількості клітин. У дослідженні, проведеному компанією Key Biologics Holdings [4], виявлено, що додавання плериксафору до Г-КСФ значно підвищує рівень мобілізованих CD34+ СК. Зокрема, кількість мобілізованих CD34+-клітин збільшувалася до 4,8 раза порівняно з 1,7 раза лише при використанні Г-КСФ, що зменшувало кількість необхідних сеансів аферезу та полегшувало процес збору клітин для пацієнтів.
У нашому дослідженні підтверджується ефективність застосування плериксафору в комбінації з Г-КСФ для мобілізації CD34+-клітин. В усіх 10 хворих, яким вводилася така комбінація, зібрали достатню кількість клітин за 1 аферез, що збігається з результатами дослідження Key Biologics Holdings.
У дослідженні у відділенні педіатрії Сичуанського університету (Sichuan University), Китай [5], зафіксовано, що комбінація Г-КСФ + плериксафор значно підвищила проліферацію CD34+ порівняно з монотерапією Г-КСФ. За допомогою метааналізу 193 осіб у групі Г-КСФ + плериксафор та 214 пацієнтів у групі Г-КСФ виявлено суттєве збільшення кількості клітин CD34+ у групі плериксафору (медіана 28,11; 95% довірчий інтервал (ДІ) 14,07–42,14; p=0,004). Аналіз за підгрупами свідчить про збільшення викиду клітин у хворих на множинну мієлому, неходжкінську лімфому. Можна зробити висновок, що плериксафор у комбінації з Г-КСФ ефективно збільшує мобілізацію СК у різних групах пацієнтів.
Одним з перспективних напрямків підвищення ефективності мобілізації є поєднання Г-КСФ та хімієтерапії. У даних дослідження, проведеного у відділенні гематологічних злоякісних новоутворень та клітинної терапії Інституту раку Дьюка (Duke Cancer Institute) у Північній Кароліні, США, встановлено, що комбінація циклофосфаміду (Cy) з Г-КСФ суттєво підвищує ефективність колекції СК порівняно із застосуванням лише Г-КСФ [6]. Кількість зібраних CD34+-клітин Cy + Г-КСФ значно збільшує кількість збору клітин, забезпечуючи середню кількість 12•10⁶ CD34+-клітин/кг маси тіла порівняно з 5,8•10⁶ CD34+-клітин/кг маси тіла у пацієнтів із застосуванням Г-КСФ (p<0,01). Пацієнти, які отримували Cy + Г-КСФ, проходили процедуру аферезу в середньому за 1,6 доби, що швидше, ніж 2,2 доби у хворих, які отримували тільки Г-КСФ (р = 0,001).
За результатами нашого дослідження, середнє значення для осіб, що отримували Г-КСФ у монотерапії, становило 4,48•10⁶ CD34+-клітин/кг маси тіла, тоді як для пацієнтів, які отримували Г-КСФ у комбінації з циклофосфамідом, середнє значення було вищим — 6,47•10⁶ CD34+-клітин/кг маси тіла. Це свідчить про вищу ефективність мобілізаційного курсу з циклофосфамідом у забезпеченні більшої кількості CD34+-клітин. Отже, режим циклофосфамід + Г-КСФ є ефективним і зменшує кількість днів колекцій. Застосування циклофосфаміду + Г-КСФ може бути переважним для пацієнтів, які потребують максимального збору клітин якнайшвидше, але Г-КСФ може бути кращим вибором для хворих, у яких пріоритетом є мінімізація токсичності.
Завдяки ретроспективному аналізу ефективності мобілізації СК за допомогою цитарабіну встановлено, що доза препарату впливає на ефективність процедури [7]. Серед пацієнтів, які отримували цитарабін у дозі 800 мг/м², успішного збору ≥2•10⁶ CD34+-клітин/кг маси тіла досягнуто у 57%, тоді як для доз 1600 та 2400 мг/м² ці показники становили 86 і 77% відповідно. Плериксафор застосовували як додатковий засіб. Хоча загальна медіана кількості зібраних CD34+-клітин була подібною між групами (5,4•10⁶ для дозування 800 мг/м², 4,9•10⁶ для дозування 1600 мг/м² і 7,5 •10⁶ CD34+-клітин/кг маси тіла для дозування 2400 мг/м²), застосування вищих доз цитарабіну асоціювалося з вищим відсотком пацієнтів із прогресуванням захворювання на момент мобілізації (32% для 2400 мг/м² vs 0% для 1600 мг/м² та 800 мг/м², p=0,001). Результати підкреслюють важливість персоналізованого підходу до мобілізації, враховуючи дозу цитарабіну та статус захворювання пацієнта.
У нашому дослідженні 11 хворим проведено мобілізацію цитозаром. До початку мобілізації ця когорта пацієнтів отримала 1 (54%), 2 (18%), 3 лінії терапії (27%). В усіх 11 пацієнтів зібрано >4,62 млн (медіана = 5,95 млн), 81% пацієнтів зібрали продукт за 1 сенс аферезу. Враховуючи ці дані, можна підтвердити високу ефективність мобілізаційного курсу цитозаром.
Перспективним напрямком є застосування мотиксафортиду в комбінації з Г-КСФ для мобілізації гемопоетичних СК. Завдяки вищим показникам мобілізації CD34+-клітин, мотиксафортид відкриває нові можливості для поліпшення результатів аутологічної ТКМ у пацієнтів із множинною мієломою. Це робить його застосування перспективним для подальшого розвитку в клінічній практиці. Мотиксафортид і плериксафор належать до групи антагоністів рецепторів хемокінів CXCR4. Мотиксафортид чинить дію довше порівняно з плериксафором, має вищу селективність до CXCR4, що може сприяти більш ефективній мобілізації клітин за більш низьких доз або меншої кількості процедур. У результатах дослідження 3-ї фази GENESIS (NCT03246529), що проводилося у Вашингтонському університеті (University of Washington), США [8], зафіксовано високу ефективність мотиксафортиду в комбінації з Г-КСФ для мобілізації гемопоетичних СК у осіб із множинною мієломою, що готуються до аутологічної ТКМ. Дослідження досягло всіх первинних і вторинних кінцевих точок, підтверджуючи ефективність комбінації. У групі лікування (n=122) значно більше пацієнтів, які отримували мотиксафортид з Г-КСФ, змогли досягти необхідного рівня мобілізації СК. Первинною кінцевою точкою встановлено частку пацієнтів, які досягли мобілізації щонайменше 6,0•106 CD34+-клітин/кг маси тіла за 2 сеанси аферезу. У групі мотиксафортиду цю мету досягнуто у 70% усіх пацієнтів порівняно з 14,3% у групі плацебо, що відповідає співвідношенню шансів 12,9 і різниці 54,6% (95% ДІ 39,7–69,5%; р<0,0001). Додатково після 1 сеансу аферезу 67,5% усіх хворих з групи мотиксафортиду досягли цієї мети, тоді як у групі плацебо таких осіб було лише 4,8% (різниця 61,7%; 95% ДІ 49,5–73,8%; р<0,0001) з підвищенням у 14,1 раза. Медіана кількості зібраних CD34+-клітин у 1-й день аферезу в групі мотиксафортиду становила 8,5 млн клітин, що перевищує аналогічний показник у групі плацебо (1,5 млн клітин) у 5,6 раза. Комбінація мотиксафортиду дозволила 88,3% пацієнтів досягти готовності до трансплантації після 1 сеансу аферезу, тоді як у групі плацебо таких пацієнтів було лише 10,8%, що еквівалентно підвищенню у 8,2 раза. Ці результати значно знижують навантаження на хворих і ресурси лікарень, роблячи мотиксафортид перспективним варіантом для мобілізації СК у всіх пацієнтів із множинною мієломою, які готуються до аутологічної трансплантації. Наразі мотиксафортид в Україні не зареєстрований, однак його застосування є дуже перспективним у майбутньому.
Аналіз впливу віку, статі та схеми мобілізації свідчить, що ці фактори не чинять значущого впливу на ефективність мобілізації CD34+-клітин. Однак кількість попередніх ліній терапії суттєво впливає на цей процес: у пацієнтів із ≥4 лініями лікування середня кількість CD34+-клітин становила 3,53•10⁶ клітин/кг маси тіла, тоді як у хворих із <4 лініями — 6,54•10⁶ клітин/кг маси тіла. Це призводить до зниження ефективності мобілізації зі збільшенням кількості ліній терапії.
Ці результати мають важливе практичне значення для вибору стратегії лікування. Вони свідчать про необхідність оптимізації кількості ліній терапії перед мобілізацією, щоб забезпечити достатню кількість СК для трансплантації. Зокрема, при плануванні лікування пацієнтів слід враховувати, що значна передлікованість може негативно впливати на мобілізацію CD34+-клітин, що ускладнює колекцію.
ВИСНОВКИ
За результатами проведеного дослідження отримані дані про важливість застосування плериксафору з наступних причин. По-перше, отримані дані про кількість СК навіть у «незадовільних мобілізаторів», що знижує ризик непроведення трансплантації. По-друге, він зменшує кількість аферезних процедур, що економить час і ресурси медичного закладу, а також знижує рівень стресу для пацієнта. По-третє, ефективна мобілізація зменшує потребу в додаткових препаратах та тривалості лікування, що загалом робить процес більш економічно вигідним і комфортним для всіх сторін.
Так, у результатах проведеного дослідження встановлено, що проблема вивчення питання щодо збільшення мобілізації важлива, розв’язується завдяки індивідуальному підходу для кожного пацієнта. Подальшим напрямком є розвиток нових підходів мобілізації із застосуванням плериксафору, мотиксафортиду та інших схем, які включають ХТ.
CПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Kriegsmann, K., & Wuchter, P. (2019). Mobilization and Collection of Peripheral Blood Stem Cells in Adults: Focus on Timing and Benchmarking. Methods in Molecular Biology, 2017, 41–58. doi: 10.1007/978-1-4939-9574-5_4.
2. To, L. B., Levesque, J. P., & Herbert, K. E. (2011). How I treat patients who mobilize hematopoietic stem cells poorly. Blood, 118(17), 4530–4540. doi.org/10.1182/blood-2011-06-318220.
3. Worel, N., Bilgin, Y. M., & Wuchter, P. (2024). Mobilization and Collection of HSC. In A. Sureda, S. Corbacioglu, R. Greco, N. Kröger, E. Carreras (Eds.). The EBMT Handbook: Hematopoietic Cell Transplantation and Cellular Therapies. Retrieved from http://www.ncbi.nlm.nih.gov/books/NBK608238/.
4. Scott, E. P. (2019). Impact of plerixafor plus G-CSF mobilization on CD34+ cell yield. Retrieved from irp-cdn.multiscreensite.com/ 0e492e43664749af8894d768171ebadf/ files/uploaded/_%5EGCSF%20vs%20plerixafor-3_Nov.082019.pdf.
5. Li, Y., Qiu, X., Lei, Y., & Zhou, R. (2024). G-CSF + plerixafor versus G-CSF alone mobilized hematopoietic stem cells in patients with multiple myeloma and lymphoma: a systematic review and meta-analysis. Annals of Medicine, 56(1), 2329140. doi: 10.1080/07853890.2024.2329140.
6. Tuchman, S. A., Bacon, W. A., Huang, L. W., Long, G., Rizzieri, D., Horwitz, M., … Gasparetto, C. J. (2015). Cyclophosphamide-Based Hematopoietic Stem Cell Mobilization Before Autologous Stem Cell Transplantation in Newly Diagnosed Multiple Myeloma. Clinical Apheresis, 30(3), 176–182. doi: 10.1002/jca.21360.
7. Drozd-Sokołowska, J., Waszczuk-Gajda, A., Topczewska, M., Maciejewska, M., Dutka, M., Zaucha, J. M., … Basak, G. W. (2024). Stem Cell Mobilization Performed with Different Doses of Cytarabine in Plasma Cell Myeloma Patients Relapsing after Previous Autologous Hematopoietic Cell Transplantation—A Multicenter Report by the Polish Myeloma Study Group. Cancers (Basel), 16(14), 2588. doi.org/10.3390/cancers16142588.
8. BioLineRxLtd (2021). BioLineRx Announces Positive Top-Line Results from GENESIS Phase 3 Trial of Motixafortide in Stem-Cell Mobilization for Autologous Bone Marrow Transplantation in Multiple Myeloma Patients. Retrieved from ir.biolinerx.com/node/12551/pdf.
Адреса для листування:
Крячок Ірина Анатоліївна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: Irina.kryachok@gmail.com
Correspondence:
Iryna Kryachok
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: Irina.kryachok@gmail.com














Leave a comment