Довготривале спостереження, повторне лікування та перехресний аналіз застосування пембролізумабу порівняно з плацебо в ад’ювантному режимі при меланомі високого ризику II стадії в дослідженні KEYNOTE-716
Резюме. Ад’ювантна терапія пембролізумабом або ніволумабом є стандартом лікування меланоми стадії ≥IIB. У цьому аналізі наводяться оновлені дані дослідження KEYNOTE-716, які охоплюють результати повторного призначення та переходу на пембролізумаб у пацієнтів, які раніше отримували плацебо. У дослідження залучено 976 осіб віком від 12 років з резектованою меланомою, яких випадковим чином розподілили в групу прийому пембролізумабу або групу отримання плацебо. При медіані спостереження 52,8 міс застосування пембролізумабу супроводжувалося вищими показниками виживаності без рецидивів (ВБР) та виживаності без віддалених метастазів (ВБВМ) порівняно з плацебо: 71% проти 58% для ВБР і 81% проти 70% для ВБВМ відповідно. Медіани показника виживаність без прогресування / рецидиву 2 (ВБП / ВБР2) не досягнуто в жодній групі (відносний ризик (ВР) 0,75 (95% довірчий інтервал (ДІ) 0,56–1,01)). Серед учасників 9 пацієнтів отримували повторне лікування, а 71 пацієнт перейшов на прийом пембролізумабу після плацебо. У групі повторного лікування випадків рецидиву у осіб з резектабельною меланомою не відмічалося, тоді як серед хворих, що перейшли на пембролізумаб, у 41% відмітили рецидиви. Серед пацієнтів з нерезектабельною меланомою частота об’єктивної відповіді (ЧОВ) на лікування пембролізумабом становила 0% у групі повторного лікування та 43% — у групі переходу на прийом препарату. Профіль безпеки відповідав попереднім результатам: побічні ефекти (ПЕ) виникли у 67% пацієнтів, що отримували повторне лікування, та у 61% осіб, які перейшли на пембролізумаб. Оновлений аналіз KEYNOTE-716 підтверджує ефективність ад’ювантної терапії пембролізумабом при меланомі IIB / IIC стадії після операції: пембролізумаб сприяв подовженню ВБР і ВБВМ з позитивною динамікою щодо ВБП / ВБР2 при стабільному профілі безпеки.
DOI: 10.32471/clinicaloncology.2663-466X.56-4.33803
Вступ
 Ад’ювантна терапія із застосуванням блокатора PD-1 пембролізумабу або ніволумабу є поточним стандартом лікування меланоми стадії ≥IIB [1]. У III фазі дослідження KEYNOTE-716 виявлено, що пембролізумаб в ад’ювантному режимі забезпечує вищі клінічні результати порівняно з плацебо у пацієнтів із меланомою стадії IIB або IIC [2–3]. Так, у групі пембролізумабу не досягнуто медіани ВБР (ВР=0,65; 95% ДІ 0,46–0,92; p=0,0066) і ВБВМ (ВР=0,64; 95% ДІ 0,47–0,88; p=0,0029). Крім того, застосування пембролізумабу характеризувалося прийнятним профілем безпеки для пацієнтів. У цьому аналізі наводяться оновлені дані дослідження KEYNOTE-716, які охоплюють результати повторного призначення та переходу на пембролізумаб у хворих, які раніше отримували плацебо.
Ад’ювантна терапія із застосуванням блокатора PD-1 пембролізумабу або ніволумабу є поточним стандартом лікування меланоми стадії ≥IIB [1]. У III фазі дослідження KEYNOTE-716 виявлено, що пембролізумаб в ад’ювантному режимі забезпечує вищі клінічні результати порівняно з плацебо у пацієнтів із меланомою стадії IIB або IIC [2–3]. Так, у групі пембролізумабу не досягнуто медіани ВБР (ВР=0,65; 95% ДІ 0,46–0,92; p=0,0066) і ВБВМ (ВР=0,64; 95% ДІ 0,47–0,88; p=0,0029). Крім того, застосування пембролізумабу характеризувалося прийнятним профілем безпеки для пацієнтів. У цьому аналізі наводяться оновлені дані дослідження KEYNOTE-716, які охоплюють результати повторного призначення та переходу на пембролізумаб у хворих, які раніше отримували плацебо.
Дизайн дослідження
Дослідженням KEYNOTE-716 (NCT03553836) охоплено пацієнтів (n=976) віком від 12 років із гістологічно підтвердженою меланомою шкіри стадії IIB або IIC (за класифікацією Американського об’єднаного онкологічного комітету (American Joint Committee on Cancer — AJCC), 8-ме видання, 2017 р., які пройшли хірургічне лікування. Хворі мали функціональний статус 0 або 1 за шкалою Східної об’єднаної групи онкологів (Eastern Cooperative Oncology Group — ECOG) та не отримували системну чи променеву терапію в минулому.
Медіана часу від рандомізації до дати завершення збору даних становила 52,8 міс (діапазон 39,4–64,8). Пацієнтів віком ≥12 років із резектованою меланомою стадії IIB або IIC випадково розподілено у співвідношенні 1:1 для отримання пембролізумабу 200 мг (у дозі 2 мг/кг маси тіла, проте не більше 200 мг для осіб віком <18 років) (n=487) або плацебо внутрішньовенно кожні 3 тиж протягом не більше 17 циклів (приблизно 1 рік) (n=489). Лікування припиняли в разі неприйнятної токсичності, прогресування захворювання або рішення пацієнта / лікаря. Основною кінцевою точкою була ВБР за критеріями оцінки відповіді у пацієнтів із солідними пухлинами RECIST 1.1 (за оцінкою дослідника), вторинними кінцевими точками — ВБВМ, загальна виживаність (ЗВ) та безпека. Дослідницькою точкою була ВБП / ВБР2 за RECIST 1.1 за оцінкою дослідника, яка визначалася як період часу від рандомізації до першого прогресування захворювання після первинного неоперабельного рецидиву онкопатології, другого рецидиву або смерті. Пацієнти могли перейти на повторне лікування або на терапію пембролізумабом за наступних умов: рецидив хвороби через ≥6 міс після завершення 17 циклів пембролізумабу або рецидив при будь-якій кількості циклів плацебо за відсутності затримок у лікуванні >12 тиж і після повного видалення ураження або біопсії нерезектабельного чи метастатичного захворювання. Хворі могли отримувати (нео-)ад’ювантну променеву терапію і мали відповідати функціональному статусу за шкалою ECOG 0–2 (в учасників віком ≥18 років). Медіана часу від 1-ї дози повторного лікування пембролізумабом до дати завершення збору даних становила 21,9 міс (діапазон 7,2–35,8), а для пацієнтів, які перейшли на пембролізумаб, цей показник становив 36,9 міс (діапазон 0,3–59,0). Хворі, які відповідали цим критеріям, могли перейти на прийом пембролізумабу в 2-й частині дослідження (у дозі 2 мг/кг маси тіла, проте не більше 200 мг для пацієнтів віком <18 років) внутрішньовенно кожні 3 тиж протягом не більше 17 циклів для резектабельного та до 35 циклів для неоперабельного захворювання.
Результати дослідження
При медіані спостереження 52,8 міс застосування пембролізумабу супроводжувалося подовженням ВБР (рівень 48-місячної ВБР становив 71% у групі пембролізумабу та 58% у групі плацебо) (ВР=0,62 (95% ДІ 0,50–0,78)) та ВБВМ (рівень 48-місячної ВБВМ становив 81% та 70% у групі прийому препарату та плацебо відповідно) (ВР=0,59 (95% ДІ 0,45–0,77)). При цьому медіани ВБП / ВБР2 не досягнуто в жодній групі (ВР=0,75 (95% ДІ 0,56–1,01)) (рис. 1). У дослідженні також оцінено кількість пацієнтів, яких необхідно пролікувати (NNT) для запобігання одному випадку рецидиву чи розвитку метастазів: для ВБР NNT становив 5,3, а для ВБВМ — 7,8, що демонструє, скільки хворих потрібно пролікувати для отримання позитивного ефекту за обмежений час виживаності. Загалом 9 осіб отримали повторне лікування (6 — з резектабельною меланомою і 3 — з нерезектабельною), а 71 пацієнт (41 — з резектабельною та 30 — з нерезектабельною меланомою) перейшли на терапію пембролізумабом. Середній термін спостереження для 2-ї частини становив 35,2 міс. У осіб з резектабельною меланомою, що отримували повторне лікування, не спостерігалося випадків рецидиву (0 з 6 пацієнтів), тоді як у 41% хворих, які перейшли на пембролізумаб (17 із 41), відмічалися рецидиви. Серед осіб з нерезектабельним захворюванням ЧОВ на лікування становила 0% (0 / 3; 95% ДІ 0–71) у групі повторного лікування і 43% (13 / 30; 95% ДІ 26–63) у групі переходу на прийом пембролізумабу. У 33% (1 / 3) повторно пролікованих пацієнтів і 47% (14 / 30) пацієнтів, які перейшли на пембролізумаб, зафіксовано випадки прогресування (медіана ВБП становила НД та 22 міс відповідно в обох групах) (рис. 2). Профіль безпеки у 1-й частині відповідав попереднім даним. У 2-й частині ПЕ, пов’язані з лікуванням, виявлені у 67% повторно пролікованих пацієнтів та 61% хворих у групі переходу (ПЕ III / IV ступенів у 11% та 10% відповідно; ПЕ V ступеня не фіксувалися). Імуноопосередковані ПЕ або реакції на інфузію виникали у 0% осіб групи повторного лікування і у 30% у групі переходу на пембролізумаб (ПЕ III / IV ступенів у 0 і 6% відповідно; ПЕ V ступеня не відмічалися в жодній з груп).
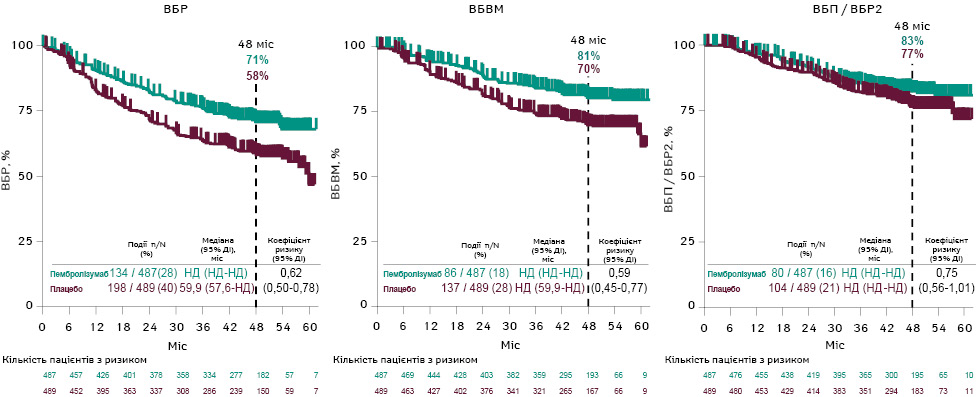
Примітка: НД — не досягнуто.
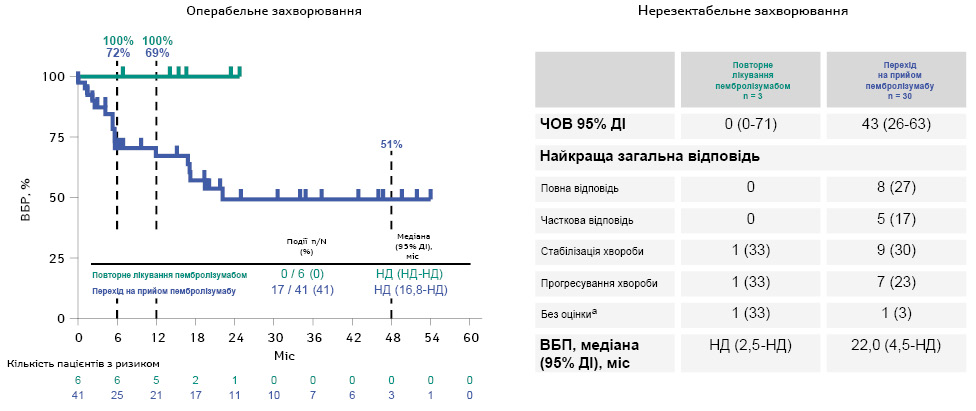
aВключно з пацієнтами, у яких не проводили оцінку після початкового обстеження. Дата зрізу даних: 16 лютого 2024 р.
Висновки
Результати оновленого аналізу дослідження KEYNOTE-716 продовжують підтримувати проведення ад’ювантної терапії пембролізумабом для лікування меланоми стадії IIB або IIC після хірургічного лікування. Після більш ніж 4 років спостереження пембролізумаб сприяв подовженню ВБР та ВБВМ порівняно з плацебо, а також відмічалася позитивна тенденція щодо ВБП / ВБР2. Не виявлено також нових сигналів щодо безпеки при повторному застосуванні пембролізумабу або переході на нього. У показниках NNT встановлено підвищення порівняно з попередніми даними (NNT для ВБР — 5,3 (оцінка за загальною площею під кривою Каплана — Меєра (RMST) до 60 місяців) проти 12,5 (на 24 міс, метод оцінки не уточнено); для ВБВМ — 7,8 проти 16,7) [4]. Дані щодо оцінки ЗВ ще недостатні й будуть повідомлені в майбутньому.
Список використаної літератури
1. Michielin, O., van Akkooi, A. C. J., & Ascierto, P. A.; ESMO Guidelines Committee. (2019). Electronic address: clinicalguidelines@esmo.org. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann. Oncol., 30(12), 1884–1901. doi: 10.1093/annonc/mdz411.
2. Long, G. V., Luke, J. J., Khattak, M. A., Merino, L. de la C., Del Vecchio, M., Rutkowski P., … Ascierto, P. A. (2022) Pembrolizumab versus placebo as adjuvant therapy in resected stage IIB or IIC melanoma (KEYNOTE-716): distant metastasis-free survival results of a multicentre, double-blind, randomised, phase 3 trial. Lancet Oncol., 23(11), 1378–1388. doi: 10.1016/S1470-2045(22)00559-9.
3. Luke, J. J., Rutkowski, P., Queirolo, P., Merino, C., Del Vecchio, M., Rutkowski, P., … Long, G. V. (2022). Pembrolizumab versus placebo as adjuvant therapy in completely resected stage IIB or IIC melanoma (KEYNOTE-716): a randomised, double-blind, phase 3 trial. Lancet., 399(10336), 1718–1729. doi: 10.1016/S0140-6736(22)00562-1.
4. Chen, L. N., & Carvajal, R. D. (2023). Considerations for adjuvant immunotherapy in stage II melanoma: KEYNOTE-716 and beyond. Ann. Transl. Med., 11(10), 368. doi: 10.21037/atm-23-839.
Ірина Неміш














Leave a comment