7-річний аналіз ефективності пембролізумабу в ад’ювантному режимі порівняно з плацебо при меланомі III стадії в межах дослідження EORTC1325 / KEYNOTE-054
Резюме. У попередньо опублікованих первинних аналізах цього дослідження 3-ї фази виявлено, що 12-місячне застосування пембролізумабу в ад’ювантному режимі сприяло значному підвищенню виживаності без рецидивів (ВБР) і виживаності без віддалених метастазів (ВБВМ) порівняно з плацебо у пацієнтів з резектованою меланомою III стадії високого ризику. Дані щодо стабільності цих переваг при медіані спостереження 3,5 та 5 років було опубліковано раніше [7–10]. У цьому дослідженні представлені результати з тривалішим періодом спостереження. Матеріали та методи дослідження. У це дослідження рандомізовано 1019 пацієнтів, які отримували пембролізумаб у дозі 200 мг або плацебо внутрішньовенно кожні 3 тиж (загальна кількість доз — 18). Первинними кінцевими точками була ВБР у загальній популяції та в підгрупі PD-L1-позитивних пацієнтів з меланомою. Вторинною точкою дослідження була ВБВМ у цих двох популяціях, а дослідницькою — виживаність без прогресування / рецидиву 2 (ВБП2). Результати. Медіана спостереження становила 6,9 року. У загальній популяції пацієнтів, які отримували лікування, ВБР була тривалішою в групі пембролізумабу, ніж у групі плацебо (коефіцієнт ризику (КР) 0,63; 95% довірчий інтервал (ДІ) 0,53–0,74). Через 7 років ВБР становила 50% (95% ДІ 46–55%) у групі пембролізумабу та 36% (95% ДІ 32–41%) у групі плацебо. Позитивні ефекти призначення пембролізумабу відмічали як при локорегіонарних рецидивах, так і при віддалених метастазах, а також при IIIA–C підстадіях меланоми та у PD-L1-позитивних і PD-L1-негативних популяцій, а також у популяції з BRAF-мутацією, так і у осіб, у яких не виявлено цієї мутації. ВБВМ була тривалішою у групі пембролізумабу, ніж у групі плацебо (КР 0,64; 95% ДІ 0,54–0,76). Через 7 років ВБВМ становила 54% (95% ДІ 50–59%) у групі пембролізумабу та 42% (95% ДІ 37–46%) у групі плацебо. ВБП2 була тривалішою у групі пембролізумабу, ніж у групі плацебо (КР 0,69; 95% ДІ 0,57–0,84). Через 7 років ВБП2 становила 61% (95% ДІ 57–66%) у групі пембролізумабу та 53% (95% ДІ 49–57%) у групі плацебо. Висновки. У 7-річному аналізі ефективності пембролізумабу в ад’ювантному режимі зафіксоване стійке підвищення довгострокових показників ВБР, ВБВМ, ВБП2 порівняно з плацебо у пацієнтів з резектабельною меланомою III стадії.
DOI: 10.32471/clinicaloncology.2663-466X.56-4.33781
Вступ
 У ключових рандомізованих контрольованих дослідженнях із застосуванням інгібіторів імунних контрольних точок, таких як іпілімумаб, ніволумаб та пембролізумаб в ад’ювантному режимі, а також комбінації інгібіторів BRAF-MEK дабрафенібу та траметинібу продемонстрували позитивні результати лікування у пацієнтів із меланомою групи високого ризику. Це сприяло схваленню Управлінням з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) вищевказаних препаратів у лікуванні цього захворювання [1–15]. Ефективність іпілімумабу [1–3], ніволумабу [4–6], пембролізумабу [7–10] і дабрафенібу поєднано з траметинібом [11–14] вивчалася у клінічних дослідженнях у хворих із меланомою III стадії. У нещодавніх дослідженнях KN-716 [16–18] і 76 K-Trial [19] отримано аналогічні позитивні результати ад’ювантної терапії пембролізумабом або ніволумабом у пацієнтів зі IIB–C стадіями меланоми, що також зумовило їх схвалення FDA.
У ключових рандомізованих контрольованих дослідженнях із застосуванням інгібіторів імунних контрольних точок, таких як іпілімумаб, ніволумаб та пембролізумаб в ад’ювантному режимі, а також комбінації інгібіторів BRAF-MEK дабрафенібу та траметинібу продемонстрували позитивні результати лікування у пацієнтів із меланомою групи високого ризику. Це сприяло схваленню Управлінням з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) вищевказаних препаратів у лікуванні цього захворювання [1–15]. Ефективність іпілімумабу [1–3], ніволумабу [4–6], пембролізумабу [7–10] і дабрафенібу поєднано з траметинібом [11–14] вивчалася у клінічних дослідженнях у хворих із меланомою III стадії. У нещодавніх дослідженнях KN-716 [16–18] і 76 K-Trial [19] отримано аналогічні позитивні результати ад’ювантної терапії пембролізумабом або ніволумабом у пацієнтів зі IIB–C стадіями меланоми, що також зумовило їх схвалення FDA.
Проведено 3-тю фазу подвійного сліпого дослідження Європейської організації з дослідження та лікування раку (European Organisation for Research and Treatment of Cancer — EORTC) 1325 / KEYNOTE-054, метою якого була оцінка ефективності застосування пембролізумабу в ад’ювантному режимі протягом 12 міс порівняно з плацебо у пацієнтів з резектованою меланомою III стадії високого ризику. При медіані спостереження 15 міс застосування пембролізумабу в ад’ювантному режимі суттєво підвищило ВБР порівняно з плацебо (КР 0,57; 98,4% ДІ 0,43–0,74; p <0,0001) [7]. Ця користь зберігалася при подальшій медіані спостереження 3 та 3,5 року (КР 0,59; 95% ДІ 0,49–0,70). Крім того, застосування пембролізумабу значно підвищило ВБВМ (КР 0,60; 95% ДІ 0,49–0,73; p <0,0001) [8–9]. Також встановлені довгострокові переваги щодо показників ВБР та ВБВМ протягом 5 років спостереження [10]. У цьому дослідженні наводяться результати 7-річного аналізу, який базується на розширеному подальшому спостереженні за результатами дослідження EORTC 1325 / KN-054.
Методи
Дизайн дослідження
У рандомізованому подвійному сліпому плацебо-контрольованому клінічному дослідженні 3-ї фази EORTC 1325 / KEYNOTE-054 хворих рандомізовано у співвідношенні 1:1 у групу отримання внутрішньовенної інфузії в дозі 200 мг пембролізумабу або у групу прийому плацебо у тій же дозі кожні 3 тиж. Лікування продовжували до моменту, поки пацієнт не отримав 18 доз препарату (тривалість лікування становила близько 1 року) або до розвитку рецидиву захворювання, або до появи ознак неприйнятної токсичності. Якщо у пацієнта, який приймав плацебо, виникав рецидив без метастазів у головний мозок, йому дозволялося отримувати перехресне лікування. Особи, що отримували пембролізумаб і у яких рецидив стався більш ніж через 6 міс після завершення року терапії, могли знову розпочати лікування. Дослідження проводилося згідно з Гельсінською декларацією та нормами належної клінічної практики (Good Clinical Practice — GCP), встановленими Міжнародною конференцією з гармонізації (International Conference for Harmonisation — ICH).
Пацієнти
У дослідження залучено пацієнтів віком від 18 років із гістологічно підтвердженою меланомою шкіри з метастазами в регіонарні лімфатичні вузли. Повну регіонарну лімфаденектомію необхідно було виконати не пізніше ніж за 13 тиж до початку лікування. Хворі мали відповідати критеріям IIIA стадії меланоми з принаймні одним мікрометастазом розміром >1 мм у найбільшому діаметрі або стадії IIIB–C без наявності транзиторних метастазів згідно з класифікацією Американського об’єднаного комітету з раку (American Joint Committee on Cancer — AJCC) 2009 р., 7-ме видання [20].
Функціональний статус пацієнтів за шкалою Східної кооперативної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) мав бути 0 або 1. До критеріїв залучення належали: наявність автоімунних захворювань, неконтрольованих інфекцій, застосування системних кортикостероїдів і попереднє проведення системної терапії для лікування меланоми. Зразки пухлини з уражених меланомою лімфатичних вузлів були направлені на центральну патологічну оцінку експресії PD-L1 за допомогою імуногістохімічного методу (антитіло 22C3), причому позитивною вважалася експресія PD-L1 при забарвленні більш ніж 1% пухлинних клітин [7]. Усі пацієнти надали письмову інформовану згоду.
Процедура рандомізації
Централізована реєстрація пацієнтів проводилася в штаб-квартирі EORTC. Рандомізацію стратифіковано за стадіями AJCC 7 (стадії IIIA–C з 1–3 ураженими вузлами, стадія IIIC з >3 ураженими вузлами) та за регіонами. Лише фармацевти мали доступ до інформації про призначене лікування, тоді як дослідники, пацієнти і ті, хто займався збором чи аналізом даних, не були обізнані про це. У разі рецидиву або розвитку серйозного побічного ефекту (ПЕ) інформацію про лікування хворого можна було розкрити на запит дослідника.
Процедури
Комп’ютерну, магнітно-резонансну томографію або обидва ці методи проводили кожні 12 тиж протягом перших 2 років, потім кожні 6 міс до 5-го року і далі щорічно. Після локорегіонарного рецидиву регулярні оцінки стану захворювання мали виконуватися до розвитку віддалених метастазів за тією ж схемою. Рецидив або метастатичні ураження необхідно було підтвердити гістологічно, коли це було можливо. Після виникнення віддалених метастазів пацієнти продовжували спостерігатися або відповідно до протоколу (якщо вони отримували перехресне лікування або повторну терапію), або згідно з місцевими стандартами.
Результати
Основною кінцевою точкою дослідження була ВБР в усій популяції та в підгрупі пацієнтів з пухлинами, що експресують PD-L1. Другорядними кінцевими точками були ВБВМ та ЗВ, а дослідницькою — ВБП2 у цих 2 популяціях. ВБР визначали як час від рандомізації до 1-го рецидиву (локальних, регіонарних або віддалених метастазів) чи смерті з будь-якої причини. ВБВМ визначали як час від рандомізації до 1-ї появи віддаленого метастазу або смерті з будь-якої причини. ВБП2 визначали як час від рандомізації до першої з таких подій: 1) прогресування нерезектабельного рецидиву відповідно до критеріїв RECIST 1.1; 2) рецидив захворювання після 1-го резектабельного рецидиву; або 3) смерть. Якщо у пацієнтів не відмічено негативних подій, їх спостереження припиняли на дату останньої оцінки захворювання, проведеної згідно з протоколом.
Статистичний аналіз
Детальну інформацію щодо розрахунку розміру вибірки представлено в публікації з результатами первинного аналізу [7]. Раніше в дослідженні проаналізовано перевагу пембролізумабу порівняно з плацебо щодо ВБР та ВБВМ як у загальній популяції, так і в підгрупі пацієнтів із пухлинами, які експресують PD-L1 [7, 9]. Дані щодо безпеки, впливу лікування та якості життя опубліковані раніше [7, 21]. Кінцевою датою збору даних для цього аналізу було 3 січня 2024 р. Станом на цей час померло 286 пацієнтів. Аналіз ЗВ запланований після 380 смертей або через 10 років після рандомізації останнього пацієнта (листопад 2026 р.) залежно від того, що станеться раніше. У цьому звіті представлені оновлені результати оцінки всіх кінцевих точок ефективності, за винятком загальної виживаності (ЗВ).
Часові кінцеві точки оцінювали за методом Каплана — Меєра, а ДІ для оцінок на 5 і 7 років розраховували за формулою Грінвуда з використанням логарифмічного перетворення (-log). Для оцінки відношення ризиків лікування та його 95% ДІ використовували модель пропорційних ризиків Кокса, стратифіковану за стадією на момент рандомізації, з використанням методу Вальда. Для оцінки відношення ризиків лікування в підгрупах, а також для проведення тесту на взаємодію використовувалася нестратифікована модель Кокса з урахуванням ефекту від терапії, відповідної змінної та інтерактивного терміну.
Аналізи виконувалися за допомогою програмного забезпечення SAS версії 9.4 (SAS Institute, Cary, North Carolina).
Результати
Із серпня 2015 р. до листопада 2016 р. в 123 медичних центрах 23 країн рандомізовано 1019 пацієнтів. З них 514 осіб отримували пембролізумаб, а 505 — плацебо. Початкові характеристики пацієнтів були подібними в обох групах, як наведено раніше [7]. Медіана спостереження для обох груп становила 6,9 року.
ВБР
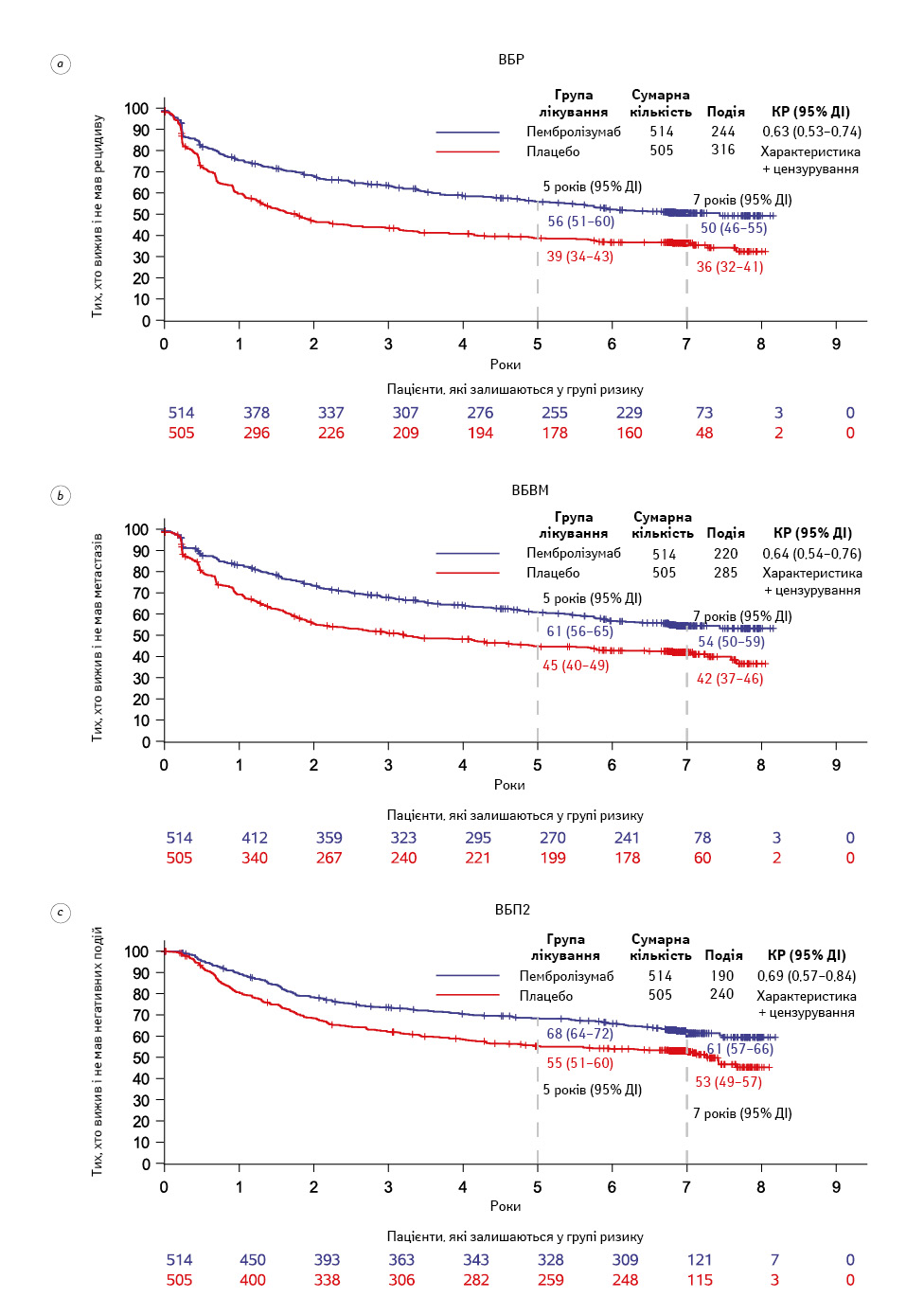
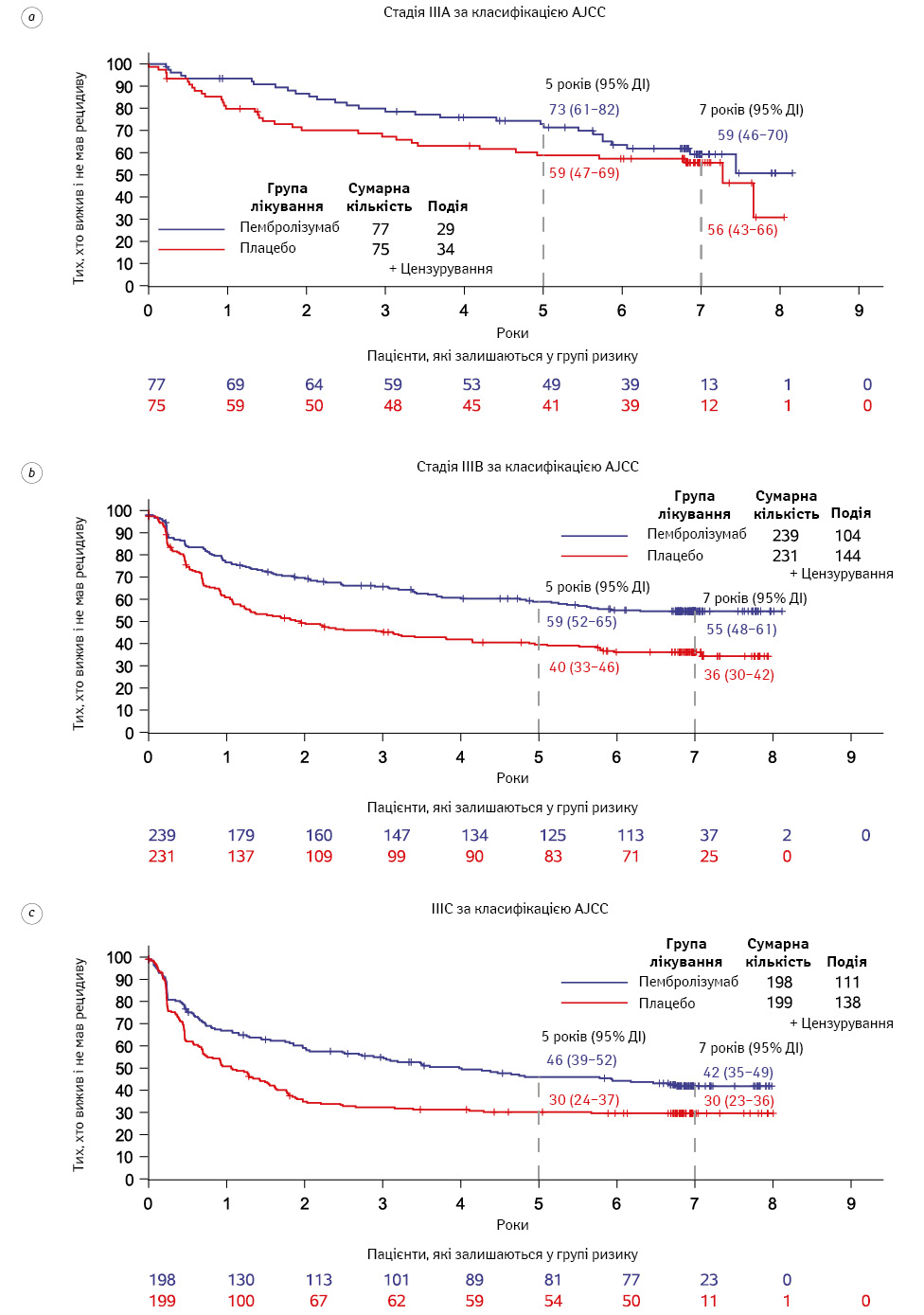
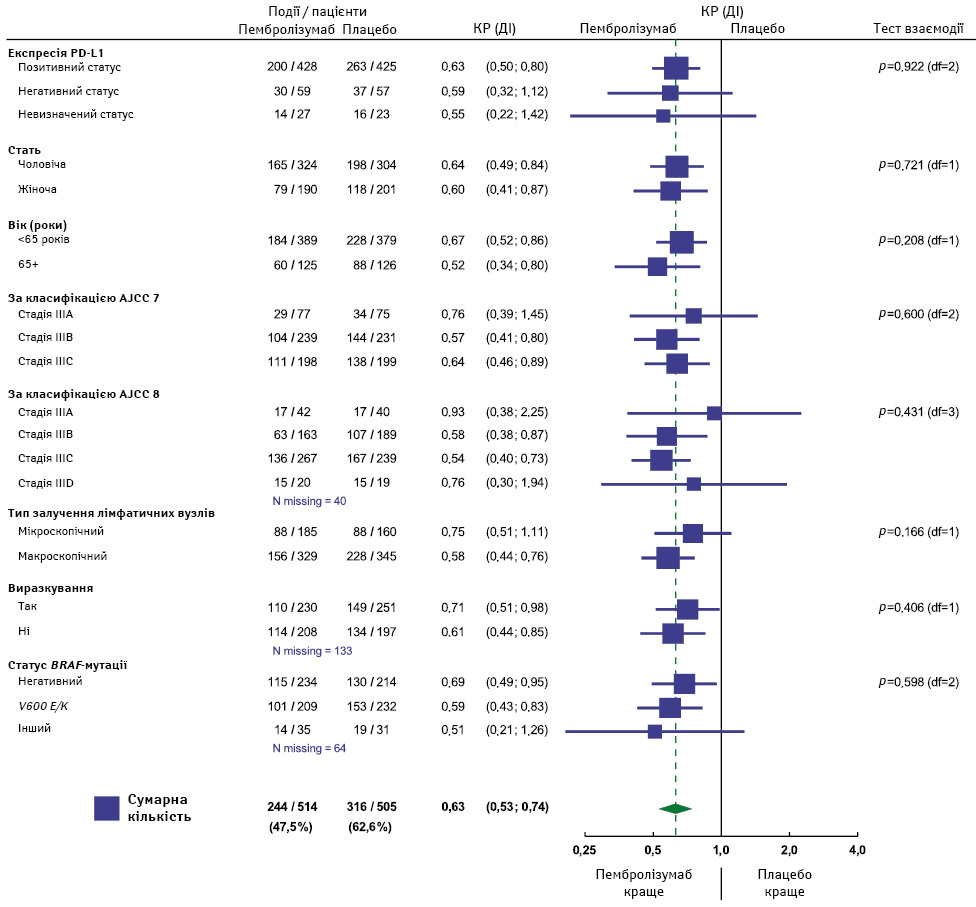
ВБР була значно тривалішою в групі пембролізумабу порівняно з групою плацебо (КР 0,63; 95% ДІ 0,53–0,74) (рис. 1a). Через 7 років 50% усіх пацієнтів (95% ДІ 46–55%) у групі пембролізумабу не мали рецидиву, тоді як у групі плацебо цей показник становив 36% (95% ДІ 32–41%). Лікування виявило позитивний ефект як при локорегіонарних рецидивах, так і віддалених метастазах (таблиця). Тести взаємодії не виявили різниці у впливі лікування на різні підгрупи пацієнтів (рис. 2). Ефект лікування був схожим як у пацієнтів із PD-L1-позитивними, так і PD-L1-негативними пухлинами (рис. 2). Відношення ризиків для стадій IIIA–C згідно з класифікацією AJCC 7 становило 0,76 (95% ДІ 0,39–1,45), 0,57 (95% ДІ 0,41–0,80) та 0,64 (95% ДІ 0,46–0,89) відповідно. Дані щодо ВБР за групами лікування та класифікацією AJCC 7 наведені на рис. 3.
| Пембролізумаб (n=514) n (%) | Плацебо (n=505) n (%) | |
| Статус ВБР | ||
| Жодної події | 270 (52,5) | 189 (37,4) |
| Локорегіональний рецидив | 76 (14,8) | 96 (19,0) |
| Віддалені метастази | 142 (27,6) | 182 (36,0) |
| Обидва діагнози встановлюються протягом 30 днів один від одного | 10 (1,9) | 32 (6,3) |
| Смерть унаслідок меланоми, про рецидиви не повідомлялося | 3 (0,6) | 0 (0,0) |
| Смерть з інших причин, не пов’язаних з меланомою, або з невідомих причин | 13 (2,5) | 6 (1,2) |
| Статус ВБВМ | ||
| Жодної події | 294 (57,2) | 220 (43,6) |
| Віддалені метастази | 199 (38,7) | 276 (54,7) |
| Лімфатичний вузол | 67 (13,0) | 92 (18,2) |
| Легені | 73 (14,2) | 111 (22,0) |
| Печінка | 41 (8,0) | 58 (11,5) |
| Кістка | 21 (4,1) | 36 (7,1) |
| Головний мозок | 31 (6,0) | 39 (7,7) |
| Шкіра | 12 (2,3) | 23 (4,6) |
| Інші м’які тканини | 27 (5,3) | 43 (8,5) |
| Інший орган | 24 (4,7) | 42 (8,3) |
| Смерть унаслідок меланоми, про рецидиви не повідомлялося | 7 (1,4) | 2 (0,4) |
| Смерть з інших причин, не пов’язаних з меланомою, або з невідомих причин | 14 (2,7) | 7 (1,4) |
| ВБП2 | ||
| Жодної події | 324 (63,0) | 265 (52,5) |
| Подія | 190 (37,0) | 240 (47,5) |
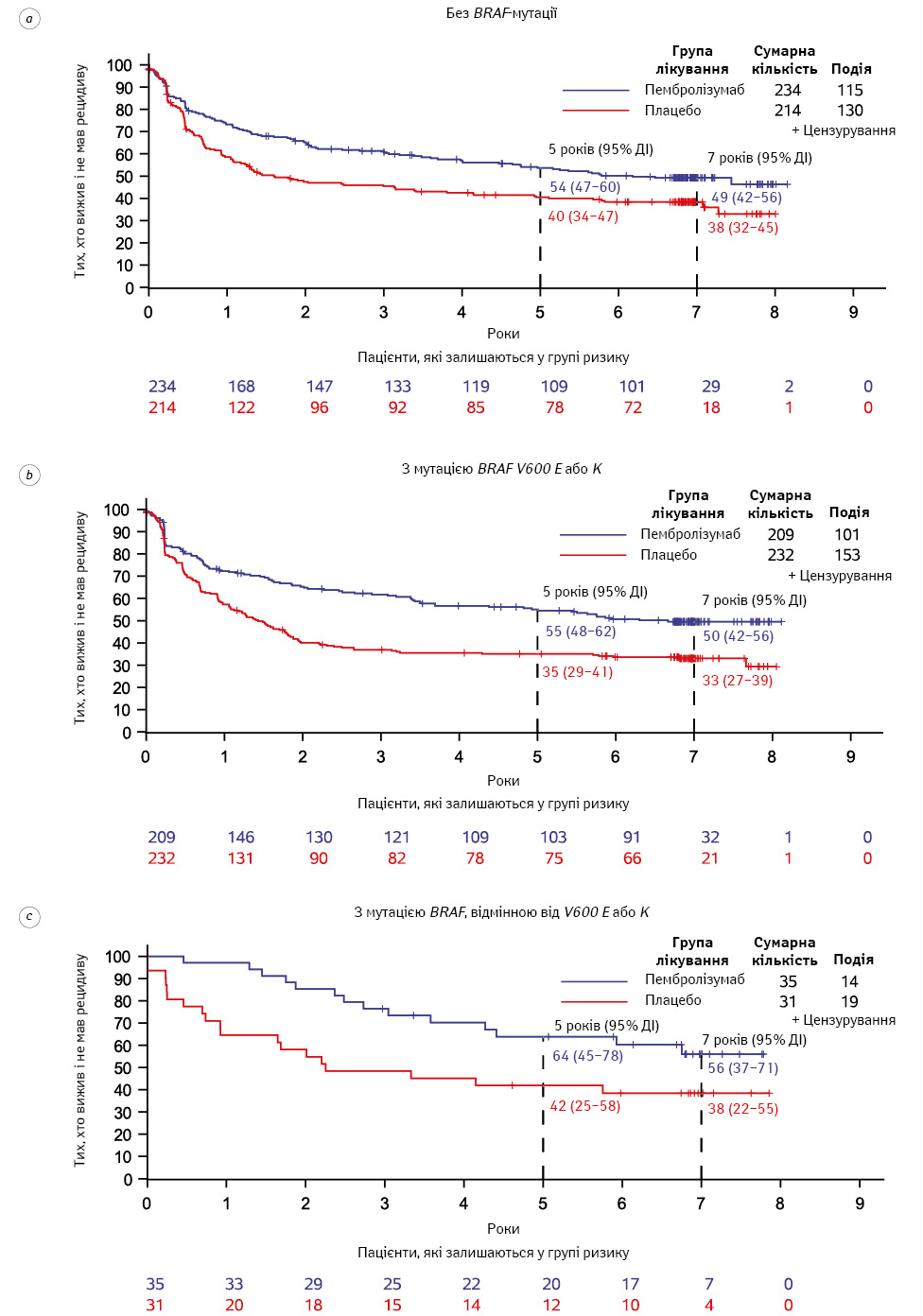
У пацієнтів із мутацією BRAF–V600 відсоток пацієнтів, які залишилися живими та без рецидиву через 7 років, становив 50% (95% ДІ 42–56%) у групі пембролізумабу та 33% (95% ДІ 27–39%) у групі плацебо (КР 0,59; 99% ДІ 0,43–0,83) (рис. 2, 4).
ВБВМ
Серед пацієнтів з ізольованим локорегіонарним рецидивом терапію анти-PD-1 або анти-PD-L1 призначали за відсутності віддалених метастазів у 19 (25%) із 76 пацієнтів у групі пембролізумабу та у 70 (73%) із 96 хворих у групі плацебо. ВБВМ була вищою у групі пембролізумабу, ніж у групі плацебо (відношення ризиків (hazard ratio — HR) 0,64, 95% ДІ 0,54–0,76) (рис. 1b). Через 7 років ВБВМ становила 54% (95% ДІ 50–59%) у групі пембролізумабу та 42% (95% ДІ 37–46%) у групі плацебо. За допомогою тестів взаємодії не виявлено різниці ефекту лікування між різними підгрупами пацієнтів.
ВБП2
Серед пацієнтів із рецидивами терапію анти-PD-1 або анти-PD-L1 призначали за відсутності прогресування або повторного рецидиву у 64 (28%) із 228 осіб у групі пембролізумабу та у 200 (65%) із 310 у групі плацебо. ВБП2 була вищою у групі пембролізумабу, ніж у групі плацебо (КР 0,69; 95% ДІ 0,57–0,84) (рис. 1c). Через 7 років ВБП2 становила 61% (95% ДІ 57–66%) у групі пембролізумабу та 53% (95% ДІ 49–57%) у групі плацебо відповідно. За допомогою тестів на взаємодію не виявлено гетерогенності ефекту лікування в різних підгрупах.
Обговорення
У 7-річному аналізі дослідження EORTC1325 / KEYNOTE-054 виявлено, що 12-місячне ад’ювантне лікування пембролізумабом порівняно з плацебо забезпечує тривалу користь як за первинною кінцевою точкою (ВБР), так і за вторинною (ВБВМ) у пацієнтів із резектованою меланомою стадії III групи високого ризику. КР у цьому дослідженні для ВБР становив 0,63 та для ВБВМ — 0,64 відповідно, тобто був дещо вищим, ніж у попередніх оцінках, проведених через 3,5 (ці показники становили 0,59 і 0,60 відповідно) та 5 років (КР для ВБР становив 0,61 і для ВБВМ — 0,62 відповідно) [9, 10]. Через 7 років різниця в показниках ВБР між групами становила близько 14% (50% для пембролізумабу проти 36% для плацебо), а для ВБВМ — 12% (54% для пембролізумабу проти 42% для плацебо). Ці відмінності були дещо менші, ніж через 5 років, коли вони становили 17% для ВБР і 16% для ВБВМ відповідно.
Варто відмітити, що на порівняння показників ВБВМ між групами могло вплинути те, що анти-PD-1 / PD-L1 терапію після рецидиву частіше призначали в групі плацебо (73%), ніж у групі пембролізумабу (25%). Застосування пембролізумабу виявило стабільну користь у всіх підгрупах пацієнтів (рис. 2–3) незалежно від класифікацій AJCC 7–8 [20], що узгоджується з попередніми звітами [7–10, 23]. Подібний ефект зафіксовано в дослідженні KN-716, в якому при спостереженні протягом 39 міс лікування пембролізумабом значно підвищувало ВБР (КР 0,62) та ВБВМ (КР 0,59) у пацієнтів зі стадіями IIB–C (з негативною біопсією сигнальних лімфатичних вузлів), де порівнювали 1 рік ад’ювантної терапії пембролізумабом із плацебо [18]. Це свідчить про те, що особи з мінімальною залишковою пухлиною отримують однакову користь незалежно від статусу сигнальних лімфатичних вузлів. Крім того, ефект лікування був подібним у хворих із PD-L1-позитивними та PD-L1-негативними пухлинами. У нещодавньому ретроспективному дослідженні підтверджено ефективність і безпеку анти-PD-1 терапії у педіатричних пацієнтів [24].
У хворих із меланомою з мутацією BRAF V600 E/K ад’ювантна терапія пембролізумабом показала перевагу у 7-річному показнику ВБР, який становив приблизно 17% (50% для пембролізумабу проти 33% для плацебо), що подібно до даних дослідження COMBI-AD у тій самій популяції пацієнтів, в якій ця різниця становила 16% (51% у групі пембролізумабу проти 35% у групі плацебо) [14]. Однак у дослідженні COMBI-AD не проведено оцінки ВБВМ після 1-го рецидиву або розвитку нової меланоми [14], тому порівнювати результати ВБВМ між цими двома дослідженнями неможливо [25].
Різниця у 7-річному показнику ВБП2 між групами становила близько 8% (61% для пембролізумабу проти 53% для плацебо), що менше порівняно з 14% різницею, зафіксованою для ВБР. Лікування після рецидиву могло вплинути на різницю між ВБР і ВБП2. Серед пацієнтів, у яких стався рецидив, анти-PD-1 / анти-PD-L1 терапію призначали 28% усіх пацієнтів у групі пембролізумабу та 65% у групі плацебо. Водночас комбінацію інгібіторів BRAF і MEK частіше застосовували після 1-го рецидиву в групі пембролізумабу (19 проти 10%). У нещодавньому обсерваційному дослідженні встановлено, що комбінація інгібіторів BRAF і MEK подовжує час до розвитку наступного рецидиву у пацієнтів із локорегіонарним рецидивом [26], а перевага такої комбінації при метастазах добре відома [27, 28]. Системну терапію після рецидиву застосовували у 54% усіх пацієнтів у групі пембролізумабу та 72% у групі плацебо.
Варто зазначити, що вплив пембролізумабу на показники якості життя, пов’язані зі здоров’ям (Health-related quality of life — HRQoL), у дослідженні EORTC1325 / KEYNOTE-054 був мінімальним як у короткостроковій, так і в довгостроковій перспективі, як було нещодавно опубліковано [21, 29]. Перспективним новим напрямом у покращенні ад’ювантної терапії є поєднання пембролізумабу з мРНК-вакциною V940 після операції. У результатах рандомізованого дослідження фази IIb за участю 157 пацієнтів зафіксоване перспективне підвищення ВБР (КР 0,56) при такій комбінації порівняно з монотерапією пембролізумабом [30].
Крім того, ландшафт ад’ювантної терапії макроскопічної меланоми III стадії значно змінюється завдяки результатам дослідження SWOG1801, яке вивчало періопераційне застосування пембролізумабу (перші 3 дози препарату призначали перед операцією, потім проводилася операція та решту 15 доз застосовували післяопераційно). У цьому дослідженні встановлено підвищення виживаності без подій (КР 0,58) порівняно із застосуванням лише післяопераційної терапії пембролізумабом [31].
Ще більш вражаючі результати отримано під час застосування 2 циклів іпілімумабу та ніволумабу до операції з подальшою операцією і ад’ювантною терапією ніволумабом. Цей підхід виявив значне підвищення виживаності без подій (КР 0,32) у дослідженні NADINA порівняно з післяопераційною терапією ніволумабом протягом 1 року [32]. Це вказує на те, що неоад’ювантні та періопераційні стратегії готові до широкого впровадження в лікуванні меланоми III стадії [33, 34].
У підсумку за допомогою 7-річного аналізу ад’ювантної терапії пембролізумабом встановлено стійке підвищення ВБР, ВБВМ і ВБП2 порівняно з плацебо у пацієнтів із резектованою меланомою III стадії. Зважаючи на поточну кількість летальних наслідків, очікується, що 380 смертей не буде зафіксовано до листопада 2026 р., тому клінічна кінцева точка для аналізу ЗВ буде доступна через 10 років після рандомізації останнього пацієнта, тобто в листопаді 2026 р.
Адаптований переклад за Eggermont, A. M. M., Kicinski, M., Blank, C. U., Mandala, M., Long, G. V., Atkinson, V., … Robert, C. (2024). Seven-year analysis of adjuvant pembrolizumab versus placebo in stage III melanoma in the EORTC1325 / KEYNOTE-054 trial. European Journal of Cancer, 211, 114327. doi.org/10.1016/j.ejca.2024.114327.
Стаття друкується у скороченому вигляді.
Список використаної літератури знаходиться в редакції.
Ірина Неміш














Leave a comment