Рідкісна форма метастазування нирково-клітинного раку в малу слинну залозу: клінічний випадок
Антонів Р.Р.1, Костишин І.Д.1, Гірна Г.А.1, Бойко В.В. 2, Михайлюк П.І.1, Писар А.М.1, Семенів І.П.2
- 1Івано-Франківський національний медичний університет, Україна
- 2Комунальне некомерційне підприємство «Прикарпатський клінічний онкологічний центр Івано-Франківської обласної ради», Україна
Резюме. Актуальність. Нирково-клітинний рак (НКР) входить до 10 найпоширеніших онкологічних захворювань в Україні. Особливості перебігу цієї онкопатології ускладнюють її діагностику на ранніх стадіях. Мета. Навести клінічний випадок захворювання на метастатичний НКР (мНКР) із вторинним ураженням слинної залози (СЗ) твердого піднебіння. Матеріали та методи дослідження. Розглянуто клінічний випадок, проаналізовано дані діагностичних досліджень, оцінено ефективність лікувальних заходів. Результати. Пацієнти із пухлинами орофарингеальної ділянки потребують комплексного клінічного обстеження з метою виключення метастатичного характеру новоутворень цієї локалізації. Хірургічне висічення пухлинного вогнища рідкісних локалізацій є важливим діагностично-лікувальним засобом. З одного боку, отримуємо верифікацію процесу, у цьому випадку метастатичного, що дає додаткову інформацію про його стадіювання, з іншого — становить частину етапу циторедуктивного лікування. Зважаючи на вкрай низьку ймовірність метастазування НКР у малу СЗ ротової порожнини виникають певні труднощі при гістологічному дослідженні операційного матеріалу в подібних випадках. Важливу роль у верифікації новоутворень орофарингеальної ділянки відіграє обов’язкове проведення імуногістохімічного дослідження. Висновки. Метастатичне ураження СЗ — рідкісна форма маніфестації НКР. Рутинне патогістологічне дослідження не завжди може вказати на правильний діагноз. Проведення імуногістохімічного аналізу дозволяє оптимізувати діагностичний алгоритм при метастатичному ураженні СЗ. Комбіноване лікування високодиференційованого олігометастатичного НКР, що включає проведення циторедуктивної нефректомії та метастазектомії солітарного вогнища з наступною системною терапією, дає обнадійливі результати щодо загальної та канцер-специфічної виживаності у молодих пацієнтів. Важливе значення для своєчасної діагностики та підвищення ефективності лікування нетривіальних форм метастазування новоутворень нирки мають мультидисциплінарний підхід та тісна співпраця лікувальної та діагностичної ланок високоспеціалізованої онкологічної допомоги.
Одержано 20.11.2024
Прийнято до друку 27.11.2024
DOI: 10.32471/clinicaloncology.2663-466X.56-4.33655
ВСТУП
Метастатичне ураження малих СЗ ротової порожнини — рідкісний стан, який найчастіше пов’язаний зі злоякісними новоутвореннями голови й шиї. Рак молочної залози, легень, передміхурової залози, нирок також має потенціал щодо ураження СЗ, однак випадки носять казуїстичний характер. Серед СЗ найчастіше уражується привушна СЗ, рідше — піднижньощелепна та під’язикова. Близько 0,1% усіх метастатичних уражень СЗ пов’язані з раком нирки. За даними наукової літератури, повідомляють про 83 опубліковані випадки мНКР із вторинним ураженням СЗ із 1965 р. [1–2].
НКР в Україні за поширеністю посідає 7-ме та 9-те місця серед чоловіків та жінок відповідно. Щорічно виявляється близько 4 тис. нових випадків НКР, з них 24% — на IV стадії. Близько 20% усіх хворих помирає протягом 1 року з моменту діагностики [3]. Найчастішими локалізаціями вторинних вогнищ є печінка, легені, кістки, наднирники, головний мозок, підшлункова залоза [4]. Метастази НКР уражують органи голови та шиї у 13–15% спостережень, найчастіше повідомляють про вторинне ураження привушної залози. Існують певні складнощі в гістологічній верифікації рідкісних пухлин під час світлової мікроскопії біопсійного матеріалу. У таких випадках встановлення діагнозу часто можливе тільки після проведення імуногістохімічного дослідження [5–7].
Мета дослідження: продемонструвати випадок захворювання на мНКР із вторинним ураженням малої СЗ, звернути увагу на роль мультидисциплінарного підходу для лікування цієї онкопатології.
ПРЕЗЕНТАЦІЯ КЛІНІЧНОГО ВИПАДКУ
Хворий А., 34 роки, звернувся до Прикарпатського клінічного онкологічного центру Івано-Франківської обласної ради (далі — Прикарпатський онкоцентр) у грудні 2022 р. зі скаргами на наявність утворення на піднебінні, яке викликає дискомфорт при вживанні їжі, ковтанні. При огляді виявлено: на межі твердого та м’якого піднебіння новоутворення розміром 1,5×1,0 см червоного кольору із «часточковою» будовою та фестончастими краями, при пальпації — еластичної консистенції, неболісне (рис. 1). Проведено біопсію. При гістологічному дослідженні — капілярна гемангіома. При ультразвуковому дослідженні виявлено: у нижній частині лівої нирки гетерогенне об’ємне утворення розміром 53×43×49 мм, а також ознаки гепатиту, хронічних холециститу та пієлонефриту. При проведенні клініко-лабораторних досліджень відхилень не виявлено.
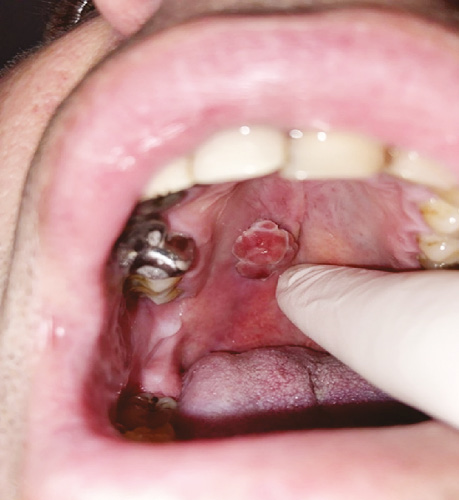
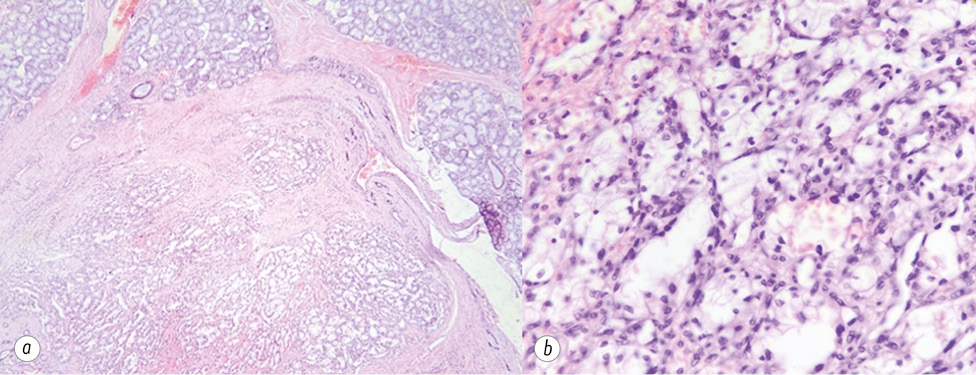
В умовах хірургічного відділення Прикарпатського онкоцентру проведено електрохірургічне висічення утвору слизової оболонки твердого піднебіння. При проведенні оперативного втручання відмічено інтенсивну кровоточивість тканин. Крововтрата близько 150 мл. При проведенні післяопераційного патогістологічного дослідження виявлено: в гістопрепараті фрагмент СЗ з утворенням солідної та світлоклітинно-тубулярної будови, запальною інфільтрацією. Гістологічна картина може відповідати мономорфній аденомі СЗ.
З метою уточнення патологічного процесу матеріал спрямований на імуногістохімічне дослідження. У висновку цього дослідження вказано, що імунофенотип пухлини відповідає метастазу світлоклітинного раку нирки у СЗ (рис. 2).
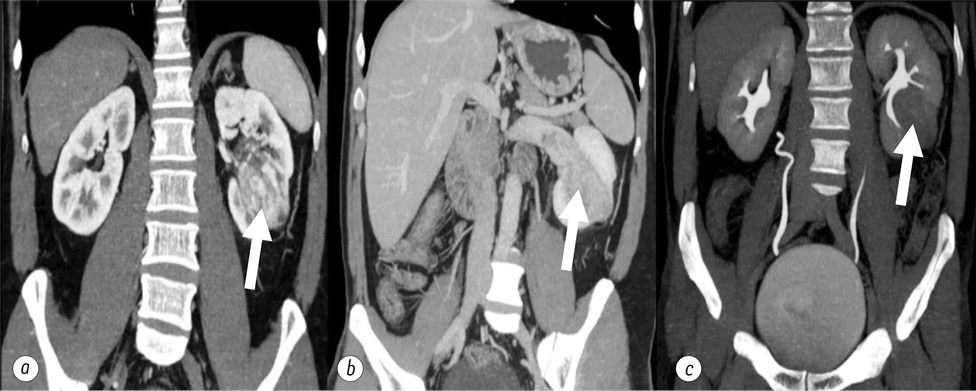
При подальшому обстеженні проведено комп’ютерну томографію із внутрішньовенним контрастуванням — картина неопластичного утворення лівої нирки з інвазією чашково-мискової системи та основного стовбура лівої ниркової вени та формуванням пухлинного тромбу (рис. 3). Збільшених, структурно змінених лімфатичних вузлів не виявлено. Одиничне вогнище в сегменті ІІ печінки надто дрібне для диференціації — потребує динамічного спостереження. Остеолітична ділянка в тілі хребця Th1. Помірна гепатомегалія.
З метою виключення вторинного ураження кісток скелета проведена остеосцинтиграфія. Даних на користь вторинного ураження не виявлено.
При обговоренні клінічного випадку на засіданні мультидисциплінарної комісії рекомендовано хірургічне лікування. У лютому 2023 р. в умовах Прикарпатського онкоцентру проведено хірургічне втручання в об’ємі циторедуктивної нефректомії зліва.
При дослідженні макропрепарату виявлено пухлину розміром <5 см у нижньому полюсі лівої нирки в межах фіброзної капсули нирки, на розрізі — жовтого кольору. У нирковій вені зафіксовано пухлинний тромб. При патогістологічному дослідженні: НКР, світлоклітинний тип, G1 за Фурманом без некрозу. Інвазія в судини, крововиливи, вогнищева інвазія в капсулу нирки без проростання в жирову паранефральну клітковину.
Післяопераційний період проходив без ускладнень. Хворого виписано зі стаціонару на 7-му добу після хірургічного втручання в задовільному стані.
Заключний клінічний діагноз: рак лівої нирки pT3a cN0 pM1 (мала СЗ твердого піднебіння), стадія IV. Стан після хірургічного лікування (видалення утвору твердого піднебіння та циторедуктивної нефректомії), клінічна група ІІ.
Рішенням мультидисциплінарної комісії пацієнту рекомендована ад’ювантна таргетна терапія сунітинібом, яку розпочато у квітні 2023 р. за стандартною схемою.
При проведенні комп’ютерної томографії в січні 2024 р. відмічено: в лівій частці печінки у проєкції S2 ділянка гіподенсії розміром <5 мм, занадто мала для диференціації. Інших ознак на користь продовження хвороби не виявлено. Хворого спрямовано на виконання магнітно-резонансної томографії, за допомогою якої не виявлено переконливих даних на користь об’ємних утворень печінки.
Хворий продовжував терапію сунітинібом до червня 2024 р., коли з власного бажання припинив лікування. Прибув для планового обстеження в листопаді 2024 р. в задовільному стані без будь-яких скарг та змін при фізикальному обстеженні. Лабораторні показники в межах норми. За даними контрольної комп’ютерної томографії з контрастуванням голови, органів грудної клітки, черевної порожнини й таза в листопаді 2024 р. ознак на користь рецидиву онкопатології не виявлено. Структурно змінених лімфатичних вузлів у зоні сканування, ознак вторинного ураження головного мозку, паренхіми печінки та кісток не зафіксовано. Одиничне вогнище в ІІ сегменті печінки без виражених змін у динаміці. Остеолітична ділянка в тілі хребця Th1 в динаміці без виражених змін, відповідає дегенеративним змінам. Порівняно із комп’ютерною томографією від липня 2023 р. — рентгенологічна картина стабільна.
РЕЗУЛЬТАТИ ТА ОБГОВОРЕННЯ
Відомо, що клінічні прояви НКР виникають доволі пізно. Молодий вік пацієнта, задовільний загальносоматичний стан, відсутність супутніх захворювань — фактори, які спричиняють пізню діагностику пухлини нирки. Маніфестація мНКР із ураження малої СЗ твердого піднебіння — надзвичайно рідкісна клінічна ситуація. У розглянутому нами випадку виявлені зміни ротової порожнини були ключовим фактором в діагностиці онкопатології нирки. Окрім того, це дало можливість провести максимальну хірургічну циторедукцію НКР, що само собою знижує ризик прогресування захворювання та підвищує загальну виживаність при цій патології. Згідно з рекомендаціями Європейської асоціації урологів (European Association of Urology — EAU), хворим із олігометастатичним НКР рекомендоване виконання «негайної» циторедуктивної нефректомії з повною метастазектомією. Таке лікування у осіб з мНКР за даними клінічних досліджень дозволяє досягти найвищих результатів загальної виживаності [8, 9]. Підбір пацієнта для хірургічного лікування ґрунтується на прогностичних моделях для хворих на мНКР, які включають клінічні, лабораторні, гістологічні фактори ризику. Розроблено значну кількість прогностичних шкал для оцінки ризику несприятливого перебігу мНКР, однак найчастіше використовують моделі, розроблені Меморіальним онкологічним центром імені Слоуна — Кеттерінга (Memorial Sloan Kettering Cancer Center)та Міжнародним консорціумом з метастатичного раку нирки (International Metastatic Renal Cancer Database Consortium — IMDC) [10]. Обидві моделі знаходять практичне застосування при плануванні циторедуктивної нефректомії та виборі оптимальної системної терапії у хворих на мНКР. Проте модель, що запропонована IMDC, використовується у більшості сучасних рандомізованих дослідженнях та вважається кращою для клінічної практики. Оцінка ризику для хворих на мНКР, згідно з IMDC, ґрунтується на функціональному статусі пацієнта, визначеному за шкалою Карновського, інтервалом між діагностикою НКР та початком системної терапії, рівні гемоглобіну, скоригованого кальцію, кількості нейтрофілів та тромбоцитів. У разі відсутності жодного із вказаних факторів хворого відносять до групи сприятливого ризику, за умови наявності 1–2 факторів — проміжного ризику, а при виявленні 3–6 факторів — до групи підвищеного ризику [11].
При оцінці пацієнта з нашого клінічного випадку за прогностичною шкалою IMDC виявлено тільки 1 фактор ризику — час від діагностики до системного лікування <1 року, що вказує на проміжний ризик несприятливого перебігу захворювання.
Очікувана медіана загальної виживаності для хворих проміжного ризику за шкалою IMDC становить 22,5 міс [12]. Однак існують повідомлення про досягнення медіани загальної виживаності в 98,3 міс за умови проведення повної метастазектомії у хворих на мНКР [13]. Опубліковано низку досліджень, що демонструють результати проведення метастазектомії при вторинному ураженні різних локалізацій, однак дані про лікування хворих із метастатичним ураженням малих СЗ ротової порожнини обмежені [14–15]. Охарактеризований нами пацієнт на час отримання результатів контрольної комп’ютерної томографії прожив без рецидиву онкопатології 21 міс та продовжує спостереження.
ВИСНОВКИ
Метастатичне ураження малих СЗ ротової порожнини — рідкісна форма маніфестації НКР. Рутинне патогістологічне дослідження не завжди може вказати на правильний діагноз. Проведення імуногістохімічного аналізу дозволяє оптимізувати діагностичний алгоритм при метастатичному ураженні малих СЗ.
Комбіноване лікування високодиференційованого олігометастатичного НКР нирки, що передбачає проведення циторедуктивної нефректомії та метастазектомії солітарного вогнища з наступною системною терапією, дає обнадійливі результати щодо загальної та канцер-специфічної виживаності у молодих пацієнтів.
Важливе значення для своєчасної діагностики та підвищення ефективності лікування нетривіальних форм метастазування новоутворень раку нирки мають мультидисциплінарний підхід та тісна співпраця лікувальної та діагностичної ланок високоспеціалізованої онкологічної допомоги.
Додаткова інформація. Автори заявляють про відсутність конфлікту інтересів.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Gupta, S., Alruwaili, K. H. A., Escobedo, R. L. O., Pangarkar, M., Chawla, J. P. S., Sunitha, S., … Yadav, A. B. (2024). Renal cell carcinoma metastasizing to salivary glands: Systematic review. National Journal of Maxillofacial Surgery, 15(1), 3–17. doi.org/10.4103/njms.njms_79_23
2. Majewska, H., Skálová, A., Radecka, K., Stodulski, D., Hyrcza, M., Stankiewicz, C., & Biernat, W. (2016). Renal clear cell carcinoma metastasis to salivary glands — a series of 9 cases: clinico-pathological study. Polish Journal of Pathology, 67(1), 39–45. doi.org/10.5114/pjp.2016.59475.
3. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2024). Рак в Україні, 2022–2023. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. (Vol. 25). Кропивницький: Поліум.
4. Gong, J., Maia, M. C., Dizman, N., Govindarajan, A., & Pal, S. K. (2016). Metastasis in renal cell carcinoma: Biology and implications for therapy. Asian Journal of Urology, 3(4), 286–292. doi.org/10.1016/j.ajur.2016.08.006.
5. McHugh, J. B., Hoschar, A. P., Dvorakova, M., Parwani, A. V., Barnes, E. L., & Seethala, R. R. (2007). p63 immunohistochemistry differentiates salivary gland oncocytoma and oncocytic carcinoma from metastatic renal cell carcinoma. Head and Neck Pathology, 1(2), 123–131. doi.org/10.1007/s12105-007-0031-44.
6. Morita, Y., Kashima, K., Suzuki, M., Kinosada, H., Teramoto, A., Matsumiya, Y., & Uzawa, N. (2021). Differential Diagnosis between Oral Metastasis of Renal Cell Carcinoma and Salivary Gland Cancer. Diagnostics (Basel, Switzerland), 11(3), 506. doi.org/10.3390/diagnostics11030506.
7. Vitruk, I., Voylenko, O., Stakhovskyi, O., Kononenko, O., Pikul, M., Semko, S., … Stakhovsky, E. (2023). Advantages of оrgan-sparing treatment approaches in metastatic kidney cancer. Journal of Cancer Research and Clinical Oncology, 149(7), 3131–3137. https://doi.org/10.1007/s00432-022-04216-6.
8. Fares, A. F., Araujo, D. V., Calsavara, V., Saito, A. O., Formiga, M. N., Dettino, A. A., … Cunha, I. W. (2019). Complete metastasectomy in renal cell carcinoma: a propensity-score matched by the International Metastatic RCC Database Consortium prognostic model. Ecancermedicalscience, 13, 967. doi.org/10.3332/ecancer.2019.967.
9. Studentova, H., Spisarova, M., Kopova, A., Zemankova, A., Melichar, B., & Student, V., Jr. (2023). The Evolving Landscape of Cytoreductive Nephrectomy in Metastatic Renal Cell Carcinoma. Cancers, 15(15), 3855. doi.org/10.3390/cancers15153855.
10. Sun, M., Shariat, S. F., Cheng, C., Ficarra, V., Murai, M., Oudard, S., … Karakiewicz, P. I. (2011). Prognostic factors and predictive models in renal cell carcinoma: a contemporary review. European Urology, 60(4), 644–661. doi.org/10.1016/j.eururo.2011.06.041.
11. Heng, D. Y., Xie, W., Regan, M. M., Warren, M. A., Golshayan, A. R., Sahi, C., … Choueiri, T. K. (2009). Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. Journal of Clinical Oncology, 27(34), 5794–5799. doi.org/10.1200/JCO.2008.21.4809.
12. Heng, D. Y., Xie, W., Regan, M. M., Harshman, L. C., Bjarnason, G. A., Vaishampayan, U. N., … Choueiri, T. K. (2013). External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. The Lancet. Oncology, 14(2), 141–148. doi.org/10.1016/S1470-2045(12)70559-4.
13. Fares, A. F., Araujo, D. V., Calsavara, V., Saito, A. O., Formiga, M. N., Dettino, A. A., … Cunha, I. W. (2019). Complete metastasectomy in renal cell carcinoma: a propensity-score matched by the International Metastatic RCC Database Consortium prognostic model. Ecancermedicalscience, 13, 967. doi.org/10.3332/ecancer.2 019.967.
14. Jakubowski, C. D., Vertosick, E. A., Untch, B. R., Sjoberg, D., Wei, E., Palmer, F. L., … Russo, P. (2016). Complete metastasectomy for renal cell carcinoma: Comparison of five solid organ sites. Journal of Surgical Oncology, 114(3), 375–379. doi.org/10.1002/jso.24327.
15. Mikhail, M., Chua, K. J., Khizir, L., Tabakin, A., & Singer, E. A. (2022). Role of metastasectomy in the management of renal cell carcinoma. Frontiers in Surgery, 9, 943604. doi.org/10.3389/fsurg.2022.943604.
Адреса для листування:
Антонів Ростислав Ростиславович
76018, Івано-Франківськ, вул. Галицька, 2
Комунальне некомерційне підприємство «Прикарпатський клінічний
онкологічний центр Івано-Франківської обласної ради»
E-mail: r.antoniv@gmail.com
Correspondence:
Rostyslav Antoniv
2 Halytska str., Ivano-Frankivsk, 76018
Ivano-Frankivsk National Medical University
E-mail: r.antoniv@gmail.com














Leave a comment