Вплив індексу пухлинного навантаження печінки на післяопераційні ускладнення та виживаність при метастатичному колоректальному раку
Бурлака А.1, Безверхний В.1, Микитюк А.1, Дупик М.1, Шудрак А.1, Звірич В.1, Земсков С.2, Скиба В.2
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Національний медичний університет ім. О.О. Богомольця, Київ, Україна
Резюме. Вступ. Усе більше зростає інтерес клінічних онкологів стосовно того, яким чином можна здійснити перехід від технічно до біологічно-керованої хірургії колоректального раку (КРР) з метастазами в печінку. Згідно з даними наукової літератури новий спосіб прогнозування результату хірургічного лікування метастазів КРР «tumor burden score» — індекс пухлинного навантаження (ІПН) можна віднести до найточніших. Мета. Визначити можливі кореляційні зв’язки між ІПН, онкологічним прогнозом та післяопераційними ускладненнями оперованих хворих на метастатичні форми КРР на національній популяційній вибірці. Матеріали та методи дослідження. Під час дослідження використано базу даних клініки Державного некомерційного підприємства (ДНП) «Національний інститут раку» для ретроспективного аналізу хворих на КРР, які перенесли резекцію печінки в період з вересня 2002 до березня 2024 р. До обраної когорти залучено 351 хворого, які мали синхронне та метахронне метастатичне ураження печінки (cT1–4N0–2M0–1). ІПН використовували як комбінований показник, що враховує максимальний розмір метастазів та кількість вогнищ, та розраховували, використавши математичну формулу Metro-ticket за K. Sasaki. Результати. Медіана кількості метастатичних уражень становила 5 (1–23), а середній розмір таргетного найбільшого метастатичного вогнища становив 35±1,6 см. Середнє значення ІПН становило 7±0,14. На основі даних кластеризації вирахувано виживаність у когортах з ІПН <3,5; 3,5–10 та >10 відповідно. Медіана в цих когортах становила 69,5, 60,3 та 23,1 міс відповідно та 5-річна загальна виживаність (ЗВ) — 56,3, 49,7 та 7,4% відповідно (р <0,001) Здатність ІПН прогнозувати ЗВ проаналізовано за допомогою ROC-кривої, що продемонструвала високу чутливість із AUC=0,822. За даними багатофакторного аналізу за Коксом, кластери ІПН чинили достовірний негативний вплив на ЗВ, зокрема когорти із ІПН 3,5–10 (відносний ризик (ВР) = 0,43; 95% довірчий інтервал (ДІ) 0,18–0,97; р=0,04) та ІПН ≥10 (ВР=1,4; 95% ДІ 1,31–1,46; р=0,005). Висновки. У цьому дослідженні встановлено, що ІПН може бути застосований до національної популяції хворих на КРР із метастатичною хворобою. Модель має потенціал прогнозування ЗВ та хірургічних ускладнень.
Одержано 4.11.2024
Прийнято до друку 12.11.2024
DOI: 10.32471/clinicaloncology.2663-466X.56-4.33480
ВСТУП
КРР є одним з найпоширеніших видів онкопатології і 2-ю основною причиною смерті від раку в усьому світі та в Україні [1]. На момент встановлення діагнозу близько 30% усіх пацієнтів з КРР мають ізольовані синхронні метастази в печінку та у близько 50% усіх хворих виявляють метахронні метастази [2]. Лікування при синхронному метастатичному ураженні печінки передбачає проведення індукційної хімієтерапії та симультанні чи двоетапні резекції (ДЕР) [3]. ДЕР можуть реалізовуватися шляхом стратегій liver-first або colon-first залежно від поширеності метастазів у печінку [4]. Важливо розуміти, що хірургічне лікування білобарного метастатичного ураження печінки має відмінності та може реалізуватися через паренхімозберігаючу хірургію, анатомічно-орієнтовані резекції, ДЕР печінки із емболізацією портальної вени і повною чи частковою транссекцією паренхіми з метою «бустеризації» гіпертрофії майбутнього залишку печінки [5]. Також переживає еволюцію хірургічний доступ через все ширшу імплементацію лапароскопічної хірургії печінки, що перевищує 15% у спеціалізованих центрах [6].
Згідно з даними наукової літератури, технічна резектабельність первинної пухлини КРР та радіологічно або клінічно візуалізованих проявів метастатичної хвороби рівнозначна можливості резекції всіх наявних метастазів за умови збереження 25–30% від усього загального об’єму печінки за відсутності супутньої патології печінки та зі збереженням адекватного судинного кровотоку та жовчовиділення [7]. На жаль, у 80% усіх пацієнтів діагностують нерезектабельні форми метастатичного ураження печінки, що спричинене поширенням або метастазуванням у «критичні» сайти [8]. Важливо розуміти, що пацієнти, визначені як технічно нерезектабельні, можуть бути прооперовані в майбутньому за умови, що їх ІПН знизиться на тлі індукційної системної хімієтерапії [9].
Мультидисциплінарне планування лікування метастатичних форм КРР вважається золотим стандартом [10]. Група експертів, що входять до складу мультидисциплінарної команди, розробляють оптимальну тактику неоад’ювантного системного лікування та узгоджують найкращу хірургічну стратегію з урахуванням симптомності первинної пухлини, локалізації метастатичних вогнищ та загальним соматичним статусом хворого [10]. Саме тому оцінка резектабельності наразі залишається переважно технічним рішенням [8]. Упродовж останніх десятиріч запропоновані клініко-біологічні характеристики, що потенційно відображають несприятливу біологію пухлини, для визначення профілів ризику раннього рецидиву та обмеженої ЗВ після місцевого лікування у конкретного пацієнта, такі як Y. Fong та GAME [11–12]. Однак ці шкали ризику мають обмеження, зокрема субоптимальну прогностичну ефективність [13]. Одночасно залишається відкритим питання, чи буде мати резекція онкологічний терапевтичний ефект для кожного окремого хворого. Усе більше зростає інтерес клінічних онкологів стосовно того, яким чином можна здійснити перехід від технічно до біологічно-керованої хірургії [14]. Біологічно-керована хірургія враховує генетичні мутації, відповідь на індукційну системну терапію чи інші клінічні й біологічні параметри та спрямована на відбір пацієнтів для оптимальної стратегії лікування для досягнення довготривалого виживання та одужання [15]. У хворих на КРР з «несприятливою біологією» пухлини клінічна користь від будь-якого хірургічного лікування може бути обмеженою. Онкологічний світ користується парадигмою, де таймінг «наступної хвилі» метастатичної хвороби слугує в якості індикатора «біології пухлини» [16]. Так, особи з раннім рецидивом (у перші 6 міс) мають значно несприятливіший прогноз виживаності порівняно з пізнім (≥6 міс), адже 5-річна ЗВ становить 25,9 та 53,1% для пацієнтів з раннім та пізнім рецидивом відповідно [10]. Згідно з даними наукової літератури новий спосіб прогнозування результату хірургічного лікування метастазів КРР «tumor burden score» — ІПН можна віднести до найточніших [17]. Останній використовується для оцінки перспективи хірургічного лікування первинного новоутворення печінки чи трансплантації печінки [18]. Проте в наявних міжнародних та національних клінічних настановах не враховують ІПН при визначенні тактики лікування КРР [19]. В аналізі публікацій встановлено, що інформативність ІПН в умовах національної онкології майже не досліджена. Тому метою цього дослідження було визначити можливі кореляційні зв’язки між ІПН, онкологічним прогнозом та післяопераційними ускладненнями оперованих хворих на метастатичні форми КРР на національній популяційній вибірці.
МАТЕРІАЛИ ТА МЕТОДИ
Під час дослідження використано базу даних клініки Національного інституту раку для ретроспективного аналізу хворих на КРР, які перенесли резекцію печінки в період з вересня 2002 до березня 2024 р. (табл. 1).
| Змінна | Кількість пацієнтів, n=351 | |
| n | % | |
| Вік, років | 65,5 (37–84) | |
| Стать (жінки / чоловіки) | 163 / 188 | 46,4 / 53,6 |
| Період лікування (2002–2012 / 2012–2024) | 31 / 320 | 8,8 / 91,2 |
| Правобічно / лівобічно локалізована первинна пухлина | 89 / 262 | 25,4 / 74,6 |
| Унілобарне / білобарне поширення | 27 / 324 | 7,7 / 92,3 |
| Синхронні / метахронні метастази | 201 / 150 | 57,3 / 42,7 |
| Стадія за критерієм ≥Т3 | 115 / 236 | 32,7 / 67,3 |
| Стадія за критерієм N0 / N1-2 / Nx | 130 / 194 / 27 | 37,1 / 55,3 / 7,6 |
| Отримували неоад’ювантну / ад’ювантну хімієтерапію | 216 / 198 | 61,5 / 56,4 |
| Кількість курсів хімієтерапії* | 4 (0–24) | |
| Кількість видалених метастазів* (344) | 5 (1–23) | |
| 1 | 108 | 31,4 |
| 2–5 | 193 | 56,1 |
| 6–10 | 31 | 9,1 |
| 11–15 | 6 | 1,7 |
| >15 | 6 | 1,7 |
| Максимальний розмір метастазів, мм (344)** | 35±1,6 | |
| ІПН** (344) | 7±0,14 | |
| Статус KRAS-мутації, дикий / мутований (201) | 64 / 137 | 31,8 / 68,2 |
| R1 край резекції | 105 / 246 | 29,9 / 70,1 |
| Резекція ≤2 / ≥3 анатомічних сегментів печінки | 240 / 111 | 31,6 / 68,4 |
| Симультанні резекції печінки із первинною пухлиною | 58 | 16,5 |
| Лапароскопічні резекції печінки | 55 | 84,3 |
*Дані представлено в форматі Median (min.-max.). Дані щодо кількості метастазів та їх розміру отримані з архіву історій хвороби у 344 хворих з 351. Статус гена KRAS був доступний для аналізу у 201 хворого.
**Дані представлено у форматі Mean ± Std. Error of Mean.
До обраної когорти залучено 351 хворого, які мали синхронне та метахронне метастатичне ураження печінки (cT1–4N0–2M0–1). Пацієнтів, які мали прогресування хвороби на тлі індукційної чи неоад’ювантної хімієтерапії, R2 резекцію, незавершене хірургічне лікування при ДЕР, нерезектабельне інтра- / екстраабдомінальне метастатичне ураження, чи хворих із відсутністю даних щодо результатів перебігу лікування не залучали в дослідження.
Зібрані демографічні та клініко-патологічні дані, зокрема щодо віку, статі, супутніх хвороб, застосованої хімієтерапії та локалізації первинної пухлини. Зазначали категорію Т первинної пухлини за класифікацією Американського об’єднаного комітету з раку (American Joint Committee on Cancer — AJCC, 8-ме видання) [20], метастази в лімфатичні вузли первинної пухлини, мутаційний статус KRAS на момент встановлення діагнозу. Також збирали дані про локалізацію та поширеність метастазів (уні-, білобарні), кількість вогнищ, розмір найбільшого метастазу та стан хірургічного краю резекції (хворих зі статусом R2 не залучали до аналізу). ІПН використовували як комбінований показник ІПН, що враховує максимальний розмір метастазу та кількість вогнищ, та розраховували наступним чином: ІПН2 = (максимальний діаметр метастазу КРР)2 + (кількість метастазів КРР)2 [14]. Пацієнтів розподілено на 3 кластери щодо ІПН: із низьким (<3), помірним (≥3 до <9) або високим (≥9) показником відповідно до класифікації авторів [20]. Показник ІПН розраховувався на основі патологоанатомічних даних після резекції та/або радіологічних даних. Резекції печінки класифікувалися як «великі» та «малі» (резекція ≥3 та ≤2 сегментів відповідно) згідно з термінологією «New World» [21].
Статистична обробка результатів. Нормальність розподілу змінних перевіряли за допомогою тесту Шапіро — Вілка. Зведені статистичні дані представлені у вигляді цілих чисел та відсоткових значень для категоріальних змінних, медіани з інтерквартильними значенням для неперервних змінних та середнього значення із відхиленням від стандартної похибки для інтервальних даних з нормальним розподілом. ЗВ оцінювали за допомогою методу Каплана — Меєра, розраховували від дати операції; відмінності в ЗВ оцінювали за Log-rank. Для порівняння прогностичної здатності ІПН використано аналіз ROC-кривої з результатом, що нас цікавив, — ЗВ та ускладнення. K-mean кластерний аналіз використали для визначення кластерів серед когорт хворих з різними рівнями ІПН. Для оцінки зв’язку відповідних клініко-патологічних факторів з прогнозом використали регресійну модель пропорційних ризиків за Коксом. Оцінка виживаності представлена як ВР з 95% ДI. Для аналізу даних використано статистичний пакет Prizm 10.0 та онлайн-сервіс datatab.net.
РЕЗУЛЬТАТИ
Загалом 351 пацієнт отримав хірургічне лікування через метастатичну хворобу КРР та відповідність критеріям залучення (див. табл. 1). Середній вік хворих становив 65,5 року (37–84), більшість були чоловіками 188 (53,6%); отримували передопераційну хімієтерапію унаслідок метастатичного ураження печінки — 216 (61,5%); більшість схем — це «дуплети» на основі оксаліплатину — 174 (49,6%); 45 (12,8%) хворих отримали іринотекан; 14 (3,9%) осіб отримували «триплети». Також 74 (21,1%) пацієнти отримували комбіновану цитотоксичну схему поєднано з інгібітором EGFR чи анти-VEGF терапію (54,4%). Медіана кількості метастатичних уражень становила 5 (1–23), а середній розмір таргетного найбільшого метастатичного вогнища становив 35±1,6 см. Когорти із солітарними метастазами та кількістю вогнищ у діапазоні 2–5 реєстрували у 108 (31,4%) та 193 (56,1%) хворих відповідно. ІПН розраховували за допомогою радіологічної візуалізації, що звірялися з протоколами операції та морфологічним висновком, середнє значення ІПН становило 7±0,14. Статус мутації онкогену KRAS представлений у 201 (57,3%) хворого, а мутації підтвердили у 137 (68,2%) випадках.
Щодо оперативних втручань, то більшість резекцій печінки мали R0 статус, тоді як R1 виявили у 105 (29,9%) випадках. Більшість інтервенцій (240 (68,4%)) носили характер «малих» резекцій печінки. Стратегію симультанної хірургії із первинною пухлиною реалізовано у 58 (16,5%) випадках. Лапароскопічний доступ використано у 55 (84,3%) хворих.
Протягом середнього періоду спостереження, що становив 61,5 міс, померло 156 пацієнтів, залучених у дослідження. Показник 1, 3 і 5-річної ЗВ становив 96,5, 80,7 і 50,8% відповідно.
Статистичну значущість ІПН щодо прогнозування ускладнення та ЗВ розраховували за допомогою ROC-кривої та AUC-аналізу [12].
На основі кластеризації за методами k-середніх та Elbow нам вдалося визначити 3 когорти хворих, у яких залежно від значення ІПН виявлено різний онкологічний прогноз. Оптимальні точки відсікання для моделі ІПН встановлені на рівні 3,5 та 10 відповідно до кумулятивного відсотка розподілу ІПН, де 1 кластер з ІПН ≤3,5; 2-й та 3-й кластери з ІПН 3,5–10 та >10 відповідно (рис. 1).
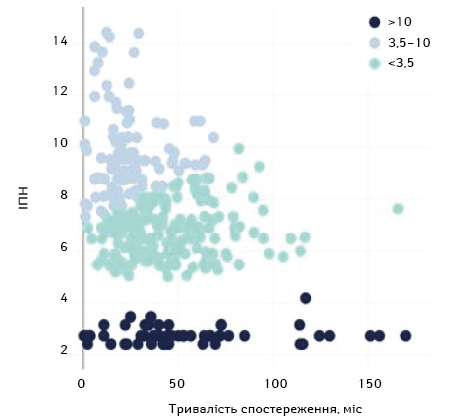
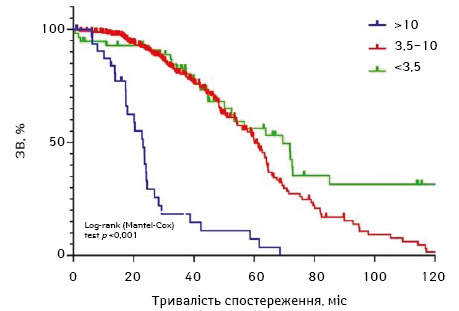
На основі даних кластеризації вирахувано виживаність в когортах з ІПН <3,5; 3,5–10 та >10 відповідно. Медіана в цих когортах становила 69,5, 60,3 та 23,1 міс відповідно та 5-річна ЗВ — 56,3; 49,7 та 7,4% відповідно (р <0,001) (рис. 2).
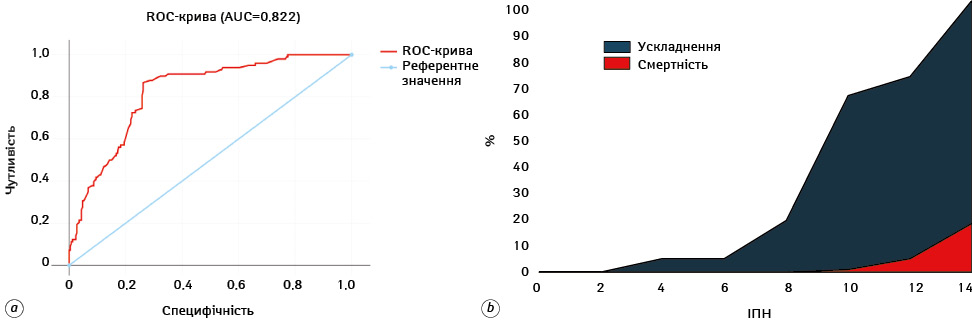
Здатність ІПН прогнозувати ЗВ проаналізовано за допомогою ROC-кривої, що продемонструвала високу чутливість із AUC=0,822 (рис. 3a, b). Усього зареєстровано 172 (49,0%) хворих, які мали досвід ускладнення в ранній післяопераційний період. Серед них 25 (7,1%) осіб оперовані в межах ДЕР та симультанної хірургічної стратегії, у них зафіксовано тенденцію до зростання ускладнень.
За даними багатофакторного аналізу за Коксом (табл. 2), кластери ІПН мали достовірний негативний вплив на ЗВ, зокрема когорти із ІПН 3,5–10 (ВР=0,43; 95% ДІ 0,18–0,97; p=0,04) та ІПН ≥10 (ВР=1,4; 95% ДІ 1,31–1,46; p=0,005). Також ураження регіонарних лімфатичних вузлів (ВР=1,90; 95% ДІ 1,25–2,90; p=0,03), використання стратегії ДЕР (ВР=1,1; 95% ДІ 1,02–1,13; p=0,005) та післяопераційні тяжкі ускладнення (ВР=1,2; 95% ДІ 1,1–1,26; p=0,01) мали негативний вплив на ЗВ.
| Змінна | ВР (95% ДІ) | Значення p |
| ІПН
(3,5 — реф.): |
||
| 3,5–10 | 0,43 (0,18–0,97) | 0,04 |
| >10 | 1,4 (1,31–1,46) | 0,005 |
| Білобарне метастатичне ураження
(ні — реф.) |
||
| Так | ns | ns |
| Кількість курсів ХТ (1–6 — реф.) | ||
| ≥6 | ns | ns |
| Статус регіонарних лімфовузлів (pN0 — реф.) | ||
| pN1–2 | 1,2 (1,25–2,90) | 0,003 |
| ДЕР | 1,1 (1,02–1,13) | 0,005 |
| Хірургічний доступ (ВХ — реф.) | ||
| Лапароскопічний | ns | ns |
| Післяопераційні ускладнення* | 1,2 (1,1–1,26) | 0,01 |
| Післяопераційна смертність | ns | ns |
| Статус KRAS-мутації
(дикий тип — реф.) |
ns | ns |
Примітки: ns — статистично незначуще; реф. — референтне значення в моделі рівняння за Коксом; ВХ — відкрита хірургія; pN — статус ураження регіонарних лімфатичних вузлів за TNM AJCC 6–8 видань.
*Оцінювалися тільки ускладнення за шкалою Cavien — Dindo ІІІ–IV ступеня.
ОБГОВОРЕННЯ
Пошук універсальної моделі прогнозування перебігу лікування метастатичної хвороби КРР триває вже декілька десятиріч [22–24]. У низці досліджень розроблені прогностичні номограми для визначення довготривалого онкологічного прогнозування у хворих на КРР із метастатичним ураженням печінки [25]. Зокрема, K. Sasaki та співавт. представили підхід Metro-ticket, що дозволяє стратифікувати дані хворих за розміром та кількістю вогнищ у печінці [14]. Модель Metro-ticket вперше показала свою ефективність та точність прогнозування ризиків канцер-специфічної смерті пацієнтів у дослідженні A. Vitale на когорті із 4759 хворих на первинний рак печінки [26]. Прогностичну користь цієї нової моделі вивчено і порівняно із золотим стандартом морфологічної класифікації пухлин за шкалою Fong, що широко використовується в якості предиктора ЗВ, зокрема і під час планування трансплантації [12]. Однак математична модель за K. Sasaki із градацією ІПН виявилася набагато кращим інструментом для прогнозування довгострокової виживаності порівняно з традиційною категоризацією за розміром пухлини.
Використавши вже розроблену математичну формулу Metro-ticket за K. Sasaki, ми розрахували ІПН шляхом оцінки розмірів та кількості метастазів у печінці кожного оперованого хворого. Власний ретроспективний аналіз показав ефективність прогностичної моделі Metro-ticket на національній популяційній когорті пацієнтів з КРР із метастатичним ураженням печінки. Вважаємо, що наше дослідження є важливим, оскільки воно продемонструвало, що концепція, яку розроблено для осіб з гепатоцелюлярною карциномою та проаналізовано на іншій популяції, можна безпосередньо використовувати для оцінки прогнозу пацієнтів з метастатичною формою КРР. Поєднуючи розмір і кількість пухлин у Metro-ticket, прогностична модель ІПН мала кращу прогностичну дискримінаційну здатність для хворих із кластером >10, оскільки остання когорта мала найбільш значущу силу взаємодії порівняно з такою за Коксом, що доводить інформативність цього предиктора довгострокової виживаності.
З розкриттям механізмів метастазування КРР відбувалася еволюція хірургічної стратегії на користь екстремальних підходів, оскільки технічна резектабельність стала орієнтиром в ухваленні рішень міждисциплінарних команд, а ресурсність органа дозволила реалізовувати альтернативні судинно-орієнтовані «великі» резекції [27, 28]. Практичну цінність підходу Metro-ticket важко переоцінити, оскільки проста у використанні формула ІПН2 = (максимальний діаметр метастазу КРР)2 + (кількість метастазів КРР)2 дозволяє об’єктивізувати 2 віртуальних хворих. Так, оперуючи хворого «X» із метахронним метастазом у правій частці печінки розміром 280 мм та 2 метастазами із діаметром 5 мм у лівій частці через відносну простоту реалізації гемігепатектомії ми можемо розцінити 19 білобарних метастазів із максимальним діаметром 8 мм пацієнта «Y» як нерезектабельний випадок. Цікаво, що ІПН у хворого «X» та «Y» становлять 18,4 та 7,2 відповідно, а отже ризики раннього рецидиву вищі у хворого «X». А судинно-орієнтована хірургія печінки із використанням сучасної ультразвукової навігації дозволяє видалити 19 вогнищ за 1 хірургічний етап без ризиків розвитку гепатоспецифічних ускладнень [29].
Більше того, вплив ІПН на безпосередні хірургічні результати наразі практично не вивчений. Y. Endo та співавт. встановили, що у пацієнтів з високими показниками ІПН одномоментні резекції асоціювалися з підвищеною частотою післяопераційних ускладнень [30]. У їхньому аналізі виявлено, що ІПН >10 асоціюється із вищим ризиком тяжких ускладнень. Також видається логічним, що когорта хворих, яким реалізували ДЕР та «великі резекції» через недостатній об’єм майбутнього залишку печінки, мали більший вплив на цей висновок.
Лімітуючим моментом цього дослідження вважаємо відсутність окремого аналізу для осіб із синхронними та метахронними метастазами. На аналіз могли вплинути розбіжність термінології хірургічного лікування та системного лікування до 2014 р., що потребує вивчення на більших вибірках пацієнтів, можливо, у межах багатоцентрового дослідження.
ВИСНОВКИ
У цьому дослідженні встановлено, що ІПН може бути застосований до національної популяції хворих на КРР із метастатичною хворобою. Модель має потенціал прогнозування ЗВ та хірургічних ускладнень.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Morgan, E., Arnold, M., Gini, A., Lorenzoni, V., Cabasag, C. J., Laversanne, M., … Bray, F. (2023). Global burden of colorectal cancer in 2020 and 2040: incidence and mortality estimates from GLOBOCAN. Gut, 72(2), 338–344. doi: 10.1136/gutjnl-2022-327736.
2. Horn, S. R., Stoltzfus, K. C., Lehrer, E. J., Dawson, L. A., Tchelebi, L., Gusani, N. J., … Zaorsky, N. G. (2020). Epidemiology of liver metastases. Cancer Epidemiology, 67, 101760. doi: 10.1016/j.canep.2020.101760.
3. Machairas, N., Di Martino, M., Primavesi, F., Underwood, P., de Santibanes, M., Ntanasis-Stathopoulos, I., … Pawlik, T. M. (2024). Simultaneous resection for colorectal cancer with synchronous liver metastases: current state-of-the-art. Journal of Gastrointestinal Surgery, 28(4), 577–586. doi: 10.1016/j.gassur.2024.01.034.
4. Chan, A. K. C., Mason, J. M., Baltatzis, M., & Siriwardena, A. K. (2022). Management of Colorectal Cancer with Synchronous Liver Metastases: An Inception Cohort Study (CoSMIC). Annals of Surgical Oncology, 29(3), 1939–1951. doi: 10.1245/s10434-021-11017-7.
5. Turk, S., Plahuta, I., Magdalenic, T., Spanring, T., Laufer, K., Mavc, Z., … Ivanecz, A. (2023). Two-stage hepatectomy in resection of colorectal liver metastases — a single-institution experience with case-control matching and review of the literature. Radiology and Oncology, 57(2), 270–278. doi: 10.2478/raon-2023-0026.
6. Rozhkova, V., Burlaka, A., Lukashenko, A., Ostapenko, Y., & Bezverkhnyi, V. (2023). Laparoscopic and Open Liver Resections for Colorectal Cancer Liver Metastasis in the Ukrainian State Center. Cureus, 15(5), e38701. doi: 10.7759/cureus.38701.
7. Nordlinger, B., Sorbye, H., Glimelius, B., Poston, G. J., Schlag, P. M., Rougier, P., … Gruenberger, T. (2008). Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet, 371(9617), 1007–1016. doi: 10.1016/S1470-2045(13)70447-9.
8. Michiel Zeeuw, J., Wesdorp, N. J., Ali, M., Bakker, A. J. J., Voigt, K. R., Starmans, M. P. A., … Kazemier, G. (2024). Prognostic value of total tumor volume in patients with colorectal liver metastases: A secondary analysis of the randomized CAIRO5 trial with external cohort validation. European Journal of Cancer, 207, 114185. doi: 10.1016/j.ejca.2024.114185.
9. Adam, R., & Kitano, Y. (2019). Multidisciplinary approach of liver metastases from colorectal cancer. Annals of Gastroenterological Surgery, 3(1), 50–56. doi: 10.1002/ags3.12227.
10. Milana, F., Famularo, S., Luberto, A., Rimassa, L., Scorsetti, M., Comito, T., … Torzilli, G. (2022). Multidisciplinary Tumor Board in the Management of Patients with Colorectal Liver Metastases: A Single-Center Review of 847 Patients. Cancers, 14(16), 3952. doi: 10.3390/cancers14163952.
11. Schadde, E., Grunhagen, D. J., Verhoef, C., Krzywon, L., & Metrakos, P. (2021). Limitations in resectability of colorectal liver metastases 2020 — a systematic approach for clinicians and patients. Seminars in Cancer Biology, 71, 10–20. doi: 10.1016/j.semcancer.2020.09.008.
12. Fong, Y., Fortner, J., Sun, R. L., Brennan, M. F., & Blumgart, L. H. (1999). Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Annals of Surgery, 230(3), 309–318. doi: 10.1097/00000658-199909000-00004.
13. Bolhuis, K., Wensink, G. E., Elferink, M. A. G., Bond, M. J. G., Dijksterhuis, W. P. M., Fijneman, R. J. A., … Roodhart, J. M. L. (2022). Externalvalidationoftwoestablished clinical risk scores predicting outcome after local treatment of colorectal liver metastases in a nationwide cohort. Cancers, 14(10), 2356. doi: 10.3390/cancers14102356.
14. Sasaki, K., Morioka, D., Conci, S., Margonis, G. A., Sawada, Y., Ruzzenente, A., … Pawlik, T. M. (2018). The Tumor Burden Score: A New «Metro-ticket» Prognostic Tool For Colorectal Liver Metastases Based on Tumor Size and Number of Tumors. Annals of Surgery, 267(1), 132–141. doi: 10.1097/SLA.0000000000002064.
15. Chow, F. C., & Chok, K. S. (2019). Colorectal liver metastases: an update on multidisciplinary approach. World Journal of Hepatology, 11(2), 150–172. doi: 10.4254/wjh.v11.i2.150.
16. Riddiough, G. E., Fifis, T., Muralidharan, V., Perini, M. V., & Christophi, C. (2019). Searching for the link; mechanisms underlying liver regeneration and recurrence of colorectal liver metastasis post partial hepatectomy. Journal of Gastroenterology and Hepatology, 34(8), 1276–1286. doi: 10.1111/jgh.14644.
17. Sasaki, K., Margonis, G. A., Andreatos, N., Zhang, X. F., Buettner, S., Wang, J., … Pawlik, T. M. (2017). The prognostic utility of the «Tumor Burden Score» based on preoperative radiographic features of colorectal liver metastases. Journal of Surgical Oncology, 116(4), 515–523. doi: 10.1002/jso.24678.
18. Lima, H. A., Endo, Y., Alaimo, L., Moazzam, Z., Munir, M. M., Shaikh, C., … Pawlik, T. M. (2022). Tumor Burden Score and Serum Alpha-fetoprotein Subclassify Intermediate-Stage Hepatocellular Carcinoma. Journal of Gastrointestinal Surgery, 26(12), 2512–2521. doi: 10.1007/s11605-022-05469-9.
19. Ho, S. Y., Liu, P. H., Hsu, C. Y., Huang, Y. H., Lei, H. J., Liao, J. I., … Huo, T. I. (2023). Surgical resection versus transarterial chemoembolization for patients with hepatocellular carcinoma beyond Milan criteria: prognostic role of tumor burden score. Scientific Reports, 13(1), 13871. doi: 10.1038/s41598-023-41068-7.
20. Weiser, M. R. (2018). AJCC 8th Edition: Colorectal Cancer. Annals of Surgical Oncology, 25(6), 1454–1455. doi: 10.1245/s10434-018-6462-1.
21. Nagino, M., DeMatteo, R., Lang, H., Cherqui, D., Malago, M., Kawakatsu, S., … Clavien, P. A. (2021). Proposal of a new comprehensive nota-tion for hepatectomy: the «new world» terminology. Annals of Surgery, 274, 1e3. doi: 10.1097/SLA.0000000000004808.
22. Malik, H. Z., Prasad, K. R., Halazun, K. J., Aldoori, A., Al-Mukhtar, A., Gomez, D., … Toogood, G. J. (2007). Preoperative prognostic score for predicting survival after hepatic resection for colorectal liver metastases. Annals of Surgery, 246, 806–814. doi: 10.1097/SLA.0b013e318142d964.
23. Wang, H. W., Wang, L. J., Jin, K. M., Bao, Q., Li, J., Wang, K., & Xing, B. C. (2021). The prognostic impact of resection margin status varies according to the genetic and morphological evaluation (GAME) score for colorectal liver metastasis. Journal of Surgical Oncology, 124(4), 619-626. doi: 10.1002/jso.26557.
24. House, M. G., Ito, H., Gönen, M., Fong, Y., Allen, P. J., DeMatteo, R. P., … D’Angelica, M. I. (2010). Survival after hepatic resection for metastatic colorectal cancer: trends in outcomes for 1600 patients during two decades at a single institution. Journal of the American College of Surgeons, 210, 744–752. doi: 10.1016/j.jamcollsurg.2009.12.040.
25. Martín-Cullell, B., Virgili, A. C., Riera, P., Fumagalli, C., Mirallas, O., Pelegrín, F. J., … Páez, D. (2024). Histopathological, Clinical, And Molecular (HICAM) score for patients with colorectal liver metastases. British Journal of Surgery, 111(3), znae016. doi: 10.1093/bjs/znae016.
26. Jiang, C., Qin, F., Yan, J., Zou, J., Wang, H., Zhang, H., … Hou, G. (2024). Tumor burden score is superior to primary liver cancer stages in predicting prognosis for patients with combined hepatocellular-cholangiocarcinoma after surgery: A multi-center study. European Journal of Surgical Oncology, 50(11), 108610. doi: 10.1016/j.ejso.2024.108610.
27. Torzilli, G. (2021). Parenchyma-sparing vessel-guided major hepatectomy: nonsense or new paradigm in liver surgery? British Journal of Surgery, 108(2), 109–111. doi: 10.1093/bjs/znaa112.
28. Burlaka, A., Rozhkova, V., Pavliuk, R., Chukanov, O., & Beznosenko, A. (2024). Laennec’s approach for central liver resection of colorectal cancer liver metastasis adjacent to the hepatic hilum that occurred 10 years after colectomy: A case report. International Journal of Surgery Case Reports, 116, 109327. doi: 10.1016/j.ijscr.2024.109327.
29. Burlaka, A. A., Makhmudov, D. E., Lisnyi, I. I., Paliichuk, A. V., Zvirych, V. V., & Lukashenko, A. V. (2022). Parenchyma-sparing strategy and oncological prognosis in patients with colorectal cancer liver metastases. World Journal of Surgical Oncology, 20(1), 122. doi: 10.1186/s12957-022-02579-1.
30. Endo, Y., Alaimo, L., Moazzam, Z., Woldesenbet, S., Lima, H. A., Munir, M. M., … Pawlik, T. M. (2024). Postoperative morbidity after simultaneous versus staged resection of synchronous colorectal liver metastases: Impact of hepatic tumor burden. Surgery, 175(2), 432–440. doi: 10.1016/j.surg.2023.10.019.
Адреса для листування:
Бурлака Антон Анатолійович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: nir.burlaka@gmail.com
Correspondence:
Anton Burlaka
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: nir.burlaka@gmail.com














Leave a comment