Персоніфікований підхід до обсягу хірургічного лікування раку правої половини ободової кишки з урахуванням факторів прогнозу. Стан проблеми та результати власних досліджень
- 1Національний університет охорони здоров’я України ім. П.Л. Шупика, Київ, Україна
- 2Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
Резюме. У структурі онкологічної захворюваності та смертності колоректальний рак (КРР) продовжує утримувати одну з провідних позицій як в Україні, так і світі. За останні 5 років у нашій державі реєструється високий темп приросту захворюваності на КРР, особливо на рак правої половини ободової кишки (РППОК), істотні зрушення у віковій структурі пацієнтів через переважання осіб віком старше 60 років, помітне збільшення кількості хворих із різними ускладненнями та поширенням пухлинного процесу, особливо у осіб молодого віку, спричинених пандемією COVID-19 та воєнними діями в Україні. РППОК при ІІ-ІІІ стадіях онкопатології асоціюється з нижчим показником загальної (ЗВ) та безрецидивної виживаності (БРВ) через варіативність хірургічної техніки правобічної геміколектомії. Стандартний об’єм видалення груп лімфатичних вузлів при РППОК до сьогодні не визначено. Відповідно до японських клінічних рекомендацій лімфаденектомія D3 необхідна у всіх випадках, крім I стадії, тоді як згідно з європейськими клінічними рекомендаціями стандартний обсяг оперативного втручання включає лише лімфаденектомію D2. Наразі відсутній консенсус та докази рандомізованих результатів досліджень щодо відмінностей між лімфатичною дисекцією D2 і D3 при РППОК. Крім того, прогнозування як при КРР, так і при РППОК традиційно покладалося на визначення стадії за TNM-класифікацією, розробленою фахівцями Міжнародного союзу боротьби з раком (Union for International Cancer Control — UICC) та Американського об’єднаного комітету з раку (American Joint Committee on Cancer — AJCC). Однак, з погляду клінічної симптоматики, існують відмінності в моделях виживання у хворих на РППОК. Стратифікація ризику та прогнозування залежить від багатьох факторів. У роботі проаналізовані патоморфологічні, імуногістохімічні, молекулярно-генетичні маркери, які могли би бути незалежними предикторами своєчасного виявлення рецидивів при РППОК. Наше власне дослідження містить комплексний ретроспективний аналіз показників 99 хворих на РППОК, яким виконано лапароскопічну правобічну геміколектомію з дисекцією D2, D3 в Державному некомерційному підприємстві «Національний інститут раку» (ДНП «НІР») за період 2017-2023 рр. Аналіз ефективності лікування пацієнтів із РППОК здійснювали на основі моделі виживаності Каплана — Меєра з визначенням та оцінкою медіани та середнього показника виживаності у 41 прооперованого хворого за 5-річний період спостереження. Метою цього дослідження є визначення прогностичних факторів, які можуть бути асоційовані із ЗВ та БРВ у прооперованих хворих на РППОК IІ–IІІ стадій. Матеріали і методи дослідження. Пошук наукової літератури здійснювали шляхом аналізу баз даних PubMed, Embase, Cochrane Library, China National Knowledge Infrastructure, Wanfang, Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN), Національного канцер-реєстру України. Метааналіз охоплював міжнародні ретроспективні когортні дослідження для порівняння з групою дослідження прооперованих хворих на РППОК у ДНП «НІР» за 5-річний період.
Одержано 28.08.2024
Прийнято до друку 5.09.2024
DOI: 10.32471/clinicaloncology.2663-466X.55-3.33307
ВСТУП
КРР залишається однією з центральних і актуальних проблем сучасної онкології, продовжуючи посідати провідні місця у структурі онкологічної захворюваності та смертності дорослого населення як в Україні, так і країнах Європейського Союзу (ЄС) та США. На сьогодні це найбільш поширена нозологічна форма серед злоякісних новоутворень (ЗН). У структурі злоякісних пухлин шлунково-кишкового тракту КРР у представників обох статей посідає 3-тє місце за частотою захворюваності — 9,7% серед усіх нозологічних форм раку та 2-ге за показником смертності — 8,5%. За міжнародними даними, частка раку правої половини товстої кишки перевищує 60% [1].
В Україні КРР залишається основним структуроутворювальним онкологічним захворюванням, що становить 13,8% від усіх ЗН. Питома вага КРР серед 5 основних нозологічних форм ЗН у статево-віковій структурі онкозахворюваності населення України віком 55–74 рр. становить 14,6% у чоловіків (ободова кишка 7,3%) та 13,4% у жінок (ободова кишка 7,7%), посідаючи 2-ге рангове місце. У структурі смертності КРР також посідає 2-ге місце з показниками 12,7% у чоловіків (ободова кишка 6,6%) та 13,9% у жінок (ободова кишка 8,7%), тобто є соціально значущим онкологічним захворюванням [2].
Систематичний пошук здійснювали у PubMed, Embase, Кокранівській базі даних та доказовій базі NCCN. Сучасна лікувальна тактика локалізованого та місцево-поширеного раку проксимального відділу ободової кишки ІІІ стадії є стандартизованою та регламентованою міжнародними керівними настановами (NCCN Guidelines v. 4, 2024; ESMO Guidelines, 2021). РППОК саме при захворюваннях ІІ–ІІІ стадій асоціюється з нижчими показниками ЗВ та БРВ через варіативність хірургічної техніки правобічної геміколектомії. Основним методом радикального лікування РППОК є хірургічний, що дає змогу поліпшити безпосередні та віддалені результати. Втім на сьогодні немає чітко сформульованого стандарту (консенсусу) щодо виконання лімфодисекції при РППОК. Перспективним напрямом потенційного підвищення ефективності лікування хворих на РППОК є дослідження молекулярно-генетичних маркерів [3].
Прогнозування РППОК традиційно ґрунтується на стадіюванні, як це визначено в класифікації TNM. Тим не менш існують відмінності в прогнозних моделях виживаності незалежно від стадії, у яких поєднується складна взаємодія багатьох факторів. Гістопатологічні ознаки пухлини, такі як пухлинний ріст, периневральна інвазія, ураження лімфатичних вузлів, їх кількість та локалізація, а також молекулярно-генетичні особливості пухлини (MSI, KRAS, BRAF та CDX2) можуть бути предикторами у стратифікації ризику і визначенні прогнозу [4].
Саме метастазування в лімфатичні вузли впливає на прогноз і є ключовим фактором при ухваленні рішення щодо тактики хірургічного лікування та призначення в подальшому ад’ювантної хімієтерапії. Тому уражені лімфатичні вузли є основною складовою в сучасній системі стадіювання РППОК. У хворих на РППОК з ураженням лімфатичних вузлів 5-річна ЗВ становить менше ніж 70%, а це означає, що значна кількість пацієнтів із прихованими метастазами в лімфатичні вузли може загинути від рецидиву захворювання. Персоніфікований підхід до обсягу хірургічного лікування РППОК з урахуванням факторів прогнозу може допомогти виявити цю підгрупу хворих, поліпшити подальше лікування та підвищити якість життя. Оптимальний обсяг хірургічної резекції з радикальною лімфаденектомією залишається предметом обговорень сьогодення. Розширена лімфаденектомія, дисекція позабрижових лімфатичних вузлів, високе лігування артерій і повне висічення брижі ободової кишки належать до хірургічних методів з вивіреними онкологічними основами, але не підтверджені найвищими рівнями доказів [5].
Останнім часом у хірургії КРР почали використовувати молекулярні методи дослідження. BRAF являє собою протоонкоген, який кодує протеїнкіназу BRAF, життєво важливий компонент шляху мітоген-активованої протеїнкінази (mitogen activated protein kinases — MAPK) [6]. Шлях MAPK, зі свого боку, відіграє важливу роль у клітинній проліферації, диференціюванні, виживаності та апоптозі [7]. Мутацію BRAF (BRAF-mt) діагностують у близько 11% усіх КРР, вона відіграє ключову роль в онкогенезі [8]. Хоча існує близько 30 різних мутацій BRAF, мутація V600E є найпоширенішою, на її частку припадає 90% усіх мутацій BRAF при КРР [9]. Важливість статусу BRAF для прогнозування КРР залишається дискусійною [10–12], хоча поточні дані схиляються до несприятливого прогнозу [13–17]. Пацієнти з BRAF-mt КРР, як правило, у більшості випадків особи жіночої статі та старші за віком на момент встановлення діагнозу. Існує асоціація між ступенем диференціювання, муцинозною гістологічною структурою пухлини та проксимальною її локалізацією в товстій кишці [7, 8, 18]. Корисність визначення BRAF-мутації в прогнозуванні залежить від стадії пухлинного процесу [8, 19, 20] та статусу мікросателітної нестабільності (Microsatellite instability — MSI) [13–16].
Докази того, що BRAF-mt є негативним прогностичним показником при метастатичному колоректальному раку (мКРР) опубліковано в багатьох наукових працях, що пов’язано з більш низьким показником ЗВ та резистентністю до інгібіторів рецептора епідермального фактора росту (Epidermal growth factor receptor — EGFR) [19, 21–24]. Об’єднаний аналіз досліджень CAIRO, CAIRO2, COIN та FOCUS [25–28], проведений S. Venderbosch та співавт. у 2014 р. [19], виявив найнижчі ЗВ та БРВ саме при BRAF-mt мКРР (оцінка відносного ризику (ОР) 1,91;
95% довірчий інтервал (ДІ) 1,66–2,15) [19], що підтверджено в багатьох інших наукових роботах [18, 21, 29].
Найбільш значущі розбіжності при дослідженні молекулярно-генетичних факторів виявлено між стадіями II і III КРР. Рандомізовані популяційні дослідження висвітлюють змішані дані, але припускають, що саме BRAF-мутації пов’язані з найнесприятливішим прогнозом [10, 30]. Необхідно підкреслити, що визначення статусу MSI при BRAF-мутації може впливати на визначення часового періоду виникнення рецидиву і прогнозування ЗВ. Проте є суперечливі дані про взаємозв’язок між BRAF, MSI та прогнозом [14, 16, 17]. У ретроспективному аналізі результатів досліджень PETACC-8 [31] та N0147 [32] у 2017 р., проведеному J. Taieb та співавт., встановили, що BRAF-mt пов’язана зі значно більш коротким часом до рецидиву, більш коротким періодом виживання після рецидиву та нижчою ЗВ у пацієнтів з мікросателітною стабільністю (Microsatellite stability — MSS) (але не у осіб з MSI) з ІІІ стадією захворювання [16]. Навпаки, у дослідженні, проведеному E.M. De Cuba та співавт., виявлено, що BRAF-mt при II–III стадіях з MSI є незалежним прогностичним фактором несприятливого прогнозу щодо рак-специфічної виживаності, але не для ЗВ [17]. Подальші дослідження свідчать, що BRAF-mt є незалежним чинником ризику несприятливого прогнозу, на який впливає саме статус MSI [33–35]. У ретроспективному дослідженні L. Li та співавт. досліджували вплив BRAF-mt у пацієнтів із КРР II стадії, які не отримували хімієтерапію, та довели, що BRAF-mt є незалежним фактором ризику несприятливого прогнозу, але, що цікаво, вони не виявили, що статус MSI впливає на прогноз. У цій когорті пацієнтів з КРР II стадії автори зафіксували, що поєднання мутаційного статусу BRAF з мутаційним статусом KRAS та PIK3CA підвищує рівень чутливості при прогнозуванні БРВ та ЗВ порівняно з 1 мутацією BRAF ((ROC AUC 0,65, p <0,002 порівняно з R 0,54), р=0,392) [34]. Отже, точність прогнозу може бути підвищена, якщо тестування BRAF розглядається в комбінації з іншими тестами та біомаркерами (KRAS та PIK3CA) [34]. Необхідно зазначити, що MSI характеризується мутаціями зсуву кодонів зчитування в мікросателітних ділянках [36]. Підвищений показник MSI (MSI-H) виявляється у 15% усіх КРР і виникає або через спорадичну мутацію (епігенетична інактивація hMLH1), або в умовах спадкового неполіпозного КРР (синдрому Лінча) [36].
У хворих молодшої вікової групи (40–50 років) зі встановленим на ранній стадії РППОК та MSI-H і які були асоційовані із нерухомим зазубреним типом, що продукують муцин, збільшенням кількості лімфоцитів, які інфільтрують пухлину, диференціюванням перснеподібних клітин, запальною реакцією, подібною до хвороби Крона, і вищим ступенем злоякісності — мали вищу ЗВ [37, 38].
До 1999 р. MSI не вважався основним прогностичним фактором [39], проте у декількох метааналізах, проведених у 2011–2014 рр., доведено, що MSI пов’язаний з підвищенням ЗВ та БРВ і може мати важливе прогностичне значення [40], особливо для хворих, у яких виявлено онкопатологію на ранній стадії (І–ІІ стадії) [41–43]. Інші дані системного огляду англійських науковців S. Popat та співавт. стверджують, що у 1277 хворих на КРР (І–IV стадії) з MSI-H виявили зниження показника ЗВ на 35% (ОР 0,65, 95% ДІ 0,59–0,71) [42]. Проте в оновленому метааналізі, проведеному C. Guastadisegni та співавт., виявили підвищення ЗВ, БРВ у 1972 з MSI-H із 12 785 пацієнтів із КРР усіх стадій [43]. Прогностичний вплив MSI-H при мКРР є менш вивченим [13], проте у кількох дослідженнях зафіксовано, що наявність MSI-H при мКРР має найнесприятливіший прогноз для ЗВ [19, 21, 44].
Імуногістохімічний маркер CDX2 є гомеобоксним геном, що кодує білковий транскрипційний фактор, і є регулятором розвитку та диференціації кишечнику [45]. Також припущено, що CDX2 відіграє роль супресора пухлини в товстій кишці дорослих [46, 47]. Нещодавно CDX2 ідентифіковано як новий прогностичний біомаркер при КРР, де втрата CDX2 спричиняла зниження ЗВ та БРВ [48–50]. CDX2 відсутній у близько 10% усіх випадків КРР [50].
CDX2-негативні пухлини часто мають значні несприятливі прогностичні ознаки, такі як прогресуюча стадія, судинна інвазія, низька диференціація (високий ступінь злоякісності), правостороння локалізація пухлини, фенотип метилатора CpG-острівців (CpG island methylator phenotype — CIMP) і мутація BRAF [48, 51]. Втрата експресії CDX2 при КРР корелюється із нижчими ЗВ і БРВ незалежно від етнічної приналежності, MSI або стадії [48–50]. G. Tomasello та співавт. (2018) встановили, що експресія CDX2 пов’язана із 50%-вим нижчим ризиком смерті порівняно із відсутньою експресією CDX2, що більш характерна для ІІ–ІІІ стадій КРР зі зниженням виживаності до 70%. Експресія CDX2 також пов’язана зі зниженням БРВ до 52% [49, 52]. Деякі автори довели, що CDX2 має прогностичну цінність лише у хворих КРР III–IV стадій саме із мутацією BRAF дикого типу I, але не у хворих із II стадією КРР із мутацією BRAF [52]. K. Slik та співавт. виявили, що у хворих на II стадії КРР втрата експресії CDX2 асоціювалася зі зниженням БРВ та рак-специфічною виживаністю лише у когорті MSS, а не когорті MSI-H [53].
Необхідно відмітити, що для забезпечення досягнення 5-річних ЗВ та БРВ має значення раннє виявлення рецидиву КРР у прооперованих пацієнтів. Звичайні методи, такі як комп’ютерна томографія (КТ), ендоскопія та раково-ембріональний антиген (Carcinoembryonic antigen — CEA), які використовуються для діагностики рецидивів, не сприяють їх ранньому виявленню та підвищенню виживаності. Останніми роками в міжнародній онкологічній спільноті значно поширені рідкі біопсії, а саме виявлення циркулювальної пухлинної ДНК (цпДНК), яку досліджено як біомаркер для хворих на КРР з погляду прогнозу та моніторингу рецидиву, а також для проведення спрямованої терапії. Рідкі біопсії включають виявлення пухлинних біомаркерів у зразках рідин пацієнта, таких як кров, сеча, слина, кал, спинномозкова рідина або жовч. цпДНК або РНК циркулювальні пухлинні клітини і пухлинні екзосоми, цитокіни та білки представляють інтерес як біомаркери рідкої біопсії [54, 55].
Рідкі біопсії часто можна проводити послідовно під час перебігу хвороби пацієнта та використовувати для інтерпретації захворювання, а також змін у біології пухлини та оцінки відповіді пухлини на терапію [56, 57]. Слід зауважити, що цпДНК є лише невеликою частиною вільно циркулювальної (вцДНК). цпДНК, на відміну від вцДНК, вважається пухлиноспецифічною. Співвідношення між цпДНК і вцДНК може сильно варіювати в межах від 1 до 40% через характеристики первинної пухлини, а також наявність і локалізацію метастатичного ураження [58, 59].
Доведено, що цпДНК виявляється у близько 46% усіх пацієнтів з I стадією онкопатології, у 73% усіх хворих — II–III стадіями та у 90% усіх осіб із мКРР [60]. Встановлено, що післяопераційне виявлення цпДНК у пацієнтів з КРР є незалежним маркером рецидиву захворювання. У хворих із I–III стадією КРР виявлення цпДНК через 30 днів після операції було пов’язане з вищою ймовірністю рецидиву, ніж у тих, у кого не виявлено цпДНК [61]. Виявлення цпДНК також асоціюється з нижчим БРВ. Крім того, пацієнти з виявленою позитивною цпДНК до оперативного втручання мають не тільки вищий ризик рецидиву, але й менший термін до виникнення рецидиву [62]. Крім того, хворі з позитивною цпДНК мають гірші віддалені результати лікування і після хірургічної резекції. Аналогічні результати відмічаються у осіб з цпДНК після проведення ад’ювантної хімієтерапії. T. Reinert та співавт. виявили, що такі пацієнти мали у 17 разів більше шансів для розвитку рецидивів захворювання (коефіцієнт ризику (hazard ratio — HR) 17,5; 95% ДІ 5,4–56,5; p <0,001). За результатами проведеного аналізу цпДНК виявлено рецидив захворювання до 16,5 міс раніше стандартної рентгенологічної візуалізації (у середньому 8,7 міс; діапазон: 0,8–16,5 міс) [63]. Так, виявлення цпДНК може надати прогностичну інформацію для хворих на КРР та ідентифікувати їх як пацієнтів із підвищеним ризиком розвитку рецидиву патологічного стану.
РЕЗУЛЬТАТИ ВЛАСНИХ ДОСЛІДЖЕНЬ
Ефективність хірургічного лікування РППОК визначає ЗВ та БРВ. За міжнародними даними, досліджуваний показник 5-річної ЗВ хворих на РППОК становить 65,1% (95% ДІ 64,6–65,6%); залежно від стадій: при I–III стадіях становить 77,4% (95% ДІ 76,6–78,2%), 68,3% (95% ДІ 67,6–69,1%) і 53,3% (95% ДІ 52,5–54,2%) відповідно [64, 65].
В Україні, за даними Національного канцер-реєстру України, у 2020–2021 рр. показник 5-річної ЗВ при раку ободової кишки становить 33% [66]. За оцінками Міжнародного агентства з дослідження раку (International Agency for Research on Cancer — IACR) відділу Всесвітньої організації охорони здоров’я (ВООЗ) згідно з даними статистичних і епідеміологічних досліджень, захворюваність на КРР як у світі, так і Україні щорічно неухильно зростає. У нашій державі основними причинами такої ситуації є низький рівень профілактичних оглядів, відсутність скринінгу на КРР, пізня діагностика, пандемія COVID-19, війна, що підвищують відсоток занедбаних випадків та, як наслідок, знижують виживаність та якість життя хворих на рак ободової кишки.
З метою пошуку прогностичних факторів, які можуть бути асоційованими із ЗВ та БРВ, проведено ретроспективне дослідження 99 прооперованих хворих на РППОК IІ–IІІ стадій у ДНП «НІР». Для визначення ЗВ та БРВ проаналізовано стаціонарні карти 41 пацієнта з РППОК, яким проведено лапароскопічну правобічну геміколектомію з лімфатичною дисекцією D2 і D3 за період 2017–2019 рр., які досягли 5-річної виживаності.
Аналіз ефективності лікування визначали на основі моделі виживаності Каплана — Меєра (рисунок). Оцінювали середній показник виживаності та медіану за 5-річний період спостереження, різницю між групами визначали за допомогою Logrank test.
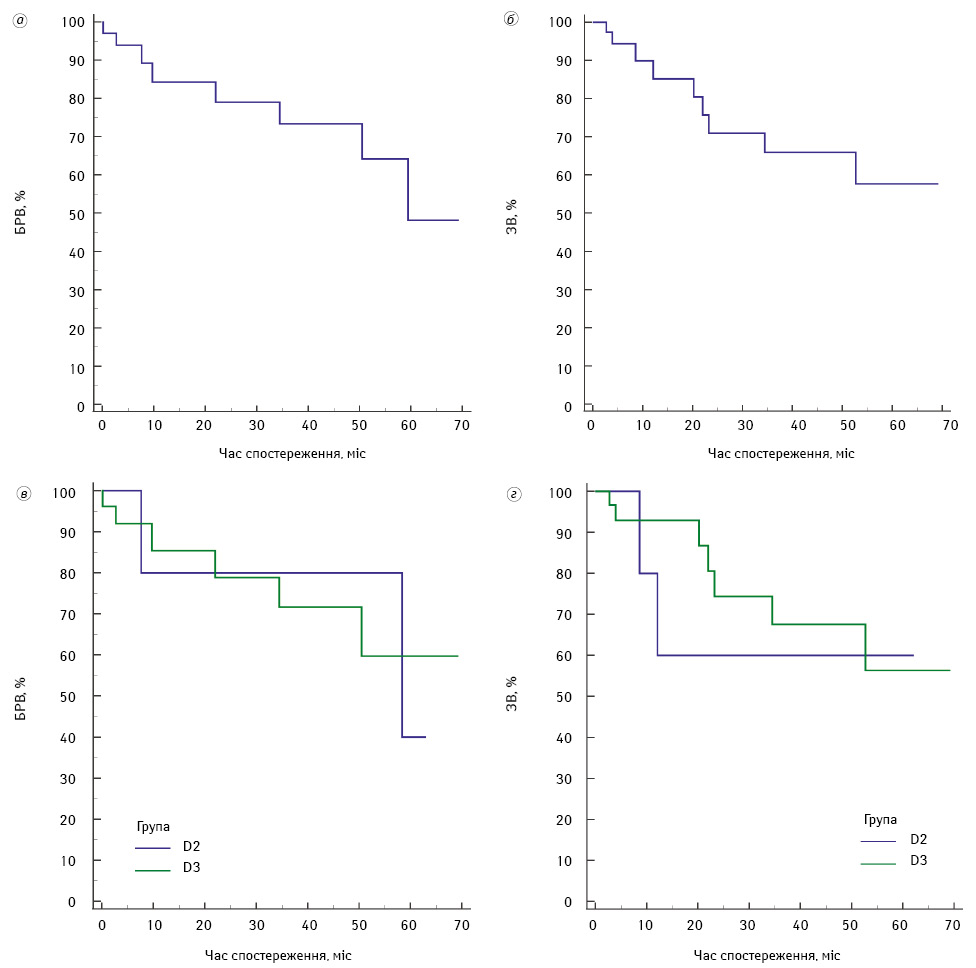
Медіана БРВ усіх лапароскопічно прооперованих хворих на РППОК становила 59,4 міс (95% ДІ 34,5–59,4). 5-річна БРВ усіх хворих на РППОК становила 48,1±16,6%, які були комплексно проліковані в період з 2017 до 2019 рр. Медіани ЗВ не досягнуто, а 5-річна ЗВ в усіх групах спостереження становила 57,7±11,7 міс.
Серед когорти пацієнтів, залучених у дослідження, у 21,95% усіх хворих виконано лімфатичну дисекцію D2 (група D2), для решти 78,05% осіб виконано більш потенційно радикальну лімфатичну дисекцію D3 (група D3).
Також проведено оцінку БРВ та ЗВ хворих на РППОК залежно від застосування виду лімфатичної дисекції (D2, D3). Медіана БРВ у групі D2 становила 58,2 міс (95% ДІ 35,5–58,2) порівняно із групою D3, де медіани не досягнуто. 5-річна БРВ становила 40,02±9,7% у групі D2 проти
59,7±14,4%, проте статистично значущої різниці між групами спостереження не виявлено (Logrank test = 0012, p=0,98). Проведення лімфодисекції D3 також статистично значуще не знижувало ризик виникнення рецидивів (HR=0,98; 95% ДІ 1,20–4,95).
Медіани ЗВ хворих на РППОК у групах D2 та D3 не досягнуто. 5-річна ЗВ у групі D2 становила 60,1±21,9% проти 56,3±14,1% у групі D3 та статистично значущої різниці між двома групами спостереження не виявлено (Logrank test = 0,013, p=0,9). Аналогічно, як із БРВ, не зафіксовано впливу потенційно більш радикальної дисекції D3 на підвищення ЗВ (HR=0,92; 95% ДІ 1,18–4,58).
Підсумовуючи ретроспективний аналіз виживаності хворих на РППОК, пролікованих у ДНП «НІР» за період 2017–2019 рр., не виявлено статистично значущої різниці між групами пацієнтів, яким проводили лімфатичні дисекції D2 і D3. Також встановлено, що потенційно більш радикальна лімфодисекція D3 не впливає на підвищення БРВ та ЗВ порівняно із радикальною лімфодисекцією D2.
ВИСНОВКИ
Отже, проведений системний огляд наукової літератури дає можливість зробити висновок, що діагностика статусу MSI одночасно з визначенням BRAF-мутації та виявленням експресії CDX2 можуть бути незалежними прогностичними факторами для своєчасності виявлення рецидиву захворювання. Наявність цпДНК у зразках рідин пацієнта, яка є пухлинно-специфічним маркером, що допомагає встановити рецидив захворювання до 16,5 міс раніше стандартної рентгенологічної візуалізації, дає можливість виявити своєчасну важливу інформацію у визначенні прогнозу стратифікації ризику для хворих на РППОК та ідентифікувати їх як пацієнтів із підвищеним ризиком розвитку рецидиву захворювання, а також дасть можливість підвищити ЗВ та БРВ.
Підсумовуючи результати власного дослідження, можна констатувати, що проведений ретроспективний аналіз виживаності хворих на РППОК, пролікованих у ДНП «Національний інститут раку» за період 2017–2019 рр., не виявив статистично значущої різниці між групами пацієнтів, яким проводили лімфатичні дисекції D2 і D3. Також встановлено, що потенційно більш радикальна лімфодисекція D3 не впливає на підвищення БРВ та ЗВ порівняно із лімфодисекцією D2.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Constantinou, V., & Constantinou, C. (2024). Focusing on colorectal cancer in young adults (Review). Molecular and Clinical Oncology, 20(1), 8. doi: 10.3892/mco.2023.2706.
2. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2023). Рак в Україні, 2021–2022. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. (Vol. 24). Кропивницький: Поліум.
3. Tejedor, P., Simó, V., Arredondo, J., López-Rojo, I., Baixauli, J., Jiménez, L. M., Gómez-Ruiz, M., & Pastor, C. (2021). The impact of sars-cov-2 infection on the surgical management of colorectal cancer: lessons learned from a multicenter study in Spain. Revista Espanola De Enfermedades Digestivas, 113(2), 85–91. doi: 10.17235/reed.2020.7460/2020.
4. Chen, H., Jiang, R.-Y., Hua, Z., Wang, X.-W., Shi, X.-L., Wang, Ye., … Zhong, D.-R. (2024). Comprehensive analysis of gene mutations and mismatch repair in Chinese colorectal cancer patients. World Journal Gastrointestinal Oncology, 16(6), 2673–2682. doi: 10.4251/wjgo.v16.i6.2673.
5. Ozawa, T., Hashiguchi, Y., Ishihara, S., Hayama, T., Tsuchiya, T., Nozawa, K., … Matsuda, K. (2021). Proposal for a post-operative surveillance strategy for stage I colorectal cancer patients based on a novel recurrence risk stratification: a multicenter retrospective study. International Journal of Colorectal Disease, 36(1), 67–74. link.springer.com/article/10.1007/s00384-020-03737-1#Bib1.
6. Sclafani, F., Gullo, G., Sheahan, K., & Crown, J. (2013). BRAF mutations in melanoma and colorectal cancer: A single oncogenic mutation with different tumour phenotypes and clinical implications. Critical Reviews in Oncology/Hematology, 87, 55–68. doi: 10.1016/j.critrevonc.2012.11.003.
7. Burotto, M., Chiou, V. L., Lee, J. M., & Kohn, E. C. (2014). The MAPK pathway across different malignancies: A new perspective. Cancer, 120, 3446–3456. doi: 10.1002/cncr.28864.
8. Chen, D., Huang, J. F., Liu, K., Zhang, L. Q., Yang, Z., Chuai, Z. R., … Fu, W. L. (2014). BRAFV600E mutation and its association with clinicopathological features of colorectal cancer: A systematic review and meta-analysis. PLoS ONE, 9, e90607. doi: 10.1371/journal.pone.0090607.
9. Clarke, C. N., & Kopetz, E. S. (2015). BRAF mutant colorectal cancer as a distinct subset of colorectal cancer: Clinical characteristics, clinical behavior, and response to targeted therapies. Journal of Gastrointestinal Oncology, 6, 660–667. doi: 10.3978/j.issn.2078-6891.2015.077.
10. Phipps, A. I., Alwers, E., Harrison, T., Banbury, B., Brenner, H., Campbell, P. T., … Peters, U. (2020). Association Between Molecular Subtypes of Colorectal Tumors and Patient Survival, Based on Pooled Analysis of 7 International Studies. Gastroenterology, 158(8), 2158–2168. doi: 10.1053/j.gastro.2020.02.029.
11. Nazemalhosseini-Mojarad, E., Kishani Farahani, R., Mehrizi, M., Baghaei, K., Yaghoob Taleghani, M., Golmohammadi, M., … Zali, M. R. (2020). Prognostic Value of BRAF and KRAS Mutation in Relation to Colorectal Cancer Survival in Iranian Patients: Correlated to Microsatellite Instability. Journal of Gastrointestinal Oncology, 51(1), 53–62. doi: 10.1007/s12029-019-00201-4.
12. Liou, J. M., Wu, M. S., Shun, C. T., Chiu, H. M., Chen, M. J., Chen, C. C., … Liang, J. T. (2011). Mutations in BRAF correlate with poor survival of colorectal cancers in Chinese population. International Journal of Colorectal Disease, 26, 1387–1395. doi: 10.1007/s00384-011-1229-1.
13. French, A. J., Sargent, D. J., Burgart, L. J., Foster, N. R., Kabat, B. F., Goldberg, R., … Thibodeau, S. N. (2008). Prognostic significance of defective mismatch repair and BRAF V600E in patients with colon cancer. Clinical Cancer Research, 14, 3408–3415. doi: 10.1158/1078-0432.CCR-07-1489.
14. Samowitz, W. S., Sweeney, C., Herrick, J., Albertsen, H., Levin, T. R., Murtaugh, M. A., … Slattery, M. L. (2005). Poor survival associated with the BRAF V600E mutation in microsatellite-stable colon cancers. Cancer Research, 65, 6063–6069. doi: 10.1158/0008-5472.CAN-05-0404.
15. Ogino, S., Nosho, K., Kirkner, G. J., Kawasaki, T., Meyerhardt, J. A., Loda, M., … Fuchs, C. S. (2009). CpG island methylator phenotype, microsatellite instability, BRAF mutation and clinical outcome in colon cancer. Gut, 58, 90–96. doi: 10.1136/gut.2008.155473.
16. Taieb, J., Le Malicot, K., Shi, Q., Penault-Llorca, F., Bouché, O., Tabernero, J., … Sinicrope, F. A. (2016). Prognostic Value of BRAF and KRAS Mutations in MSI and MSS Stage III Colon Cancer. Journal of the National Cancer Institute, 109(5), djw272. doi: 10.1093/jnci/djw272.
17. De Cuba, E. M., Snaebjornsson, P., Heideman, D. A., van Grieken, N. C., Bosch, L. J., Fijneman, R. J., … Meijer, G. A. (2016). Prognostic value of BRAF and KRAS mutation status in stage II and III microsatellite instable colon cancers. International Journal of Cancer, 138, 139–1145. doi: 10.1002/ijc.29855.
18. Kalady, M. F., Dejulius, K. L., Sanchez, J. A., Jarrar, A., Liu, X., Manilich, E., … Church, J. M. (2012). BRAF mutations in colorectal cancer are associated with distinct clinical characteristics and worse prognosis. Diseases of the Colon & Rectum, 55, 128–133. doi: 10.1097/DCR.0b013e31823c08b3.
19. Venderbosch, S., Nagtegaal, I. D., Maughan, T. S., Smith, C. G., Cheadle, J. P., Fisher, D., … Koopman, M. (2014). Mismatch repair status and BRAF mutation status in metastatic colorectal cancer patients: A pooled analysis of the CAIRO, CAIRO2, COIN, and FOCUS studies. Clinical Cancer Research, 20, 5322–5330. doi: 10.1158/1078-0432.CCR-14-0332.
20. Bourhis, A., De Luca, C., Cariou, M., Vigliar, E., Barel, F., Conticelli, F., Marcorelles, P., … Samaison, L. (2020). Evaluation of KRAS, NRAS and BRAF mutational status and microsatellite instability in early colorectal carcinomas invading the submucosa (pT1): Towards an in-house molecular prognostication for pathologists? Journal of Clinical Pathology, 73, 741–747. doi: 10.1136/jclinpath-2020-206496.
21. Tran, B., Kopetz, S., Tie, J., Gibbs, P., Jiang, Z. Q., Lieu, C. H., … Desai, J. (2011). Impact of BRAF mutation and microsatellite instability on the pattern of metastatic spread and prognosis in metastatic colorectal cancer. Cancer, 117, 4623–4632. doi: 10.1002/cncr.26086.
22. Sanz-Garcia, E., Argiles, G., Elez, E., & Tabernero, J. (2017). BRAF mutant colorectal cancer: Prognosis, treatment, and new perspectives. Annals of Oncology, 28, 2648–2657. doi: 10.1093/annonc/mdx401.
23. Bokemeyer, C., Kohne, C., Rougier, P., Stroh, C., Schlichting, M., & Van Cutsem, E. (2010). Cetuximab with chemotherapy (CT) as first-line treatment for metastatic colorectal cancer (mCRC): Analysis of the CRYSTAL and OPUS studies according to KRAS and BRAF mutation status. Journal of Clinical Oncology, 28, 3506. doi: 10.1200/jco.2010.28.15_suppl.3506.
24. Modest, D. P., Ricard, I., Heinemann, V., Hegewisch-Becker, S., Schmiegel, W., Porschen, R., … Reinacher-Schick, A. (2016). Outcome according to KRAS-, NRAS- and BRAF-mutation as well as KRAS mutation variants: Pooled analysis of five randomized trials in metastatic colorectal cancer by the AIO colorectal cancer study group. Annals of Oncology, 27(9), 1746–1753. doi: 10.1093/annonc/mdw261.
25. Koopman, M., Antonini, N. F., Douma, J., Wals, J., Honkoop, A. H., Erdkamp, F. L., … Loosveld, O. J. (2007). Sequential versus combination chemotherapy with capecitabine, irinotecan, and oxaliplatin in advanced colorectal cancer (CAIRO): A phase III randomised controlled trial. Lancet, 370, 135–142. doi: 10.1016/S0140-6736(07)61086-1.
26. Punt, C., Tol, J., Rodenburg, C., Cats, A., Creemers, G., Schrama, J., … Antonini, N. (2008). Randomized phase III study of capecitabine, oxaliplatin, and bevacizumab with or without cetuximab in advanced colorectal cancer (ACC), the CAIRO2 study of the Dutch Colorectal Cancer Group (DCCG). Journal of Clinical Oncology, 26, LBA4011. doi: 10.1200/jco.2008.26.15_suppl.lba4011.
27. Maughan, T. S., Adams, R. A., Smith, C. G., Meade, A. M., Seymour, M. T., Wilson, R. H., … Kenny, S. L. (2011). Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: Results of the randomised phase 3 MRC COIN trial. Lancet, 377, 2103–2114. doi: 10.1016/S0140-6736(11)60613-2.
28. Seymour, M. T., Maughan, T. S., Ledermann, J. A., Topham, C., James, R., Gwyther, S. J., … Ferry, D. R. (2007). Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): A randomised controlled trial. Lancet, 370, 143–152. doi: 10.1016/S0140-6736(07)61087-3.
29. Van Cutsem, E., Köhne, C. H., Láng, I., Folprecht, G., Nowacki, M. P., Cascinu, S., … Ciardiello, F. (2011). Cetuximab plus irinotecan, fluorouracil, and leucovorin as first-line treatment for metastatic colorectal cancer: Updated analysis of overall survival according to tumor KRAS and BRAF mutation status. Journal of Clinical Oncology, 29, 2011–2019. doi: 10.1200/JCO.2010.33.5091.
30. Rowland, A., Dias, M. M., Wiese, M. D., Kichenadasse, G., McKinnon, R. A., Karapetis, C. S., & Sorich, M. J. (2015). Meta-analysis of BRAF mutation as a predictive biomarker of benefit from anti-EGFR monoclonal antibody therapy for RAS wild-type metastatic colorectal cancer. British Journal of Cancer, 112, 1888–1894. doi: 10.1038/bjc.2015.173.
31. Taieb, J., Tabernero, J., Mini, E., Subtil, F., Folprecht, G., Van Laethem, J.-L., … Blons, H. (2014). Oxaliplatin, fluorouracil, and leucovorin with or without cetuximab in patients with resected stage III colon cancer (PETACC-8): An open-label, randomised phase 3 trial. Lancet Oncology, 15, 862–873. doi: 10.1016/S1470-2045(14)70227-X.
32. Yoon, H. H., Tougeron, D., Shi, Q., Alberts, S. R., Mahoney, M. R., Nelson, G. D., … Sargent, D. J. (2014). KRAS codon 12 and 13 mutations in relation to disease-free survival in braf–wild-type stage III colon cancers from an adjuvant chemotherapy trial (n0147 alliance). Clinical Cancer Research, 20, 3033–3043. doi: 10.1158/1078-0432.CCR-13-3140.
33. Amaki-Takao, M., Yamaguchi, T., Natsume, S., Iijima, T., Wakaume, R., Takahashi, K., … Miyaki, M. (2016). Colorectal Cancer with BRAF D594G Mutation Is Not Associated with Microsatellite Instability or Poor Prognosis. Oncology, 91, 162–170. doi: 10.1159/000447402.
34. Li, L., Ni, B. B., Zhong, Q. H., Liu, Y. H., Zhang, M. H., Zhang, K. P., … Wang, L. (2017). Investigation of correlation between mutational status in key EGFR signaling genes and prognosis of stage II colorectal cancer. Future Oncology, 13, 1473–1492. doi: 10.2217/fon-2017-0040.
35. Sinicrope, F. A., Shi, Q., Smyrk, T. C., Thibodeau, S. N., Dienstmann, R., Guinney, J., … Goldberg, R. M. (2015). Molecular markers identify subtypes of stage III colon cancer associated with patient outcomes. Gastroenterology, 148, 88–99. doi: 10.1053/j.gastro.2014.09.041.
36. Grady, W. M., & Carethers, J. M. (2008). Genomic and epigenetic instability in colorectal cancer pathogenesis. Gastroenterology, 135, 1079–1099. doi: 10.1053/j.gastro.2008.07.076.
37. Raut, C. P., Pawlik, T. M., & Rodriguez-Bigas, M. A. (2004). Clinicopathologic features in colorectal cancer patients with microsatellite instability. Mutation Research, 568, 275–282. doi: 10.1016/j.mrfmmm.2004.05.025.
38. Ward, R., Meagher, A., Tomlinson, I., O’connor, T., Norrie, M., Wu, R., & Hawkins, N. (2001). Microsatellite instability and the clinicopathological features of sporadic colorectal cancer. Gut, 48, 821–829. doi: 10.1136/gut.48.6.821.
39. Compton, C., Fenoglio-Preiser, C. M., Pettigrew, N., & Fielding, L. P. (2000). American Joint Committee on Cancer Prognostic Factors Consensus Conference: Colorectal Working Group. Cancer, 88, 1739–1757. doi: 10.1002/(SICI)1097-0142(20000401)88:7<1739::AID-CNCR30>3.0.CO;2-T.
40. Fang, S. H., Efron, J. E., Berho, M. E., & Wexner, S. D. (2014). Dilemma of stage II colon cancer and decision making for adjuvant chemotherapy. Journal of the American College of Surgeons, 219, 1056–1069. doi: 10.1016/j.jamcollsurg.2014.09.010.
41. Gelsomino, F., Barbolini, M., Spallanzani, A., Pugliese, G., & Cascinu, S. (2016). The evolving role of microsatellite instability in colorectal cancer: A review. Cancer Treatment Reviews, 51, 19–26. doi: 10.1016/j.ctrv.2016.10.005.
42. Popat, S., Hubner, R., & Houlston, R. S. (2005). Systematic review of microsatellite instability and colorectal cancer prognosis. Journal of Clinical Oncology, 23, 609–618. doi: 10.1200/JCO.2005.01.086.
43. Guastadisegni, C., Colafranceschi, M., Ottini, L., & Dogliotti, E. (2010). Microsatellite instability as a marker of prognosis and response to therapy: A meta-analysis of colorectal cancer survival data. European Journal of Cancer, 46, 788–2798. doi: 10.1016/j.ejca.2010.05.009.
44. Kim, C. G., Ahn, J. B., Jung, M., Beom, S. H., Kim, C., Kim, J. H., … Shin, S. J. (2016). Effects of microsatellite instability on recurrence patterns and outcomes in colorectal cancers. British Journal of Cancer, 115, 25–33. doi: 10.1038/bjc.2016.161.
45. Verzi, M. P., Shin, H., Ho, L. L., Liu, X. S., & Shivdasani, R. A. (2011). Essential and redundant functions of caudal family proteins in activating adult intestinal genes. Molecular Cell Biology, 31, 2026–2039. doi: 10.1128/MCB.01250-10.
46. Bonhomme, C., Duluc, I., Martin, E., Chawengsaksophak, K., Chenard, M., Kedinger, M., … Domon-Dell, C. (2003). The Cdx2 homeobox gene has a tumour suppressor function in the distal colon in addition to a homeotic role during gut development. Gut, 52, 1465–1471. doi: 10.1136/gut.52.10.1465.
47. Hryniuk, A., Grainger, S., Savory, J. G., & Lohnes, D. (2014). Cdx1 and Cdx2 function as tumor suppressors. Journal of Biological Chemistry, 289, 33343–33354. doi: 10.1074/jbc.M114.583823.
48. Dalerba, P., Sahoo, D., Paik, S., Guo, X., Yothers, G., Song, N., … Clarke, M. F. (2016). CDX2 as a Prognostic Biomarker in Stage II and Stage III Colon Cancer. New England Journal of Medicine, 374, 211–222. doi: 10.1056/NEJMoa1506597.
49. Tomasello, G., Barni, S., Turati, L., Ghidini, M., Pezzica, E., Passalacqua, R., & Petrelli, F. (2018). Association of CDX2 Expression with Survival in Early Colorectal Cancer: A Systematic Review and Meta-analysis. Clinical Colorectal Cancer, 17, 7–103. doi: 10.1016/j.clcc.2018.02.001.
50. Hansen, T. F., Kjaer-Frifeldt, S., Eriksen, A. C., Lindebjerg, J., Jensen, L. H., Sørensen, F. B., & Jakobsen, A. (2018). Prognostic impact of CDX2 in stage II colon cancer: Results from two nationwide cohorts. British Journal of Cancer, 119, 1367–1373. doi: 10.1038/s41416-018-0285-5.
51. Baba, Y., Nosho, K., Shima, K., Freed, E., Irahara, N., Philips, J., … Ogino, S. (2009). Relationship of CDX2 loss with molecular features and prognosis in colorectal cancer. Clinical Cancer Research, 15, 4665–4673. doi: 10.1158/1078-0432.CCR-09-0401.
52. Bruun, J., Sveen, A., Barros, R., Eide, P. W., Eilertsen, I., Kolberg, M., … Kallioniemi, O. (2018). Prognostic, predictive, and pharmacogenomic assessments of CDX 2 refine stratification of colorectal cancer. Molecular Oncology, 12, 1639–1655. doi: 10.1002/1878-0261.12347.
53. Slik, K., Turkki, R., Carpen, O., Kurki, S., Korkeila, E., Sundstrom, J., & Pellinen, T. (2019). CDX2 Loss With Microsatellite Stable Phenotype Predicts Poor Clinical Outcome in Stage II Colorectal Carcinoma. American Journal of Surgical Pathology, 43, 1473–1482. doi: 10.1097/PAS.0000000000001356.
54. Siravegna, G., Marsoni, S., Siena, S., & Bardelli, A. (2017). Integrating liquid biopsies into the management of cancer. Nature Reviews Clinical Oncology, 14, 531–548. doi: 10.1038/nrclinonc.2017.14.
55. Rompianesi, G., Di Martino, M., Gordon-Weeks, A., Montalti, R., & Troisi, R. (2021). Liquid biopsy in cholangiocarcinoma: Current status and future perspectives. World Journal of Gastrointestinal Oncology, 13, 332–350. doi: 10.4251/wjgo.v13.i5.332.
56. Parikh, A. R., Leshchiner, I., Elagina, L., Goyal, L., Levovitz, C., Siravegna, G., … Corcoran, R. B. (2019). Liquid versus tissue biopsy for detecting acquired resistance and tumor heterogeneity in gastrointestinal cancers. Nature Medicine, 25, 1415–1421. doi: 10.1038/s41591-019-0561-9.
57. Di Nicolantonio, F., Vitiello, P. P., Marsoni, S., Siena, S., Tabernero, J., Trusolino, L., Bernards, R., & Bardelli, A. (2021). Precision oncology in metastatic colorectal cancer-from biology to medicine. Nature Reviews Clinical Oncology, 18, 506–525. doi: 10.1038/s41571-021-00495-z.
58. Galarza Fortuna, G. M., & Dvir, K. (2020). Circulating tumor DNA: Where are we now? A mini review of the literature. World Journal of Clinical Oncology, 11, 723–731. doi: 10.5306/wjco.v11.i9.723.
59. Siravegna, G., Lazzari, L., Crisafulli, G., Sartore-Bianchi, A., Mussolin, B., Cassingena, A., … Bardelli, A. (2018). Radiologic and Genomic Evolution of Individual Metastases during HER2 Blockade in Colorectal Cancer. Cancer Cell, 34, 148–162. doi: 10.1016/j.ccell.2018.06.004.
60. Tie, J., Kinde, I., Wang, Y., Wong, H. L., Roebert, J., Christie, M., … Gibbs, P. (2015). Circulating tumor DNA as an early marker of therapeutic response in patients with metastatic colorectal cancer. Annals of Oncology, 26, 1715–1722. doi: 10.1093/annonc/mdv177.
61. Reinert, T., Schøler, L. V., Thomsen, R., Tobiasen, H., Vang, S., Nordentoft, I., … Andersen, C. L. (2016). Analysis of circulating tumour DNA to monitor disease burden following colorectal cancer surgery. Gut, 65, 625–634. doi: 10.1136/gutjnl-2014-308859.
62. Benhaim, L., Bouché, O., Normand, C., Didelot, A., Mulot, C., Le Corre, D., … Laurent-Puig, P. (2021). Circulating tumor DNA is a prognostic marker of tumor recurrence in stage II and III colorectal cancer: Multicentric, prospective cohort study (ALGECOLS). European Journal of Cancer, 159, 24–33. doi: 10.1016/j.ejca.2021.09.004.
63. Reinert, T., Henriksen, T. V., Christensen, E., Sharma, S., Salari, R., Sethi, H., … Lindbjerg Andersen, C. (2019). Analysis of Plasma Cell-Free DNA by Ultradeep Sequencing in Patients With Stages I to III Colorectal Cancer. JAMA Oncology, 5, 1124–1131. doi: 10.1001/jamaoncol.2019.0528.
64. SEER: An Interactive Website for SEER Cancer Statistics. Surveillance Research Program. National Cancer Institute, 2023. Retrieved from surveillance.cancer.gov.
65. American Cancer Society. Cancer Facts & Figures 2023. American Cancer Society, Atlanta, GA, 2023. Retrieved from http://www.cancer.org/ research/cancer-facts-statistics/ all-cancer-facts-figures/2023-cancer-facts-figures.html.
66. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2021). Рак в Україні, 2019–2020. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. (Vol. 22). Кропивницький: Поліум.
Адреса для листування:
Рудь Ігор Миколайович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: rud_ihor@ukr.net
Correspondence:
Igor Rud
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: rud_ihor@ukr.net














Leave a comment