Про створення концепції розвитку раку легень
Болгова Л.С., Туганова Т.М., Алексєєнко О.І.
Резюме. Висока захворюваність на рак легень (РЛ) (2,1 млн) і смертність від нього (1,7 млн) кожного року у всьому світі становить велику проблему в галузі онкопульмонології. Відомо, що РЛ діагностують у 60–70% усіх хворих з ІІІ–ІV стадіями, коли вже неможливо провести повний курс спеціальної терапії. Таке положення потребує всебічного вивчення проблеми РЛ. Одним з головних запитань є вивчення гістогенезу, від чого залежить точність морфологічної діагностики, характер лікування і його ефективність. Проведення наукових досліджень з питань морфологічної діагностики РЛ: нам удалося виявити дані в науковій літературі, які дозволили уточнити тонкощі структури легень, що має безпосереднє значення до початку розвитку патологічних процесів в органі — це місце переходу базального епітелію бронхів в альвеолярний. Доведено, що саме це місце є найбільш уразливе в процесі розвитку патологічного процесу. Установлена стовбурова клітина (СК) легень — альвеолярний епітелій 2-го типу, з якого бере початок будь-який патологічний процес у легенях і, зокрема, РЛ. У результатах наших досліджень виявлено, що початок росту РЛ починається під циліндричним епітелієм. За численними гістологічними препаратами плоскоклітинного, залозистого і дрібноклітинного типів раку зафіксований ріст РЛ від базальної мембрани альвеоли до її центру, де розвивається некроз, як загальновідомий факт патогенезу епітеліальних пухлин, що виникає при нестачі кровопостачання. Отже, враховуючи дані фундаментальних публікацій, причетних до проблеми РЛ і результатів наших досліджень, нами установлено, що РЛ починає свій ріст з місця переходу базального епітелію бронхів і росте в альвеолах. Про напрямок його росту свідчать імуногістохімічні дослідження, за допомогою яких визначені ознаки вираженої проліферації в базальних рядах новоутворення і слабкої реакції або відсутність її при наближенні пухлини до центру альвеоли. Установлений нами феномен є пріоритетним, не описаним у науковій літературі та таким, що пояснює безсимптомність початку розвитку РЛ і низьку виживаність.
Одержано 30.08.2024
Прийнято до друку 13.09.2024
DOI: 10.32471/clinicaloncology.2663-466X.55-3.33274
Висока захворюваність на РЛ (2,1 млн) і смертність від нього (1,7 млн) кожного року в усьому світі становить велику проблему у сфері онкології і, зокрема, онкопульмонології. Відомо, що РЛ виявляють у 60–70% усіх пацієнтів на ІІІ–ІV стадіях, коли вже неможливо провести курс спеціальної терапії [1, 2]. Для розкриття сутності цього патологічного процесу може допомогти вивчення гістогенезу РЛ. Працюючи більш ніж 50 років у галузі морфологічної (цитологічної та гістологічної) діагностики пухлин легень, ми вивчили спеціальну літературу з різних питань стосовно структури легень у нормі [3], визначення СК легень [4, 5], результати численних експериментальних досліджень за 20 років нинішнього сторіччя, присвячених вивченню гістогенезу РЛ, аналіз яких провела G. Ferone (2021) [6]. Вченими також відмічена неоднорідність структури РЛ. В одному пухлинному вузлі виявляються різні гістологічні типи РЛ, але до цього часу в науковій літературі немає єдиного обґрунтованого доказу гістогенезу РЛ. Великий досвід у морфологічній діагностиці РЛ і результати наших наукових досліджень, які опубліковані у фахових журналах [7–17], з урахуванням даних багатьох фундаментальних монографій відомих вчених світу [3–5], дозволили нам створити концепцію розвитку РЛ.
Так, Ф. Неттер (2019) [3] ілюструє доказові анатомічні дані стосовно росту бронхіолоальвеолярних структур від бронхів різного калібру, тобто будова легень в центральних і периферичних відділах органа має подібну структуру, це свідчить про можливість початку розвитку РЛ в будь-якій частині легень, що має безпосереднє відношення до наших досліджень (рис. 1).
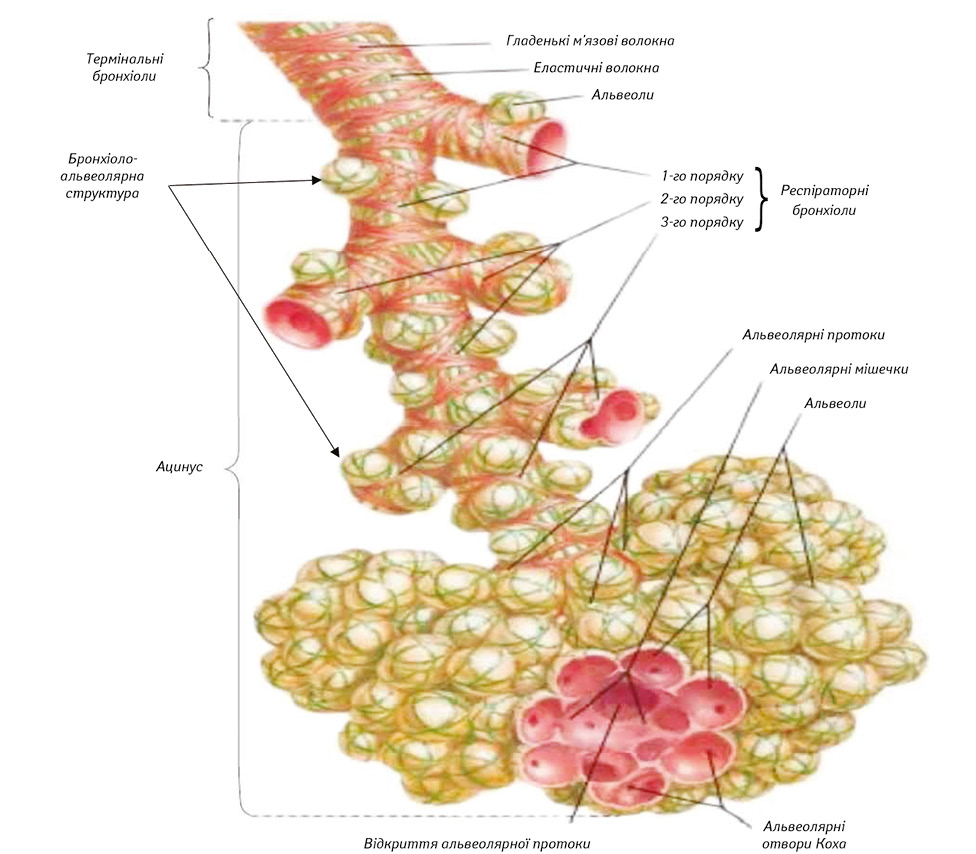
Водночас І. Esipova (1975) [18] на основі морфологічних і фізіологічних досліджень дійшла до важливого висновку про те, що всі патологічні процеси в легенях починаються з термінальних бронхіол, які знаходяться і в центральних, і периферичних відділах органа. Це положення ухвалене Міжнародною номенклатурою і має вирішальне значення в розкритті морфологічної сутності патологічних процесів різного генезу і, зокрема, у вивченні розвитку РЛ. У наших дослідженнях доведене вищезгадане положення.
Фундаментальні публікації Е.Weibel (1970) [4], А. Загорулько і Т. Аскара (2002) [5] дозволили авторам визначити СК легень, якою є пневмоцит (альвеолоцит ІІ типу, АТІІ). Логічно визнати, що АТІІ є СК РЛ. Вивчаючи гістологічні препарати різних типів РЛ, ми виявили і продемонстрували на відповідних мікрофотографіях початок і направлення росту цього патологічного процесу з базальних клітин альвеол до їх центру.
Відомо також, що СК легень фіксуються в нішах упродовж усього бронхіального дерева, що підтверджує можливість мультифокального росту РЛ [19]. Подібні явища ми виявили в наших дослідженнях.
Вивчаючи зміни епітеліальних клітин у бронхіальному епітелії при патологічних процесах у легенях, численні автори встановили місце переходу базального епітелію бронхів в альвеолярний і подальший розвиток захворювання в альвеолах [20–23] (рис. 2). Зафіксований факт має важливе загальне біологічне і патологоанатомічне значення. Це місце стику 2 типів епітелію, бронхіального і альвеолярного, є найбільш уразливе в людському організмі — «Status resistance minimum». Прикладом подібного є місце стику, де відбувається трансформація циліндричного епітелію цервікального каналу в плоский епітелій ектоцервіксу, тобто місце, де розвиваються передрак і рак шийки матки, на чому ґрунтується і підтверджений багаторічною медичною практикою скринінг наведених захворювань у жінок усього світу. Таке місце переходу базального епітелію бронхів в альвеолярний виявити не завжди просто, але правильність патогенетичного напрямку розвитку захворювання допомогла вченим продемонструвати це явище на схемі (див. рис. 2). Водночас ріст РЛ в альвеолах ми ідентифікували у всіх препаратах різних гістологічних типів, що є нашим пріоритетним дослідженням, який не висвітлений у спеціальній літературі.
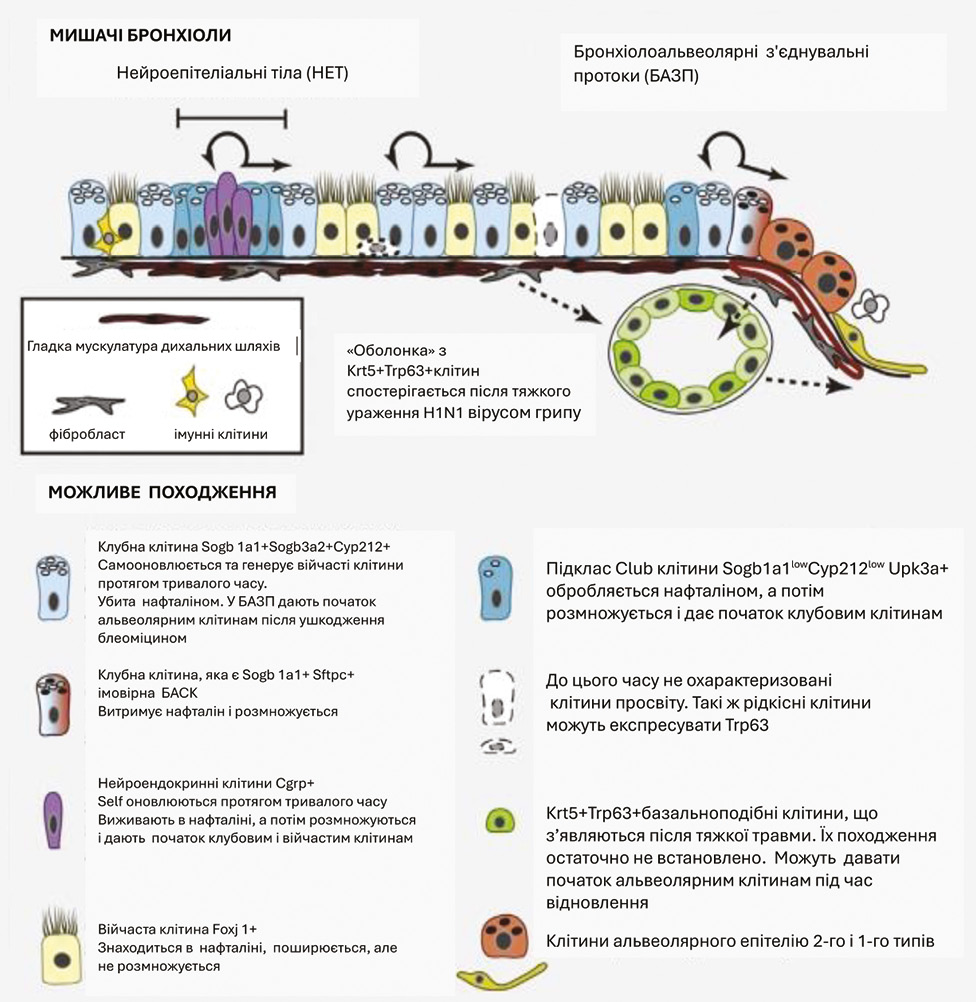
Про 2 джерела розвитку РЛ зазначають A. Have-Opbroek та співавт. (1997) [24], але наші дослідження не підтверджують таку думку.
Водночас вищезгадані автори передбачають онтофетальний механізм диференціювання клітин бронхіального епітелію. Цей висновок підтримали J. Kathiriya та співавт. (2020) [25]. Автори довели, що ушкоджені клітини циліндричного епітелію в процесі відновлення спочатку набувають ознак альвеолярного епітелію, а потім поступово диференціюються в зрілий циліндричний тип. Отримані результати дозволили авторам вважати клітини альвеолярного епітелію онтогенетичними СК легень, а відтак і СК РЛ. Дані знаходять підтвердження в наших дослідженнях.
I. Вertoncello (2015) [26] стверджує, що залозистий РЛ (ЗРЛ) починає свій ріст виключно з клітин альвеолярного епітелію. Т. Colbу та співавт. (2004) [27], вивчаючи структуру ЗРЛ, знаходили в ній клітини альвеолярного, різних клітин циліндричного епітелію і дійшли висновку, що з цих клітин може починати свій розвиток аденокарцинома. Враховується те, що наразі в науковій літературі та медичній практиці онкопульмонології розрізняють 2 типи РЛ, які найбільш часто діагностують, — плоскоклітинний і ЗРЛ які прийнято називати недрібноклітинними, можна передбачити єдиний їх генез, який ми виявляємо при вивченні гістологічних препаратів.
Згадаємо, що в ХХІ ст. опубліковано більш ніж 60 статей з результатами експериментальних досліджень, присвячених гістогенезу РЛ. G. Ferone (2021) [6] проведено аналіз цих публікацій, і вона дійшла висновку про їх неоднозначність, тобто автори не знайшли єдиного консенсусу щодо гістогенезу РЛ і, отже, питання залишається відкритим.
Відомі дослідники констатували, що в одному вузлі пухлини можна знайти ділянки різних гістологічних типів і ступенів диференціювання РЛ [28–33], і ми теж виявляли подібні структури в операційних матеріалах хворих на РЛ. Отримані однозначні результати численних авторів свідчать про єдине джерело розвитку РЛ, але до цього часу ніхто не переконав вчених у правильності такого висновку. Про це свідчать дані Всесвітньої організації охорони здоров’я (ВОOЗ) та міжнародних гістологічних класифікацій (МГК) пухлин легень останніх видань [34, 35]. Експерти виключили з МГК бронхіолоальвеолярний тип РЛ. Можливо, така конструкція має певну формальну новизну, але при цьому втрачається гістогенетична складова, а це свідчить про невизначеність гістогенезу РЛ та обґрунтовує необхідність подальших досліджень.
РЕЗУЛЬТАТИ НАШИХ ДОСЛІДЖЕНЬ
Проведені нами наукові дослідження морфологічної діагностики РЛ на клітинному, субклітинному і тканинному рівнях з використанням різних методів забарвлення, імуногістохімічних та гістогенетичних (за визначенням негістонових білків ДНК і РНК в ядрах за допомогою імпрегнації розчином срібла) досліджень протягом декількох десятиріч дозволило отримати оригінальні результати, опубліковані у фахових журналах у 1999–2023 [3–14]. Підготовлена і видана нами спеціальна монографія [10]. Зроблені доповіді на з’їздах і конференціях в Україні і за кордоном.
Зокрема, проведені нами спеціальні дослідження зіскребків з поверхні екзофітних пухлин у бронхах на операційному матеріалі дозволили впевнитися, що РЛ починає свій ріст під циліндричним епітелієм. Так, у зіскребках, зроблених з поверхні новоутворень, лише в 36% усіх випадків отримані ракові клітини, які виявлені в цитологічних препаратах, що свідчить про проростання пухлини через шар циліндричного епітелію. У решти зіскребків знайдений тільки циліндричний епітелій, тобто новоутворення росло під ним.
Виконані морфометричні дослідження росту пухлини в бронхах і перибронхіально у 120 хворих дозволило встановити, що перибронхіальна частина новоутворення в 5–40 разів більша, ніж ендобронхіальна. Перибронхіальний ріст виявлено в 94 (78%) осіб, тільки ендобронхіальний — у 20 (17%) і ендо-перибронхіальний — у 6 (5%). Отримані дані переконливо свідчать про значну перевагу перибронхіального росту РЛ.
Вивчені особливості гістологічної структури РЛ у 120 хворих, які обстежувалися і лікувалися в Державному некомерційному підприємстві (ДНП) «Національний інститут раку». Гістологічні препарати забарвлювали гематоксилином і еозином, а також за методом Папаніколау. Для визначення ступеня проліферації клітин використали моноклональні антитіла — Ki-67 та ядерного антигену проліферувальних клітин (Proliferating Cell Nuclear Antigen — PCNA).
Також на гістологічних препаратах використано імпрегнацію розчином срібла за методикою W.M. Howell та D.A. Black [36] для визначення морфофункціональних типів ядерцевих організаторів і аргентофільних позаядерцевих гранул для якісної і кількісної оцінки нуклеопротеїдних компонентів як гістогенетичної складової.
Досліджена гістологічна структура плоскоклітинного раку легень (ПРЛ) дозволила виявити ріст пухлини в альвеолах в 100% усіх спостережень, ріст ЗРЛ в альвеолах виявлений у 85%, а дрібноклітинного — в 60% (рис. 3–6).
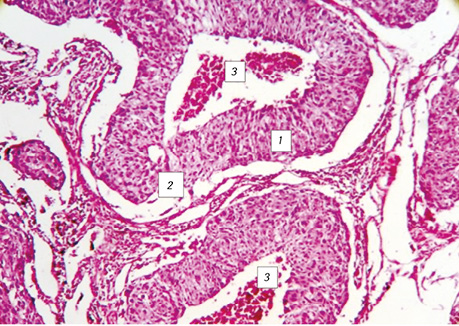
×1000
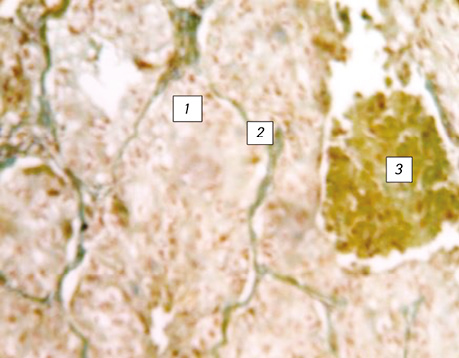
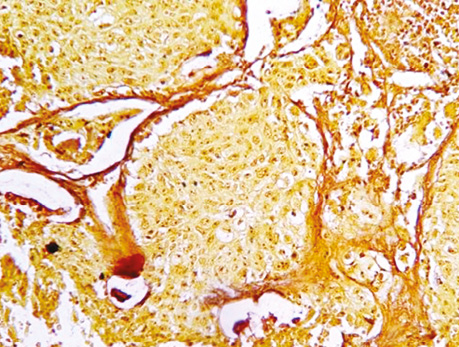
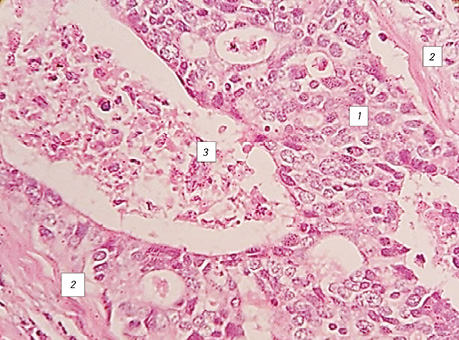
У багатьох випадках зафіксовано проростання раку через базальну мембрану, коли пухлина росла поза альвеолою у вигляді солідного пласта, створюючи поліморфізм гістологічної структури всіх типів РЛ (див. рис. 5). Крім того, у різних місцях гістологічних препаратів недрібноклітинного РЛ відмічалися альвеоли округлої, видовженої та неправильної форми, що тільки знаючи ідеологію росту РЛ, можна правильно оцінити та ідентифікувати морфологічний тип пухлини. На різних зрізах у гістологічних препаратах РЛ прослідковуються бронхи малих розмірів, в яких можна зафіксувати незмінений циліндричний епітелій, відмічаються також альвеоли без пухлинного ураження. Охарактеризована структура передбачає різні показники імуногістохімічних реакцій, які складно оцінити чи класифікувати.
Уперше в медичній літературі ми демонструємо установлений характерний ріст РЛ в альвеолах, який бере початок від базальної мембрани і розростається в напрямку до її центру (рис. 3–4, 6–10), що підтверджується морфологічними ознаками клітин, їх розгалуженням, інтенсивністю їх забарвлення і некрозом ракових клітин у центрі альвеол. Визначаються ракові клітини, які відпадають від пухлинного солідного шару і потрапляють у некротичні маси. Цей послідовний процес від базального епітелію з високою проліферативною активністю до некротичних змін клітин у центрі альвеоли відповідає загальновідомій морфологічній закономірності росту епітеліальних пухлин (морфогенезу), який супроводжується розпадом тканини в її центрі у зв’язку з нестачею кровопостачання внаслідок інтенсивного росту новоутворення.
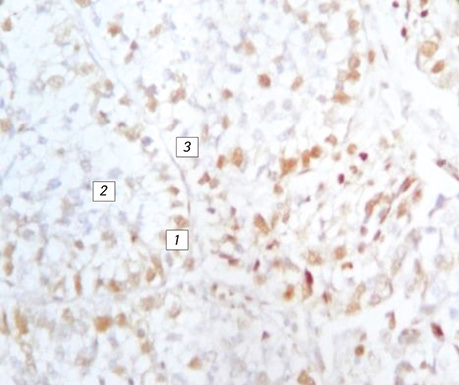
Гістологічний препарат, ×200
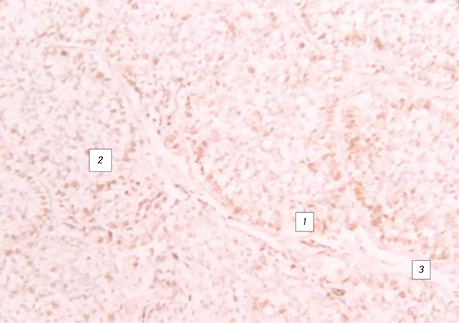
реакція — PCNA. Гістологічний препарат, ×200
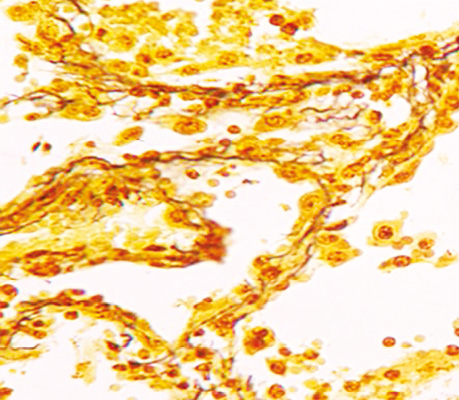
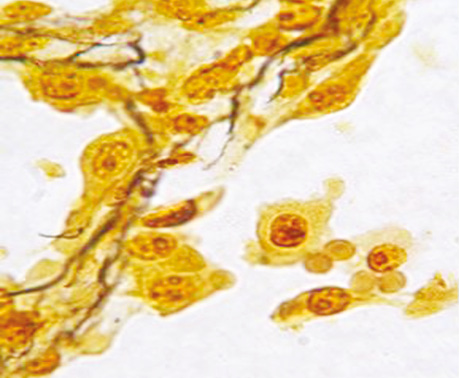
Ріст РЛ в альвеолах підтверджується також наявністю міжальвеолярних перетинок, в яких часто прослідковуються судини з еритроцитами. Використання методики забарвлення за Папаніколау дозволяє легко ідентифікувати міжальвеолярні перетинки, які забарвлюються в зелений колір, на відміну від ракової тканини, що набуває коричневих тонів (див. рис. 4).
Поряд з цим імуногістохімічні реакції з моноклональними антитілами Ki-67 і PCNA дають позитивну реакцію клітин, які ростуть від базальної мембрани, і від’ємну — в клітинах, що наближаються до центру альвеоли, де вони некротизуються (див. рис. 7–8).
Вивчені якісні і квантитативні показники морфофункціональних типів ядерцеутворювальних регіонів (МФТ ЯУР) хромосом клітин недрібноклітинного РЛ, які свідчать про подібний рівень нуклеопротеїдних процесів, в ядрах залозистого (8,7±0,1) і плоскоклітинного — (7,9±0,1) раку, що наближує їх за біологічною сутністю і опосередковано може свідчити про єдиний їх генезис. Визначені доказові показники МФТ ЯУР хромосом в ядрах СК без морфологічних змін (3,8±0,1), з ознаками проліферації й атипії (5,3±0,1), що може свідчити про кількісний ріст нуклеопротеїдних речовин у СК і підтверджувати процес їх малігнізації, тобто бути джерелом розвитку РЛ [12–17].
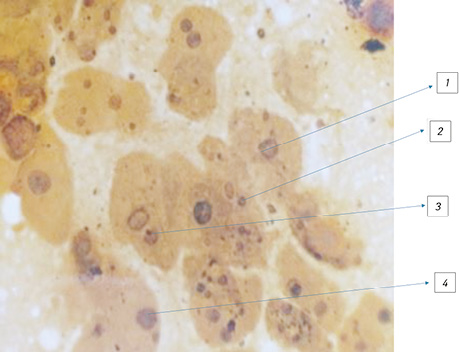
Проведені дослідження гістологічних препаратів помірно- і низькодиференційованого плоскоклітинних типів РЛ, імпрегнованих розчином срібла за методом W.M.Howell, D.A. Black [37], дозволили виявити позаядерцеві аргентофільні гранули (ПЯАГ) в клітинах АТІІ без морфологічних змін, з ознаками проліферації і вираженої атипії, характерної для пухлини. Установлена закономірність підвищення показників і характеру локалізації ПЯАГ в міру наростання ознак проліферації і атипії в альвеолярних клітинах, що підтверджує доказовим квантитативним методом можливість їх малігнізації і пухлинної трансформації, що може свідчити про розвиток РЛ з альвеолярного епітелію (рис. 9–11).
Електронно-мікроскопічні дослідження макроскопічно незміненої паренхіми частки легень, видаленої у хворого з низькодиференційованою аденокарциномою, дозволили на субмікроскопічному рівні визначити ознаки атипії в СК (рис. 12–13), що підтверджує процес їх малігнізації, продемонстрований на мікрофотографіях на клітинному, тканинному і субклітинному рівнях дослідження [3–6, 9–13].
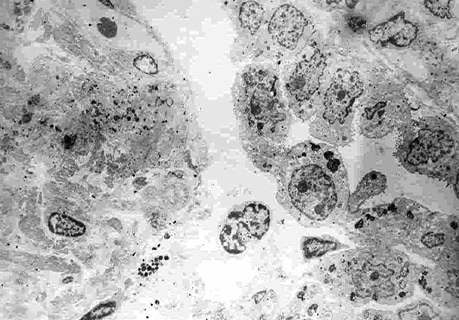
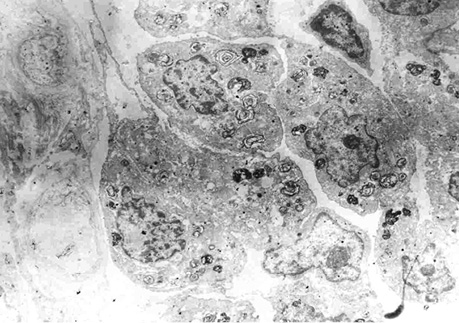
Спеціальні дослідження дозволили виявити пухлинні клітини і АТІІ з характерними морфологічними ознаками в макроскопічно незміненій паренхімі видаленої частки легені з пухлиною. Для цього проведено цитологічне дослідження у 23 хворих.
З поверхні розрізів макроскопічно незміненої паренхіми легені на відстані 2 см і найбільш віддаленої ділянки — 5 см від периферичного краю новоутворення (до вісцеральної плеври) зроблені зіскребки з подальшим вивченням цитологічних препаратів [7]. У результаті досліджень установлено, що у всіх зазначених місцях на різній відстані від периферичного краю видаленої пухлини діагностовані клітини раку і АТІІ з ознаками проліферації й атипії, що свідчить про наявність ракових клітин у незміненій паренхімі від периферичного краю видаленої пухлини до вісцеральної плеври, що може свідчити про можливість пролонгації ракового процесу в інших частинах легень. Логічно передбачити такі зміни в інших долях легень, чим можна пояснити низьку виживаність хворих на РЛ.
Отже, обґрунтування джерела розвитку зі СК (АТІІ) і виявлених особливостей гістологічної структури росту РЛ стало можливим лише завдяки створенню нами концепції розвитку цього захворювання на основі особистих комплексних морфологічних досліджень [12–17] і результатів відповідних незалежних фундаментальних публікацій учених з різних країн світу (Weibel E.R., 1970 [4]; Esipova I., 1975 [18]; Загорулько А.К. та співавт., 2002 [5]; Nicholson S., 2001 [30]; Hogan B.L. та співавт., 2014 [21]; Frank D.B. та співавт., 2019 [22]; Ferone G. та співавт., 2021 [6] та ін.).
На основі багаторічних результатів наукових досліджень з урахуванням відповідних даних наукової літератури нами створена концепція розвитку РЛ зі СК (АТІІ) та виявлених особливостей його гістологічної структури (початок розвитку РЛ від базальної мембрани альвеоли до її центру, де розвивається некроз з наявністю пухлинних клітин, які некротизуються і потрапляють у центр альвеоли — як відомий феномен морфогенезу епітеліальних пухлин), не описаний у медичній літературі науковий факт і є пріоритетом нашого дослідження.
Створена концепція на основі наших досліджень і різнопланових відповідних даних наукової літератури дозволяє сформулювати низку установлених важливих для онкопульмонологів та онкоморфологів висновків, які пояснюють, що:
1) існує єдине джерело розвитку різних гістологічних типів РЛ — СК — альвеолярний епітелій 2-го типу (АТІІ), установлений нами за гістологічними препаратами 120 досліджених хворих;
2) безсимптомний початок розвитку РЛ з клітин АТІІ, локалізованих в альвеолах, яких в організмі людини нараховується 300–400 млн, пояснюється ураженням тільки їх частини і сприяє пролонгації пухлини до тих пір, поки почне проявлятися фатальна клінічна картина і хворий звертається по медичну допомогу, у цей час у 60–70% усіх пацієнтів діагностують ІІІ–ІV стадії захворювання, коли найімовірніше уже неможливо провести повний комплекс ефективного лікування, чим пояснюється низька виживаність (висока смертність) хворих на РЛ;
3) розвиваються швидкі рецидиви після оперативного лікування навіть у I клінічній стадії РЛ (за даними наукової літератури), що свідчить про можливий ріст патологічного процесу в альвеолах, який макроскопічно не може виявитися під час оперативного втручання, але нами встановлено за матеріалами зіскребків з розрізів незміненої паренхіми легень на відстані 2 і 5 см від периферичного краю видаленої пухлини наявність ракових клітин і СК з ознаками проліферації і атипії, які являються можливим потенціальним зачатком нових ракових розростань; зазначений розвиток патогенезу РЛ можливий і в інших долях легень, що може пояснити низьку виживаність і високу смертність хворих з цією онкопатологією;
4) відомі первинно множинні пухлинні вузли в легенях S. Nicholson (2001) [30], E.S. Grigoryeva та співавт. [36] та ін. підтверджують мультифокальний ріст РЛ, який відомий за експериментальними моделями (G. Ferone та співавт., 2021) і співпадає з результатами наших досліджень;
5) вивчення початку розвитку РЛ за допомогою експериментальних методів неможливе, тому що не існують доказові методи визначення початку малігнізації окремих клітин, а в експерименті пухлину досліджують у тих випадках, коли рентгенологічними методами виявляється вже об’ємне новоутворення, яке не може вважатися початковим етапом малігнізації клітин і послідовного розвитку РЛ;
6) установлений нами характерний початковий і пролонгований ріст РЛ за множинними гістологічними препаратами різних морфологічних типів можуть взяти до уваги експерти ВООЗ зі створення МГК новоутворень легень.
У висновку можна констатувати, що врахування результатів наших досліджень може кардинально змінити підходи до морфологічної та рентгенологічної діагностики РЛ, сприяти розробленню нового можливого способу введення лікарських циторедуктивних і інших препаратів, а також створенню аргументованих програм профілактики цього захворювання.
Список використаної літератури
1. Федоренко, З. П., Михайлович, Ю. Й., Гулак, Л. О., Сумкіна, О. В., Горох, Є. Л., & Куценко, Л. Б. (2022). Рак в Україні, 2020–2021. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. (Т. 23). Кропивницький: Поліум.
2. Sung, H., Ferlay, J., Siegel, R. L., Laversanne, M., Soerjomataram, I., Jemal, A., & Bray, F. (2021). Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. Cancer Journal for Clinicians, 71(3), 209–249. doi.org/10.3322/caac.21660.
3. Netter, F. (2019). Atlas of human anatomy. Amsterdam: Elsevier.
4. Weibel, E. R. (1970). Morphometry of human lungs. Berlin: Springer.
5. Загорулько, А. К., & Аскари, Т. А. (2002). Атлас ультраструктурной морфологии респираторного отдела легких. Симферополь: «AZ — PRESS» — «СОНАТ».
6. Ferone, G., Lee, M. C., Sage, J., & Berns, A. (2020). Cells of origin of lung cancers: lessons from mouse studies. Genes & Development, 34(15–16), 1017–1032. doi: 10.1101/gad.338228.120.
7. Болгова, Л. С., Aлeксeeнкo, O. I., Tугaнoвa, T. Н., Зотиков, Л. A., & Кротевич, М. С. (2008). Цитологические, цитогенетические и ультраструктурные исследования при изучении гистогенеза железистого рака легкого. Oнкология, 10(3), 334–338.
8. Bolgova, L., Shypko, A., Tuganova, T., Alekseenko, O., Smolanka, I., Ponomarenko, A., & Bilko, N. (2023). New data on histogenesis and histological structure of lung cancer. Experimental oncology, 45(1), 62–69. doi.org/10.15407/exp.-oncology.2023.01.062.
9. Болгова, Л. С. (1999). О гистогенезе рака легкого. Онкология, 4, 262–265.
10. Болгова, Л. С., & Туганова Т. Н. (2013). Рак легкого: вопросы гистогенеза и цитологической диагностики. Київ: KIM.
11. Болгова, Л. С., & Ярощук, Т. М. (2010). Гистогенез рака легкого. Вопросы онкологии, 56(4), 469–476.
12. Болгова, Л. С., Tуганова, T. Н., Aлексеенко, O. I., Кротевич, М. С., & Шестакова, Т. С. (2010). Патологоанатомическое изучение характера роста и распространение рака легкого для уточнения гистогенеза. Онкология, 12(1), 112–126.
13. Болгова, Л. С., Туганова, Т. Н., Алексеенко, О. И., & Ярощук, Т. М. (2011). Исследование ядрышковых организатооов хромосом в эпителии паренхимы легкого для уточнения гистогенеза железистого рака. Онкология, 13(1), 17–21.
14. Bolgova, L. S., Tuganova, T. N., Alekseenko, O. I., Litvinets, O. M., Suprun, G. A., & Ponomarenko, A. A. (2020). Histogenesis of central lung cancer: cytological investigation. Experimental oncology, 42(4), 310–313. doi.org/10.32471/exp-oncology.2312-8852.vol-42-no-4.15232.
15. Болгова, Л. С., Туганова, Т. Н., Алексєєнко, О. І., Ярощук, Т. М., Махортова, М. Г., Логінова, Є. О., … Богоніс, Н. В. (2021). Можливості ексфоліативної цитологічної діагностики залежно від характеру росту раку легені. Клінічна онкологія, 11(3–4), 146–149. doi: 10.32471/clinicaloncology.2663-466X.43-3.28332.
16. Болгова, Л. С., Туганова, Т. М., Алексєєнко, О. І., Пономаренко, А. О., & Захаричев, В. Д. (2022). Гістогенез раку легені — етапи дослідження. Медична інформатика та інженерія, 3(59), 30–41. doi.org/1011603/mie.1996-1960.2022.3.13371.
17. Bolgova, L. S., Tuganova, T. N., Alekseenko, O. I., & Ponomarenko, A. A. (2022). On the origin of lung cancer development. Experimental oncology, 44(1), 17–22. doi.org/10.32471/exp-oncology.2312-8852.vol-44-no-1.17227.
18. Esipova I. (1975). Lung in pathology. Part I. Nauka.
19. Navarro, S., & Driscoll, B. (2017). Regeneration of the Aging Lung: A Mini-Review. Gerontology, 63(3), 270–280. doi.org/10.1159/00045108.
20. Kim, C. F., Jackson, E. L., Woolfenden, A. E., Lawrence, S., Babar, I., Vogel, S., … Jacks, T. (2005). Identification of bronchioloalveolar stem cells in normal lung and lung cancer. Cell, 121(6), 823–835. doi: 10.1016/j.cell.2005.03.032.
21. Hogan, B. L., Barkauskas, C. E., Chapman, H. A., Epstein, J. A., Jain, R., Hsia, C. C., … Morrisey, E. E. (2014). Repair and Regeneration of the Respiratory System:Complexity, Plasticity, and Mechanisms of Lung Stem Cell Function. Cell Stem Cell, 15(2), 123–138. doi.org/10.1016/j.stem.2014.07.012.
22. Frank, D. B., Penkala, I. J., Zepp, J. A., Sivakumar, A., Linares-Saldana, R., Zacharias, W. J., … Morrisey, E. E. (2019). Early lineage specification definesalveolar Epithelial ontogeny in the murine lung. Proceedings of the National Academy of Sciences of the United States of America, 116(10), 4362–4371. doi.org/10.1073/pnas.1813952116.
23. Sainz de Aja, J., Dost, A. F. M., & Kim, C. F. (2021). Alveolar progenitor cells and the origin of lung cancer. Journal of Internal Medicine, 289(5), 629–635. doi: 10.1111/joim.13201
24. Have-Opbroek, A. A., Benfield, J. R., van Krieken, J. H., & Dijkman, J. H. (1997). The alveolar type II cell in the genesis of human adenocarcinomas and squamous cell carcinomas. Histopathology, 12, 319–336.
25. Kathiriya, J. J., Brumwell, A. N., Jackson, J. R., Tang, X., & Chapman, H. A. (2020). Distinct Airway Epithelial Stem Cells Hide among Club Cells but Mobilize to Promote Alveolar Regeneration. Cell Stem Cell, 26(3), 346–358.e4. doi:10.1016/j.stem.2019.12.014.
26. Bertoncello, I. (2015). Stem Cells in the Lung. Devlopment, Repair and Regeneration. Springer.
27. Colby, T. V., Noguchi, M., Henschke, C., Vazquez, M. F., Geisinger, K., Yokose, T., … Jen, J. (2004). Tumours of the lung: Adenocarcinoma. In W. D. Тravis, E. Brambilla, H. K. Muller-Hermelink, & C. C. Harris (Eds.), Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart, 35–36. Lyon: IARC Press.
28. Lin, M. W., Su, K. Y., Su, T. J., Chang, C. C., Lin, J. W., Lee, Y. H., … Hsieh, M. S. (2018). Clinicopathological and genomic comparisons between different histologic components in combined small cell lung cancer and non-small lung cancer. Lung Cancer, 125, 282–290. doi: 10.1016/j.lungcan.2018.10.006.
29. Okudela, K., Kojima, Y., Matsumura, M., Arai, H., Umeda, S., Tateishi, Y., … Ohashi, K. (2018). Relationship between non-TRU lung adenocarcinomas and Bronchiolar metaplasia — potential implication in their histogenesis. Histology and Histopathology, 33(3), 317–326. doi: 10.14670/HH-11-935.
30. Nicholson, A. G., Perry, L. J., Cury, P. M., Jackson, P., McCormick, C. M., Corrin, B., & Wells, A. U. (2001). Reproducibility of the WHO/IASLC grading system for pre-invasive squamous lesion of the bronchus a study of inter-observer and intra-observer variation. Histopathology, 38(3), 202–8. doi: 10.1046/j.1365-2559.2001.01078.x.
31. Gazdar, A., Franklin, W. A., Brambilla, E., Hainaut, P., Yokota, J., & Harris, C. C. (2004). Tumours of the lung: Genetic and molecular alterations. In W. D. Тravis, E. Brambilla, H. K. Muller-Hermelink, & C. C. Harris (Eds.), Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart, 21–23. Lyon: IARC Press.
32. Chen, Z., Fillmore, C. M., Hammerman, P. S., Kim, C. F., & Wong, K. K. (2014). Non-small-cell lung cancers: a heterogeneous set of diseases. Nature Reviews Cancer, 14(8), 535–546. doi.org/10.1038/nrc3775.
33. Sousaa, V. M. L., & Carvalho, L. (2018). Heterogenity in Lung Cancer. Pathobiology, 85, 96–107 doi: 10.1159/000487440.
34. Gazdar, A., Franklin, W. A., Brambilla, E., Hainaut, P., Yokota, J., & Harris, C. C. (2004). Tumours of the lung: Small cell carcinoma. In W.D. Тravis, E. Brambilla, H. K. Muller-Hermelink, & C. C. Harris (Eds.), Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart, 31–34. Lyon: IARC Press.
35. World Health Organization (2021). Publication of the WHO Classification of Tumours (5th ed.), V. 5. Retrieved from http://www.iarc.who.int/ news-events/publication-of-the-who-classification-of-tumours-5th-edition-volume-5-thoracic-tumours.
36. Grigoryeva, E. S., Kokova, D. A., Gratchev, A. N., Cherdyntsev, E. S., Buldakov, M. A., … Cherdyntseva, N. V. (2015). Smoking-related DNA adducts as potential diagnostic markers of lung cancer: new perspectives. Experimental oncology, 37(1), 5–12.
37. Howell, W. M., & Black, D. A. (1980). Controlled silver staining of nucleolar regions with protective Colloidal developer a one step method. Experientia, 36(8), 1014–1015. doi: 10.1007/BF01953855.
Адреса для листування:
Болгова Лідія Севастянівна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: bolgova2006@ukr.net
Correspondence:
Lidiya Bolgova
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: bolgova2006@ukr.net














Leave a comment