Персоналізована таргетна терапія місцево-поширеного та метастатичного нирково-клітинного раку: від ретроспективних досліджень до клінічної практики
Чехун В.1, Стаховський Е.2, Вітрук Ю.2, Лук’янова Н.1, Войленко О.2, Стаховський О.2, Кононенко О.2, Семко С.2, Пікуль М.2, Гречко Б.2, Кошель Д.2, Тимошенко А.2, Буйвол О.2, Кротевич М.2, Трохимич С.2, Вітрук В.3, Гарбар Р.3, Яценюк Н.3
- 1Інститут експериментальної патології, онкології та радіобіології ім. Р.Є. Кавецького НАН України, Київ, Україна
- 2Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 3Центр сучасної урології, Київ, Україна
Резюме. Матеріали та методи дослідження. Ретроспективно проаналізовано результати лікування 126 хворих на місцево-поширений та метастатичний нирково-клітинний рак (НКР), яким упродовж 2010–2020 рр. проведено неоад’ювантну таргетну терапію (неоТТ) сунітинібом чи пазопанібом та хірургічне видалення пухлини. 97 (77%) пацієнтів приймали протягом 2 міс щоденно пазопаніб у дозі 800 мг, 29 (23%) хворих упродовж 10 тиж щоденно отримували сунітиніб у дозі 50 мг з перервою у 2 тиж між 4-тижневими циклами. Розмір пухлини становив від 38 до 170 (74,3±23,3) мм. Регресію пухлини на проведену терапію оцінювали після 2 блоків терапії відповідно до RECIST 1.1. Для дослідження біомаркерів (мікроРНК) на клінічному матеріалі хворих (парафінових блоках пухлин) використано метод полімеразної ланцюгової реакції (ПЛР) у реальному часі. Результати. У 107 (84,9%) випадках після проведення неоад’ювантної терапії розмір пухлини зменшився від 2 до 60% (у середньому (20,1±10,7)%), а у 19 (15,1%) хворих — не змінився або збільшився на 4% (у середньому (0,7±1,3)%). Загалом часткову регресію пухлини діагностовано у 27 (21,4%), стабілізацію процесу — у 99 (78,6%) випадках. У додатковому субаналізі 99 (78,6%) результатів лікування хворих зі стабілізацією процесу після неоад’ювантної терапії встановлено, що у 37 (29,4%) випадках була наявна резистентна пухлина до терапії та був призначений неефективний препарат, тому в деяких випадках зафіксовано збільшення розміру новоутворення. У решти — 62 (49,2%) пацієнтів пухлина була чутливою до призначеної терапії, однак рівень її регресії був нижчим за 30%. У проведеному аналізі виявлено значну варіабельність профілів експресії мікроРНК у тканині НКР: так, для пухлин, у яких відповідь на лікування пазопанібом становила ≥30%, рівні онкогенної мікроРНК-144 та онкосупресорних мікроРНК-99b та -377 були відповідно у 5,05 та 2,61 раза вищі, ніж у тканині пацієнтів з регресією <10%; у хворих після терапії сунітинібом, у яких виявлено регресію новоутворення на ≥30%, показники онкосупресорних мікроРНК-210 та мікроРНК-377 були відповідно у 5,4 та 2,17 раза нижчі, ніж у хворих із регресією <10%. За допомогою визначення суміжної експресії мікроРНК-99b / -377 та мікроРНК-210 / -377 ідентифіковано молекулярно-біологічні ознаки НКР, які чутливі як до сунітинібу, так і пазопанібу, чутливі до одного з них або не чутливі до жодного із застосованих препаратів. Висновки. Використання показників суміжної експресії пухлинно-асоційованих мікроРНК-99b / -377 та мікроРНК-210 / -377 має важливу предиктивну цінність та дозволяє здійснювати науково обґрунтоване призначення ефективних у кожному конкретному випадку препаратів для персоналізованого лікування хворих на НКР. У разі відсутності чутливості до будь-якого з інгібіторів тирозинкінази рекомендовано призначати імунотерапію.
Одержано 2.09.2024
Прийнято до друку 12.09.2024
DOI: 10.32471/clinicaloncology.2663-466X.55-3.33245
ВСТУП
Упродовж останніх десятиріч в Україні, як і в усьому світі, кардинально змінилася парадигма діагностики та лікування хворих на НКР [1–3]. Завдяки впровадженню в клінічну практику нових променевих методів діагностики, до 60% підвищилася частота раку нирки, виявленого на початкових стадіях. Поряд із цим майже 40% усіх пацієнтів звертаються по медичну допомогу вже із запущеними формами, наявністю місцево-поширеного процесу, метастатичної хвороби [4], які потребуватимуть як хірургічного лікування, так і системної терапії [5].
Завдяки розробці та появі таргетної та імунотерапії останніми роками відбулися певні зрушення в бік підвищення показників виживаності хворих на НКР, тому що основним методом лікування метастатичного НКР стала системна терапія з чи без нефректомії [6, 7]. Однак украй важливим питанням є вибір послідовності лікування: хірургічне — системна терапія, системна терапія — хірургічне чи тільки системна терапія [8, 9].
Іншою нерозв’язаною проблемою є вибір препарату для терапії НКР. Згідно з наявними стандартами як першу лінію нео- або ад’ювантної таргетної чи системної терапії призначають імунотерапію, сунітиніб, пазопаніб чи кабозантиніб, схожу ефективність яких доведено в багатьох дослідженнях [10–15]. Як правило, призначення цих лікарських засобів проводилося емпірично в межах клінічного дослідження чи згідно з уподобаннями лікаря або матеріальними можливостями хворого, що вказує на доцільність пошуку маркерів чутливості до таргетної терапії з метою проведення персоналізованого лікування пацієнтів та підвищення його ефективності.
МЕТА ДОСЛІДЖЕННЯ
Оцінити клінічне значення біомаркерів (експресії мікроРНК) у пухлинній тканині для прогнозування ефективності системної терапії НКР.
МАТЕРІАЛИ ТА МЕТОДИ
Ретроспективно проаналізовано результати лікування 126 хворих на місцево-поширений та метастатичний НКР (мНКР), яким упродовж 2010–2020 рр. проведено неоад’ювантну таргетну терапію (неоТТ) сунітинібом чи пазопанібом та хірургічне видалення пухлини. 97 (77%) пацієнтів приймали пазопаніб у дозі 800 мг щоденно перорально протягом 2 міс, 29 (23%) хворих щоденно отримували сунітиніб у дозі 50 мг упродовж 28 діб з перервою в прийомі препарату протягом 14 діб та повторним 28-денним курсом терапії.
До призначення лікування усім хворим виконано біопсію пухлини нирки та морфологічно підтверджено наявність світлоклітинного НКР. Після проведення терапії виконували оцінку її ефективності на основі даних спіральної комп’ютерної (СКТ) чи магнітно-резонансної томографії (МРТ) за критеріями RECIST 1.1 та з обов’язковим урахуванням відсотка регресії основного вогнища в нирці.
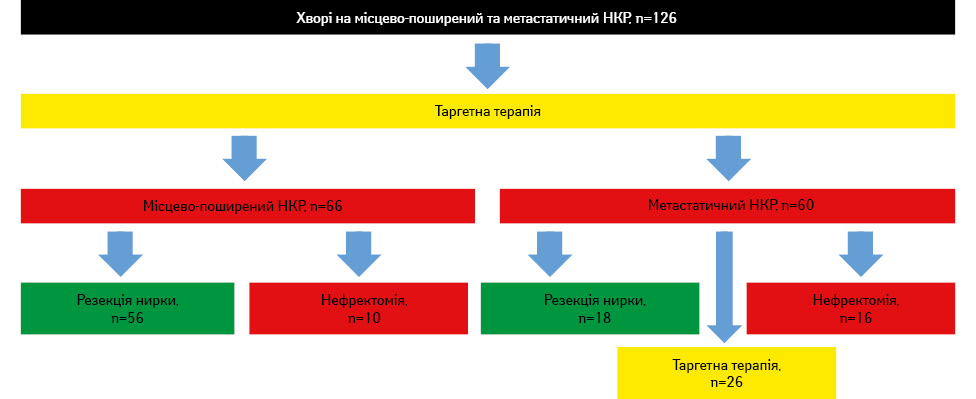
Оперативне лікування проводили в термін не менше 2 тиж після припинення або закінчення курсу неоТТ задля повного виведення таргетного препарату з організму та швидшої регенерації тканин після проведення хірургічного втручання (рис. 1).
Патоморфологічне дослідження матеріалу проводили у відділенні патологічної анатомії Державного некомерційного підприємства (ДНП) «Національний інститут раку» за наступною методикою: макропрепарат фіксували в 10% водному нейтральному розчині формаліну. Із різних ділянок макропрепарату вирізали шматочки розмірами до 0,5×0,5×0,5 см, які використовували для виготовлення гістологічних препаратів. Забарвлення виконували за допомогою гематоксилін-еозину. Оцінювали: ступінь гістопатологічної атипії ядер пухлини нирки за Фурманом [16].
Для дослідження біомаркерів у тканині НКР (парафінових блоках новоутворення) використано метод ПЛР у реальному часі, який проводився в Інституті експериментальної патології, онкології та радіобіології ім. Р.Є. Кавецького НАН України. З парафінових блоків з пухлинної тканини виділяли тотальну РНК за допомогою комерційного набору RNeasy FFPE Kit (QIAGEN, Німеччина). Кількість виділеної РНК визначали на спектрофотометрі NanoDrop 2000c Spectrophotometer»(ThermoScientific, США). Чистоту виділеної РНК контролювали, використовуючи співвідношення величин оптичного поглинання при довжині хвиль 260 та 280 нм.
РНК розчиняли у tris-EDTA буфері, а до проведення ПЛР зберігали за температури 20 °С. ПЛР зі зворотною транскрипцією (ЗТ-ПЛР) проводили на системі виявлення QuantStudio 5 Dx Real-Time PCR System (ThermoScientific, США) з використанням комерційного набору для ЗТ-ПЛР Maxima™ SYBR Green / ROX Master Mix (2X) (ThermoScientific, США) за протоколом виробника. Для визначення мікроРНК використовували окремий stem-loop праймер для синтезу кДНК та універсальний reverse primer 5’-GTGCAGGGTCCGAGGT-3’ за методикою stem-loop miRNA RT-PCR [17]. Послідовності праймерів для виявлення мікроРНК отримані за допомогою ресурсу genomics.dote.hu:8080/mirnadesigntool та синтезовані компанією Metabion, Німеччина. Після закінчення ЗТ-ПЛР до продукту реакції додавали суміш реагентів і проводили ПЛР у реальному часі.
Статистична обробка результатів виконана в пакеті Statistical software EZR v. 1.54 (graphical user interface for R statistical software version 4.0.3, R Foundation for Statistical Computing, Vienna, Austria) [18]. Закон розподілу кількісних показників відрізнявся від нормального, тому для їх представлення розраховано медіанне значення (Ме) та міжквартильний інтервал (QI–QIII). Показники для 2 груп порівнювали за критерієм Манна — Уїтні. Для порівняння якісних ознак використано точний критерій Фішера (у випадку альтернативного закону розподілу) або критерій χ2 (для ≥3 градацій).
РЕЗУЛЬТАТИ
Згідно з дослідженням неоТТ отримали 126 пацієнтів: 66 (52,4%) хворих на місцево-поширений та 60 (47,6%) — на мНКР (табл. 1).
| Показник | Нирково-клітинний рак | Рівень значущості відмінності, р | ||
| місцево-поширений,n=66 | метастатичний,n=60 | |||
| Вік, років | 55,9±10,3 | 56,7±8,5 | 0,35 | |
| Стать | чоловіки | 42 (63,6%) | 47 (78,3%) | 0,35 |
| жінки | 24 (26,4%) | 13 (21,7%) | ||
| Індекс маси тіла | 28,9±5,4 | 29,4±5,2 | 0,3 | |
| ECOG, бали | 0,5±0,5 | 0,5±0,5 | 0,17 | |
| Супутня патологія, n (%) | є | 55 (83,3) | 57 (95) | 0,23 |
| немає | 11 (16,7) | 3 (5) | ||
| сШКФ, мл/хв/1,73м2 | 95,1±28,4 | 95,7±27,4 | 0,46 | |
| Хворі з ХХН, n (%)
(сШКФ <60 мл/хв/1,73 м2) |
8 (12,1) | 5 (8,3) | 0,92 | |
| Максимальний діаметр пухлини, мм | 72,5±23,9 | 75,1±22,8 | 0,27 | |
| NCIU-нефрометрія, сегмент нирок, n (%) | полюс | 37 (56,1) | 29 (48,3) | 0,41 |
| латерально | 11 (16,7) | 11 (18,3) | ||
| медіально | 18 (27,2) | 20 (33,4) | ||
| RENAL score, бали | 10,5±0,7 | 10,8±0,7 | 0,017 | |
| Об’єм функціонуючої паренхіми нирок, % | 76,3±10,5 | 69±13,2 | 0,005 | |
| Fuhrman score, Grade, n (%) | І | 3 (4,6) | – | 0,007 |
| ІІ | 48 (72,7) | 18 (30) | ||
| ІІІ | 13 (19,7) | 24 (40) | ||
| IV | 2 (3) | 18 (30) | ||
Як зазначено в табл. 1, статистичної різниці за віком, статтю, індексом маси тіла, ECOG-статусом, наявністю супутнього захворювання, показником сумарної швидкості клубочкової фільтрації (сШКФ), кількістю хворих із хронічною хворобою нирок (ХХН), максимальним діаметром пухлини та її розміщенням згідно з NCIU-нефрометрією між хворими на місцево-поширений та мНКР не виявлено (р >0,1).
Пацієнти відрізнялися за сумою балів за RENAL, об’ємом функціонуючої паренхіми нирок на стороні ураження та агресивності пухлини за Фурманом (р <0,017). Слід підкреслити, що у хворих на метастатичний НКР були складнощі з точки зору хірургії пухлини, третина (33,4%) яких локалізувалася у воротах нирки, при цьому об’єм функціонуючої паренхіми нирок становив у середньому 70%. Також значно переважала кількість пухлин із ІІІ–IV ступенем за Фурманом (70%) у хворих на мНКР, що ще раз вказувало на агресивність такого виду новоутворень та їх здатність до метастазування.
Після проведеної неоТТ відсоток регресії первинної пухлини оцінювали за результатами проведеного повторного СКТ чи МРТ органів грудної, черевної порожнини та малого таза. Загальний відсоток регресії пухлини згідно з RECIST 1.1 представлено на рис. 2.
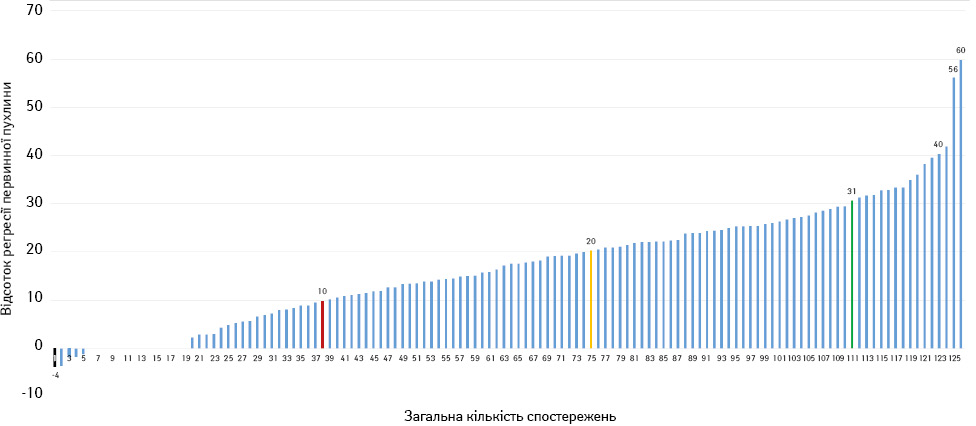
Представлені на рис. 2 дані свідчать, що у 107 (84,9%) випадках після проведення неоТТ розмір новоутворення зменшився від 2 до 60% (у середньому (20,1±10,7)%), а в 19 (15,1%) хворих — розмір пухлини не змінився або діагностовано його збільшення з максимальним показником — 4% (у середньому (0,7±1,3)%). Загалом часткову регресію новоутворення діагностовано у 27 (21,4%), стабілізацію процесу — у 99 (78,6%) випадках (табл. 2).
| Показник | НКР, n (%) | Рівень значущості відмінності, р | |
| місцево-поширений, n=66 | метастатичний, n=60 | ||
| Прогресія | – | – | 0,8 |
| Стабілізація | 52 (78,8) | 47 (78,3) | |
| Часткова регресія | 14 (21,2) | 13 (21,7) | |
| Повна відповідь | – | – | |
Як зазначено в табл. 3, за результатами неоТТ як прогресію захворювання, так і повну відповідь на терапію не відмічено в жодному випадку НКР.
| мікроРНК | RECIST 1.1,% | ||||
| 0–10 | 11–20 | 21–30 | > 30 | ||
| Онкогенні | мікроРНК-144 | 0,52±0,10 | 1,09±0,42 | 0,81±0,13 | 2,63±0,91* |
| мікроРНК-155 | 2,86±0,90 | 3,88±0,86 | 3,41±0,97 | 3,70±1,28 | |
| мікроРНК-222 | 4,20±0,93 | 3,90±0,25 | 2,33±0,70 | 5,40±1,36 | |
| Онкосупресорні | мікроРНК-99b | 0,39±0,27 | 0,32±0,19 | 0,48±0,23 | 1,02±0,32* |
| мікроРНК-210 | 0,44±0,54 | 0,86±0,30 | 0,65±0,26 | 0,85±0,65 | |
| мікроРНК-302a | 0,16±0,29 | 0,18±0,12 | 0,17±0,12 | 0,18±0,14 | |
| мікроРНК-377 | 0,57±0,16 | 0,59±0,75 | 0,60±0,63 | 1,49±0,28* | |
Примітка: *p <0,05 щодо хворих із 0–10% регресією пухлини.
Проведений аналіз виявив значну варіабельність профілів експресії мікроРНК у тканині НКР: так, для пухлин, у яких відповідь на лікування пазопанібом становила ≥30%, рівні онкогенної мікроРНК-144 та онкосупресорних мікроРНК-99b та -377 були відповідно у 5,05 та 2,61 раза вищі, ніж у пацієнтів з регресією <10% (див. табл. 3).
У хворих після терапії сунітинібом, у яких спостерігалася регресія пухлини ≥30%, показники онкосупресорних мікроРНК-210 та мікроРНК-377 були відповідно у 5,4 та 2,17 раза нижчі, ніж у хворих із регресією <10% (табл. 4).
| МікроРНК | RECIST 1.1,% | ||||
| 0–10 | 11–20 | 21–30 | > 30 | ||
| Онкогенні | мікроРНК-144 | 2,99±0,22 | 0,37±0,67 | 0,26±0,22 | 0,39±0,36 |
| мікроРНК-155 | 4,40±0,68 | 1,38±0,16 | 2,78±0,20 | 3,12±0,55 | |
| мікроРНК-222 | 3,55±0,93 | 3,48±0,38 | 4,64±0,21 | 4,59±0,89 | |
| Онкосупресорні | мікроРНК-99b | 0,44±0,22 | 0,29±0,46 | 0,32±0,58 | 0,25±0,24 |
| мікроРНК-210 | 1,74±0,18 | 0,82±0,25 | 0,75±0,42* | 0,32±0,16* | |
| мікроРНК-302a | 0,50±0,33 | 0,06±0,19 | 0,05±0,17 | 1,28±0,87 | |
| мікроРНК-377 | 0,76±0,27 | 0,52±0,13 | 0,42±0,55 | 0,35±0,13* | |
Примітка: *p <0,05 щодо хворих із 0–10% регресією пухлини.
За допомогою визначення суміжної експресії пухлинно-асоційованих мікроРНК-99b / -377 та мікроРНК-210 / -377 ідентифіковано молекулярно-біологічні ознаки НКР, які чутливі як до сунітинібу, так і пазопанібу, чутливі до одного з них або не чутливі до жодного з даних препаратів (рис. 3–6).
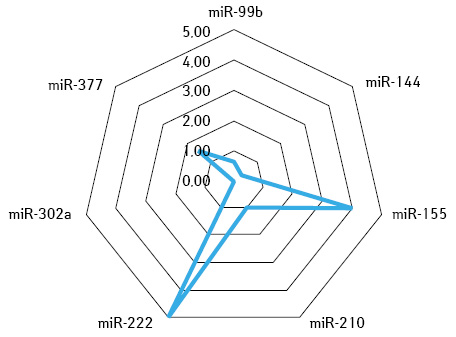
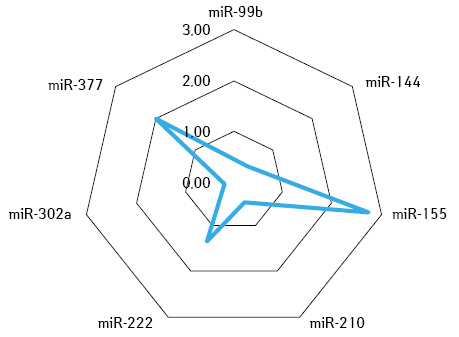
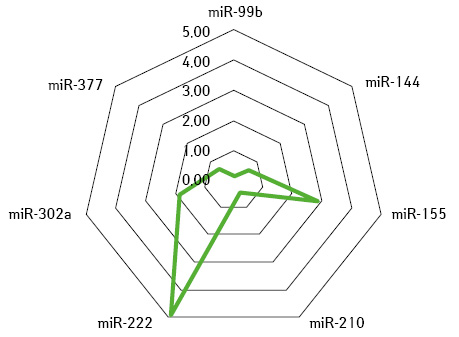
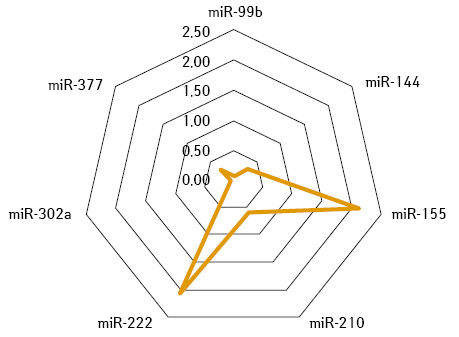
У додатковому субаналізі результатів лікування 99 (78,6%) хворих зі стабілізацією процесу після неоад’ювантної системної терапії зафіксовано, що у 37 (29,4%) випадках розвинулася резистентна пухлина до терапії або був призначений неефективний препарат, тому в деяких випадках зафіксовано збільшення розміру пухлини. У решти — 62 (49,2%) пацієнтів пухлина була чутливою до призначеної терапії, однак рівень її регресії становив <30%, що, вірогідно, пов’язано також з іншими факторами. Враховуючи зазначене, проведений мультифакторний аналіз чинників, які впливали на ефективність неоТТ. Поріг ефективності: регресія пухлини ≤20% — негативний, більше 20% — позитивний результат. Ефекту лікування досягнуто для 89 (70,6%) пацієнтів, а їх пухлини вважалися чутливими; не досягнуто ефекту — у 37 (29,4%) хворих, у яких пухлини оцінювали як резистентні до терапії (табл. 5).
| Факторна ознака | Коефіцієнт моделі, b±m | Рівень значущості відмінності коефіцієнта від 0, p | Показник вірогідного інтервалу (95% довірчий інтервал (ДІ)) | |
| Вік, на рік | 0,018±0,019 | 0,341 | – | |
| Стать | жінки | Референтний | ||
| чоловіки | 0,16±0,40 | 0,683 | – | |
| Iндекс маси тіла, на ОД | 0,035±0,035 | 0,311 | – | |
| ECOG, на ОД | –0,14±0,32 | 0,664 | – | |
| Супутня патологія | ні | Референтний | ||
| так | 0,90±0,56 | 0,109 | – | |
| сШКФ, на ОД | 0,001±0,007 | 0,831 | – | |
| Розмір пухлини, на ОД | –0,0040±0,0078 | 0,604 | – | |
| RENAL score, на ОД | 0,27±0,27 | 0,303 | – | |
| NCIU-нефрометрія | полюс нирки | Референтний | ||
| латерально | 0,77±0,55 | 0,161 | – | |
| медіально | 0,31±0,49 | 0,536 | – | |
| Об’єм функціонуючої паренхіми нирки (RFPV), на ОД | –0,046±0,016 | 0,005 | 0,96 (0,93–0,99) | |
| M-стадія | 1,92±0,42 | <0,001 | 6,85 (3,02–15,6) | |
| Fuhrman score, на ОД | 1,26±0,31 | <0,001 | 3,54 (1,92–6,51) | |
| Препарат | пазопаніб | Референтний | ||
| сунітиніб | –0,01±0,44 | 0,975 | – | |
Як представлено в табл. 5, більшість факторів статистично не впливали на ефективність проведення таргетної терапії. Дійсно, не встановлено залежності рівня об’єктивної відповіді НКР на проведення неоад’ювантної терапії від максимального діаметра пухлини (р=0,6). Так, у 5 хворих з новоутворенням ≤40 мм, регресію >20% діагностовано у 2 (40%) випадках, так само як у 65 хворих з пухлиною >70 мм рівень регресії >20% виявлено у 29 (44,6%) випадках. Аналогічні показники діагностовано під час порівняння залежності ефективності від віку (р=0,34), статі (р=0,68), індексу маси тіла (р=0,31), ECOG-статусу (р=0,66), наявності супутньої патології (р=0,1), сШКФ (р=83), RENAL score (р=0,3) та NCIU-нефрометрії (р >0,16). Достовірний вплив на ефективність терапії зафіксовано залежно від початкового об’єму функціонуючої паренхіми нирок на стороні ураження (р=0,005), гістологічної градації пухлини за Фурманом та наявності чи відсутності метастатичних вогнищ (р <0,001).
Для відбору сукупності факторних ознак, пов’язаних із ризиком недосягнення ефекту лікування, використано метод побудови та аналізу багатофакторних моделей логістичної регресії. Для відбору значущих ознак використано метод покрокового включення / виключення (поріг включення становив p <0,05; поpіг виключення — р >0,15). Виділено 3 основних фактори ризику: RFPV, М-стадія та градація за Фурманом. Модель побудована на виділених ознаках адекватна (хі-квадрат=43,9 при 5 ступенях свободи; p <0,001). На рис. 7 наведено криву операційних характеристик моделі.
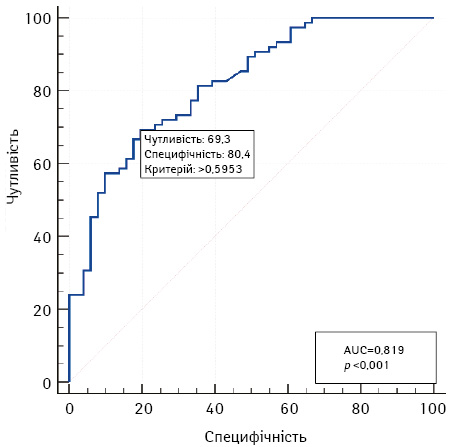
Площа під кривою операційних характеристик моделі AUC=0,82 (95% ДІ 0,74–0,88%), що свідчить про сильний зв’язок RFPV, М-стадії та градації за Фурманом з ризиком недосягнення ефекту лікування. При виборі оптимального порогу чутливість 3-факторної моделі становить 69,3% (95% ДІ 57,6–79,5%), специфічність — 80,4% (95% ДІ 66,9–90,2%).
Для підтвердження отриманих даних при аналізі результатів гістологічного дослідження біопсійного матеріалу виявлено, що із 126 хворих на НКР, яким проведено неоТТ, переважна більшість — 66 (52,4%) мали ІІ ступінь морфофункціональної атипії ядер за Фурманом. У меншої кількості НКР (37 (29,4%) випадків) виявлено ІІІ ступінь за Фурманом, водночас як І та ІV ступінь за Фурманом діагностовано у 3 (2,4%) та 20 (15,9%) випадках відповідно. При аналізі відсотка регресії НКР залежно від ступеня градації за Фурманом (табл. 6) найвищий рівень регресії (34,5±18,8) був при НКР з І ступенем градації за Фурманом зі значним його зниженням залежно від підвищення агресивності пухлини. Завдяки сумарній статистичній оцінці виявлено значний вплив гістопатологічної градації НКР за Фурманом на відсоток регресії новоутворення (р <0,001).
| Ступінь гістопатологічної градації НКР за Фурманом | Регресія первинної пухлини, % | Рівень значущості відмінності, р |
| І, n=3 (2,4%) | 34,5±18,8 | <0,001 |
| ІІ, n=66 (52,4%) | 21,7±10,5 | |
| ІІІ, n=37 (29,4%) | 13,6±9,5 | |
| ІV, n=20 (15,8%) | 4,7±10,3 |
Представлені дані свідчать про значно більший злоякісний потенціал пухлин із ІV ступенем гістопатологічної градації ядра НКР — ІV за Фурманом та про низьку ефективність таргетної терапії в лікуванні цієї категорії пацієнтів, що свідчить про важливе предиктивне значення цього критерію для визначення показань до проведення неоТТ у хворих на НКР.
Іншим фактором, який впливав на ефективність неоТТ у осіб з НКР, був первинний об’єм функціонуючої паренхіми нирок на стороні ураження (табл. 7).
| Об’єм функціонуючої паренхіми нирок на стороні ураження, n (%) | Регресія первинної пухлини, % | Рівень значущості відмінності, р |
| ≥85%, n=24 (19) | 20,8±13,7 | 0,005 |
| (84–70)%, n=52 (41,3) | 18,2±10,3 | |
| (69–55)%, n=35 (27,8) | 14,8±9,6 | |
| <55%, n=15 (11,9) | 11,7±6,1 |
У табл. 7 представлено, що таргетна терапія була ефективною у 76 (60,3%) хворих із об’ємом функціонуючої паренхіми нирок на стороні ураження ≥70%. За меншого відсотка збереженої паренхіми ефективність неоТТ була нижчою, що вказує на те, що загальна фільтраційна здатність нирок впливає на переносимість терапії та її ефективність.
Ще одним фактором, який достовірно впливав на ефективність неоТТ хворих на НКР, була наявність метастатичних вогнищ у різних органах, яку діагностовано у 60 (47,6%) пацієнтів.
У табл. 8 наведено, що найбільший рівень регресії НКР (22,8±11)% зафіксовано у хворих без метастазів, водночас в разі їх наявності достовірно знижується ефективність терапії (регресія — 10,5±10,3)%) (р <0,00001). При цьому в разі метастатичного ураження однієї системи організму рівень регресії був дещо вищим (14,4±10,3)%, ніж у хворих з ураженням ≥2 систем — (9,4±10,1)%.
| Метастатичне вогнище, n (%) | Регресія пухлини, % | Рівень значущості відмінності, р |
| Немає, n=66 (52,4) | 22,8±11 | <0,001 |
| Наявні, n=60 (47,6) | 10,5±10,3 | |
| зокрема ураження однієї системи, n=13 (29,4) | 14,4±10,3 | |
| ураження двох і більше систем, n=47 (15,8) | 9,4±10,1 |
ОБГОВОРЕННЯ
Лікування осіб з метастатичним НКР є актуальним, складним і остаточно не розв’язаним питанням сучасної онкології. Незважаючи на прогрес у системній терапії, хірургічне лікування все-таки має значення для підвищення показника виживаності багатьох пацієнтів та виконується у вигляді циторедуктивної нефректомії — перед системною терапією або консолідативної нефректомії — після системної терапії [19]. Досі тривають суперечки щодо необхідності хірургічного лікування таких хворих, оскільки більшість пацієнтів мають складні новоутворення великого розміру і для них ефективнішим буде проведення системної терапії. З іншого боку, первинна пухлина, звичайно, є джерелом метастазів, і її видалення у деяких пацієнтів може суттєво знизити загальний тягар захворювання та підвищити ймовірність того, що метастази відповідатимуть на системну терапію, а поєднання її з повним видаленням метастазів — підвищує ефективність лікування [20, 21].
Оцінку консолідаційної нефректомії досліджено ще минулого сторіччя [22–24] і доведено ризик затримки системної терапії після попередньої нефректомії через хірургічну травму, погіршення загального стану чи прогресування захворювання. Крім того, деякі пацієнти не є кандидатами на циторедуктивну нефректомію, якщо у них первинна пухлина вважається нерезектабельною. У таких хворих може бути можливим попередня системна терапія з подальшою консолідаційною нефректомією [25]. Потенційною перевагою цієї стратегії лікування НКР є виявлення пацієнтів із більш сприятливими фенотиповими ознаками пухлинного вогнища, які отримають користь від мультимодального підходу. Наприклад, хворі на НКР з високою швидкістю прогресії після системної терапії можуть мати нижчу ймовірність отримати користь від нефректомії [26, 27].
За останні 10 років дослідження експресії мікроРНК у тканині НКР дозволили остаточно підтвердити дисрегуляцію їх рівнів за наявності цієї форми раку [28]. Варто зазначити, що при пухлинах нирок експресія більшості мікроРНК пригнічується порівняно з нормальною тканиною, і це зниження часто асоціюється з метилюванням промоторних ділянок або зміною кількості копій [29].
Як і у випадку з іншими генами-супресорами пухлини, експресія окремих мікроРНК інгібована або порушена, при НКР також поширені однонуклеотидні точкові поліморфізми (Single nucleotide polymorphism — SNP). Ці SNP змінюють здатність мікроРНК зв’язуватися з послідовностями-мішенями і пов’язані з ризиком розвитку НКР [30].
Таргетна терапія є одним з найефективніших підходів до лікування хворих на НКР, однак важливим питанням є прогнозування відповіді на протипухлинні препарати. Показано, що експресія мікроРНК-141 суттєво знижена у пухлинах з негативною відповіддю на сунітиніб порівняно з позитивним ефектом цього препарату [31]. В іншому дослідженні встановлено, що рівень експресії мікроРНК-942 був найбільш точним предиктором ефективності сунітинібу для пацієнтів з НКР. Висока експресія мікроРНК-942, -628-5p, -133a та -484 у пухлинній тканині асоціюється зі зменшенням тривалості періоду до прогресування та низькими показниками загальної виживаності пацієнтів з НКР, і ці мікроРНК також були гіперекспресованими в резистентній до сунітинібу клітинній лінії Caki-2 порівняно з чутливою клітинною лінією [32].
Отримані нами дані підтверджують значення мікроРНК як інноваційних потенційних біомаркерів пухлини, що можуть покращити діагностичні та прогностичні підходи, а отже, і оптимізувати стратегію лікування хворих на місцево-поширений та мНКР.
ВИСНОВКИ
Існує необхідність у персоніфікованому, а не емпіричному призначенні таргетних препаратів на основі вивчення пухлинних маркерів чутливості, що дозволить значно підвищити їх ефективність та результати лікування хворих на місцево-поширений та мНКР.
Використання показників суміжної експресії пухлинно-асоційованих мікроРНК-99b / -377 та мікроРНК-210 / -377 має важливу предиктивну цінність та дозволяє здійснювати науково обґрунтоване призначення ефективних у кожному конкретному випадку лікарських засобів для персоналізованого лікування хворих на НКР. У разі відсутності чутливості до будь-якого з інгібіторів тирозинкінази рекомендовано призначати імунотерапію.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. EAU Guidelines on Renal Cell Carcinoma 2024. Retrieved from uroweb.org/guidelines/renal-cell-carcinoma.
2. NCCN Guidelines on Kidney Cancer, Version 2.2025. Retrieved from http://www.nccn.org/guidelines/guidelines-detail?category=1&id=1440.
3. Міністерство охорони здоров’я України. (2022). Наказ від 20 червня 2022 р. № 1061 «Про затвердження Уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Рак нирки». Retrieved from http://www.dec.gov.ua/mtd/rak-nyrky.
4. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2024). Рак в Україні, 2022–2023. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. (Vol. 25). Кропивницький: Поліум.
5. Siegel, R., Miller, K. D., & Jemal, A. (2020). Cancer Statistics, 2020. Cancer Journal for Clinicians, 70, 7–30. doi: 10.3322/caac.21590.
6. Méjean, A., Ravaud, A., Thezenas, S., Colas, S., Beauval, J. B., Bensalah, K., … Escudier, B. (2018). Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. New England Journal of Medicine, 379(5), 417–427. doi: 10.1056/NEJMoa1803675.
7. Bex, A., Mulders, P., Jewett, M., Wagstaff, J., van Thienen, J. V., Blank, C. U., … Haanen, J. (2019). Comparison of Immediate vs Deferred Cytoreductive Nephrectomy in Patients With Synchronous Metastatic Renal Cell Carcinoma Receiving Sunitinib: The SURTIME Randomized Clinical Trial. JAMA Oncology, 5, 164. doi: 10.1001/jamaoncol.2018.5543.
8. Стаховський, Е., Вітрук, Ю., Войленко, О., Стаховський, О., Кононенко, О., Пікуль, М., … Яценюк, Н. (2023). Функціональні результати органозберігаючого лікування місцево-поширеного та метастатичного нирково-клітинного раку. Клінічна онкологія, 13 (4(52)), 236–240. doi: 10.32471/clinicaloncology.2663-466X.52-4.31458.
9. Стаховський, Е., Вітрук, Ю., Войленко, О., Стаховський, О., Кононенко, О., Пікуль, М., … Яценюк, Н. (2023). Онкологічні результати органозберігаючого лікування місцево-поширеного нирково-клітинного раку. Клінічна онкологія, 13 (4(52)), 251–256. doi: 10.32471/clinicaloncology.2663-466X.52-4.31426.
10. Fady, G., Sunil, H. P., & Ithaar, H. D. (2019). Current Status of Immunotherapy for Localized and Locally Advanced Renal Cell Carcinoma. Journal of Clinical Oncology, 7309205. doi: 10.1155/2019/7309205.
11. Motzer, R. J., Hutson, T. E., Olsen, M. R., Hudes, G. R., Burke, J. M., Edenfield, W. J., … Figlin, R. A. (2012). Randomized phase II trial of sunitinib on an intermittent versus continuous dosing schedule as first-line therapy for advanced renal cell carcinoma. Journal of Clinical Oncology, 30(12), 1371–1377. doi: 10.1200/JCO.2011.36.4133.
12. Motzer, R. J., Hutson, T. E., Cella, D., Reeves, J., Hawkins, R., Guo, J., … Choueiri, T. K. (2013). Pazopanib versus sunitinib in metastatic renal-cell carcinoma. New England Journal of Medicine, 369(8), 722–731. doi: 10.1056/NEJMoa1303989.
13. Escudier, B., Porta, C., Bono, P., Powles, T., Eisen, T., Sternberg, C. N., … Cella, D. (2014). Randomized, controlled, double-blind, cross-over trial assessing treatment preference for pazopanib versus sunitinib in patients with metastatic renal cell carcinoma: PISCES Study. Journal of Clinical Oncology, 32(14), 1412–1418. doi: 10.1200/JCO.2013.50.8267.
14. Choueiri, T. K., Hessel, C., Halabi, S., Sanford, B., Michaelson, M. D., Hahn, O., … Morris, M. J. (2018). Cabozantinib versus sunitinib as initial therapy for metastatic renal cell carcinoma of intermediate or poor risk (Alliance A031203 CABOSUN randomised trial): Progression free survival by independent review and overall survival update. European Journal of Cancer, 94,115–125. doi: 10.1016/j.ejca.2018.02.012.
15. Powles, T., Plimack, E. R., Soulières, D., Waddell, T., Stus, V., Gafanov, R., … Rini, B. I. (2020). Pembrolizumab plus axitinib versus sunitinib monotherapy as first-line treatment of advanced renal cell carcinoma (KEYNOTE-426): extended follow-up from a randomised, open-label, phase 3 trial. Lancet Oncology, 21(12), 1563–1573. doi: 10.1016/S1470-2045(20)30436-8.
16. Fuhrman, S. A., Lasky, L. C., & Limas, C. (1982). Prognostic significance of morphologic parameters in renal cell carcinoma. American Journal of Surgical Pathology, 6(7), 655–663. doi: 10.1097/00000478-198210000-00007.
17. Ye, J., Xu, M., Tian, X., Cai, S., & Zeng, S. (2019). Research advances in the detection of miRNA. Journal of pharmaceutical analysis, 9(4), 217–226.
18. Kanda, Y. (2013). Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant, 48, 452–458. doi: 10.1038/bmt.2012.244.
19. Ball, M. W. (2017). Surgical Management of Metastatic Renal Cell Carcinoma. Discover Medicine, 23(129), 379–387.
20. Feuer, Z., Taylor, J., & Huang, W. C. (2021). The contemporary role of metastasectomy in the management of metastatic RCC. Journal of Cancer Metastasis and Treatment, 7, 68. doi: 10.20517/2394-4722.2021.164.
21. Campbell, S. S., Ornstein, M. C., & Rathi, N. (2022). Partial Nephrectomy for Metastatic Renal Cell Carcinoma. European Urology Open Science, 44, 92–93. doi: 10.1016/j.euros.2022.05.019.
22. Wolf, J. S., Aronson, F. R., Small, E. J., & Carroll, P. R. (1994). Nephrectomy for metastatic renal cell carcinoma: a component of systemic treatment regimens. Journal of Surgical Oncology, 55(1), 7–13. doi: 10.1002/jso.2930550104.
23. Bennett, R. T., Lerner, S. E., Taub, H. C., Dutcher, J. P., & Fleischmann, J. (1995). Cytoreductive surgery for stage IV renal cell carcinoma. Journal of Urology, 154(1), 32–34.
24. Walther, M. M., Yang, J. C., Pass, H. I., Linehan, W. M., & Rosenberg, S. A. (1997). Cytoreductive surgery before high dose interleukin-2 based therapy in patients with metastatic renal cell carcinoma. Journal of Urology, 58(5), 1675–1678. doi: 10.1016/s0022-5347(01)64091-6.
25. Chang, K. C., Chan, K. L., & Lam, C. W. (1999). Spontaneous regression of renal cell carcinoma metastases. Hong Kong Medical Journal, 5(1), 72–75.
26. Bex, A., Ljungberg, B., van Poppel, H., & Powles, T. (2016). The Role of Cytoreductive Nephrectomy: European Association of Urology Recommendations in 2016. European Urology, 70(6), 901–905. doi: 10.1016/j.eururo.2016.07.005.
27. Maisel, F., Smolle, M. A., Mollnar, S., Riedl, J. M., Barth, D. A., Seles, M., … Posch, F. (2022). Benefit of Metastasectomy in Renal Cell Carcinoma: A Propensity Score Analysis. Clinical Genitourinary Cancer, 20(4), 344–353. doi: 10.1016/j.clgc.2022.03.010.
28. Kajdasz, A., Majer, W., Kluzek, K., Sobkowiak, J., Milecki, T., Derebecka, N., … Wesoly, J. (2021). Identification of RCC Subtype-Specific microRNAs-Meta-Analysis of High-Throughput RCC Tumor microRNA Expression Data. Cancers, 13(3), 548. doi: 10.3390/cancers13030548.
29. Shiomi, E., Sugai, T., Ishida, K., Osakabe, M., Tsuyukubo, T., Kato, Y., … Obara, W. (2019). Analysis of expression patterns of microRNAs that are closely associated with renal carcinogenesis. Frontiers in Oncology, 9, 431. doi: 10.3389/fonc.2019.00431.
30. Gilyazova, I. R., Beeraka, N. M., Klimentova, E. A., Bulygin, K. V., Nikolenko, V. N., Izmailov, A. A., … Aliev, G. (2021). Novel MicroRNA Binding Site SNPs and the Risk of Clear Cell Renal Cell Carcinoma (ccRCC): A Case-Control Study. Current Cancer Drug Targets, 21(3), 203–212.
31. Berkers, J., Govaere, O., Wolter, P., Beuselinck, B., Schöffski, P., van Kempen, L. C., … Lerut, E. (2013). A possible role for microRNA-141 down-regulation in sunitinib resistant metastatic clear cell renal cell carcinoma through induction of epithelial-to-mesenchymal transition and hypoxia resistance. The Journal of Urology, 189(5), 1930–1938. doi: 10.1016/j.juro.2012.11.133.
32. Brodziak, A., Sobczuk, P., Bartnik, E., Fiedorowicz, M., Porta, C., Szczylik, C., & Czarnecka, A. M. (2019). Drug resistance in papillary RCC: from putative mechanisms to clinical practicalities. Nature Reviews Urology, 16(11), 655–673. doi: 10.1038/s41585-019-0233-z.
Адреса для листування:
Вітрук Юрій
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: uvitruk@ukr.net
Correspondence:
Iurii Vitruk
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: uvitruk@ukr.net














Leave a comment