Вибір неоад’ювантного лікування місцево-поширеного хімієрезистентного люмінального раку грудної залози у пацієнток у період менопаузи
Смоланка І.І., Іванкова В.С., Мовчан О.В., Іванкова О.М., Ляшенко А.О. , Лобода А.Д., Досенко І.В., Лигирда О.Ф., Банковська Н.В., Ковальчук С.І., Локес І.В.
Резюме. Лікування місцево-поширеного раку грудної залози (МПРГЗ) є складною проблемою сучасної онкології, потребує індивідуального комплексного підходу до лікування, що складається із системної неоад’ювантної та за необхідності ад’ювантної терапії, хірургічного етапу з наступним опроміненням. Передопераційна протипухлинна терапія, що проводиться на першому етапі лікування МПРГЗ, дозволяє створити умови для виконання радикального оперативного втручання. Проте поширені форми раку грудної залози (РГЗ) часто виявляються резистентними до стандартних методик лікування і потребують персоніфікованого підходу до терапії. Метою дослідження було підвищення ефективності неоад’ювантного лікування хворих на місцево-поширений хімієрезистентий люмінальний рак грудної залози (МПХРЛРГЗ) за допомогою розробки та удосконалення комбінованої терапії. Матеріали та методи. 40 пацієнток з МПХРЛРГЗ у період менопаузи, у яких не отримано відповіді пухлини на проведену неоад’ювантну поліхімієтерапію (НПХТ) на основі антрациклінів та/або таксанів, розподілено на 2 групи: І група отримувала ендокринну терапію (ЕТ); ІІ група — ЕТ та променеву терапію (ПТ). Результати. У І групі відповідь пухлини на лікування досягнута у 55,0±1,91%, при чому часткова регресія (ЧР) — у 40,0±2,18%, тоді як повна регресія (ПР) — у 15,0±2,24%. У ІІ групі відповідь пухлини на лікування відмічалася у 70,0±1,56%, з них у 25,0±3,12% — ПР, а у 45,0±2,8% — ЧР. У І групі органозберігаючі операції (ОЗО) виконано у 75±3,2%; у ІІ групі — у 95,00±1,15%. У І групі визначено зменшення пухлинної маси на 51,41±2,24%, у ІІ групі — на 64,56±1,72% (t=3,06; р=0,002). Висновки. Отже, комбіноване лікування з використанням ЕТ та ПТ при люмінальному МПХРЛРГЗ сприяє підвищенню показника відповіді пухлини на лікування та підвищує частоту виконання ОЗО. Передопераційна ЕТ інгібіторами ароматази на тлі ПТ є розумною альтернативою в лікуванні МПХРЛРГЗ у пацієнток у період постменопаузи з гормонозалежним РГЗ.
Одержано 15.08.2024
Прийнято до друку 30.08.2024
DOI: 10.32471/clinicaloncology.2663-466X.55-3.33221
ВСТУП
Близько 70% усіх випадків РГЗ належать до люмінальних підтипів, що характеризуються наявністю експресії естрогенових рецепторів (estrogen receptor — ER), найбільш сприятливим перебігом захворювання та вищими показниками виживаності порівняно з іншими імуногістохімічними варіантами.
Незважаючи на широке використання передопераційної хімієтерапії (ХТ), показники повної патоморфологічної відповіді (сomplete pathomorphological response — pCR), безрецидивної та загальної виживаності дотепер незадовільні. У багатьох клінічних дослідженнях виявлено, що вищий рівень pCR пов’язаний зі збільшенням тривалості загальної та безрецидивної виживаності. Найкращу кореляцію pCR і показника виживаності виявлено для агресивних молекулярно-біологічних підтипів (HER2-позитивний, тричі негативний). Люмінальні підтипи РГЗ, незважаючи на порівняно низьку частоту pCR, характеризуються більш високим рівнем виживаності. ХТ на основі антрациклінів та/або таксанів є стандартною в першій лінії для більшості пацієнток з МПРГЗ, але майже 30% усіх хворих все-таки виявляються нечутливими до лікування, особливо це характерно для люмінального РГЗ. Причину низької чутливості до ХТ багато дослідників пов’язує з хімієрезистентністю (ХР). ХР — це стійкість клітин пухлини до дії 1 або кількох препаратів (не менше 2 ліній ХТ), що призводить до неефективності комплексного лікування (Європейське товариство медичної онкології (European Society for Medical Oncology — ESMO), Національний інститут раку (National Cancer Institute — NCI), США, 2022) [1].
Незважаючи на високу ефективність використання ЕТ та таргетної терапії при люмінальному РГЗ, у значної частини пацієнтів розвивається рецидив або прогресує метастатичне захворювання. Охарактеризовано декілька механізмів резистентності до ET, включно з втратою експресії ER, взаємодією ER з рецепторами фактора росту, субклональними геномними змінами пухлинних супресорів або драйверів, а також активацію міссенс-мутацій ESR1 [2].
Сучасні клінічні стратегії ефективного лікування та запобігання рецидиву ER-позитивного РГЗ пов’язані з дією ЕТ через інгібування синтезу гормонів або антагоністичне зв’язування рецептора. Ефективність ЕТ при неметастатичному РГЗ становить близько 50%, тоді як при розвитку метастатичної хвороби — не більше ніж у 30% усіх пацієнтів. Таргетні агенти, такі як інгібітори CDK4/6 (палбоцикліб, рибоцикліб або абемацикліб), а також інгібітор рапаміцину (mTOR) еверолімус застосовують у комбінації з ЕТ за наявності віддалених метастазів, комбінована дія цих препаратів підвищує показники виживаності без прогресування порівняно з проведенням лише ЕТ [3]. Однак пацієнти з мутантним ESR1 є резистентними до стандартної ЕТ і у них зафіксовано нижчий показник загальної виживаності [4, 5].
Згідно з останніми рекомендаціями Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN) методами ЕТ РГЗ є: 1) у жінок у період пременопаузи — застосування інгібіторів ароматази із супресією функції яєчників за допомогою аналогів гонадоліберину (GnRH); 2) у жінок у період постменопаузи — використання інгібітора ароматази в монотерапії [6]. У плані комбінованої терапії при РГЗ ЕТ проводять у пацієнтів з підтвердженою експресією ER або гестагенових рецепторів у клітинах пухлини як самостійне лікування у групі пацієнтів без метастазів у лімфатичні вузли з низьким ризиком розвитку рецидиву або дисемінації; як самостійне або послідовне лікування поєднане з хіміє- або ПТ у хворих без метастазів у лімфатичні вузли, із середнім ризиком розвитку рецидиву або дисемінації; як самостійне або послідовне лікування в комбінації з хіміє- або ПТ у пацієнтів з метастазами в лімфатичні вузли [7].
Наразі проводиться доволі багато досліджень з вивчення ролі ЕТ в неоад’ювантному режимі, однак не всі вони фіксують достатню очікувану ефективність, тому продовження випробувань у цій сфері є доволі актуальним.
Для пацієнтів з місцево-поширеними процесами, які залишаються неоперабельними після неоад’ювантної системної терапії, згідно з рекомендаціями Американського товариства радіаційної онкології (American Society for Radiation Oncology — ASTRO), Європейського товариства радіаційної онкології (European Society for Radiotherapy and Oncology — ESTRO), Німецького товариства радіаційної онкології (Deutsche Gesellschaft für Radioonkologie — DEGRO), NCCN і ESMO прийнятим є проведення ПТ з метою досягти операбельності пухлини.
У процесі проведення ПТ при РГЗ використовується високоенергетичне рентгенівське випромінювання, протони, фотони, електрони для знищення швидко зростаючих ракових клітин та є ефективним способом локорегіонарного контролю для зниження ризику розвитку рецидиву після операції [8].
Мета дослідження — підвищити ефективність неоад’ювантного лікування хворих на МПХРЛРГЗ за допомогою комбінованої терапії.
МАТЕРІАЛИ І МЕТОДИ
У дослідження увійшло 40 пацієнток з МПХРЛРГЗ у період менопаузи, ІІБ–ІІІС (T2-4с N0-2M0) стадіями захворювання з 2020 до 2023 рр.
I група (20 хворих) — отримували летрозол 2,5 мг щоденно per os протягом 3 міс та після цього проведено радикальне хірургічне лікування; II група (20 хворих) — отримували летрозол 2,5 мг щоденно per os протягом 3 міс та отримували ПТ за радикальною програмою: грудна залоза, підпахвинна, парастернальна та надключична ділянки (разова вогнищева доза — 2 Гр, сумарна вогнищева доза — 60 Гр протягом 45 днів), та в середньому через 28 днів проведено радикальне хірургічне лікування.
Після хірургічного лікування пацієнтки обох груп продовжували отримувати ЕТ.
ПТ проводили на лінійному прискорювачі електронів Clinac 2100. На основі анатомічної 3D-інформації була можливість впевнитися в тому, що достатній ізодозний розподіл охоплює всі уражені ділянки, а дози в суміжних здорових органах обмежені до рівня толерантних. Для кожного клінічного випадку виконано планування 3D-конформної ПТ. Розрахунок доз проводився для фотонного випромінювання енергією 6 МеВ з клиноподібними фільтрами (або без них), із застосуванням багатопелюсткового коліматора діафрагми. Використовували методику «поле в поле», при якій до 2 тангенціальних полів додавалося кілька невеликих фігурних (сформованих за допомогою багатопелюсткового коліматора діафрагми) полів для створення гомогенного розподілу дози в лікувальному обсязі — зменшення зон максимумів дози і підведення дози до «недоопромінених» зон. На лімфатичні вузли над-/підключичної зони променева дія здійснювалася в основному з одного переднього поля. За необхідності для адекватного розподілу дози в заданому обсязі використовувалися «задні» поля невеликих розмірів (рис. 1).
Оцінку ефекту неоад’ювантної терапії проводили за критеріями RECIST 1.1. Оцінка терапевтичного патоморфозу проводилася за методом гістостереометрії. При підрахунках встановлювали об’ємну частку життєздатної пухлинної тканини (ОЧЖПТ) у серійних зрізах.
Статистична обробка отриманих даних
Прогноз лікування пацієнтів оцінювали через виживаність без прогресування (disease-free survival — DFS). DFS встановлювали через інтервал від дати операції до виявлення рецидиву онкопатології. Аналіз виживаності проводили за допомогою методу Каплана — Меєра. Криві виживаності порівнювали за допомогою тесту Log-rank. Однофакторний аналіз пропорційних ризиків Кокса використовувався для виявлення зв’язку клінічних і патологічних факторів із DFS. Двосторонній рівень значущості р <0,05.
РЕЗУЛЬТАТИ
У всіх випадках отримано загальну клінічну відповідь. ЧР пухлини зафіксовано у 37 пацієнток (91,89±1,37%), стабілізація — у 3 (8,11±3,17%). Прогресування захворювання на тлі проведення терапії не зафіксовано.
У І групі – відповідь пухлини на лікування досягнута у 55,0±1,91%, причому ЧР досягнуто у 40,0±2,18%, тоді як ПР у 15,0±2,24%. У ІІ групі – відповідь пухлини на лікування досягнута у 70,0±1,56%, причому ЧР досягнуто у 45,0±2,42%, тоді як ПР у 5 (25,0±2,24%) (табл. 1).
| Ступінь об’єктивної відповіді | Групи хворих, n (%) | р | |
| І група, n=20 (%) | ІІ група, n=20 (%) | ||
| Повна регресія | 3 (15,0±1,91) | 5 (25,0±2,24) | <0,05 |
| Часткова регресія | 8 (40,0±2,18) | 9 (45,0±2,42) | <0,05 |
| Стабілізація | 9 (45,0±2,42) | 6 (30,0±2,28) | <0,05 |
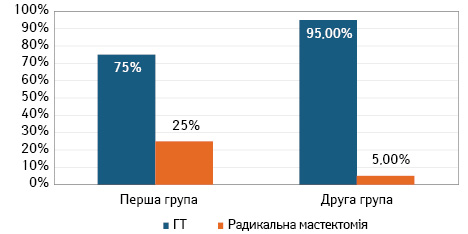
Радикальні оперативні втручання вдалося виконати всім хворим. ОЗО виконано 34 хворим (85±1,42%), у 6 випадках (15,0±2,12%) виконані мастектомії (підшкірна мастектомія з одномоментним ендопротезуванням або радикальні мастектомії за Маденом). У І групі ОЗО виконано 15 пацієнткам (75±1,15%), мастектомії – 5 хворим (25,0±2,88%); у ІІ групі ОЗО виконано 19 пацієнткам (95±1,32%), мастектомія — 1 пацієнтці (5±3,02%) (рис. 2).
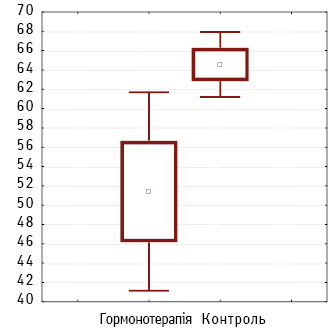
При вивченні постопераційного матеріалу ОЧЖПТ у І групі в середньому виявлено зменшення пухлинної маси на 51,41±2,24%, у ІІ групі — на 64,56±1,72% (t=3,06; р=0,002). Це вказує на підвищений показник відповіді на проведене комбіноване лікування (рис. 3).
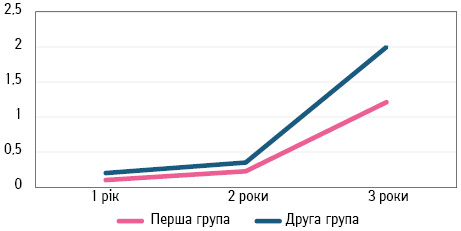
У 2 пацієнток І групи та в одної пацієнтки ІІ групи виявлено рецидив через 3 роки після проведеного лікування (рис. 4).
Доведено, що проведення неоад’ювантної ЕТ на тлі ПТ у хворих на МПХРЛРГЗ підвищує показник відповіді пухлини на проведене лікування, достовірно підвищуючи відсоток часткових та повних клінічних регресій пухлини, сприяє переведенню занедбаних форм РГЗ у радикально резектабельні, підвищуючи відсоток виконання радикальних оперативних втручань. Завдяки розробленій методиці вдалося збільшити вираженість лікувального патоморфозу та підвищити відсоток випадків pCR. Враховуючи отримані результати, є доцільним проведення подальших досліджень для отримання більш вірогідних результатів виживаності.
У пацієнток з виявленим рецидивом захворювання на тлі проведення ЕТ підтверджено мутацію гена ESR1 та запропоновано терапію інгібіторами CDК4/6.
ОБГОВОРЕННЯ
Групою дослідників [9] проведено метааналіз щодо оцінки віддалених результатів лікування пацієнтів з МПРГЗ за допомогою НПХТ проти неоад’ювантної ендокринотерапії (НЕТ). У результатах зафіксовано, що показники загальної та безрецидивної виживаності для обох методів достовірно не відрізнялися.
Більш високий відсоток ОЗО в групі з проведеною ПТ пов’язаний, на нашу думку, із синергетичним впливом методик лікування, що узгоджується з даними R. Nogueira та співавт. [10]. Виявлено, що проведення НЕТ у монорежимі та в комбінації з ПТ у хворих на МПХРЛРГЗ підвищує результати лікування в цілому та надає можливість виконувати радикальні операції з кращим косметичним ефектом, що збігається з даними N. Riaz та співавт. [11].
За даними O. Kaidar-Person та співавт. [12], комбінація ПТ та ЕТ сприяє підвищенню показників безрецидивної виживаності.
Так, використання НЕТ у хворих на МПХРЛРГЗ дозволило достовірно підвищити показник клінічної відповіді пухлини на лікування та підвищити відсоток виконання органозберігаючих втручань, що сприяло прискоренню соціальної адаптації та підвищенню якості життя жінок. Необхідні подальші дослідження з вивчення ефективності НЕТ у комбінації з ПТ та порівняно з НПХТ у цієї когорти хворих для отримання більш вірогідних результатів, на що вказують також результати метааналізу та висновки дослідників S. Nardin і S. Zhang та співавт. [13, 14].
ВИСНОВКИ
1. Впровадження розробленої комбінованої методики лікування із застосуванням неоад’ювантної ПТ та ЕТ інгібіторами ароматази у пацієнток у період постменопаузи з ER-позитивним МПХРЛРГЗ достовірно підвищує показник клінічної відповіді пухлини на лікування, сприяє переведенню неоперабельних форм РГЗ в резектабельні, підвищуючи відсоток виконання радикальних оперативних втручань.
2. Комбінація ЕТ з ПТ виявила тенденцію до підвищення показника 3-річної безрецидивної виживаності порівняно з ПТ.
3. Виявлення мутації гена ESR1 є рекомендованим етапом при виборі тактики лікування хворих з МПХРЛРГЗ.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Clusan, L., Ferrière, F., Flouriot, G., & Pakdel, F. (2023). A Basic Review on Estrogen Receptor Signaling Pathways in Breast Cancer. International Journal of Molecular Sciences, 24(7), 6834. doi.org/10.3390/ijms24076834.
2. Xia, S., & Lin, Q. (2022). Estrogen Receptor Bio-Activities Determine Clinical Endocrine Treatment Options in Estrogen Receptor-Positive Breast Cancer. Technology in Cancer Research & Treatment, 21, 15330338221090351. doi: 10.1177/15330338221090351.
3. Lacopetta, D., Ceramella, J., Baldino, N., Sinicropi, S., & Catalano, A. (2023). Targeting Breast Cancer: An Overlook on Current Strategies. International Journal of Molecular Sciences, 24(4), 3643. doi.org/10.3390/ijms24043643.
4. Freitag, C. E., Mei, P., Wei, L., Parwani, A. V., & Li, Z. (2021). ESR1 genetic alterations and their association with clinicopathologic characteristics in advanced breast cancer: a single academic institution experience. Human Pathology, 107, 80–86. doi: 10.1016/j.humpath.2020.10.007. pubmed.ncbi.nlm.nih.gov/33157125/.
5. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). (2024). Breast Cancer. Version 1.2024. Retrieved from http://www.nccn.org/professionals/physician_gls/pdf/breast.pdf.
6. Radiation therapy for breast cancer. Mayo Clinic. 2022. Retrieved from http://www.mayoclinic.org/ tests-procedures/radiation-therapy-forbreast-cancer/about/pac-20384940.
7. Movchan, О., Smolanka, І., Lyashenko, А., Dosenko, І., Loboda, А., & Ivankova, О. (2022). Systemic therapy of inflammatory breast cancer with type 2 diabetes mellitus — Prevention of high risk of radiation-induced progression of tumor tissue cancer. Romanian Journal of Medical Practice, 17(4), 181–185. doi: 10.37897/RJMP.2022.4.810.
8. Yu, K., Wu, S., Liu, G., Wu, J., Di, G., Hu, Z., … Shao, Z. M. (2019). Concurrent neoadjuvant chemotherapy and estrogen deprivation in patients with estrogen receptor-positive, human epidermal growth factor receptor 2-negative breast cancer (CBCSG-036): A randomized, controlled, multicenter trial. Cancer, 125(13), 2185–2193. doi: 10.1002/cncr.32057.Early Breast Cancer Trialists’ Collaborative Group (EBCTCG) (2018). Long-term outcomes for neoadjuvant chemotherapy versus neoadjuvant endocrinetherapy in advanced breast cancer: meta-analysis of individual patient data from ten randomised trials. The Lancet. Oncology, 19(1), 27–39. doi.org/10.1016/S1470-2045(17)30777-5
9. Nogueira, R., Vital, F., Bernabé, D., & Carvalho, M. (2022). Interventions for Radiation-Induced Fibrosis in Patients With Breast Cancer: Systematic Review and Meta-analyses. Advances in Radiation Oncology, 7(3), 100912. doi: 10.1016/j.adro.2022.100912.
10. Riaz, N., Jeen, T., Whelan, T., & Nielsen, T. (2023). Recent Advances in Optimizing Radiation Therapy Decisions in Early Invasive Breast Cancer. Cancers, 15(4), 1260. doi.org/10.3390/cancers15041260.
11. Kaidar-Person, O., Tramm, T., Kuehn, T., Gentilini, O., Prat, A., Montay-Gruel, P., … Poortmans, P. (2024). Optimising of axillary therapy in breast cancer: lessons from the past to plan for a better future. Radiologia Medica, 129, 315–327. doi: 10.1007/s11547-023-01743-1.
12. Nardin, S., Ruelle, T., Giannubilo, I., & Del Mastro, L. (2023). Adjuvant treatment in hormone receptor-positive early breast cancer: New approaches of endocrine therapy. Tumori, 110(3), 162–167. doi: 10.1177/03008916231216830.
13. Zhang, S., Wang, X., & Jiang, Z. (2023). Expert consensus on endocrine therapy of breast cancer (2023 edition). Zhonghua Yi Xue Za Zhi, 103(38), 2993–3001. doi: 10.3760/cma.j.cn112137-20230616-01027.
Адреса для листування:
Ляшенко Андрій Олександрович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: artz.doctor@gmail.com
Correspondence:
Andriy Lyashenko
Nonprofit Organization National Cancer Institute
33/43 Yulii Zdanovskoi str., Kyiv, 03022
E-mail: artz.doctor@gmail.com














Leave a comment