Неоад’ювантна хімієтерапія в комплексному лікуванні хворих на рак яєчників ІІІ–ІV стадій
Грицик Р.А.1, Крижанівська А.Є.2
- 1Івано-Франківський національний медичний університет, Україна
- 2Комунальне некомерційне підприємство «Прикарпатський клінічний онкологічний центр Івано-Франківської обласної ради», Україна
Резюме. Мета. Оцінка ефективності неоад’ювантної хімієтерапії з подальшою інтервальною циторедуктивною операцією порівняно з первинною циторедуктивною операцією та подальшими циклами хімієтерапії. Матеріали і методи дослідження. Проведено аналіз результатів лікування 142 пацієнток з раком яєчників (РЯ) IІІ–ІV стадій, які отримали лікування в Комунальному некомерційному підприємстві «Прикарпатський клінічний онкологічний центр Івано-Франківської обласної ради» (КНП «ПКОЦ ІФ ОР») з 2017 до 2023 р. Пацієнток за методом лікування розподілено на 2 групи: І група (69 хворих) — первинна циторедуктивна операція (ПЦО), ад’ювантні цикли поліхімієтерапії; ІІ група (73 хворі) — 3 неоад’ювантні цикли поліхімієтерапії, інтервальна циторедуктивна операція (ІЦО), ад’ювантні цикли поліхімієтерапії. Усі пацієнтки отримували хімієтерапію за схемою паклітаксел + карбоплатин. Аналізували ефективність ІЦО порівняно з ПЦО (індекс перитонеального канцероматозу (index of peritoneal carcinomatosis — PCI), динаміку зниження рівня онкомаркера СА-125, ступінь патоморфозу пухлини, хірургічні ускладнення, результати лікування, якість життя, віддалені результати). Результати. Згідно з отриманими результатами встановлено що після проведення неоад’ювантної хімієтерапії (НАХТ) показник РСІ знизився в 1,4 раза до середнього значення 12,9±4,6 балів. При оцінці хірургічних втручань встановлено, що тривалість операції була більшою в І групі (ПЦО) порівняно з ІІ групою (ІЦО) в 1,3 раза, а також відмічається збільшення об’єму крововтрати при операції в 1,3 раза. При аналізі даних щодо ступеня патоморфозу та радикальності проведення циторедуктивних операцій у ІІ групі встановлено, що за наявності патоморфозу ІІІ–ІV ступеня — відсутні нерадикальні циторедуктивні втручання, переважають оптимальні циторедукції. Виявлено статистичну достовірність між динамікою зниження рівня СА-125 та патоморфозом 0, І, ІІ, ІІІ ступенів (p <0,05) та статистичну недостовірність з патоморфозом ІV ступеня (p >0,05). Згідно з отриманими результатами загальна кумулятивна виживаність у І та ІІ групі статистично достовірно не відрізняється, а саме 3-річна загальна кумулятивна виживаність становила 50% у І групі, а в ІІ групі — 58%. 3-річна безрецидивна кумулятивна виживаність у І групі становила 24%, а в ІІ групі — 48% відповідно. Медіана безрецидивної виживаності в І групі становила 19 міс, у ІІ групі — 25 міс. Висновки. Проведення неоад’ювантної хімієтерапії у хворих на РЯ ІІІ–IV стадій дозволяє знизити PCI, тривалість хірургічного втручання, інтраопераційні ускладнення та виявити платино-резистентні пухлини. 3-річна загальна кумулятивна виживаність була однаковою у хворих, які на першому етапі лікування мали хірургічне втручання чи неоад’ювантні цикли хімієтерапії, проте безрецидивна виживаність є достовірно вищою у хворих, які отримували неоад’ювантні цикли хімієтерапії.
Одержано 26.08.2024
Прийнято до друку 5.09.2024
DOI: 10.32471/clinicaloncology.2663-466X.55-3.33152
ВСТУП
За даними звіту Всесвітньої організації охорони здоров’я (ВООЗ), щорічна захворюваність на РЯ становить 225 500 та 140 200 смертей у всьому світі, відповідно, це 3,7% від усіх ракових захворювань у жінок і 4,2% усіх смертей від онкопатології [1]. Близько 80% випадків РЯ діагностують на пізніх стадіях — III та IV за Міжнародною федерацією гінекології та акушерства (International Federation of Gynecology and Obstetrics — FIGO), що призводить до низького показника виживаності [2]. У більшості пацієнтів спостерігається рецидив захворювання протягом перших 5 років, незважаючи на первинне агресивне лікування, тоді як лише у 20–25% усіх випадків хворі виліковуються. Більше того, 5-річна виживаність пацієнтів із поширеним РЯ не підвищилася останнім десятиріччям.
Поточна стандартна терапія для осіб із поширеним РЯ — це ПЦО з наступною ад’ювантною хімієтерапією (АХТ) комбінацією паклітакселу та карбоплатину [3]. Повна або оптимальна циторедуктивна хірургія, що визначається як відсутність залишкової пухлини або <10 мм залишкового новоутворення наприкінці операції, відповідно, є найважливішим прогностичним фактором. Нещодавно ІЦО після 3 курсів НАХТ стала альтернативною стратегією лікування пацієнтів з РЯ, в яких очікувалася неоптимальна циторедукція під час ПЦО. У кількох рандомізованих контрольованих дослідженнях відмічено, що хворі, які пройшли курс НАХТ-ІЦО, мали значно нижчі ступені тяжкості побічних ефектів і рівень хірургічної смертності після ІЦО, ніж ті, хто пройшов ПЦО [4]. Результати виживаності, такі як безрецидивна виживаність і загальна виживаність, були подібними між НАХТ-ІЦО і ПЦО [5–7]. Використання НАХТ поступово зросло з 16% протягом 2003–2010 рр. до 34% протягом 2011–2012 рр. у пацієнток з ІІІС стадією захворювання та з 41 до 62% при IV стадії онкопатології [8].
Оскільки різними дослідниками отримані різні дані щодо ефективності застосування НАХТ, то ця тема дослідження є актуальною.
Мета роботи — оцінка ефективності НАХТ з подальшою ІЦО порівняно з ПЦО та ад’ювантними циклами хімієтерапії.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Проведено аналіз результатів лікування 142 пацієнток з РЯ IІІ–ІV стадій, які отримали терапію в КНП «ПКОЦ ІФ ОР» з 2017 до 2023 р. У всіх жінок діагностовано РЯ IІІ–ІVB стадій, що підтверджено морфологічно.
Після проведення комп’ютерної томографії (КТ) та оцінки PCI проведено розподіл хворих на 2 групи: І група — PCI 10–20 балів, ПЦО — 69 пацієнток; ІІ група — PCI 10–20 балів, ІЦО — 73 пацієнток (рис. 1).
Характеристику пацієнток представлено в табл. 1.
| Параметр | І група (ПЦО)
(n=69) |
ІІ група (ІЦО)
(n=73) |
| Вік: років | 59,7±8,5 | 62,7±5,9 |
| FIGO стадія | ||
| ІІІА | 1 | − |
| ІІІВ | 5 | 3 |
| ІІІС | 51 | 66 |
| ІVA | 7 | 1 |
| ІVB | 5 | 3 |
| Індекс маси тіла (ІМТ) | 24,4±3,4 | 22,5±2,3 |
| Рівень СА-125, МО/мл | 1544±311 | 1791±268 |
У цьому дослідженні аналізували ефективність ІЦО порівняно з ПЦО (PCI, динаміку зниження рівня онкомаркера СА-125, ступінь патоморфозу пухлини, хірургічні ускладнення, результати лікування, якість життя, віддалені результати) пацієнток з РЯ ІІІ–IV стадій.
Усім жінкам визначали рівень онкомаркера СА-125 в плазмі крові перед початком лікування, а також перед кожним циклом хімієтерапії та при подальшому спостереженні.
Обов’язковою частиною обстеження була КТ ОГК, ОЧП та ОМТ з контрастуванням. КТ проводили на етапі діагностики для оцінки PCI, через місяць після хірургічного втручання, а у групі пацієнток, які отримували неоад’ювантну поліхімієтерапію, — після 3 циклів та кожні 12 тиж упродовж перших 2 років спостереження після завершення лікування, після чого — 1 раз у пів року.
Особам з І і ІІ груп проводили хірургічне втручання з метою досягнення повної циторедукції. Після завершення хірургічного втручання оцінювали наявність залишкової пухлини: R0 — відсутність залишкової пухлини, R1 — наявність дрібних поодиноких вогнищ, які сумарно не перевищують 1 см, та R2 — наявність залишкових вогнищ, які сумарно >1 см. У всіх операціях залучено сертифікованого онкогінеколога.
У І групі після проведення ПЦО пацієнтки отримали 6 циклів ПХТ. У ІІ групі всім жінкам на I етапі проведено 3 цикли ПХТ, після чого проведена ІЦО, у подальшому — 3–6 циклів ПХТ. Системна хімієтерапія базувалася на проведенні циклів хімієтерапії кожен 21 день за схемою паклітаксел 175 мг/м2 та карбоплатин AUC 6. Усім пацієнткам проведено тестування на BRCA ½ (за наявності мутації всім пацієнткам рекомендували підтримувальну терапію олапарибом).
Вивчали якість життя згідно з опитувальником EQ-5D-5L до початку лікування, після операції та завершення терапії.
Загальну і безрецидивну виживаність розраховували за методом Каплана — Меєра.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Відповідно до отриманих результатів встановлено, що в І групі (ПЦО) середній радіологічний показник PCI до початку лікування становив 15,3±2,7 балів, а в ІІ групі — 18,7±3,1 балів, що в 1,2 раза більше. Після проведення НАХТ показник знизився в 1,4 раза до середнього значення 12,9±4,6 балів (табл. 2).
| Група | PCI до початку лікування | PCI після завершення НАХТ | ||
| радіологічне | хірургічне | радіологічне | хірургічне | |
| І (ПЦО) | 15,3±2,7 | 17,1±2,4 | − | − |
| ІІ (ІЦО) | 18,7±3,1 | 19,3±2,9 | 12,9±4,6 | 13,4±3,9 |
При оцінці хірургічних втручань встановлено, що тривалість операції була довшою в І групі (ПЦО) порівняно з ІІ групою (ІЦО) в 1,3 раза, а також відмічається збільшення об’єму крововтрати при операції в 1,3 раза. Серед інтраопераційних ускладнень визначається вища частота кровотеч, перфорацій тонкої та товстої кишки в групі ПЦО, що зумовлено більшим об’ємом пухлинного ураження порівняно з пацієнтами ІІ групи.
Серед ранніх післяопераційних ускладнень у І групі зафіксовано 4 випадки кишкової непрохідності, 1 випадок гематоми передньої черевної стінки, 1 випадок кишкової неспроможності типу А. У ІІ групі виявлено 3 випадки кишкової непрохідності, 2 випадки гематоми передньої черевної стінки, 1 випадок інфекції післяопераційної рани, 1 випадок кровотечі з кукси піхви. Усі післяопераційні ускладнення усунуто консервативними методами лікування (табл. 3).
| Параметр | І група (ПЦО)
(n=69) |
ІІ група (ІЦО)
(n=73) |
| Тривалість хірургічного втручання, хв | 247±38 | 192±41 |
| Об’єм крововтрати, мл | 358±59,3 | 271±41,7 |
| Інтраопераційні ускладнення, n (%) | 11 (15,9) | 7 (9,6) |
| Кровотеча, n (%) | 3 (4,3) | 2 (2,7) |
| Перфорація кишки, n (%) | 4 (5,8) | 2 (2,7) |
| Інші ушкодження, n (%) | 4 (5,8) | 3 (4,1) |
| Ранні післяопераційні ускладнення, n (%) | 6 (8,7) | 7 (9,6) |
| Пізні післяопераційні ускладнення, n (%) | 5 (7,2) | 4 (5,5) |
| Об’єм циторедукції | ||
| R0 | 31 | 30 |
| R1 | 27 | 34 |
| R2 | 11 | 9 |
При аналізі даних щодо ступеня патоморфозу та радикальності проведення циторедуктивних операцій у ІІ групі встановлено, що за наявності патоморфозу ІІІ–ІV ступенів — відсутні нерадикальні циторедуктивні втручання, переважають оптимальні циторедукції. При ступенях патоморфозу І та ІІ фіксується наявність нерадикальних хірургічних операцій у 16% усіх випадків, субоптимальних — у 41%, а оптимальних — у 43% (табл. 4).
| Ступінь патоморфозу | 0 | І | ІІ | ІІІ | ІV |
| Кількість пацієнток | 9 | 20 | 25 | 11 | 8 |
| Радикальність проведення операції | |||||
| R0 | 3 | 11 | 9 | 4 | 3 |
| R1 | 6 | 6 | 12 | 5 | 5 |
| R2 | − | 3 | 4 | 2 | − |
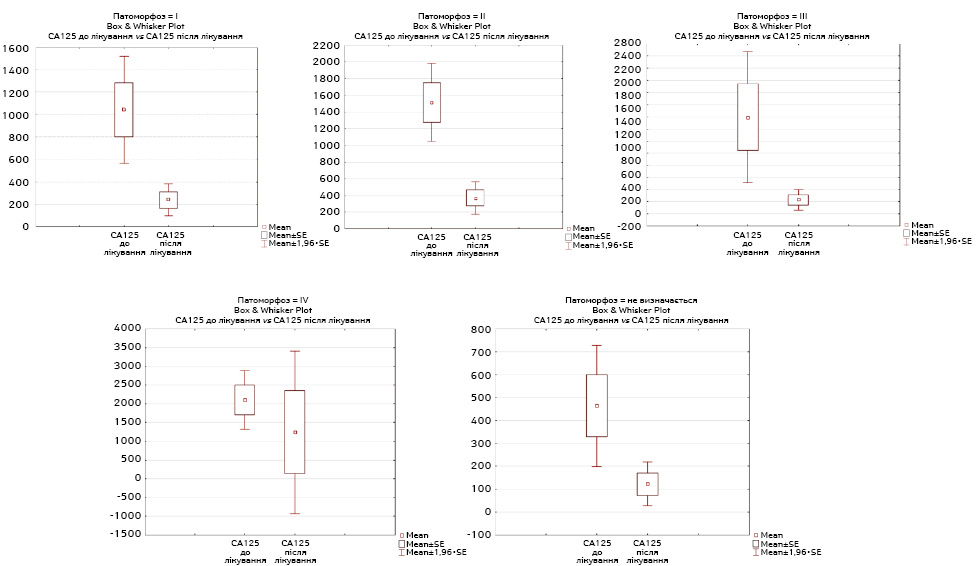
Проведено визначення статистичної залежності між ступенем патоморфозу пухлини під час НАХТ та динамікою зниження рівня онкомаркера СА-125 залежно від ступеня патоморфозу.
Згідно з отриманими даними виявлено статистичну достовірність між динамікою зниження рівня СА-125 та патоморфозом 0, І, ІІ, ІІІ ступенів (p <0,05) та статистичну недостовірність з патоморфозом ІV ступеня (p >0,05) (рис. 2).
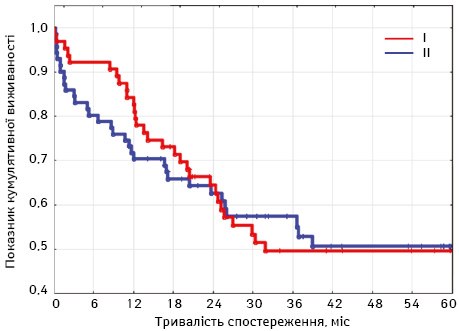
Відповідно до отриманих результатів загальна кумулятивна виживаність у І та ІІ групах статистично достовірно не відрізняється, а саме 3-річна загальна кумулятивна виживаність становила 50% у І групі, а в ІІ групі — 58%. Медіана загальної виживаності в І групі становила 31 міс, в ІІ групі — 37 міс (рис. 3).
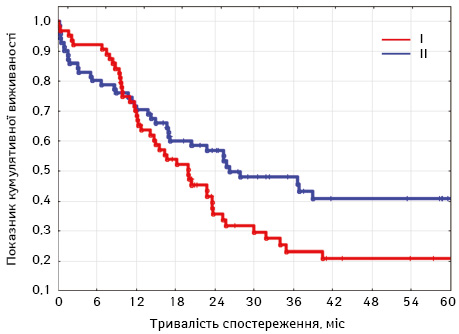
3-річна безрецидивна кумулятивна виживаність у І групі становила 24%, а в ІІ групі — 48% відповідно. Медіана безрецидивної виживаності в І групі становила 19 міс, в ІІ групі — 25 міс (рис. 4).
ВИСНОВКИ
Проведення НАХТ у хворих на РЯ ІІІ–IV стадій дозволяє знизити PCI, тривалість хірургічного втручання, інтраопераційні ускладнення та виявити платино-резистентні пухлини. 3-річна загальна кумулятивна виживаність була однаковою у пацієнтів, які на першому етапі лікування мали хірургічне втручання чи неоад’ювантні цикли хімієтерапії, проте безрецидивна виживаність є достовірно вищою у осіб, які отримували неоад’ювантні цикли хімієтерапії.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Minig, L., Zorrero, C., Iserte, P. P., & Poveda, A. (2015). Selecting the best strategy of treatment in newly diagnosed advanced-stage ovarian cancer patients. World Journal of Methodology, 5(4), 196–202. doi: 10.5662/wjm.v5.i4.196.
2. Seidman, J. D., Yemelyanova, A., Cosin, J. A., Smith, A., & Kurman, R. J. (2012). Survival rates for international federation of gynecology and obstetrics stage III ovarian carcinoma by cell type: a study of 262 unselected patients with uniform pathologic review. International Journal of Gynecological Cancer, 22(3), 367–371. doi: 10.1097/IGC.0b013e31823c6f80.
3. Du Bois, A., & Pfisterer, J. (2005). Future options for first-line therapy of advanced ovarian cancer. International Journal of Gynecological Cancer, 5(1), 42–50. doi: 10.1111/j.1525-1438.2005.15356.x.
4. Onda, T., Satoh, T., Saito, T., Kasamatsu, T., Nakanishi, T., Nakamura, K., … Yoshikawa, H. (20016). Comparison of treatment invasiveness between upfront debulking surgery versus interval debulking surgery following neoadjuvant chemotherapy for stage III/IV ovarian, tubal, and peritoneal cancers in a phase III randomised trial: Japan Clinical Oncology Group Study JCOG0602. European Journal of Cancer, 64, 22–31. doi: 10.1016/j.ejca.2016.05.017.
5. Vergote, I., Trope, C. G., Amant, F., Kristensen, G. B., Ehlen, T., Johnson, N., … Reed, N. S. (2010). Neoadjuvant chemotherapy or primary surgery in stage IIIC or IV ovarian cancer. New England Journal of Medicine, 363(10), 943–953. doi: 10.1056/NEJMoa0908806.
6. Kehoe, S., Hook, J., Nankivell, M., Jayson, G. C., Kitchener, H., Lopes, T., … Swart, A. M. (2015). Primary chemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer (CHORUS): an open-label, randomised, controlled, non-inferiority trial. Lancet, 386(9990), 249–257. doi: 10.1016/S0140-6736(14)62223-6.
7. Vergote, I., Leunen, K., & Amant, F. (2012). Primary surgery or neoadjuvant chemotherapy in ovarian cancer: what is the value of comparing apples with oranges? Gynecologic Oncology, 124(1), 1–2. doi: 10.1016/j.ygyno.2011.11.010.
8. Meyer, L. A., Cronin, A. M., Sun, C. C., Bixel, K., Bookman, M. A., Cristea, M. C., … Wright, A. A. (2016). Use and Effectiveness of Neoadjuvant Chemotherapy for Treatment of Ovarian Cancer. Journal of Clinical Oncology, 34(32), 3854–3863. doi: 10.1200/JCO.2016.68.1239.
Адреса для листування:
Грицик Роман
76018, Івано-Франківськ, вул. Галицька, 2
Комунальне некомерційне підприємство
«Івано-Франківський національний медичний університет»
E-mail: grytsy95@mail.com
Correspondence:
Roman Hrytsyk
2 Halytska str., Ivano-Frankivsk, 76018
Municipal Nonprofit Enterprise
«Ivano-Frankivsk National Medical University»
E-mail: grytsy95@mail.com














Leave a comment