Зниження захворюваності на гепатоцелюлярну карциному за допомогою вакцинації від вірусу гепатиту B
Пацко В.В., Черченко К.Д., Остапенко Ю.В., Лукашенко А.В.
Резюме. Рак печінки є 5-м за поширеністю серед онкологічних захворювань у чоловіків і 9-м серед жінок, але він посідає 2-ге місце серед причин смерті від раку у чоловіків і 6-те у жінок. Гепатоцелюлярна карцинома (ГЦК) є найпоширенішим підтипом первинної онкопатології печінки. Географічні варіації частоти раку печінки значною мірою відображають поширеність інфекції, що викликана вірусом гепатиту В (ВГB), на яку припадає майже 55% усіх випадків ГЦК у світі. Програми вакцинації проти гепатиту В є дуже ефективними, про що свідчить різке зниження захворюваності на ГЦК (60,1%), смертності внаслідок фульмінантної печінкової недостатності та хронічних захворювань печінки. Вакцинація в Україні, за даними Всесвітньої організації охорони здоров’я (ВООЗ), має стійку тенденцію до зниження. У статті наведено огляд останньої медичної літератури та досліджень у сфері вакцинації від ВГB як одного з методів профілактики ГЦК.
Одержано 16.09.2024
Прийнято до друку 27.09.2024
DOI: 10.32471/clinicaloncology.2663-466X.55-3.33122
АКТУАЛЬНІСТЬ ТЕМИ
Рак печінки є 5-м за поширеністю серед онкологічних захворювань у чоловіків і 9-м у жінок, але він посідає 2-ге місце серед причин смерті від онкопатології у чоловіків і 6-те у жінок. Найвищі показники захворюваності зафіксовано в Східній і Південно-Східній Азії та Північній Африці, найвищі у світі показники захворюваності — в Монголії (85,6 на 100 тис.), а найбільший тягар — у Китаї (45% від загальної кількості випадків) через підвищений ризик і велику кількість населення.
Країни, де рак печінки є основною причиною смерті, включають групу країн Південно-Східної Азії, де мешкає ендемічний канцерогенний плоский черв Opisthorchis viverrini, а також Монголію та кілька країн Північної та Західної Африки (наприклад Єгипет та Нігер), що значною мірою відображає найвищу у світі поширеність інфекції вірусу ВГВ та/або вірусу гепатиту С (ВГС) [1].
У всьому світі ГЦК є найпоширенішим підтипом первинного раку печінки, що становить близько 75% від загальної кількості випадків у всьому світі [2]. Внутрішньопечінкова холангіокарцинома, 2-й за поширеністю гістологічний тип, становить близько 15% від загальної кількості випадків [3]. Географічні варіації частоти виявлення раку печінки значною мірою відображають поширеність інфекції, викликаної ВГВ, на яку припадає майже 55% усіх випадків ГЦК у світі [4].
Протягом останнього періоду рівень захворюваності на рак печінки знизився в багатьох країнах підвищеного ризику: Східної та Південно-Східної Азії, що відображає зменшення забруднення продовольчих культур афлатоксинами та зниження поширеності інфекції ВГВ [5–7]. На Тайвані захворюваність на ГЦК знизилася на 80%, а смертність — на 92% у когортах, які народилися з моменту початку програми неонатальної вакцинації проти гепатиту В у 1984 р. [8]. Багато інших країн, які запровадили програми у 1980-х роках, наприклад Китай, Сінгапур, Республіка Корея та Іспанія, задокументували подібне зниження, хоча й в дещо менших масштабах [7, 9].
ПАТОГЕН
ВГВ (родина Hepadnaviridae, рід Orthohepadnavirus) має невеликий, круглий, частково дволанцюговий геном ДНК всередині ікосаедричного ядра (рис. 1). Гепатоцити є основним місцем для реплікації ВГВ [10, 11]. Люди є єдиним відомим хазяїном для реплікації ВГВ людини, але тісно пов’язані з ВГВ людини генотипи існують у вищих приматів [12, 13]. ВГВ відносно термостабільний (залишається заразним протягом принаймні 1 тиж у навколишньому середовищі) і дуже контамінантний. ВГВ є чутливим до мийних засобів і розчинників, які розчиняють ліпіди з вірусної оболонки [14].
ВГВ містить 3 важливі антигени: c, e і s. Внутрішній («core-серцевий») антиген вірусу гепатиту В (HBcAg) наявний на зібраному капсиді, який містить вірусну ДНК. Антитіла проти HBcAg (анти-HBc) легко утворюються у високих титрах під час перебігу інфекції, але не є захисними. Відкрита рамка зчитування, що кодує внутрішній білок, має preC послідовність, яка перетворює «серцевий» білок на секреторний протеїн. Цей білок не утворює капсиди або HBcAg, а утворює новий специфічний антиген, названий e-антигеном гепатиту B (HBeAg) [15]. Наявність HBeAg у плазмі крові вказує на те, що реплікація ВГВ є високоактивною, а кров та інші рідини організму (слина, сперма та вагінальні рідини) дуже заразні. Вірусна оболонка містить HBsAg, який включає 3 типи білів: малі (SHBs), середні (MHBs) і великі поверхневі білки (LHBs). SHBs є основним компонентом вірусної оболонки, які утворюють менші додаткові незаразні субвірусні частинки (noninfectious subviral particles — SVP), які виділяються в кров (співвідношення вірусних частинок SVP=1:3000). ДНК ВГВ може інтегруватися в геном інфікованого гепатоциту, що призводить до довічної інфекції, а інтегровані фрагменти ДНК можуть сприяти розвитку ГЦК. Неструктурний білок HBx підтримує транскрипцію вірусної ДНК і може спричиняти онкогенність ВГВ [10, 11, 16].
ВГВ виявляється в 10 різних генотипах (від A до J) з варіаціями у ДНК >8% між генотипами. Поширеність генотипів змінюється географічно. Існує багато субгенотипів ВГВ, які відрізняються на >4%. Генотипи ВГВ, пов’язані з різним перебігом захворювання, ступенем тяжкості патології печінки та результатами лікування [10, 11, 17–19].
ПЕРЕДАЧА ТА ПЕРЕБІГ ХВОРОБИ
Передача
ВГВ передається через контакт слизових оболонок або неушкодженої шкіри із інфікованою кров’ю чи іншими специфічними рідинами організму (слиною, спермою та вагінальною рідиною). Передача може відбуватися перинатально від матері до дитини і від людини до людини [10]. Немовлята, народжені матерями, які мають позитивний результат як на HBsAg, так і на HBeAg, мають підвищений ризик зараження (ризик передачі становить 70–100% в Азії та 40% в Африці), ніж народжені HBsAg-позитивними матерями, які не мають HBeAg (5–30% в Азії та 5% в Африці) [20, 21]. Немовлята, народжені від матері з інфекцією ВГВ з високою реплікою вірусу, знаходяться у групі підвищеного ризику перинатальної передачі [18, 19]. Кесарів розтин знижує ймовірність перинатальної передачі інфекції ВГB від HBsAg-позитивних жінок своїм немовлятам [19].
Передача ВГВ може відбуватися навіть за відсутності видимої крові, наприклад, при спільному використанні зубних щіток або бритв, контакті з ексудатами ушкодженої шкіри, слиною через укуси або інші ушкодження шкіри, при уколах голкою або повторному використанні голок та/або шприців, спільне використання жувальної гумки чи харчових продуктів або контакт із поверхнями, які забруднені ВГВ. Серед підлітків і дорослих основним шляхом передачі інфекції є статевий, через контакт зі спермою або вагінальною рідиною [10].
Перебіг хвороби
Інкубаційний період гострого гепатиту В у середньому становить 75 днів, але може коливатися від 30 до 180 днів. Ураження печінки під час інфекції ВГВ опосередковане імунною відповіддю господаря. Наслідки інфекції ВГВ залежать від факторів хазяїна, включно з віком, статтю, генетичним походженням, супутніми інфекціями, іншими супутніми захворюваннями та ліками, які приймає інфікована особа, а також від вірусних факторів, які включають генотип ВГВ та вірусну ДНК [10, 11, 22]. Недавнє інфікування ВГВ характеризується наявністю у плазмі крові HBsAg та імуноглобуліну M (IgM) проти HBcAg.
Під час початкової високореплікативної фази інфекції пацієнти також серопозитивні щодо HBeAg.
Початкова інфекція може протікати безсимптомно або може проявлятися у вигляді гострого (клінічного) гепатиту з жовтяницею або без неї, або призвести до фульмінантного гепатиту. Гострий гепатит В, що характеризується гострим запаленням і гепатоцелюлярним некрозом, розвивається в близько 1% усіх перинатальних інфекцій, 10% — ранніх дитячих інфекцій (у дітей 1–5 років) і 30% — пізніх інфекцій (у осіб віком старше 5 років). Фульмінантний перебіг виявляють рідко, переважно у немовлят і дітей, у дорослих частота розвитку гострого гепатиту B становить до 0,5–1%. У 20–33% випадків фульмінантний гепатит у дорослих призводить до летальних результатів [10, 23]. Частота розвитку хронічної ВГВ-інфекції обернено пропорційна віку зараження і виникає у близько 80–90% усіх немовлят, інфікованих перинатально, 30–50% усіх дітей, інфікованих у віці до 6 років, і в <5% інфекцій, що виникають у відносно здорових дорослих [10, 24, 25].
Хронічний гепатит В охоплює спектр захворювань і визначається як стійка інфекція ВГВ (наявність HBsAg у плазмі крові або сироватці довше 6 міс) з або без наявної активної реплікації вірусу в плазмі крові або ознаками ушкодження та запалення гепатоцитів. Хронічно інфіковані особи мають підвищений рівень ризику розвитку цирозу печінки та ГЦК [10, 20]. Деякі паралельні стани у осіб із хронічною ВГВ-інфекцією. Такі супутні інфекції, як вірус імунодефіциту людини (ВІЛ), ВГС або вірус гепатиту D (ВГD) (фульмінантний гепатит часто викликається суперінфекцією носіїв ВГС та ВГD), а також велике споживання алкоголю та вплив афлатоксинів пов’язують із підвищеним ризиком розвитку хвороб печінки [10, 20, 26].
ЛІКУВАННЯ
Специфічного лікування гострого гепатиту В не існує. Симптоматичне лікування засноване на підтримувальній терапії, спрямованій на зменшення вираженості симптомів, зокрема забезпечення адекватного харчування та компенсації рідини, втраченої через блювання та діарею [10].
Метою противірусної терапії хронічної інфекції ВГВ є зниження захворюваності та смертності внаслідок прогресуючих захворювань печінки. ВООЗ рекомендує використовувати противірусні препарати з високим бар’єром резистентності (тенофовір або ентекавір) як терапію першої лінії для уникнення проблем, повʼязаних із резистентністю до препаратів. Показано, що лікування хронічної інфекції ВГВ дозволяє попередити або сповільнити прогресування цирозу, знизити захворюваність на ГЦК і підвищує виживаність завдяки тривалому пригніченню вірусу, але це не є радикальним лікуванням. Однак лікування гепатиту В не є легкодоступним і має певні ресурсні обмеження, хоча тенофовір є доступним як частина антиретровірусної терапії.
Існують докази, що противірусне лікування в III триместр вагітності може знизити вірусне навантаження у жінок і вірогідність перинатальної передачі ВГВ від матері з дуже високим вірусним навантаженням [27, 28]. Однак ВООЗ наразі не рекомендує його регулярне застосування для профілактики передачі від матері до дитини, очікується завершення та перегляд додаткових досліджень ефективності в контексті наявного використання вакцинації при народженні та оцінка її важливості [29].
ВАКЦИНА
ВГВ відкритий у 1965 р. доктором Барухом Бламбергом, який отримав за своє відкриття Нобелівську премію. Спочатку вірус називали «австралійським антигеном», оскільки він був названий на честь зразка крові австралійського аборигена, який дав реакцію з антитілом у сироватці американського хворого на гемофілію [30].
Працюючи з доктором Б. Бламбергом, мікробіолог Ірвінг Міллман допоміг розробити аналіз крові на ВГВ. Банки крові почали використовувати цей тест у 1971 р. для скринінгу донорської крові, і ризик зараження гепатитом В при переливанні крові знизився на 25%. Через 4 роки після виявлення ВГВ доктори Б. Бламберг та І. Міллман розробили першу вакцину проти гепатиту В, яка спочатку була термічно обробленою формою вірусу.
У 1981 р. Управління з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA) схвалило більш складну вакцину проти гепатиту В, отриману з плазми крові. Цей «інактивований» тип вакцини передбачав збір крові від донорів, інфікованих ВГВ (HBsAg-позитивних). Забрану кров піддавали декільком стадіям деактивації вірусних частинок, які включали формальдегід і термічну обробку (або пастеризацію). Merck Pharmaceuticals виготовила цю плазмову вакцину під назвою «Гептавакс», яка була першою комерційною вакциною проти ВГВ. Застосування цієї вакцини припинено в 1990 р., і вона більше не доступна [31].
У 1986 р. в результаті досліджень створено друге покоління генно-інженерних (або рекомбінантних ДНК) вакцин проти гепатиту В. Ці нові схвалені вакцини виготовлені синтетичним шляхом і не містять продуктів крові, тобто неможливо заразитися гепатитом B від нових рекомбінантних вакцин, які зараз схвалені для використання у світі.
Усі вакцини проти гепатиту В, які зараз є на ринку, потребують додавання до допоміжних речовин. Рекомбінантна вакцина проти гепатиту В, виготовлена на дріжджах, призначена для дорослих пацієнтів із нирковою недостатністю (включно з хворими на пре-гемодіалізі та гемодіалізі), які погано реагують на стандартні вакцини проти гепатиту В, містить 500 мкг алюмінію фосфату та 50 мкг AS04C (3-O-дезацил-4’-монофосфорил ліпід А) як допоміжні речовини; ця вакцина застосовується в Європі [32, 33].
Вакцини проти гепатиту В (рис. 2) доступні у вигляді моновалентних форм для вакцинації при народженні або для вакцинації дорослих осіб із групи ризику, а також у комбінації з іншими вакцинами для вакцинації немовлят, зокрема проти дифтерії — правця — кашлюку (АКДП), Haemophilus influenzae типу b (Hib) та інактивованими вакцинами проти поліомієліту (IPV). Також доступна комбінована вакцина проти гепатитів B і A [10, 34–36]. Враховуючи відмінності у виробничих процесах і популяції вакцинованих, кількість білка HBsAg на дозу, яка індукує захисну імунну відповідь, відрізняється у вакцинах різних виробників. Стандартна доза для дітей містить 5–10 мкг HBsAg, а для дорослих вона становить 10–20 мкг; вакцина в дозі 40 мкг застосовується для хворих з ослабленим імунітетом і пацієнтів на діалізі. Дозування вакцини для немовлят, дітей та підлітків становить на 50% менше, ніж потрібно для дорослих. Однак відносну ефективність різних вакцин неможливо оцінити тільки на підставі відмінностей вмісту HBsAg і не існує міжнародного стандарту ефективності вакцини через різноманіття реакційної здатності вироблених вакцин різними технологіями виробництва та відмінностями в ад’ювантах, що використовуються для виготовлення. ВООЗ розробила рекомендації щодо забезпечення якості, безпеки та ефективності рекомбінантних вакцин проти гепатиту В [10, 37, 38].
ВВЕДЕННЯ, СХЕМИ ВВЕДЕННЯ ТА ЗБЕРІГАННЯ
Вакцину проти гепатиту В слід вводити внутрішньом’язово у передньолатеральний бік стегна для немовлят або в дельтоподібний м’яз для дітей старшого віку і дорослих. Введення в сідничний м’яз не рекомендується, оскільки цей шлях асоціюється зі зниженням концентрації захисних антитіл і ризиком ушкодження сідничного нерва [32].
Первинна 3-дозова схема щеплення проти гепатиту В для немовлят традиційно рекомендована завдяки історичним дослідженням, проведеним виробниками моновалентних вакцин, складається з 1 моновалентної дози при народженні, після якої вводяться 2 дози моновалентної або комбінованої вакцини проти гепатиту під час тих самих візитів, що й перша та третя дози АКДП-вмісної вакцини. Альтернативно, з програмних причин, вводять 4 дози вакцини проти гепатиту В (наприклад 1 моновалентну дозу при народженні, а потім 3 моновалентні або у складі комбінованої вакцини, що містить гепатит В) вводять під час тих самих візитів, що й 3 дози АКДП-вмісної вакцини [39].
Для відстрочених схем, зокрема для дітей, підлітків і дорослих, рекомендовано 3 дози, причому 2-гу дозу слід вводити щонайменше через 1 міс, а 3-тю дозу — через 6 міс після першої дози. За виняткових обставин (наприклад подорожей, якщо потрібен швидкий захист) можна зробити 3 ін’єкції на 0-й, 7-й і 21-й день, а потім четверту дозу через 12 міс після першої. Деякі вакцини проти гепатиту В можуть бути введені у вигляді альтернативної 2-дозової схеми із інтервалом 4–6 міс [40]. У будь-якій віковій групі переривання схеми вакцинації не робить необхідним початок вакцинації з 1-ї дози. Якщо первинна схема була перервана після першої дози, другу дозу слід вводити якомога швидше, а другу і третю дози розподілити між собою мінімальним інтервалом у щонайменше 4 тиж. Якщо відкладається лише третя доза, її слід ввести якомога швидше [41].
ЗБЕРІГАННЯ
Загалом вакцини проти гепатиту В слід транспортувати і зберігати за температури 2–8 °C. Варто уникати заморожування, оскільки це викликає дисоціацію антигену від ад’ювант галуну, що призводить до втрати ефективності. Інколи введення дози при народженні лімітовано доступом до холодного сховища [41]. Огляд ВООЗ опублікованої інформації та даних виробників на основі in vivo та in vitro дослідів з метою оцінки термостабільності моновалентних вакцин проти гепатиту В свідчить про те, що вакцини проти гепатиту В є відносно термостабільними. 4 контрольовані польові дослідження (2 серед немовлят) оцінювали підхід поза холодовим ланцюгом. Серед немовлят або дорослих, яких рандомізовано для отримання вакцини, що зберігається за межами холодового ланцюга, різниці в концентраціях антитіл анти-HBs або пропорціях, що забезпечують серопротекцію анти-HBs, не виявлено.
Вкладиші до 2 моновалентних вакцин проти гепатиту В вказують на те, що вакцина стабільна протягом 1 міс за температури 37 °C і протягом 1 тиж за температури 45 °C [42].
ІМУНОГЕННІСТЬ ТА ЕФЕКТИВНІСТЬ ВАКЦИНИ
Захисна ефективність вакцини проти гепатиту В залежить від наявності антитіл IgG до HBsAg (анти-HBs) після завершення вакцинації. Концентрація антитіл проти HBs ≥10 мМО/мл, виміряна через 1–2 міс після введення останньої дози первинної серії вакцин, вважається надійним серологічним маркером тривалого захисту від інфекції ВГВ [43]. Рекомендована кількість доз вакцини проти гепатиту В, яка є необхідною для індукції захисного імунітету, різна залежно від виробника, а також віку реципієнта.
3-дозова схема індукує захисну концентрацію антитіл у >95% усіх здорових немовлят, дітей молодшого віку і дорослих [44]. Систематичний огляд не виявив різниці в частці немовлят, які були серопротекторними після 3 або 2 первинних доз після народження (3-дозовий графік введення: 1, 2, 11 або 12 міс. Інтервал між прийомами 2 доз становить 1 і 6 міс [45].
Згідно з наявними даними, затримка введення дози вакцини при народженні немовлят від хронічно інфікованих матерів підвищує ризик перинатальної передачі ВГВ. В одному дослідженні зафіксовано, що ризик інфікування немовлят, народжених від HBsAg-позитивних матерів, значно підвищується, коли 1-шу дозу вакцини проти гепатиту В отримали через 7 днів після народження порівняно з щепленими на 1-й — 3-й дні після народження (співвідношення шансів 8,6) [46, 47]. Метааналіз рандомізованих контрольованих досліджень свідчить, що немовлята, які отримали 1-шу дозу при народженні, порівняно з немовлятами, які отримували плацебо або не були вакциновані, мають у 3,5 раза нижчу ймовірність інфікування при народженні від ВГВ-інфікованих матерів (відносний ризик 0,28; 95% довірчий інтервал (ДІ) 0,20–0,40) [48].
Немає відмінностей у результатах серопротекції (середні показники концентрації анти-HBs антитіл, частка вакцинованих, які мають достатній рівень серопротекції) між схемами з інтервалом 1, 2 або 5 міс між первинними дозами. Недостатньо даних для визначення результатів щеплення серед немовлят, що мали перинатальний контакт з ВГВ, коли інтервали між дозою при народженні та наступними дозами були більше 4–8 тиж. Більші інтервали між дозами підвищують концентрації антитіл до HBs, але не впливають на швидкість сероконверсії. У кількох дослідженнях встановлено, що при незавершенні серії вакцинації вона спричиняє захворювання печінки, пов’язане з ВГB, пізніше в житті [49].
У кількох дослідженнях виявлено відсутність різниці в пропорції дітей старшого віку та підлітків, які мають серопротекцію після отримання 2 доз вакцини (2-гу дозу вводять через 6 міс), що складається з високої (для дорослих) дози вакцини порівняно зі схемою із 3-дозовою схемою (2-га доза через 1 міс, 3-тя доза через 6 міс, що складається зі стандартної педіатричної дози вакцини. У цих дослідженнях 3-дозові схеми зазвичай призводили до більш високої концентрації анти-HBs-антитіл через 1–3 міс після вакцинації та більш тривалого збереження анти-HBs-антитіл порівняно із 2-дозовими схемами [50].
У дослідженні зафіксовано, що після 40 років менша частка дорослих досягають серопротекторної реакції на щеплення від гепатиту В. Ожиріння, куріння і хронічні захворювання також можуть призвести до нижчих показників відповіді [51]. В інших дослідженнях (зведеному аналізі даних клінічних досліджень) виявлено статистично значуще зниження імунної відповіді з віком, вказуючи на те, що рівень серопротекції анти-HBs залишається ≥90% до 49 років і ≥80% до 60 років [52]. Майже всі особи (немовлята, діти, підлітки та дорослі), які не реагують на первинну 3-дозову серію вакцини із концентрацією антитіл HBs ≥10 мМО/мл, відповідають на додаткову серію 3-дозової вакцинації [53].
Програми вакцинації проти гепатиту В є дуже ефективними, про що свідчить різке зниження захворюваності на ГЦК (60,1%), смертності внаслідок фульмінантної печінкової недостатності (76,3%) та через хронічні захворювання печінки (92,0%), що відмічалося серед вакцинованих осіб на Тайвані протягом десятиріч після вакцинації [8, 49]. Серед медичних працівників та інших здорових дорослих вакцинація проти гепатиту В є високоефективною для профілактики інфекції ВГВ [52, 53].
В огляді опублікованих досліджень поширеності гепатиту В у Західно-Тихоокеанському регіоні до та після введення вакцини проти гепатиту В виявлено, що до започаткування вакцинації поширеність хронічної інфекції становила >8% у більшості країн і що до 2014 р. вона знизилася до <1% серед дітей у більшості країн цього регіону. Наприклад, у 2 високоендемічних районах Китаю 3-дозове щеплення, починаючи з дози при народженні, знизило рівень хронічної інфекції ВГВ з 9,3 до 0,8% і з 10,4 до 0% [54, 55].
ТРИВАЛІСТЬ ЗАХИСТУ
У дослідженні [56], проведеному на Алясці (США), яка є помірною ендемічною зоною для ВГB, 3-дозова схема вакцинації (2-га доза через 1 міс, 3-тя доза через 6 міс) проти гепатиту B, вакциною, отриманою з плазми крові, у когорті 1578 неінфікованих осіб віком від 6 міс до 50 років попереджено всі клінічно виражені та хронічні інфекції ВГВ протягом принаймні 30 років. Серед субкогорти (243 особи), які не отримали бустерну вакцинацію, 49% мали титри антитіл до HBs <10 мМО/мл через 30 років. Більшість (88%) осіб без цього серопротекторного рівня анти-HBs-антитіл відповіли швидким підвищенням титру після бустерної дози, що вказує на імунологічну пам’ять і стійкість захисту. На основі цих даних підраховано, що близько 90% (у діапазоні 74–100%) вакцинованих залишалися захищеними принаймні 30 років незалежно від наявності чи відсутності вимірюваної концентрації анти-HBs-антитіл [57]. В інших довгострокових контрольованих дослідженнях після неонатальної вакцинації захист проти інфекції ВГВ підтримувався, навіть якщо близько 2/3 вакцинованих мали рівні антитіл до HBs <10 мМО/мл через 30 років [58, 59].
Огляд [60] і метааналіз 22 досліджень, що охоплював 11 090 осіб, через 5–20 років після вакцинації не виявили хронічної інфекції ВГВ, хоча показник наявності кумулятивної субклінічної інфекції ВГВ (транзиторні або стійкі анти-HBc антитіла) становив 0,7% (95% ДІ 0,5–1,0%); із цього слідував висновок, що особи, адекватно щеплені за 3- або 4-дозовою схемою, не потребують бустерної дози. В огляді [61], в якому розглянуті дослідження з 2002 р. щодо необхідності бустерної дози проти гепатиту B, зроблено висновок, що бустерні дози не потрібні імунологічно компетентним особам, які отримали повний початковий курс вакцинації, про що свідчать дослідження, проведені терміном до 20 років після первинної вакцинації [62, 63].
Немає доказів різниці захисту з або без введення бустерної дози, коли концентрація анти-HBs-антитіл знижується до <10 мМО/мл. Більшістю раніше вакцинованих осіб, у яких концентрація антитіл до HBs знижується до <10 мМО/мл, анамнестично отримано відповідь, коли їм вводили бустерну дозу або вони зазнавали впливу гепатиту В, що свідчить про наявність у них тривалого захисту Т-клітинами памʼяті [64]. У дослідженні клітинного імунітету встановлено, що відсутність анамнестичної відповіді після ревакцинації необов’язково вказує на сприйнятливість до інфекції ВГВ у таких осіб.
Потрібні додаткові довгострокові дослідження, щоб дослідити пожиттєвий захист, який забезпечує вакцина проти гепатиту В, і потребу в бустерних дозах для різних підгруп населення, особливо для ВІЛ-інфікованих / контактних з ВІЛ немовлят. Значна кількість доказів, яка існує на сьогодні, не є переконливою підставою для рекомендації бустерної дози вакцини проти гепатиту В після завершення серії первинної вакцинації для осіб з нормальним імунним статусом [65].
БЕЗПЕКА ВАКЦИНИ
Глобальний консультативний комітет з безпеки вакцин (Global Advisory Committee on Vaccine Safety — GACVS) підтвердив відмінний профіль безпеки вакцини проти гепатиту B [66, 67]. Загалом відмічаються мінімальні побічні реакції, такі як місцевий біль у місці інʼєкції, міалгія та транзиторна гарячка, переважно протягом 24 год після введення вакцини. Легкі форми реакції, як правило, трапляються рідше у дітей, ніж дорослих (<10% проти 30%). Розрахункова частота тяжких несприятливих випадків анафілаксії серед реципієнтів вакцини становить 1,1 осіб на мільйон введених доз вакцини (95% ДІ 0,1–3,9) [66, 68]. У численних довгострокових дослідженнях не виявлено доказів серйозних побічних явищ, спричинених вакциною проти гепатиту B. У даних не виявлено причинно-наслідкового звʼязку між вакциною проти гепатиту В і неврологічними захворюваннями (включно із синдромом Гієна — Барре і розсіяним склерозом), цукровим діабетом, демієлінізувальними розладами, синдромом хронічної втоми, артритом, аутоімунними розладами, астмою, випадінням волосся або синдромом раптової дитячої смерті [66, 69–71]. Не зафіксовано серйозних системних побічних явищ серед ВІЛ-інфікованих (дітей / підлітків / дорослих), які отримали вакцину проти гепатиту В [72]. Полівалентні вакцини проти гепатиту В безпечні для вагітних. Вакцина проти гепатиту В протипоказана лише особам із серйозними алергічними реакціями на будь-який з компонентів вакцини [66].
ТЕСТУВАННЯ ДО ТА ПІСЛЯ ВАКЦИНАЦІЇ
Серологічне тестування перед вакцинацією не є поширеною рутинною практикою. Згідно з рекомендаціями ВООЗ щодо тестування на ВГВ цілеспрямовано рекомендуємо пропонувати тестування особам з груп населення, які мають підвищений ризик розвитку інфекції ВГВ [29, 73].
Рутинна перевірка рівня імунної відповіді після щеплення не проводиться, але рекомендована для індивідів з підвищеним ризиком, для яких подальше лікування залежить від знання свого імунного статусу.
Європейська консенсусна група з імунітету проти гепатиту В (European Consensus Group on Hepatitis B Immunity) рекомендує особам з ослабленим імунітетом щорічно проводити оцінку анти-HBs [74]. Тим, у кого виявлено концентрацію антитіл до HBs <10 мМО/мл після первинної серії вакцинації, слід ревакцинуватися. Введення 3 додаткових доз, а потім проведення анти-HBs-антитіл-тестування через 1–2 міс після 3-ї дози, як правило, є більш практичною тактикою, ніж серологічне тестування після 1-ї дози вакцини. Кожного, хто не реагує на ревакцинацію, слід перевірити на HBsAg [10].
ВАКЦИНАЦІЯ ВІД ГЕПАТИТУ B УКРАЇНІ
Згідно з даними ВООЗ від 2022 р., охоплення немовлят 3-ю дозою вакцини проти гепатиту В в Україні становило 80,9% у 2020 р. [75], що є нижче рівня охоплення в більшості країн Європейського Союзу і нижче рекомендованого цільового покриття для елімінації захворювання [76].
Вакцинація в Україні, за даними ВООЗ, має стійку тенденцію до зниження, починаючи з 2004 р. (99% — 1-ша вакцина при народженні) до 49% у 2018 р. Особливо увагу також слід зосередити на тенденції значного, майже вдвічі, зменшення кількості вакцинацій новонароджених проти гепатиту В за останні 10 років (рис. 3).
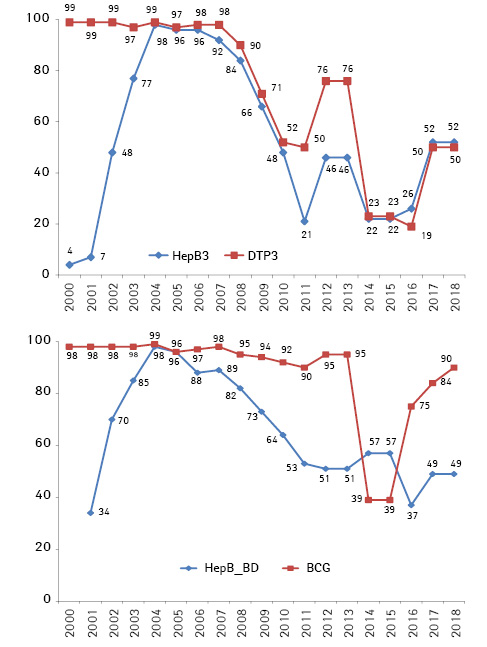
Мають бути впроваджені заходи, спрямовані на підвищення освітнього рівня населення та забезпечення вакцинами проти ВГВ, для попередження серйозних хвороб, які можуть бути спричинені персистенцією інфекції.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Schweitzer, A., Horn, J., Mikolajczyk, R. T., Krause, G., & Ott, J. J. (2015). Estimations of worldwide prevalence of chronic hepatitis B virus infection: a systematic review of data published between 1965 and 2013. Lancet, 386(10003), 1546–1555. doi: 10.1016/s0140-6736(15)61412-x.
2. Petrick, J. L., Braunlin, M., Laversanne, M., & Mcglynn, K. A. (2016). International trends in liver cancer incidence, overall and by histologic subtype, 1978–2007. Retrieved from http://www.researchgate.net/ publication/303708220_International_trends_in_liver_cancer_incidence_overall_and_by_histologic_subtype_1978-2007.
3. Okuda, K., Nakanuma, Y., & Miyazaki, M. (2002). Cholangiocarcinoma Recent Progress. Part 1 Epidemiology and Etiology. Journal of Gastroenterology and Hepatology, 17, 1049–1055. doi: 10.1046/j.1440-1746.2002.02781.x.
4. de Martel, C., Georges, D., Bray, F., Ferlay, J., & Clifford, G. M. (2020). Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis. The Lancet Global Health, 8(2), e180–e190. doi: 10.1016/s2214-109x(19)30488-7.
5. Arnold, M., Abnet, C. C., Neale, R. E., Vignat, J., Giovannucci, E. L., McGlynn, K. A., & Bray, F. (2020). Global Burden of 5 Major Types of Gastrointestinal Cancer. Gastroenterology, 159(1), 335–349.e15. doi: 10.1053/j.gastro.2020.02.068.
6. Chen, J.-G., Egner, P. A., Ng, D., Jacobson, L. P., Munoz, A., Zhu, Y.-R., Qian, G.-S., … Kensler, T. W. (2013). Reduced Aflatoxin Exposure Presages Decline in Liver Cancer Mortality in an Endemic Region of China. Cancer Prevention Research, 6(10), 1038–1045. doi: 10.1158/1940-6207.capr-13-0168.
7. Petrick, J. L., Braunlin, M., Laversanne, M., Valery, P. C., Bray, F., & Mcglynn, K. A. (2020). International trends in liver cancer incidence, overall and by histologic subtype, 1978–2012. International Journal of Cancer, 139(7), 1534–1545. doi: 10.1002/ijc.30211.
8. Chiang, C.-J., Yang, Y.-W., You, S.-L., Lai, M.-S., & Chen, C.-J. (2013). Thirty-Year Outcomes of the National Hepatitis B Immunization Program in Taiwan. JAMA, 310(9), 974–976. doi: 10.1001/jama.2013.276701.
9. Florio, A. A., Ferlay, J., Znaor, A., Ruggieri, D., Alvarez, C. S., Laversanne, M., … Petrick, J. L. (2020). Global trends in intrahepatic and extrahepatic cholangiocarcinoma incidence from 1993 to 2012. Cancer, 126(11), 2666–2678. doi: 10.1002/cncr.32803.
10. Van Damme, P. (2017). Hepatitis B Vaccines (6th ed.). Elsevier Sanders.
11. Gerlich, W. H. (2013). Medical Virology of Hepatitis B: how it began and where we are now. Virology Journal, 10(1), 239. doi: 10.1186/1743-422x-10-239.
12. Candotti, D., & Allain, J.-P. (2009). Transfusion-transmitted hepatitis B virus infection. Journal of Hepatology, 51(4), 798–809. doi: 10.1016/j.jhep.2009.05.020.
13. Bond, W. (1981). Survival of hepatitis b virus after drying and storage for one week. The Lancet, 317(8219), 550–551. doi: 10.1016/s0140-6736(81)92877-4.
14. World Health Organization (2004). Guidelines on viral inactivation and removal procedures intended to assure the viral safety of human blood plasma products, Annex 4, TRS № 924. Retrieved from http://www.who.int/publications/m/item/WHO-TRS924-Annex4.
15. Pre-capsid protein [Hepatitis B virus]. Retrieved from http://www.ncbi.nlm.nih.gov/protein/YP_009173857.1.
16. Bremer, C., & Glebe, D. (2013). The Molecular Virology of Hepatitis B Virus. Seminars in Liver Disease, 33(2), 103–112. doi: 10.1055/s-0033-1345717.
17. Kramvis, A. (2016). The clinical implications of hepatitis B virus genotypes and HBeAg in pediatrics. Reviews in Medical Virology, 26(4), 285–303. doi: 10.1002/rmv.1885.
18. Wong Vivian, C. W., Reesink, H., Henrietta, M. H., Nco Lelie, P., Reerink-Brongers, E., Yeung, C. Y., & Ma, H. K. (1984). Prevention of the HBsAg carrier state in newborn infants of mothers WHO are chronic carriers of HBsAg and HBeAg by administration of hepatitis-b vaccine and hepatitis-b immunoglobulin. The Lancet, 323(8383), 921–926. doi: 10.1016/s0140-6736(84)92388-2.
19. Pan, C. Q., Zou, H.-B., Chen, Y., Zhang, X., Zhang, H., Li, J., & Duan, Z. (2013). Cesarean Section Reduces Perinatal Transmission of Hepatitis B Virus Infection From Hepatitis B Surface Antigen-Positive Women to Their Infants. Clinical Gastroenterology and Hepatology, 11(10), 1349–1355. doi: 10.1016/j.cgh.2013.04.026.
20. Global Hepatitis Report, World Health Organization, Geneva. (2017). Retrieved from apps.who.int/iris/bitstream/10665/255016/1/9789241565455-eng. pdf?ua=1.
21. de la Hoz, F., Perez, L., de Neira, M., & Hall, A. J. (2008). Eight years of hepatitis B vaccination in Colombia with a recombinant vaccine: factors influencing hepatitis B virus infection and effectiveness. International Journal of Infectious Diseases, 12(2), 183–189. doi: 10.1016/j.ijid.2007.06.010.
22. Trépo, C., Chan, H. L. Y., & Lok, A. (2014). Hepatitis B virus infection. The Lancet, 384(9959), 2053–2063. doi: 10.1016/s0140-6736(14)60220-8.
23. Chang, J. J., & Lewin, S. R. (2006). Immunopathogenesis of hepatitis B virus infection. Immunology and Cell Biology, 85(1), 16–23. doi: 10.1038/sj.icb.7100009.
24. Shimakawa, Y., Lemoine, M., Bottomley, C., Njai, H. F., Ndow, G., Jatta, A., … Hall, A. J. (2015). Birth order and risk of hepatocellular carcinoma in chronic carriers of hepatitis B virus: a case-control study in The Gambia. Liver International, 35(10), 2318–2326. doi: 10.1111/liv.12814.
25. Hyams, K. C. (1995). Risks of Chronicity Following Acute Hepatitis B Virus Infection: A Review. Clinical Infectious Diseases, 20(4), 992–1000. doi: 10.1093/clinids/20.4.992.
26. Nikolopoulos, G. K., Paraskevis, D., Hatzitheodorou, E., Moschidis, Z., Sypsa, V., Zavitsanos, X., … Hatzakis, A. (2009). Impact of Hepatitis B Virus Infection on the Progression of AIDS and Mortality in HIV‐Infected Individuals: A Cohort Study and Meta‐Analysis. Clinical Іnfectious Diseases, 48(12), 1763–1771. doi: 10.1086/599110.
27. Brown, R. S., McMahon, B. J., Lok, A. S. F., Wong, J. B., Ahmed, A. T., Mouchli, М. А., … Mohammed, K. (2015). Antiviral therapy in chronic hepatitis B viral infection during pregnancy: A systematic review and meta-analysis. Hepatology, 63(1), 319–333. doi: 10.1002/hep.28302.
28. Hyun, M. H., Lee, Y. S., Kim, J. H., Je, J. H., Yoo, Y. J., Yeon, J. E., & Byun, K. S. (2017). Systematic review with meta-analysis: the efficacy and safety of tenofovir to prevent mother-to-child transmission of hepatitis B virus. Alimentary Pharmacology & Therapeutics, 45(12), 1493–1505. doi: 10.1111/apt.14068.
29. World Health Organization. (2015). Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection. Retrieved from http://www.who.int/publications/i/item/9789241549059.
30. Blumberg, B. S. (2024). Hepatitis B. Retrieved from press.princeton.edu/ books/paperback/9780691116235/hepatitis-b?srsltid=AfmBOop6u9r9p9aadnUXF6POaxq5tL1UMILxnlnuR017mhsWFAThVSRI.
31. Moticka, E. J. (2015). A Historical Perspective on Evidence-Based Immunology. Elsevier.
32. Beran, J. (2008). Safety and immunogenicity of a new hepatitis B vaccine for the protection of patients with renal insufficiency including pre-haemodialysis and haemodialysis patients. Expert Opinion on Biological Therapy, 8(2), 235–247. doi: 10.1517/14712598.8.2.235.
33. Package insert of vaccine Fendrix. Retrieved from http://www.ema.europa.eu/ docs/en_GB/document_library/ EPAR_-_Product_ Informaion/ human/000550/WC500021704.pdf.
34. Pichichero, M. E., Bernstein, H., Blatter, M. M., Schuerman, L., Cheuvart, B., & Holmes, S. J. (2007). Immunogenicity and Safety of a Combination Diphtheria, Tetanus Toxoid, Acellular Pertussis, Hepatitis B, and Inactivated Poliovirus Vaccine Coadministered with a 7-Valent Pneumococcal Conjugate Vaccine and a Haemophilus Influenzae Type b Conjugate Vaccine. The Journal of Pediatrics, 151(1), 43–49.e2. doi: 10.1016/j.jpeds.2007.02.013.
35. Heininger, U., Sänger, R., Jacquet, J.-M., & Schuerman, L. (2007). Booster immunization with a hexavalent diphtheria, tetanus, acellular pertussis, hepatitis B, inactivated poliovirus vaccine and Haemophilus influenzae type b conjugate combination vaccine in the second year of life: Safety, immunogenicity and persistence of antibody responses. Vaccine, 25(6), 1055–1063. doi: 10.1016/j.vaccine.2006.09.060.
36. Rao, P. (2017). Immunogenicity and safety of combined diphtheria tetanus whole cell pertussis hepatitis B/ Haemophilus influenzae type b vaccine in Indian infants. Indian Pediatrics, 44(7), 505–510. pubmed.ncbi.nlm.nih.gov/17684303/.
37. World Health Organization. (2013). Recommendations to assure the quality, safety and efficacy of recombinant hepati- tis B vaccines. WHO Technical report series № 978. Retrieved from http://www.who.int/publications/m/item/recombinant-hep-b-A4-trs-978.
38. World Health Organization. Prequalified vaccines. Retrieved from extranet.who.int/gavi/PQ_Web/.
39. Package insert of: RECOMBIVAX HB®. Retrieved from http://www.merck.com/product/usa/pi_circulars/r/recombivax_hb/recombivax_pi.pdf.
40. Wang, L. (2007). Hepatitis B vaccination of newborn infants in rural China: evaluation of a village-based, out-of-cold-chain delivery strategy. Bulletin of the World Health Organization, 85(9), 688–694. doi: 10.2471/blt.06.037002.
41. Mangione, R., Stroffolini, T., Trusti, M. E., Fragapani, D., & Mele, A. (1995). Delayed third hepatitis B vaccine dose and immune response. The Lancet, 345(8957), 1111–1112. doi: 10.1016/s0140-6736(95)90841-2.
42. World Health Organization. (2016). A systematic review of monovalent hepatitis B vaccine thermostability. Retrieved from http://www.who.int/ immunization/ sage/meetings/ 2016/ october/6_Thermostability_ HBV_04102016.pdf?ua=1.
43. Jack, A. D., Hall, A. J., Maine, N., Mendy, M., & Whittle, H. C. (1999). What Level of Hepatitis B Antibody Is Protective? Journal of Infectious Diseases, 179(2), 489–492. doi: 10.1086/314578.
44. World Health Organization. (2016). SAGE Meeting — October 2016, Background documents. Retrieved from http://www.who.int/immunization/ sage/meetings/2016/october/ 5_Update_seroprotection_after_ hep_b_in_newborns.pdf?ua=1.
45. Romano, L., & Zanetti, A. R. (2022). Hepatitis B Vaccination: A Historical Overview with a Focus on the Italian Achievements. Viruses, 14(7), 1515. doi: 10.3390/v14071515.
46. Marion, S. A., Pastore, M. T., Pi, D. W., & Mathias, R. G. (1994). Long-term Follow-up of Hepatitis B Vaccine in Infants of Carrier Mothers. American Journal of Epidemiology, 140(8), 734–746. doi: 10.1093/oxfordjournals.aje.a117321.
47. World Health Organization. (2017). Summary of findings per out- come of timing of the first dose of recombinant DNA HBV vaccines. Retrieved from https://terrance.who.int/ mediacentre/data/sage/ SAGE_Docs_Ppt_Oct2016/ 9_session_HepB/Oct2016_session9_review_hepB_vax_childhood.pdf.
48. Lee, C., Gong, Y., Brok, J., Boxall, E. H., & Gluud, C. (2006). Hepatitis B immunization for newborn infants of hepatitis B surface antigen-positive mothers. Cochrane Database of Systematic Reviews, 19(2), CD004790. doi: 10.1002/14651858.CD004790.pub2.
49. Chien, Y.-C., Jan, C.-F., Chiang, C.-J., Kuo, H.-S., You, S.-L., & Chen, C.-J. (2014). Incomplete hepatitis B immunization, maternal carrier status, and increased risk of liver diseases: A 20-year cohort study of 3.8 million vaccinees. Hepatology, 60(1), 125–132. doi: 10.1002/hep.27048.
50. Soares-Weisner, K. (2017). Safety and efficacy from randomized controlled trials and observational studies of childhood schedules using hepatitis B vaccines. Retrieved from http://www.who.int/immunization/sage/meetings/2016/october/4_Systematic_ review_of_safety_efficacy_hep_b.pdf?ua=1, accessed April 2017.
51. Averhoff, F., Mahoney, F., Coleman, P., Schatz, G., Hurwitz, E., & Margolis, H. (1998). Immunogenicity of Hepatitis B vaccines. American Journal of Preventive Medicine, 15(1), 1–8. doi: 10.1016/s0749-3797(98)00003-8.
52. Van Der Meeren, O., Crasta, P., Cheuvart, B., & De Ridder, M. (2015). Characterization of an age-response relationship to GSK’s recombinant hepatitis B vaccine in healthy adults: An integrated analysis. Human Vaccines & Immunotherapeutics, 11(7), 1725–1728. doi: 10.1080/21645515.2015.1039758.
53. Tan, K. L., Goh, K. T., Oon, C. J., & Chan, S. H. (2023). Immunogenicity of recombinant yeast-derived hepatitis B vaccine in nonresponders to perinatal immunization. JAMA, 271(11), 859–861.
54. Szmuness, W., Stevens, C. E., Harley, E. J., Zang, E. A., Alter, H. J., Taylor, P. E., … & Kellner, A. (1982). Hepatitis B Vaccine in Medical Staff of Hemodialysis Units. New England Journal of Medicine, 307(24), 1481–1486. doi: 10.1056/nejm198212093072403.
55. Dienstag, J. L. (1984). Hepatitis B Vaccine in Health Care Personnel: Safety, lmmunogenicity, and Indicators of Efficacy. Annals of Internal Medicine, 101(1), 34–40. doi: 10.7326/0003-4819-101-1-34.
56. Wiesen, E., Diorditsa, S., & Li, X. (2016). Progress towards hepatitis B prevention through vaccination in the Western Pacific, 1990–2014. Vaccine, 34(25), 2855–2862. doi: 10.1016/j.vaccine.2016.03.060.
57. Bruce, M. G., Bruden, D., Hurlburt, D., Zanis, C., Thompson, G., Rea, L., … McMahon, B. J. (2016). Antibody Levels and Protection After Hepatitis B Vaccine: Results of a 30-Year Follow-up Study and Response to a Booster Dose. Journal of Infectious Diseases, 214(1), 16–22. doi: 10.1093/infdis/jiv748.
58. Qu, C., Chen, T., Fan, C., Zhan, Q., Wang, Y., Lu, J., … Hsia, C. C. (2014). Efficacy of neonatal HBV vaccination on liver cancer and other liver diseases over 30-year follow-up of the Qidong hepatitis B intervention study: a cluster randomized controlled trial. PLoS Medicine, 11(12), e1001774. doi: 10.1371/journal.pmed.1001774.
59. Lin, A. W., & Wong, K. (2013). Long-term protection of neonatal hepatitis B vaccination in a 30-year cohort in Hong Kong. Journal of Hepatology, 59(6), 1363–1364. doi: 10.1016/j.jhep.2013.08.021.
60. Poorolajal, J., Mahmoodi, M., Majdzadeh, R., Nasseri-Moghaddam, S., Haghdoost, A., & Fotouhi, A. (2010). Long-term protection provided by hepatitis B vaccine and need for booster dose: A meta-analysis. Vaccine, 28(3), 623–631. doi: 10.1016/j.vaccine.2009.10.068.
61. Poorolajal, J., & Hooshmand, E. (2016). Booster dose vaccination for preventing hepatitis B. Cochrane Database of Systematic Reviews, 6, CD008256. doi: 10.1002/14651858.CD008256.pub3.
62. McMahon, B. J., Dentinger, C. M., Bruden, D., Zanis, C., Peters, H., Hurlburt, D., … Hennessy, T. W. (2009). Antibody Levels and Protection after Hepatitis B Vaccine: Results of a 22‐Year Follow‐Up Study and Response to a Booster Dose. Journal of Infectious Diseases, 200(9), 1390–1396. doi: 10.1086/606119.
63. Peto, T. J., Mendy, M. E., Lowe, Y., Webb, E. L., Whittle, H. C., & Hall, A. J. (2014). Efficacy and effectiveness of infant vaccination against chronic hepatitis B in the Gambia Hepatitis Intervention Study (1986–90) and in the nationwide immunisation program. BMC Infectious Diseases, 14(1), 7. doi: 10.1186/1471-2334-14-7.
64. Banatvala, J. E., & Damme, P. (2003). Hepatitis B vaccine — do we need boosters? Journal of Viral Hepatitis, 10(1), 1–6. doi: 10.1046/j.1365-2893.2003.00400.x.
65. World Health Organization. (2016). HBV vaccination — Evidence on the need for a booster dose. Summary of evidence. Retrieved from cdn.who.int/media/docs/ default-source/immunization/position_ paper_documents/ hepatitis-b/ evidence-recommendation- gratable-hepb- duration.pdf?sfvrsn=3b2c64f9_2.
66. World Health Organization. (2016). Information sheet observed rate of vaccine reaction hepatitis B vaccine, June 2012. Retrieved from http://www.who.int/teams/ regulation-prequalification/regulation-and-safety/pharmacovigilance/guidance/reaction-rates-information-sheets.
67. World Health Organization. GACVS publications. Retrieved from http://www.who.int/vaccine_safety/committee/topics/hepati- tisb/en/.
68. Bohlke, K., Davis, R. L., Marcy, S. M., Braun, M. M., DeStefano, F., … Thompson, R. S. (2003). Risk of Anaphylaxis After Vaccination of Children and Adolescents. Pediatrics, 112(4), 815–820. doi: 10.1542/peds.112.4.815.
69. Mikaeloff, Y., Caridade, G., Assi, S., Tardieu, M., & Suissa, S. (2006). Hepatitis B vaccine and risk of relapse after a first childhood episode of CNS inflammatory demyelination. Brain, 130(4), 1105–1110. doi: 10.1093/brain/awl368.
70. Yu, O., Bohlke, K., Hanson, C. A., Delaney, K., Rees, T. G., Zavitkovsky, A., … Jackson, L. A. (2007). Hepatitis B vaccine and risk of autoimmune thyroid disease: a Vaccine Safety Datalink study. Pharmacoepidemiology and Drug Safety, 16(7), 736–745. doi: 10.1002/pds.1354.
71. Duclos, P. (2003). Safety of immunisation and adverse events following vaccination against hepatitis B. Expert Opinion on Drug Safety, 2(3), 225–231. doi: 10.1517/14740338.2.3.225.
72. Okwen, M. P., Reid, S., Njei, B., & Mbuagbaw, L. (2014). Hepatitis B vaccination for reducing morbidity and mortality in persons with HIV infection. Cochrane Database of Systematic Reviews, 2014(10), CD009886. doi: 10.1002/14651858.cd009886.pub2.
73. World Health Organization. (2016). Guidelines on hepatitis B and C testing. Retrieved from apps.who.int/iris/bitstream/10665/251330/1/WHO-HIV-2016.23- eng.pdf?ua=1.
74. European Consensus Group on Hepatitis B Immunity. (2024). Are booster immunisations needed for lifelong hepatitis B immunity? Lancet, 355(9203), 561–565. pubmed.ncbi.nlm.nih.gov/10683019/.
75. Mahase, E. (2022). Hepatitis: Ukrainian refugees should be offered vaccines and free treatment, says WHO. BMJ, 377, o1132. doi: 10.1136/bmj.o1132.
76. Hepatitis B country profile Ukraine. (2000). Retrieved from med.stanford.edu/ content/ dam/sm/ liver/documents/ research/Global HepatitisB VaccinationCoverage/ EURO/Ukraine.pdf.
Адреса для листування:
Пацко Вероніка
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: veronika.patsko@unci.org.ua
Correspondence:
Veronika Patsko
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: veronika.patsko@unci.org.ua














Leave a comment