Управління токсичністю імунотерапії: клінічні рекомендації ESMO щодо діагностики, лікування та подальшого спостереження пацієнтів
Резюме. Цей огляд Європейського товариства медичної онкології (European Society for Medical Oncology — ESMO) містить ключові клінічні рекомендації щодо контролю токсичності, пов’язаної з імунотерапією, які включають оцінку, діагностику та лікування найпоширеніших тяжких побічних ефектів (ПЕ), пов’язаних з імунотерапією. Рекомендації базуються на наявних наукових даних і колективній експертній думці міждисциплінарної групи експертів з різних установ Європи, Австралії та США.
DOI: 10.32471/clinicaloncology.2663-466X.55-3.33060
Загальні аспекти лікування імуноопосередкованих ПЕ
Огляд
Імуноопосередковані ПЕ — ті, що пов’язані з використанням терапії інгібіторами контрольних точок (ІКТ) [1].
Загальні рекомендації щодо імуносупресії
Управління імуноопосередкованими ПЕ зазвичай складається з 4 послідовних кроків. Перший крок полягає в діагностиці та класифікації імуноопосередкованих ПЕ, другий — у проведенні диференційної діагностики та обстеженні пацієнтів перед початком імуносупресивної терапії, третій — у виборі відповідної тактики імуносупресивної терапії при ПЕ II ступеня і вище та четвертий — у оцінці результатів через 72 год після початку лікування.
З метою мінімізації виникнення ПЕ, спричинених прийомом глюкокортикостероїдів (ГКС), рекомендовано [2] призначати найнижчу ефективну дозу ГКС на найкоротший термін, який, як правило, становитиме кілька тижнів при імуноопосередкованих ПЕ ≥III ступеня тяжкості, включно з поступовим зниженням дози чи припиненням терапії ГКС за рекомендацією лікаря.
Імуноопосередковані токсичні ПЕ з боку шкіри
Клінічна картина захворювання
Клінічні прояви імуноопосередкованих токсичних ПЕ з боку шкіри дуже варіабельні, причому найчастіше трапляється розвиток неспецифічного макулопапульозного висипу. Повідомляється також про можливий розвиток більш специфічних аутоімунних проявів, таких як ліхеноїдні реакції, псоріаз і бульозні дерматози. Є також рідкісні поодинокі повідомлення про летальні або потенційно летальні ПЕ, такі як токсичний некроліз (синдром Лаєлла), тяжка форма синдрому Стівенса — Джонсона, DRESS-синдром (лікарська реакція з розвитком еозинофілії та системними симптомами) та ін.
Діагностика
Діагноз імуноопосередкованих ПЕ переважно ґрунтується на клінічній оцінці. За необхідності також може проводитися біопсія шкіри та більш специфічні тести залежно від вираженості клінічної картини. Для виключення бульозного пемфігоїду, який може проявлятися у вигляді ізольованого свербежу, слід провести пряму імунофлюоресценцію шкіри та тестування на аутоантитіла, спрямовані проти білків базальної мембрани шкіри.
Менеджмент
Алгоритм лікування імуноопосередкованого макулопапульозного висипу представлено на рис. 1. Незважаючи на те що переважна більшість імуноопосередкованих ПЕ мають легкий або помірний ступінь тяжкості, варто провести ранню оцінку ступеня тяжкості захворювання, щоб усунути рідкісні тяжкі форми імуноопосередкованих ПЕ, таких як синдром Стівенса — Джонсона, токсичний епідермальний некроліз, бульозні ураження та DRESS-синдром, що потребує негайного припинення терапії ІКТ, лікування у відповідного спеціаліста та подальшого спостереження.
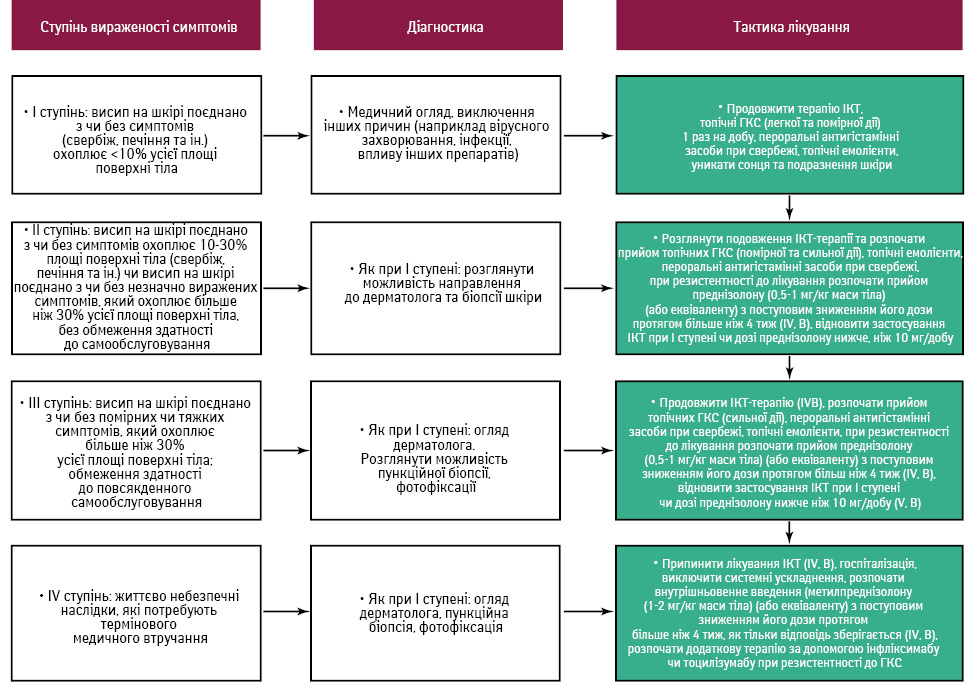
Лікування макулопапульозного висипу залежить від ступеня вираженості симптомів.
При I ступені застосовують місцеві ГКС легкої або помірної дії; пероральні антигістамінні препарати призначають для усунення свербежу.
При II ступені приймають місцеві ГКС сильної дії або системні ГКС у дозі 0,5–1 мг/кг маси тіла при рефрактерності.
При III ступені варто припинити імуноопосередковане лікування та застосовувати місцеві ГКС сильної дії або системні ГКС у дозі 1 мг/кг маси тіла при рефрактерності.
При IV ступені необхідно припинити імуноопосередковане лікування; розпочати введення внутрішньовенних ГКС у високих дозах; розглянути додаткові методи лікування. Пацієнтів із тяжкими ПЕ слід спрямувати до дерматолога для специфічного лікування. Системні ГКС, які зазвичай не призначають для лікування псоріазу, слід використовувати з обережністю через підвищений ризик розвитку рецидиву після їх відміни. У цій ситуації потрібно застосовувати місцеві ГКС та вітамін D, а також розглянути призначення системних ретиноїдів, анти-IЛ-12 та анти-IЛ-23.
Рекомендації
- За можливості слід оцінити та підтвердити наявність зв’язку між терапією ІКТ та розвитком ПЕ з боку шкіри (IV, A).
- Необхідно оцінити тяжкість ПЕ з боку шкіри та визначити необхідність спрямування пацієнта на консультацію до спеціаліста. Лікарі мають вміти діагностувати ранні ознаки DRESS-синдрому, хвороби Лаєлла та синдрому Стівенса — Джонсона (IV, A).
- Перед початком терапії ІКТ варто оглянути всю поверхню шкіри та слизові оболонки хворого (IV, A).
- Необхідно оцінити дані анамнезу щодо наявності шкірних захворювань, таких як псоріаз, чи випадків розвитку ПЕ зі шкірними проявами (IV, A).
Імуноопосередковані ПЕ з боку ендокринної системи
Імуноопосередковані ПЕ з боку ендокринної системи трапляються відносно часто.
Порушення роботи щитовидної залози
Первинний імуноопосередкований гіпотиреоз
Первинний гіпотиреоз є найпоширенішим імуноопосередкованим ПЕ з боку ендокринної системи [19].
Імуноопосередкований гіпертиреоз
Рідше діагностують імуноопосередкований гіпертиреоз [19]. Транзиторний тиреоїдит є найпоширенішою причиною розвитку імуноопосередкованого гіпотиреозу [21].
Діагностика та менеджмент
Симптоми дисфункції щитовидної залози можуть бути неспецифічними, наприклад, при гіпотиреозі виникають такі прояви, як втома, збільшення маси тіла та закрепи, а при гіпертиреозі — серцебиття, тремор і діарея. Більшість випадків виявляються під час планового виконання тестів на функцію щитовидної залози, які слід проводити кожні 3–6 тиж під час імуноопосередкованої терапії. Інтерпретація результатів цих тестів наведена на рис. 2. Хоча оцінка антитіл до щитовидної залози не впливає на лікування і не є необхідною для регулярного її проведення, у випадку стійкого гіпертиреозу рекомендується оцінити рівень антитіл до рецепторів тиреотропного гормону (ТТГ) та виключити хворобу Грейвса за допомогою методу візуалізації.
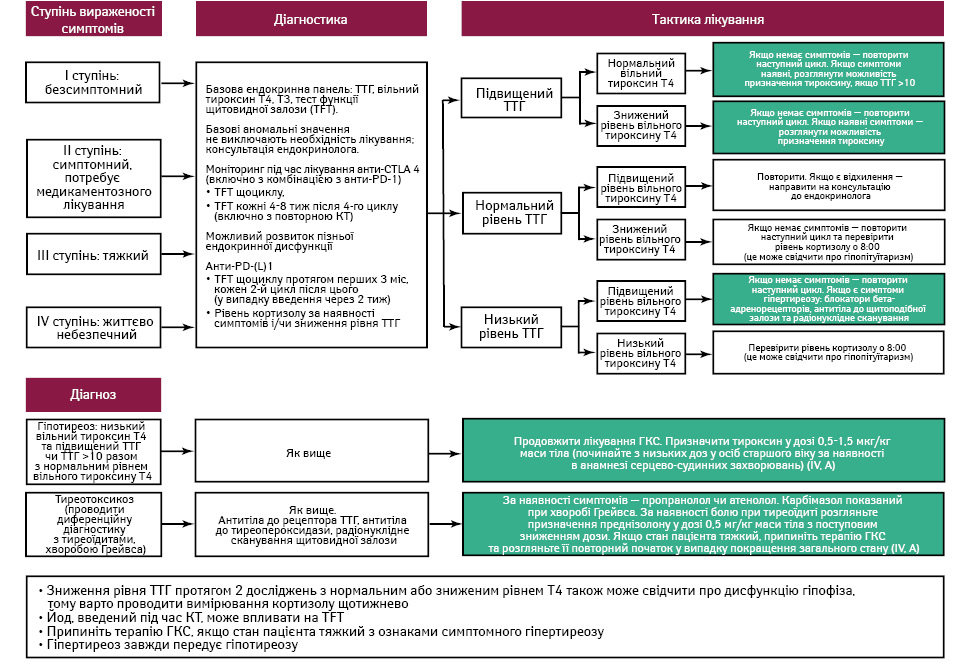
Імуноопосередковану терапію слід припиняти лише у випадках симптоматичного тиреотоксикозу. При стійкому гіпотиреозі слід призначити тривалу замісну терапію левотироксином. Підтримувальна терапія блокаторами бета-адренорецепторів є ефективною в більшості випадків тиреотоксикозу, проте у більш тяжких випадках може знадобитися застосування преднізолону в дозі 0,5–1 мг/кг маси тіла (або еквіваленту) (див. рис. 2).
Порушення роботи гіпофіза
Імуноопосередкований гіпофізит
Імуноопосередкований гіпофізит часто проявляється симптомами, пов’язаними з набряком гіпофіза, такими як головний біль, а у рідкісних випадках — втратою поля зору через стиснення зорового перехрестя. Велика кількість пацієнтів також мають ознаки центральної надниркової недостатності, такі як втома, нудота, блювання, слабкість, головний біль або артеріальна гіпотензія. Рідше можуть відмічатися симптоми центрального гіпотиреозу, нецукрового діабету або гіпогонадизму.
У випадках із головним болем або втратою зору важливо провести магнітно-резонансну томографію (МРТ) головного мозку для виключення метастазів і цереброваскулярних захворювань. За наявності кількох гормональних дефіцитів замісна терапія має насамперед фокусуватися на корекції дефіциту кортизолу (рис. 3). Припинення імуноопосередкованої терапії та призначення високих доз ГКС (наприклад 1 мг/кг маси тіла/добу преднізолону або його еквіваленту) рекомендується лише за наявності серйозних компресійних симптомів, таких як головний біль, порушення зору або наднирковий криз [14]. Імуноопосередковану терапію можна відновити після стабілізації ендокринної замісної терапії.
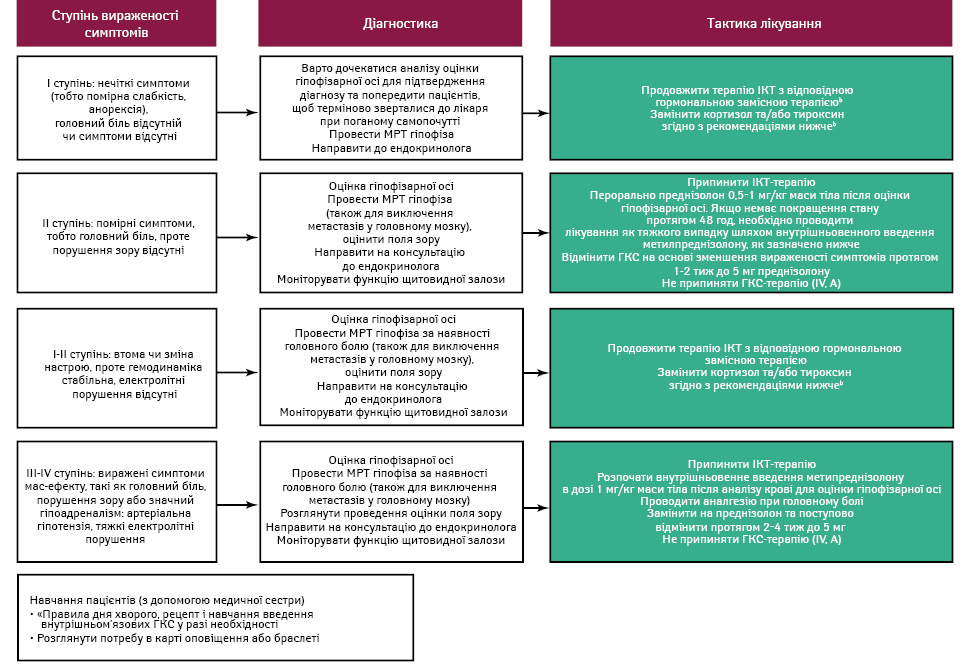
Імуноопосередкований цукровий діабет (ЦД)
Початкові прояви можуть бути як безсимптомними, так і супроводжуватися симптомами, такими як втома, нудота, блювання, зменшення маси тіла, часте сечовипускання (поліурія) або постійна спрага (полідипсія). Для діагностики варто визначити рівень глюкози в плазмі крові натще, глікозильованого гемоглобіну (HbA1c), наявність антитіл до острівцевих клітин, декарбоксилази антиглутамінової кислоти та кетонів в аналізі сечі, а також визначити рівень рН крові. Якщо виявляється гіперглікемія, а рівень С-пептиду низький та наявні аутоантитіла, це свідчить про ЦД I типу. Основою лікування є замісна інсулінова терапія; високі дози ГКС не рекомендуються.
Імуноопосередкована первинна надниркова недостатність
Імуноопосередкована первинна надниркова недостатність є однією з імуноопосередкованих ПЕ, яка може проявлятися гостро, що може супроводжуватися летальними наслідками у зв’язку з розвитком небезпечного для життя надниркового кризу внаслідок виникнення вазодилататорного шоку [25]. Симптоми первинної надниркової недостатності можуть бути неспецифічними або подібними до вторинної надниркової недостатності.
Діагностичне обстеження має включати вимірювання рівня кортизолу вранці, адренокортикотропного гормону (АКТГ), електролітів, проведення синактенового тесту та перевірку наявності антитіл до 21-гідроксилази.
Раннє розпізнавання та початок терапії ГКС є критичним. Для пацієнтів у стабільному стані зазвичай призначають гідрокортизон (20 мг вранці, 10 мг в обід), а у випадках стресових ситуацій (криз Аддісона, операція, тяжка форма інфекції) призначають стресові дози ГКС (50–100 мг внутрішньовенно гідрокортизону 4 р/добу).
Інші імуноопосередковані ендокринопатії
Також повідомлялося в літературних джерелах про розвиток імуноопосередкованого гіпогонадизму, гіпопаратиреозу, адренокортикотропного гормонозалежного синдрому Кушинга та нецукрового діабету [27].
Рекомендації
- При імуноопосередкованому гіпотиреозі II ступеня та вище замісну гормональну терапію (прийом левотироксину в дозі 50–100 мкг/добу) варто розпочати за наявності симптомів захворювання, при цьому дозу препарату варто підвищувати протягом кількох тижнів до нормалізації рівня ТТГ. Терапію IКТ варто перервати тільки, якщо симптоми захворювання є тяжкими (при III ступені тяжкості симптомів та вище) (IV, A).
- При симптоматичному імуноопосередкованому гіпертиреозі (II ступені та вище) терапію ІКТ варто перервати та розпочати терапію блокаторами бета-адренорецепторів. Застосовувати преднізолон у дозі 0,5–1 мг/кг маси тіла перорально можна короткочасно при запаленні залози або при вираженості симптомів захворювання. При безсимптомних випадках терапію ІКТ варто відновити (IV, A).
- При імуноопосередкованому гіпофізиті, якщо наявний значний головний біль, диплопія або інші неврологічні симптоми (ступінь III), показаний до застосування (метил)преднізолон у дозі 1 мг/кг маси тіла. У випадку вторинного адреналового кризу або недостатності наднирників III ступеня необхідно розпочати негайне лікування, яке включає замісну терапію ГКС у високих дозах. При безсимптомних випадках чи за наявності нетяжких симптомів (I–II ступеня) варто розпочати застосування замісної дози дефіцитних гормонів (надниркових залоз, щитовидної залози та статевих залоз) (IV, A).
- Для імуноопосередкованої первинної недостатності наднирників за відсутності симптомів або при мінімальних симптомах (I–II ступеня) показана замісна терапія ГКС. При тяжких випадках (недостатності наднирників III ступеня) варто проводити замісну високодозову терапію (IV, A).
- У разі нововиявленого інсулінорезистентного ЦД необхідно негайно розпочати інсулінотерапію. Пацієнти з кетоацидозом мають бути госпіталізовані. Діабетичний кетоацидоз варто лікувати відповідно до протоколів установи, включаючи введення внутрішньовенного інсуліну, корекцію втрати рідини і ретельний моніторинг рівня калію в плазмі крові, щогодинний контроль рівня глюкози та аніонів. Високі дози ГКС не показані (IV, E).
Імуноопосередкована гепатотоксичність
Діагностика
Усім пацієнтам, які проходять терапію ІКТ, варто регулярно оцінювати рівень сироваткових трансаміназ, лужної фосфатази (ЛФ) та білірубіну перед кожним циклом лікування. Гепатит може бути безсимптомним або проявлятися гарячкою, нездужанням, дискомфортом у животі, жовтяницею та анорексією. Біопсія печінки є корисною в диференційній діагностиці та лікуванні тяжких форм гепатиту.
Контроль (рис. 4)
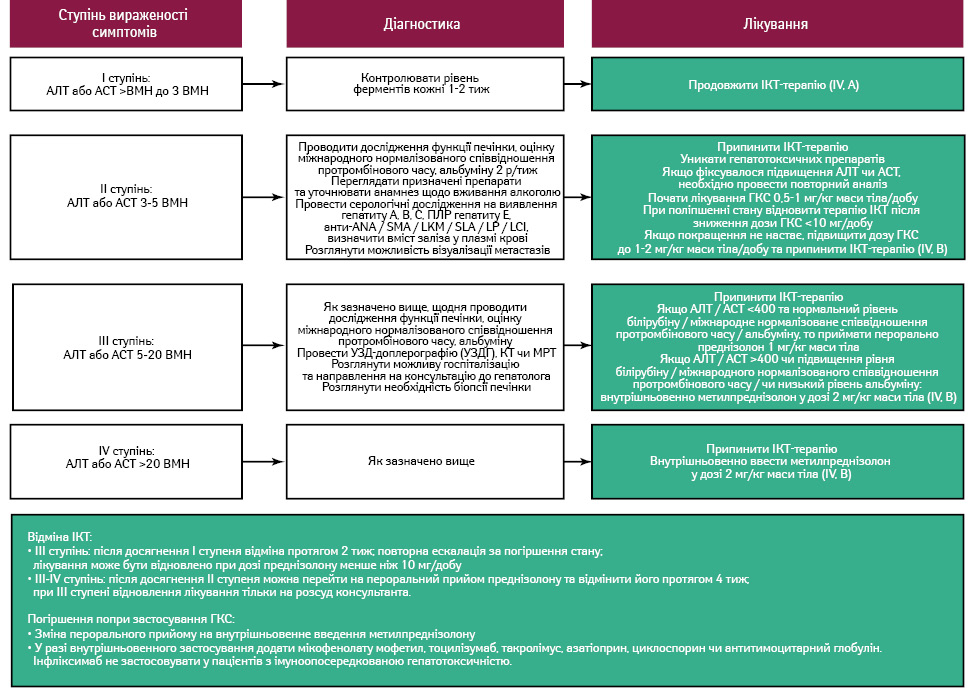
Клінічні прояви імуноопосередкованого гепатиту зазвичай зникають протягом 4–6 тиж при відповідному лікуванні. Якщо проблема залишається нерозв’язаною, варто розглянути інші супутні причини та повторити початкове діагностичне обстеження.
При ураженні печінки I ступеня тяжкості зазвичай достатньо проводити визначення рівня печінкових ферментів кожні 1–2 тиж, без необхідності припиняти імуноопосередковану терапію, якщо стан не погіршується. У випадку ураження печінки II ступеня імуноопосередковану терапію слід тимчасово припинити, а рівні трансаміназ та білірубіну контролювати 2 р/тиж. Якщо показники залишаються підвищеними навіть після припинення імуноопосередкованої терапії, необхідно розглянути призначення ГКС у дозі 0,5–1 мг/кг маси тіла/добу (метилпреднізолону або його еквіваленту). Імуноопосередковану терапію можна відновити, коли стан покращиться, а дозу ГКС знизити до менш ніж 10 мг/добу. Якщо поліпшення стану не настає, дозу ГКС підвищують до 1–2 мг/кг маси тіла/добу, і якщо це не допомагає, імуноопосередковану терапію слід припинити остаточно.
При ураженні печінки III або IV ступеня імуноопосередковану терапію слід припинити назавжди, хоча у деяких випадках можна відновити монотерапію анти-PD-(L)1. Біопсія печінки може бути показана індивідуально. У пацієнтів з гепатитом III ступеня без жовтяниці, підвищеного протромбінового часу або тяжкого ушкодження печінки може бути ефективною імуносупресивна терапія, така як призначення мікофенолату або тоцилізумабу навіть без ГКС.
Інтенсивний моніторинг печінкових ферментів є критично важливим для виявлення можливого погіршення стану. Якщо протягом 2–3 днів немає відповіді на ГКС, слід розглянути альтернативні імуносупресивні засоби, такі як мікофенолату мофетил (1000 мг 2 р/добу), тоцилізумаб (8 мг/кг маси тіла), такролімус, азатіоприн, циклоспорин або антитимоцитарний глобулін. Інфліксимаб не слід застосовувати у пацієнтів з імуноопосередкованою гепатотоксичністю, оскільки блокатори ФНП-α не рекомендовані через потенційний ризик ідіосинкратичної печінкової недостатності.
Рекомендації
- Рекомендується проводити оцінку сироваткових трансаміназ, ЛФ і білірубіну перед кожним циклом застосування терапії ІКТ (IV, A).
- При імуноопосередкованих ураженнях печінки I ступеня тяжкості рекомендується проводити контроль печінкових ферментів кожні 1–2 тиж без необхідності припинення терапії ІКТ (IV, A).
- При імуноопосередкованих ураженнях печінки II ступеня тяжкості рекомендоване тимчасове припинення терапії ІКТ з моніторингом рівня трансаміназ і білірубіну двічі на тиждень. Слід розглянути можливість застосування ГКС у дозі 0,5–1 мг/кг маси тіла/добу (V, B).
- Для пацієнтів з імуноопосередкованим ураженням печінки III або IV ступеня тяжкості варто розглянути можливість госпіталізації та застосування ГКС у дозі 1–2 мг/кг маси тіла/добу. Якщо протягом 2–3 днів немає відповіді на ГКС, слід розглянути альтернативну імуносупресивну терапію, таку як призначення мікофенолату в дозі 1000 мг двічі на добу, тоцилізумабу в дозі 8 мг/кг маси тіла, такролімусу, азатіоприну, циклоспорину або антитимоцитарного глобуліну (IV, B).
Імуноопосередкований холангіт
Імуноопосередкований холангіт є рідкісним ПЕ, яке може уражати великі та/або малі жовчні протоки, при якому фіксується більш виражене підвищення рівня γ-глутамілтрансферази (ГГТП) та ЛФ, ніж трансаміназ. Більшості пацієнтам призначають урсодезоксихолеву кислоту та преднізон або будесонід, хоча також застосовують інші імунодепресанти, наприклад мікофенолату мофетил, азатіоприн, такролімус, тоцилізумаб і плазмаферез. При медикаментозному лікуванні у більшості пацієнтів рівень печінкових ферментів знижується, але досягає нормальних значень лише в незначної кількості хворих через 6–12 тиж [36].
Рекомендація
- Пацієнтам з імуноопосередкованим холангітом варто призначати урсодезоксихолеву кислоту та преднізолон / будесонід (V, B).
Імуноопосередковане порушення роботи підшлункової залози
Діагностика
Діагноз імуноопосередкованого порушення підшлункової залози є діагнозом виключення. Диференційний діагноз ґрунтується на даних анамнезу захворювання, біохімічних аналізах та візуалізаційних дослідженнях (ультразвукової діагностики (УЗД), комп’ютерної томографії (КТ), магнітно-резонансної томографії (МРТ) і, якщо необхідно, ендосонографії з біопсією).
Імуноопосередковане порушення роботи підшлункової залози може мати різні прояви — від безсимптомного підвищення рівня ліпази до розвитку панкреатиту. Виражені симптоми порушення роботи підшлункової залози включають біль в епігастрії, нудоту та блювання. Гострий панкреатит може призвести до утворення псевдокіст, хронічного панкреатиту, недостатності підшлункової залози або ЦД. У випадку тяжкого гострого панкреатиту необхідно припинити імуноопосередковану терапію.
Існує мало доказів щодо ефективності стандартного лікування панкреатиту, яке передбачає внутрішньовенну регідратацію та знеболення. Роль ГКС залишається невідомою [22, 25].
Рекомендації
- Рекомендується проводити диференційну діагностику імуноопосередкованого порушення підшлункової залози з метастазами в підшлункову залозу та ураженням підшлункової залози внаслідок інших причин (наприклад прийому алкоголю, гіпертригліцеридемії, наявності жовчних каменів або сладжу, аутоімунного панкреатиту, неопластичних уражень паренхіми підшлункової залози, прийому нелікарських засобів, крім ІКТ). Диференційний діагноз ґрунтується на даних анамнезу захворювання, біохімічних аналізах та візуалізаційних дослідженнях (УЗД, КТ, МРТ і, якщо необхідно, ендосонографії з біопсією) (V, A).
Імуноопосередковані порушення роботи ШКТ
Імуноопосередкований ентероколіт
Частота захворюваності
Імуноопосередкований ентероколіт є найпоширенішою формою імуноопосередкованого порушення роботи шлунково-кишкового тракту (ШКТ).
Діагностика
Для диференційної діагностики імуноопосередкованого ентероколіту важливо виключити інфекції, дивертикуліт та кишкові метастази (особливо при недрібноклітинному раку легень та меланомі). Необхідні лабораторні дослідження включають загальний аналіз крові (ЗАК), електроліти сироватки, креатинін, альбумін, аналіз калу на ентеропатогени, токсин Clostridioides difficile і ПЛР на цитомегаловірус. Аналіз на С-реактивний білок (СРБ) є необов’язковим. Для пацієнтів, які можуть потребувати біологічних препаратів (інфліксимабу, ведолізумабу), слід провести скринінг на туберкульоз, вірусні гепатити та вірус імунодефіциту людини (ВІЛ). Маркери запалення кишечнику, такі як фекальний лактоферин та кальпротектин, є корисними для діагностики коліту та моніторингу ефективності лікування [27].
Клінічна картина
Характерними симптомами імуноопосередкованого ентероколіту є діарея та біль у животі, при цьому гематохезія і гарячка виявляються рідше. Розвиток гострого тяжкого коліту може призвести до зневоднення, токсичного мегаколону, перфорації товстої кишки (у 1–6,6% усіх хворих) і смерті пацієнтів, особливо при несвоєчасній діагностиці.
Рекомендоване проведення ранньої гнучкої ректосигмоїдоскопії або ілеоколоноскопії з біопсією у пацієнтів із підозрою на імуноопосередкований ентероколіт вище I ступеня [40, 41]. Наявність глибоких виразок та вираженого запалення над лівим відділом товстої кишки є прогностичними ознаками рефрактерного до ГКС захворювання, яке потребує лікування імунодепресантами [40, 44].
Терапія ґрунтується на ретроспективних серіях випадків без чітких доказових рекомендацій (рис. 5). Діарея I ступеня зазвичай лікується підтримувальною терапією, протидіарейними засобами (лоперамідом) і дієтою з низьким вмістом клітковини, при цьому імуноопосередкована терапія може продовжуватися. При стійкій діареї I ступеня або діареї / коліті II ступеня призначають ГКС (преднізолон 40–60 мг/добу). Якщо ефект відсутній, можна розглянути інфліксимаб або ведолізумаб.
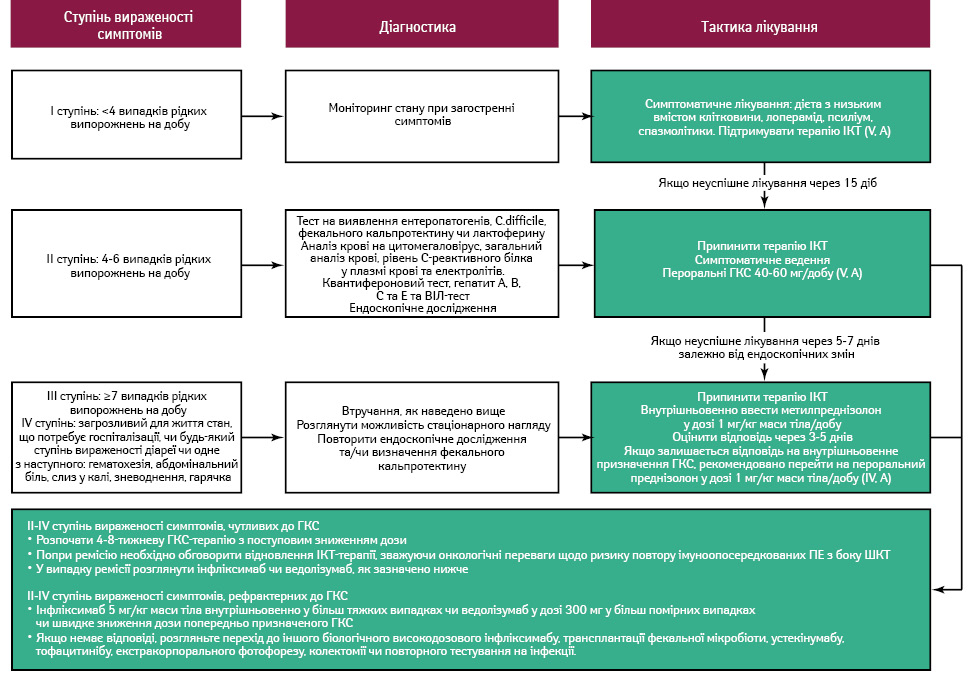
При діареї або коліті III–IV ступенів необхідне стаціонарне лікування та введення внутрішньовенних ГКС [(метил)преднізолону до 1 мг/кг маси тіла/добу]. Якщо протягом 3–5 днів спостерігається відповідь, пацієнта переводять на пероральну форму стероїдів і поступово знижують дозу. У випадках резистентності до ГКС призначають інфліксимаб або ведолізумаб.
Тривалість терапії визначається ендоскопічною та гістологічною ремісією, що контролюється повторними ендоскопіями або моніторингом кальпротектину. У деяких випадках, резистентних до ГКС та біопрепаратів, можливі альтернативні методи, як трансплантація мікробіоти або застосування устекінумабу та інших імуносупресантів.
Імуноопосередкований мікроскопічний коліт
Імуноопосередкований мікроскопічний коліт характеризується розвитком хронічної водянистої діареї у пацієнтів, які отримують терапію анти-PD-1 або анти-CTLA-4.
Запалення верхніх відділів ШКТ
Імуноопосередковане ураження верхніх відділів ШКТ зустрічається не так часто, як імуноопосередкований ентероколіт, та може супроводжуватися ураженням ротової порожнини (розвитком стоматиту), стравоходу, шлунка і дванадцятипалої кишки [45–47]. Провідними симптомами ураження верхніх відділів ШКТ є нудота, блювання, дисфагія, одинофагія, блювання з кров’ю та біль у животі [47]. Запалення верхніх відділів ШКТ може бути ізольованим або пов’язаним з ентероколітом, яке ендоскопічно може проявлятися наявністю еритеми, ерозії та виразки [45–48]. Запалення верхніх відділів ШКТ у більшості випадків можна ефективно контролювати прийомом інгібіторів протонної помпи (ІПП). Однак при тяжких формах захворювання з наявністю глибоких виразок шлунка варто призначати ГКС або біопрепарати [45, 47].
Інші імуноопосередковані ураження ШКТ
При імуноопосередкованому ураженні також є дані про наявність тріщин або фістул анального каналу, схожих з тими, що виявляються при хворобі Крона.
Рекомендації
- Варто провести гнучку сигмоїдоскопію або колоноскопію та біопсію пацієнтам, які отримують ІКТ та мають ознаки діареї вище I ступеня (IV, A).
- Не рекомендовано проводити КТ для діагностики імуноопосередкованого ентероколіту через недостатню чутливість методу (IV, E).
- Діарею або коліт I ступеня тяжкості слід лікувати шляхом надання дієтичних рекомендацій щодо споживання їжі з низьким вмістом клітковини та застосування лопераміду. Терапію ІКТ можна продовжувати під ретельним наглядом лікаря (V, A).
- При коліті II ступеня тяжкості варто призначати пероральні ГКС та за відсутності відповіді на терапію необхідно призначати ведолізумаб або інфліксимаб (V, A).
- При коліті III–IV ступеня тяжкості варто госпіталізувати пацієнтів та рекомендувати внутрішньовенне введення ГКС (IV, A). Препаратом вибору у тих хворих, які не відповідають на лікування, з гострим тяжким колітом, є інфліксимаб (IV, A). Іншим препаратом для лікування цього стану є також ведолізумаб (IV, B).
- Відновлення терапії ІКТ у пацієнтів, які перенесли шлунково-кишкові імуноопосередковані захворювання, варто обговорювати міждисциплінарно в кожному індивідуальному випадку (IV, A).
Імуноопосередковане ураження легень
Імуноопосередковане ураження легень — це група гетерогенних захворювань, яка включає імуноопосередковане інтерстиціальне захворювання легень або імуноопосередкований пневмоніт та інші рідкісні хвороби, такі як імуноопосередкований бронхіоліт або імуноопосередкований саркоїдоз легень.
Імуноопосередковане інтерстиціальне захворювання легень або імуноопосередкований пневмоніт
Частота захворюваності
Імуноопосередковане інтерстиціальне захворювання легень або імуноопосередкований пневмоніт визначається як вогнищеве або дифузне запалення паренхіми легень [51, 52].
Діагностика
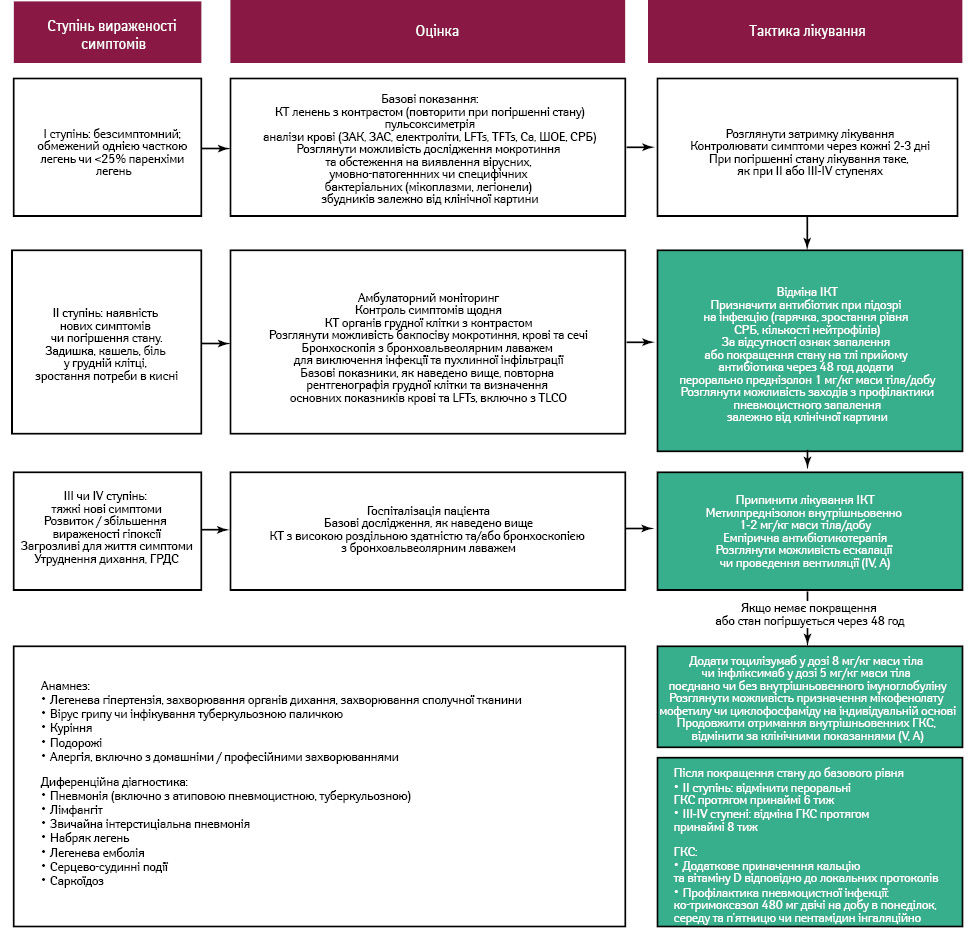
Загальні симптоми захворювання включають задишку, кашель, біль у грудній клітці, гарячку та розвиток ознак гіпоксії. Багато випадків безсимптомного імуноопосередкованого пневмоніту I ступеня можна виявити радіологічно за допомогою КТ. При наявності задишки у пацієнта варто рекомендувати йому повне клінічне обстеження, зокрема виключення інфекційної пневмонії, прогресування пухлини, тромбоемболії легеневої артерії, кардіальних подій та карциноматозу плеври.
Контроль
Моніторинг дихальної функції перед початком імунотерапії рекомендовано у пацієнтів із хронічним обструктивним захворюванням легень (ХОЗЛ) або наявним імуноопосередкованим інтерстиційним захворюванням легень. КТ високої роздільної здатності слід використовувати при підозрі на імуноопосередкований пневмоніт.
Пацієнти з пневмонітом II ступеня мають отримувати 1 мг/кг маси тіла/добу преднізолону (або його еквіваленту). Якщо протягом 48–72 год лікування ГКС не відмічається поліпшення стану, пневмоніт слід вважати рефрактерним до ГКС і проводити подальшу терапію. У разі пневмоніту ≥III ступеня тяжкості пацієнтам слід призначати 1–2 мг/кг маси тіла/добу метилпреднізолону внутрішньовенно (або його еквіваленту). Після поліпшення стану до ступеня тяжкості <I, варто починати поступово знижувати дозу ГКС протягом 4–6 тиж при пневмоніті II ступеня і протягом 6–8 тиж при ≥III ступені тяжкості.
Якщо вираженість симптомів не зменшується протягом 72 год після введення високих доз ГКС, слід запідозрити ГКС-рефрактерний пневмоніт і швидко підвищити інтенсивність лікування. До додаткових варіантів належать: тоцилізумаб (8 мг/кг маси тіла 1 р/2 тиж за необхідності) [20], інфліксимаб (5 мг/кг маси тіла 1 р/2 тиж 1 р/2 тиж за потреби) [65–68] або внутрішньовенний імуноглобулін (2 г/кг маси тіла протягом 2–5 днів) [69]. Інші препарати, такі як мікофенолату мофетил (1 г 2 р/добу) або циклофосфамід, можуть розглядатися індивідуально. У випадках, коли симптоми загрожують життю, терапію першої лінії з тоцилізумабом або інфліксимабом рекомендується проводити якнайшвидше, подібно до лікування інших імуноопосередкованих ПЕ, наприклад, коліту (рис. 6).
Саркоїдоз
Cаркоподібна реакція є рідкісною подією, яку можуть радіологічно помилково прийняти за прогресування пухлини або невдачу лікування. Найчастіше уражаються лімфатичні вузли, легені та шкіра. Біопсію ураження слід провести для диференційної діагностики з прогресуванням пухлини. Загалом більшість повідомлень про саркоподібні реакції, чутливі до лікування ГКС, або припинення терапії ІКТ. Якщо є користь при застосуванні ІКТ і пацієнт без наявності симптомів, терапію можна продовжити. Якщо пацієнт має симптоми захворювання, можна розглянути застосування ГКС у дозі 0,5–1 мг/кг маси тіла, і терапію ІКТ можна відновити після усунення ПЕ.
Рекомендації
- За наявності задишки рекомендовано провести пацієнту повне клінічне обстеження, виключити наявність інфекційної пневмонії, прогресування пухлини, легеневої емболії, серцевих подій (включно із серцевою недостатністю, міокардитом, гострим інфарктом міокарда та аритмією) і плеврального карциноматозу або випоту (IV, A).
- Випадки з наявним інтерстиційним захворюванням легень варто обговорити з фахівцем перед початком отримання ІКТ (IV, A).
- Якщо є підозра на імуноопосередковане інтерстиційне захворювання легень, варто розглянути можливість проведення КТ грудної клітки високої роздільної здатності з контрастуванням, щоб виключити іншу етіологію. Якщо результати КТ є негативними, слід розглянути можливість дослідження функції легень для виявлення можливих функціональних порушень (IV, A).
- Слід розглянути проведення бронхоальвеолярного лаважу для виключення інфекції або пухлинної інфільтрації та провести дослідження мокротиння, посів крові та сечі за наявності клінічних показань (IV, A).
- У випадках імуноопосередкованого пневмоніту II ступеня тяжкості можна розглянути можливість повторного застосування терапії ІКТ після повного усунення симптомів за умови ретельного моніторингу (V, B).
- У випадках імуноопосередкованого інтерстиційного захворювання легень II ступеня тяжкості слід розглянути застосування преднізолону (або еквіваленту) у дозі 1 мг/кг маси тіла/добу. Для імуноопосередкованого інтерстиційного захворювання легень III ступеня тяжкості варто розглянути введення метилпреднізолону (або еквіваленту) в дозі 1–2 мг/кг маси тіла/добу внутрішньовенно. Зниження дози ГКС слід починати після покращення стану до рівня <1 мг/кг маси тіла/добу протягом 4–6 тиж при II ступені вираженості захворювання та протягом 6–8 тиж при III ступені тяжкості відповідно (V, A).
- Якщо протягом 72 год після застосування ГКС не виявляється покращення стану, слід звернутися до фахівця та розглянути ескалацію терапії. Додаткові варіанти передбачають застосування тоцилізумабу [62], інфліксимабу [51, 63–65] та внутрішньовенного імуноглобуліну [66]. Можливі інші варіанти, такі як призначення мікофенолату мофетилу [67] або циклофосфаміду [51] (V, A).
Імуноопосередкована ревматологічна токсичність
Імуноопосередковані ревматичні та опорно-рухові ПЕ виявляються у близько 10% хворих з новоутвореннями, які отримують терапію ІКТ.
Артралгія і міалгія
Артралгія та міалгія є найчастішими імуноопосередкованими ревматичними проявами [68]. Після проведення диференційної діагностики варто розпочати симптоматичне лікування (застосування анальгетиків у комбінації чи без нестероїдних протизапальних препаратів (НПЗП)) (рис. 7).
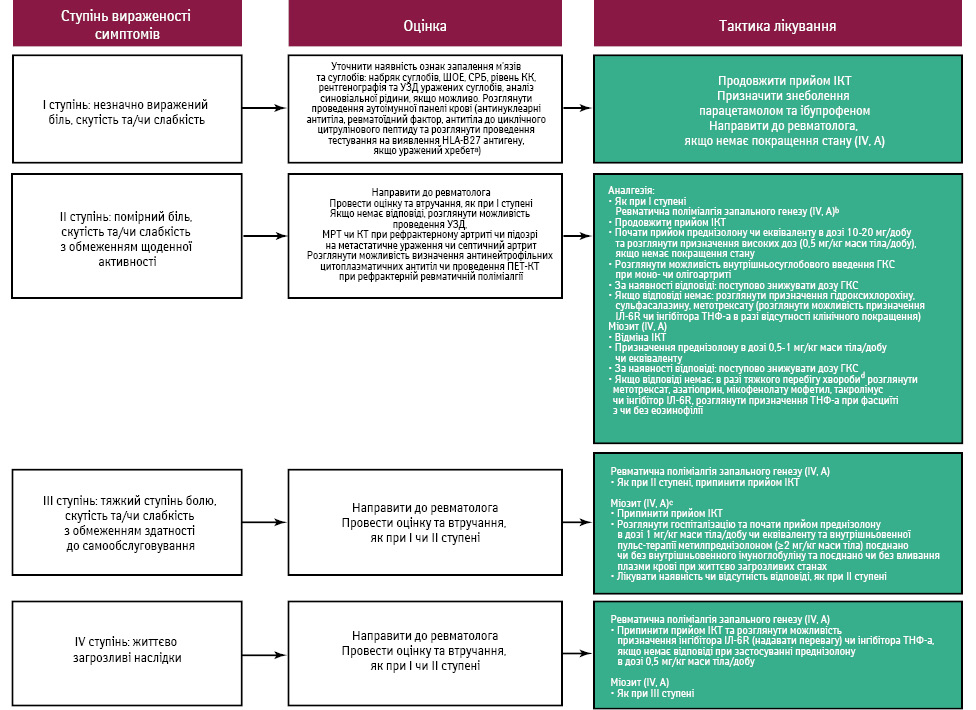
aПри міозиті шукати загрозливі для життя прояви (бульбарні симптоми, задишка, міокардит)d і проводити повне діагностичне обстеження: креатинкіназа (КК), АСТ, АЛТ, ЛДГ, феритин, тропонін I або Te, антитіл, асоційованих з міозитом, паранеопластичні антитіла, МРТ, електроміографію поєднано чи без біопсії, на індивідуальній основі, антитіла до ацетилхолінового рецептора при міастенії. Виключити дерматоміозит, якщо наявні ураження шкіри.
bЗапальний артрит (моно-, оліго- або поліартрит, псоріатичний артрит, синдром RS3PE) і синдром, подібний до ревматичної поліміалгії, є 2 основними клінічними проявами захворювання.
cПро підвищення рівня КК повідомлялося у більшості пацієнтів із міозитом, хоча зазвичай вона у межах норми у пацієнтів із міалгією.
dУ разі асоційованої міастенії гравіс або міокардиту див. окремий розділ.
eВисокочутливий тропонін Т експресується скелетними м’язами, включно з регенерувальною тканиною скелетних м’язів, тоді як високочутливий тропонін І є специфічним для міокарда. При міозиті тропонін Т може бути підвищений без ураження міокарда.
Імуноопосередковані запальний артрит та синдром ревматичної поліміалгії
Імуноопосередкований запальний артрит та синдром ревматичної поліміалгії — це 2 основні клінічні прояви, що розвиваться у 5–10% усіх пацієнтів, які отримують терапію ІКТ [69]. Артрит характеризується наявністю скутості та набряку суглобів, який може проявлятися як моно-, оліго- або поліартрит з частим теносиновітом. Початкова оцінка захворювання має включати підрахунок кількості уражених суглобів, визначення швидкості осідання еритроцитів (ШОЕ), СРБ, ревматоїдного фактора (РФ), антитіл до циклічного цитрулінованого пептиду (АЦЦП), антинуклеарних антитіл, проведення аналізу синовіальної рідини (за можливості), рентгенографії та УЗД уражених суглобів. У осіб з легкими формами артриту слід розглянути призначення НПЗП, а у випадках моно- або олігоартриту — ГКС внутрішньосуглобово. Більшість пацієнтів можуть потребувати системного застосування ГКС, яке слід розпочати з помірної дози 10–20 мг преднізону. Деяким пацієнтам може знадобитися довготривале застосування низьких або помірних доз ГКС для продовження терапії ІКТ. На ранніх стадіях слід звернутися до ревматолога (за наявності симптомів, які свідчать про II ступінь тяжкості захворювання) перед початком прийому ГКС у разі недостатньої відповіді на попередньо призначені дози ГКС чи в разі необхідності застосування схем, що зменшують потребу в ГКС. У цих хворих слід розглянути застосування базисних хворобомодифікувальних антиревматичних препаратів, таких як метотрексат, гідроксихлорохін або сульфасалазин. У разі тяжкого запального артриту або недостатньої відповіді на застосування базисних хворобомодифікувальних антиревматичних препаратів можна розглянути призначення інгібіторів рецептора IЛ-6 (у більшості випадків) або інгібітора фактора некрозу пухлин-α (ФНП-α). Продовження лікування ІКТ варто проводити індивідуально [70].
Cиндром ревматичної поліміалгії характеризується розвитком гострого, переважно двостороннього болю у плечі та/або стегні з ознаками ранкової скутості та можливим набряком рук і колін [71]. Діагностика цього синдрому має включати визначення ШОЕ, СРБ (для виключення міозиту через схожість клінічних проявів), РФ, АЦЦП, рівня КК (для виключення міозиту), проведення рентгенографії та УЗД уражених суглобів. Варто також виключити гігантоклітинний артеріїт. Лікування імуноопосередкованого синдрому ревматичної поліміалгії базується на застосуванні преднізону в дозі 10–20 мг/добу за наявності симптомів захворювання ≥II ступеня тяжкості з поступовим зниженням дози при поліпшенні стану. У випадках розвитку залежності від прийому ГКС або розвитку стійкості до терапії рекомендовано спрямувати хворого до ревматолога та розглянути призначення метотрексату або інгібіторів рецептора ІЛ-6.
Імуноопосередкований синдром сухості
Імуноопосередкований синдром сухості характеризується переважно сухістю в роті та рідше сухістю очей і артралгією, при цьому неврологічні прояви трапляються рідко [72, 73]. Важливо зазначити, що сухість у роті може бути пов’язана із застосуванням інших препаратів (наприклад морфіну), ПТ або інфекцією (кандидозом). Пацієнтів із підозрою на імуноопосередкований синдром сухості слід обстежити на наявність антинуклеарних антитіл, антитіл до антигену A, пов’язаного із синдромом Шегрена, антитіл до антигену B синдрому Шегрена, РФ, C3 і C4 комплементу. Бажано також провести біопсію малої слинної залози. При будь-якому ступені тяжкості імуноопосередкованого синдрому сухості може бути розглянуто призначення симптоматичного лікування, пілокарпіну і гідроксихлорохіну. Системні ГКС рекомендовані тільки в разі наявності позазалозистих проявів або симптомів захворювання ≥III ступеня. Припинення прийому ІКТ варто обговорити за наявності симптомів ≥III ступеня.
Імуноопосередкований міозит
Імуноопосередкований міозит є рідкісним (1%), але потенційно небезпечним для життя імуноопосередкованим ПЕ. У випадку імуноопосередкованого міозиту середня тривалість терапії ІКТ становить 4 тиж. Клінічна картина захворювання супроводжується розвитком міалгії зі слабкістю аксіальних, плечових, тазових, бульбарних та окуломоторних м’язів [74]. Патологічний механізм рабдоміолізу призводить до підвищення рівня КК, спонтанної активності уражених м’язів під час електроміографії. Імуноопосередкований міозит може бути фатальним ускладненням терапії ІКТ через ураження бульбарних м’язів та вторинне запалення міокарда [75]. Діагностична оцінка має включати визначення наявності міозит-асоційованих автоантитіл, проведення МРТ та електроміографії, а також біопсії. На МРТ часто виявляється фасциїт. Понад 80% усіх пацієнтів з імуноопосередкованим міозитом мають сприятливий клінічний результат протягом декількох місяців після припинення ІКТ та імуномодулювальної терапії [76, 77]. За наявності симптомів II ступеня тяжкості варто призначити ГКС у дозі 0,5–1 мг/кг маси тіла/добу преднізолону. За наявності бульбарних симптомів (дисфагії, дизартрії, дисфонії), задишки та/або міокардиту можна застосовувати високі дози ГКС (пульс-терапія, потім у дозі 1–2 мг/кг маси тіла) і додаткові варіанти лікування, такі як введення внутрішньовенного імуноглобуліну та/або проведення плазмаферезу [76, 78]. У пацієнтів із помірними симптомами (II ступеня тяжкості) покращення стану часто відмічається протягом кількох днів після припинення терапії ІКТ [74, 76].
У рефрактерних випадках можна розглянути призначення інгібіторів ІЛ-6R [79], а також інгібіторів ФНП-α за наявності фасциїту. Припинення лікування ІКТ є необхідним для хворих із симптомами захворювання ≥II ступеня тяжкості.
Інші системні імуноопосередковані ревматологічні стани
Розвиток васкулітів, склеродермоподібних реакцій та системного червоного вовчака також зареєстрований при лікуванні ІКТ, проте вони залишаються рідкісними [80]. У цих випадках рекомендовано спрямувати пацієнта до ревматолога або імунолога для належної клінічної, біологічної, імунологічної та візуалізаційної оцінки. За можливості варто проводити біопсію. Лікування цих випадків включає застосування ГКС, а також додаткових імуномодулювальних або імуносупресивних препаратів, таких як гідроксихлорохін, мікофенолату мофетил, метотрексат, циклофосфамід, ритуксимаб або внутрішньовенний імуноглобулін.
Рекомендації
- Раннє направлення до ревматолога слід розглядати в разі симптомів ≥II ступеня тяжкості до початку терапії ГКС, у випадках недостатньої відповіді на прийнятні дози ГКС та у випадках, що потребують режимів без ГКС (V, B).
- Початкова оцінка імуноопосередкованого запального артриту або імуноопосередкованої ревматичної поліоміалгії має включати підрахунок суглобів, за можливості аналіз синовіальної рідини, визначення рівнів ШОЕ, СРБ, РФ, анти-ЦЦП, АНА (при запальному артриті), проведення рентгенографії та УЗД уражених суглобів (IV, A).
- Після встановлення остаточного діагнозу слід розпочати симптоматичне лікування (застосування аналгетиків у комбінації чи без НПЗП) для лікування артралгії та міалгії (IV, B).
- У осіб із легкими формами артриту або з моно- чи олігоартритом слід розглянути застосування НПЗП та/або внутрішньосуглобове введення ГКС (IV, B).
- При імуноопосередкованому запальному артриті ≥II ступеня тяжкості та імуноопосередкованій ревматичній поліоміалгії слід розпочинати прийом преднізону в дозі 10–20 мг/добу з поступовим зниженням дози після покращення стану. У разі відсутності поліпшення можна розглянути призначення вищих доз (0,5 мг/кг маси тіла), а також базисних протиревматичних препаратів (метотрексату, гідроксихлорохіну або сульфасалазину) або біологічних засобів (інгібіторів ІЛ-6R (бажано), інгібіторів TNF-α) при тяжких або стійких симптомах. Доцільність продовження лікування ІКТ слід оцінювати індивідуально (IV, A).
- Призначення преднізолону в дозі 0,5–1 мг/кг маси тіла слід розпочати при імуноопосередкованому міозиті ≥II ступеня тяжкості. За наявності загрозливих для життя проявів слід розглянути застосування високих доз ГКС, введення внутрішньовенного імуноглобуліну та/або проведення плазмаферезу; припинення терапії ІКТ є обов’язковим (IV, A).
- Симптоматичне лікування, пілокарпін і гідроксихлорохін можуть бути розглянуті для будь-якого ступеня імуноопосередкованого синдрому сухості після тестування на специфічні аутоантитіла та за можливості біопсії малої слинної залози. Системні ГКС рекомендовано застосовувати лише у випадках екстрагландулярних проявів або наявності симптомів ≥III ступеня тяжкості (IV, B).
Імуноопосередкована неврологічна токсичність (рис. 8)
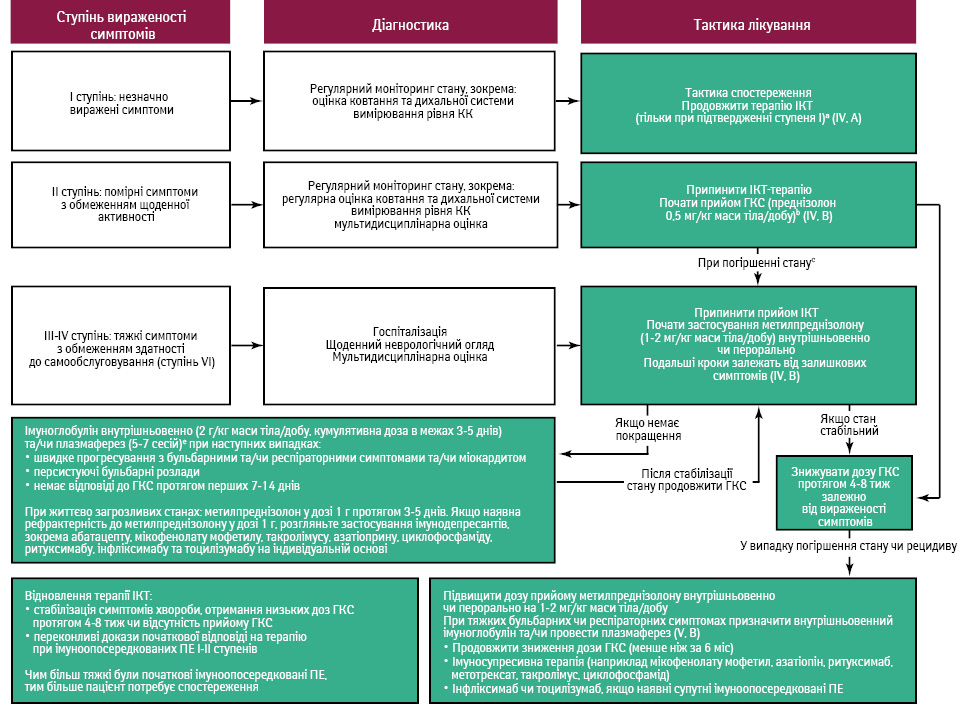
aПацієнтів з будь-якими неврологічними симптомами слід направляти до невролога, а імунотерапію ІКТ варто проводити лише після підтвердження ступеня симптоматики.
bУ всіх випадках при міастенічних симптомах може використовуватися піридостигмін, у дозі від 3 до 30 мг перорально до загальної кількості 600 мг/добу. 30 мг піридостигміну перорально еквівалентно 1 мг внутрішньовенно або 0,75 мг неостигміну внутрішньом’язово. Якщо пацієнт інтубований, застосування піридостигміну можна припинити.
cСвоєчасна консультація з неврологом є обов’язковою.
dГКС зазвичай не рекомендуються при ідіопатичній формі синдрому Гієна — Барре, але при легких формах, пов’язаних з ІКТ, можна розглянути пробне лікування (метилпреднізолон у дозі 2‒4 мг/кг маси тіла/добу) з поступовим зниженням дозування. У тяжких випадках (III‒IV ступені) також можна розглянути пульс-терапію ГКС (метилпреднізолон 1 г/добу протягом 5 днів) поєднано з введенням внутрішньовенно імуноглобуліну або плазмаферезу.
eПри симптомах, що загрожують життю, плазмаферез може бути корисним варіантом, але слід враховувати можливі протипоказання, такі як ниркова недостатність, підвищена коагуляція, сепсис або гемодинамічна нестабільність.
Рівень захворюваності
Частота виникнення імуноопосередкованих неврологічних ПЕ становить близько 1–5% [81], а час проявів варіює від 6 до 13 тиж.
Синдром, подібний до імуноопосередкованої міастенії
Синдром, подібний до імуноопосередкованої міастенії, стає все більш поширеним і викликає занепокоєння як ускладнення, пов’язане з терапією ІКТ. Типовими симптомами є слабкість проксимальних м’язів, залежна від фізичних навантажень, чи бульбарних м’язів, наприклад розвиток птозу та диплопії.
Як правило, цей синдром виникає de novo [81] та супроводжується виявлянням антитіл до ацетилхолінового рецептора у 2/3 пацієнтів. Лікування передбачає припинення ІКТ, призначення ГКС та піридостигміну. У тяжких випадках з дихальними або бульбарними симптомами необхідним може бути внутрішньовенне введення імуноглобуліну або плазмаферез [76].
Окрім припинення терапії ІКТ, першою лінією лікування цього синдрому є застосування ГКС та піридостигміну. У тяжких випадках, що супроводжуються дихальними або бульбарними симптомами, часто необхідно проводити негайне застосування внутрішньовенного імуноглобуліну та/або плазмаферезу [76].
Міастенія — міозит — міокардит (перехресний синдром)
Оскільки і міастенія, і міозит можуть включати слабкість окорухових, лицьових і бульбарних м’язів, а також проксимальний тетрапарез, важливо розпізнати клінічні ознаки міозиту та міокардиту (наприклад підвищення рівня КK, тропоніну T або I, біль).
Імуноопосередкована периферична нейропатія
Імуноопосередкована периферична нейропатія здебільшого є демієлінізувальним захворюванням і може проявлятися як гостра полірадикулонейропатія (імуноопосередкований синдром Гієна — Барре). Клінічні симптоми нагадують класичні симптоми синдрому Гієна — Барре, зокрема наявність двосторонньої проксимальної слабкості, атаксії, сенсорних порушень, автономних розладів та ураження черепних нервів. Швидка діагностика симптомів патології має важливе значення для запобігання розвитку дихальній недостатності у зв’язку з ураженням шийних нервових корінців. На відміну від класичного синдрому Гієна — Барре, рекомендовано застосовувати ГКС як терапію першої лінії. Внутрішньовенний імуноглобулін використовується як додаткова або альтернативна терапія в разі неможливості застосування ГКС.
Рекомендації
- У разі підозри на імуноопосередковані неврологічні ускладнення, такі як синдром Гієна — Барре, лейкоенцефалопатія, міастенія, міопатія та периферична нейропатія, слід негайно спрямувати пацієнта до невролога (IV, B).
- У разі будь-яких неврологічних симптомів хворого потрібно спрямувати до невролога та призупинити ІКТ до визначення ступеня тяжкості симптомів (IV, B).
- Якщо симптоми неврологічного ураження I ступеня тяжкості, терапію ІКТ можна продовжувати під ретельним наглядом (IV, B).
- При симптомах I ступеня тяжкості лікування ІКТ слід перервати та розпочати прийом (метил)преднізолону перорально або внутрішньовенно (IV, B).
- У випадках із симптомами III або IV ступеня тяжкості може бути необхідна більш інтенсивна імуносупресивна терапія, зокрема заміна ГКС на внутрішньовенний імуноглобулін або проведення плазмаферезу для лікування синдрому Гієна — Барре, лейкоенцефалопатії, міастенії або імуноопосередкованої міопатії (V, B).
Імуноопосередкована серцево-судинна токсичність
Імунотерапія ІКТ може викликати широкий спектр серцево-судинних токсичних реакцій, включно з імуноопосередкованим міокардитом, перикардитом, васкулітом, гострим коронарним синдромом, порушення провідності серця (зокрема повну блокаду серця), передсердні та шлуночкові аритмії, синдром такацубо, неінфекційну дисфункцію лівого шлуночка та серцеву недостатність [82].
Діагноз імуноопосередкованого міокардиту базується на клінічній оцінці, електрокардіографії (ЕКГ), аналізі серцевих біомаркерів та кардіовізуалізації (ехокардіографії, МРТ серця, особливо за допомогою T1– і T2-картування, T2-зваженого короткого відновлення (T2STIR) та пізнього підсилення гадолінієм (LGE)) [86].
Якщо підозрюється імуноопосередкований міокардит, але рівень тропоніну або функція лівого шлуночка залишаються нормальними, слід провести МРТ серця. Якщо МРТ недоступна або протипоказана, альтернативним методом є кардіо-ПЕТ / КТ для оцінки запалення міокарда. Якщо діагноз залишається невизначеним, варто розглянути ендоміокардіальну біопсію перед відновленням терапії ІКТ.
Лікування імуноопосередкованої серцево-судинної токсичності передбачає 3 основні складові (рис. 9). По-перше, лікування серцевих ускладнень відповідно до кардіологічних стандартів, наприклад, встановлення кардіостимулятора при повній блокаді серця. По-друге, проводиться імуносупресивна терапія для лікування міокардиту, перикардиту або васкуліту. По-третє, розглядається питання про тимчасове або повне припинення терапії ІКТ залежно від природи та ступеня тяжкості серцево-судинних ускладнень. Постійний моніторинг ЕКГ для виявлення нових блокад серця або тахіаритмій (передсердних або шлуночкових) рекомендований для пацієнтів з підтвердженим імуноопосередкованим міокардитом у гострій фазі.
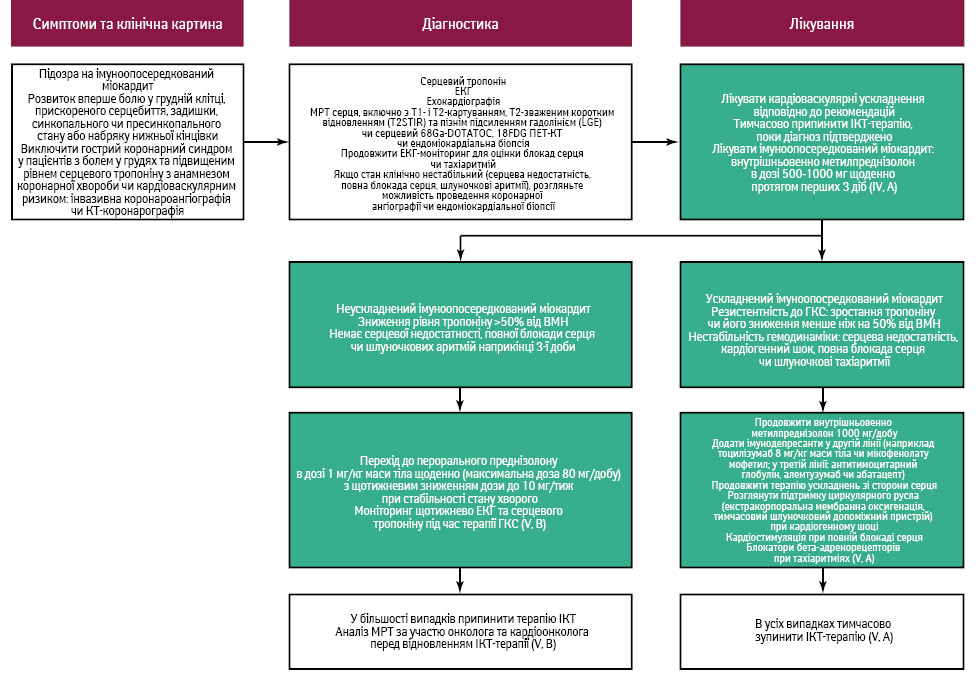
Для лікування імуноопосередкованого міокардиту, враховуючи підвищений ризик розвитку серйозних серцевих ускладнень (серцевої недостатності, кардіогенного шоку, шлуночкових аритмій та раптової смерті), рекомендовані високі дози метилпреднізолону внутрішньовенно (500–1000 мг щоденно) протягом щонайменше 3 днів. Після цього можна перейти на пероральний преднізолон у початковій дозі 1 мг/кг маси тіла/добу (для пацієнтів з масою тіла <80 кг) з подальшим зниженням дози на 10 мг щотижня до досягнення 20 мг/добу. У разі стабілізації стану хворого рекомендовано щотижневий моніторинг рівня тропоніну. Якщо клінічна нестабільність пацієнта зберігається, включаючи серцеву недостатність та/або шлуночкові аритмії, а також підвищені рівні тропоніну, незважаючи на 3 дози лікування, слід продовжити внутрішньовенну терапію метилпреднізолоном і додати імуносупресивну терапію другої лінії.
При підозрі на імуноопосередкований міокардит через розвиток нових симптомів (болю у грудях, задишки, прискореного серцебиття), підвищення рівня тропоніну або появі нових ознак дисфункції лівого шлуночка за результатами ехокардіографії, і якщо пацієнт гемодинамічно нестабільний або має шлуночкові аритмії, рекомендується невідкладна терапія метилпреднізолоном внутрішньовенно (500–1000 мг), а також препарати для лікування серцевої недостатності. Результати дослідження свідчать, що раннє застосування високих доз ГКС (≥500 мг преднізолону) протягом 24 год знижує ризик розвитку серйозних серцевих ускладнень у хворих з імуноопосередкованим міокардитом порівняно з відкладеним лікуванням або більш низькими дозами. Перед відновленням терапії ІКТ у пацієнтів, які перенесли міокардит, необхідно провести міждисциплінарне обговорення, враховуючи тяжкість первинного епізоду, ступінь відновлення серцевої функції, реакцію на онкологічне лікування та наявність альтернативних варіантів терапії.
Рекомендації
- Осіб з підозрюваними випадками імуноопосередкованого міокардиту слід госпіталізувати на вторинний чи третинний рівень надання медичної допомоги з моніторингом ЕКГ та готовністю до реанімації (V, A).
- Необхідно виключити інші причини підвищення рівня тропоніну, зокрема ГКС, особливо у пацієнтів з факторами ризику або встановленою ішемічною хворобою серця (V, A).
- Терапію ІКТ слід тимчасово призупинити або повністю припинити в разі підтвердження імуноопосередкованого міокардиту (V, A).
- Діагностична МРТ серця та визначення тропоніну рекомендовані при підозрі на імуноопосередкований міокардит або перикардит (IV, A).
- Якщо МРТ або тропонін не дають необхідних діагностичних результатів, варто розглянути ендоміокардіальну біопсію для підтвердження діагнозу перед відновленням ІКТ (V, A).
- У випадках підтвердженого міокардиту слід негайно розпочати внутрішньовенне введення метилпреднізолону в дозі 500–1000 мг щодня протягом 3 діб з подальшим переглядом лікування (V, A).
- Якщо рівень тропоніну знижується до <50% від пікової концентрації або до нормальних значень через 3 доби після початку лікування, а пацієнт є клінічно стабільним, рекомендовано перейти на пероральний прийом преднізолону в дозі 1 мг/кг маси тіла/добу (до максимальної дози 80 мг/добу), поступово знижуючи дозу на 10 мг щотижня за умови стабільності стану (V, A).
- Серцеву недостатність або кардіогенний шок слід лікувати відповідно до рекомендацій Європейського товариства кардіологів (European Society of Cardiology — ESC) щодо серцевої недостатності (III, A).
- Рекомендовано обговорення на багатопрофільній нараді перед відновленням терапії ІКТ у хворих із легким, клінічно неускладненим імуноопосередкованим міокардитом (V, A).
- Для лікування неускладненого імуноопосередкованого перикардиту рекомендовано використовувати пероральний преднізолон та колхіцин (500 мг 2 р/добу) (IV, A).
- У випадках перикардиту із середнім або великим випотом слід призначити внутрішньовенний метилпреднізолон у дозі 500–1000 мг та колхіцин 500 мг 2 р/добу, тимчасово призупинивши ІКТ. При великому випоті в перикарді або тампонаді рекомендується провести перкутанний перикардіоцентез (V, A).
Імуноопосередкована ниркова токсичність
Рівень захворюваності
Частота розвитку імуноопосередкованої дисфункції нирок становить 2–7% і найчастіше фіксується у пацієнтів, які отримують комбіновану терапію анти-PD(L)1 та анти-CTLA-4 (5%) [91–94].
Діагностика та контроль (рис. 10)
Біопсія нирки рекомендована при підозрі іншої ймовірної етіології захворювання, оскільки результати можуть допомогти визначити стратегію лікування. Емпірична терапія ГКС є доцільною, особливо за умови високої ймовірності імуноопосередкованого гострого інтерстиціального нефриту (ГІН) і за відсутності протипоказань до проведення біопсії. Зазвичай лікування ГКС показане в разі підвищення рівня креатиніну вдвічі порівняно з базовим показником (відповідає стадії II за класифікацією KDIGO або 2-му класу за критеріями CTCAE). Рекомендована початкова доза преднізолону становить 1 мг/кг маси тіла перорально, однак у тяжких випадках (стадія III за KDIGO, клас 3-й або 4-й за CTCAE або необхідність у замісній нирковій терапії) може бути доцільним застосування пульс-терапії метилпреднізолоном (250–500 мг) протягом 3 діб. Повільне зниження дози ГКС протягом 8–12 тиж рекомендоване для мінімізації ризику рецидивів. Інші імуносупресивні засоби, що застосовуються при стійких до ГКС випадках, включають мікофенолату мофетил, циклофосфамід і ритуксимаб. Інфліксимаб і тоцилізумаб також можуть бути ефективними, хоча вони не рекомендовані для лікування антитіло-опосередкованого ниркового васкуліту, оскільки відсутня достатня кількість даних про їх ефективність у випадках нефриту, не пов’язаного з ІКТ.
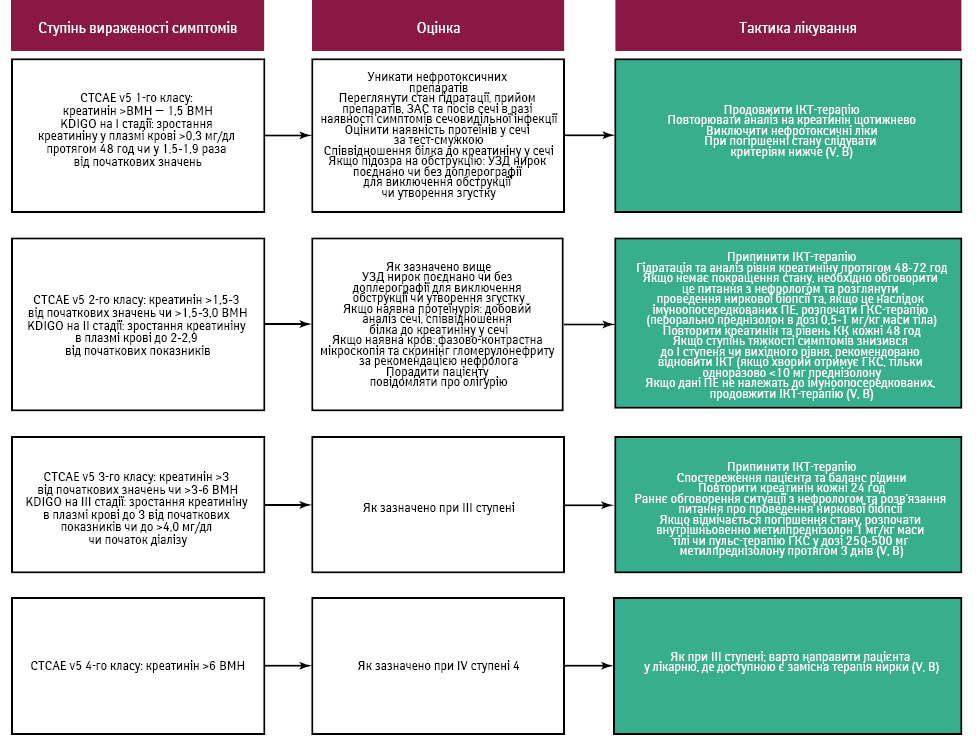
Рекомендації в разі підозри на імуноопосередкований нефрит (V, B):
- Необхідно виключити інші можливі причини ниркової недостатності.
- Імунотерапію слід призупинити або припинити залежно від ступеня тяжкості ниркової недостатності.
- Прийом інших нефротоксичних препаратів слід припинити.
- Почати прийом (метил)преднізону в дозі 1 мг/кг маси тіла або розглянути пульс-терапію метилпреднізолоном у випадках гострої ниркової недостатності III стадії.
- Біопсію нирок слід розглядати індивідуально для підтвердження діагнозу.
Імуноопосередкована токсичність очей
Імуноопосередкована токсичність очей діагностується рідко (<1%) [102], але може загрожувати органу зору, якщо вчасно її не діагностувати та не лікувати. Симптоми включають сухість очей, свербіж, сльозотечу, а також порушення зору, такі як розмитість або двоїння. Під час первинного огляду важливо виключити інші причини, такі як сторонні тіла, метастази в центральну нервову систему (ЦНС), інфекції або судинні патології. Своєчасне звернення до офтальмолога необхідно як для діагностики, так і лікування [102, 103].
Імуноопосередкована токсичність очей може проявлятися у формі уражень, таких як кон’юнктивіт або кератит, внутрішньоочних запалень (увеїту), або орбітальної міопатії (орбітального міозиту) [103, 104]. Важливо пам’ятати, що сухість очей може бути ознакою синдрому Шегрена, а орбітальна міопатія — проявом таких захворювань, як міозит, міокардит, міастенія гравіс або синдром Гієна — Барре.
Лікування імуноопосередкованої токсичності очей залежить від тяжкості стану. Легкі випадки увеїту зазвичай добре піддаються місцевій терапії, зокрема застосуванню місцевих ГКС. У таких випадках можна уникнути системного застосування ГКС, що дозволяє уникнути системної терапії та продовжити імунотерапію, зваживши користь і ризики для пацієнта. У випадках тяжкої форми імуноопосередкованої токсичності очей, зокрема орбітальної міопатії, необхідно припинити ІКТ і призначити системні ГКС [102]. Якщо хворий не реагує на ГКС, можуть знадобитися імуносупресори 2-ї лінії. Повторне призначення ІКТ або його продовження має здійснюватися з обережністю.
Рекомендація
- У разі підозри на імуноопосередковану токсичність очей слід негайно звернутися до офтальмолога для точної діагностики та лікування (IV, B).
Імуноопосередкована гематологічна токсичність
Імуноопосередкована гематологічна токсичність є відносно рідкісним ускладненням (<5%) [105–107], проте супроводжується підвищеним рівнем смертності.
Імуноопосередкована гематологічна токсичність може бути тяжкою або навіть летальною і проявлятися різними формами, такими як анемія (зокрема апластичною та автоімунною гемолітичною анемією (АІГА)), лейкопенія, лімфопенія, нейтропенія, тромбоцитопенія, панцитопенія, тромботична тромбоцитопенічна пурпура, гемолітико-уремічний синдром, гемофагоцитарний лімфогістіоцитоз (ГЛГ) та порушення згортання крові, включно з набутою гемофілією. Важливою особливістю імуноопосередкованої АІГА є висока частота негативного тесту прямої антиглобулінової реакції (тесту Кумбса), що фіксується у близько 40% усіх випадків [109].
Раннє звернення до гематолога рекомендоване для діагностики та лікування. Потрібно розглянути можливість раннього дослідження кісткового мозку, особливо для виключення інших причин панцитопенії, таких як вторинний мієлодиспластичний синдром або апластична анемія. Лікування імуноопосередкованої гематологічної токсичності залежить від ступеня тяжкості та включає симптоматичне лікування, таке як переливання крові, підтримка фактора росту та застосування системних ГКС.
У серії випадків близько 70% усіх пацієнтів із імуноопосередкованою гематологічною токсичністю проявили позитивну відповідь на лікування ГКС [106]. У випадках резистентності до ГКС рекомендовано використовувати імуносупресори другого ряду, такі як внутрішньовенний імуноглобулін, ритуксимаб, мікофенолату мофетил і циклоспорин. У випадках тромбоцитопенії, що не піддається лікуванню внутрішньовенним імуноглобуліном і ГКС, ефективним виявився ельтромбопаг, агоніст рецепторів тромбопоетину для перорального застосування [110].
Рекомендації
- У разі підозри на імуноопосередковану гематологічну токсичність необхідно негайно залучити гематолога і припинити терапію ІКТ (IV, B).
- Лікування має включати підтримку препаратами крові, факторами росту та внутрішньовенне введення (метил)преднізолону в дозі 1 мг/кг маси тіла як першу лінію терапії (V, B).
- Терапія анти-ІЛ-6R може бути використана для імуноопосередкованого ГЛГ [111].
- Ельтромбопаг або інші пероральні агоністи рецепторів тромбопоетину можуть бути розглянуті для лікування тромбоцитопенії, що не піддається терапії ГКС або внутрішньовенним імуноглобуліном, за погодженням із гематологом (V, B).
Отже, цей огляд рекомендацій ESMO, який ґрунтується на наукових даних та думці експертів з різних країн, представляє клінічні рекомендації для оцінки, діагностики та лікування токсичності, спричиненої імунотерапією, зокрема ІКТ, забезпечуючи комплексний підхід до лікування ПЕ.
Адаптований переклад за Haanen, J. B. A. G., Carbonnel, F., Robert, C., Kerr, K. M., Peters, S., Larkin, J., & Jordan, K.; ESMO Guidelines Committee (2018). Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 28(4), iv119-iv142. doi: 10.1093/annonc/mdx225.
Стаття друкується у скороченому вигляді.
Список використаної літератури знаходиться в редакції.
Ірина Неміш














Leave a comment