Досвід двоетапних резекцій при білобарних метастазах колоректального раку в печінку: хірургічні результати та фактори прогнозу
Микитюк А.І., Бурлака А.А., Лукашенко А.В., Безносенко А.П., Рожкова В.О., Щебетун А.Д., Банковська Н.В.
Резюме. Вступ. За даними Всесвітньої організації охорони здоров’я (ВООЗ), колоректальний рак (КРР) посідає 3-тє місце серед злоякісних новоутворень за частотою виявлення у світі. Близько 43% усіх пацієнтів мають віддалене метастатичне ураження печінки, що є основною причиною смерті. Двоетапна резекція печінки (ДЕР) є ефективним методом хірургічного лікування при білобарних колоректальних метастазах у печінку. Метою методу є індукція росту залишкового об’єму печінки з метою уникнення післяопераційної печінкової недостатності. Метою нашого аналізу була оцінка периопераційних та віддалених результатів ДЕР при метастатичному білобарному ураженні КРР в умовах державного високоспеціалізованого центру. Матеріали та методи. Проведено ретроспективний аналіз проспективно-підтримуваної бази 480 пацієнтів на основі Національного канцер-реєстру. Збір даних проводився в період з 1 січня 2015 р. до 1 квітня 2024 р. Проаналізовано стандартні демографічні та клініко-патологічні дані, зокрема стать, вік, інформацію про ініціальний діагноз, неоад’ювантну терапію та характеристики первинної пухлини. Порівняння хірургічних та онкологічних результатів проводилося за допомогою відповідності дослідження «випадок-контроль». ДЕР підлягали пацієнти з множинними верифікованими білобарними печінковими колоректальними метастазами в печінку, завершеною ДЕР, досягненням повного видалення вогнищ у печінці та референтними показниками майбутнього залишку печінки (volume of the future liver remnant — FLR). Результати. Відповідно до критеріїв, у дослідження залучено 45 пацієнтів, проте 4 з них вибуло із дослідження з причини прогресії захворювання (7,2%) та летального випадку після 1-го етапу хірургічного лікування (2,4%). Показники смертності на 90-й день після 2-го етапу резекції печінки становлять 24,4%. Медіана спостереження для усіх пацієнтів становила 28 міс (1–96 міс). Показник 5-річної загальної виживаності (ЗВ) становив 37±12% міс, медіана виживаності — 30±6 міс. Кумулятивна 5-річна безрецидивна виживаність становила 21±5%, однак 9,7% усіх пацієнтів не змогли завершити друге хірургічне втручання та виявились у когорті «drop-out» і не пережили 5-річний період. Висновки. ДЕР забезпечують задовільні онкологічні результати лікування пацієнтів із білобарними метастазами в печінку. Впровадження цієї методики в умовах Державного некомерційного підприємства (КНП) «Національний інститут раку» дозволило підвищити показники 5-річної виживаності до рівня світових. Вважаємо, що мультидисциплінарний підхід використання двоетапної стратегії хірургічного лікування білобарних метастазів у печінку при КРР є безпечною методикою за умов дотримання сучасних стандартів у хірургії печінки.
Одержано 12.07.2024
Прийнято до друку 26.07.2024
DOI: 10.32471/clinicaloncology.2663-466X.55-3.32966
ВСТУП
За даними ВООЗ, КРР посідає 3-тє місце серед злоякісних новоутворень за частотою виявлення у світі [1]. Найбільш поширеним місцем метастазування КРР є печінка, близько 43% усіх пацієнтів мають метастатичне ураження печінки, що є основною причиною смерті [2]. Запорукою ефективного лікування метастатичного КРР є комбінація хірургічних (резекції, абляції, трансплантації), малоінвазивних методів (трансартеріальної хімієемболізації, артеріальної перфузії печінки), системної терапії (хімієтерапії та імунотерапії) та променевої терапії — стереотаксичної променевої терапії тіла та селективної внутрішньої радіаційної терапії (Stereotactic body radiation therapy — SBRT / Selective Internal Radiation Therapy — SIRT). Резекція метастатичних вогнищ печінки залишається найбільш ефективним методом радикального лікування, який достовірно підвищує показники 5-річної виживаності: 27% при синхронних ураженнях печінки, 50% при ранніх метахронних метастазах та 66% при пізніх метахронних метастазах [3–5]. З метою зниження можливих післяопераційних дисфункцій органів (післяопераційної печінкової недостатності [6]) використовують ДЕР для модуляції FLR [7]. Успіх цього методу залежить від інтенсивності гіпертрофії залишкової частки печінки після проведення першого хірургічного етапу. Метою класичного методу ДЕР є індукування атрофії іпсилатеральної долі печінки за допомогою портальної венозної депривації та досягнення контрлатеральної гіпертрофії залишкового FLR із попередньою санацією цієї долі. Опції досягнення гіпертрофії залишку печінки розподіляють на емболізацію гілок ворітної вени (ЕВВ); портовенозне лігування (ПВЛ); транссекцію паренхіми печінки з одномоментним лігуванням ворітної вени з подальшою поетапною гепатектомією (Associating Liver Partition and Portal vein ligation for Staged hepatectomy — ALPPS). Техніка ALPPS, зі свого боку, має на меті виконання санації перспективної долі печінки, лігування портальної вени із наслідуючою трансекцією печінки по лінії демаркації. В обох випадках під час другого хірургічного етапу видалялася уражена частина печінки, за потреби виконувалася лімфаденектомія, холецистектомія. В одному випадку використано методику mini-ALPPS — відмінність цієї методики від класичного ALPPS є часткова трансекція печінки (на відміну від повноцінної трансенкції) з емболізацією ворітної вени (уникаючи лігування портальної вени). Середня тривалість очікування між 1-м та 2-м етапом становить 2–8 тиж. У разі недостатнього збільшення залишкового об’єму печінки можна розглянути високоселекційну емболізацію сегментарних гілок ворітної вени. Проте у випадку рефрактерності до гіпертрофії або прогресування захворювання (трапляється у 30% усіх випадків) — від 2-го етапу резекції печінки слід відмовитися [8, 9]. Як частину алгоритму, системну хімієтерапію можна проводити між 1-м і 2-м етапом для запобігання рецидиву або росту пухлини в FLR.
Незважаючи на значний прогрес у цій галузі, багато аспектів ДЕР на тлі метастазів КРР залишаються предметом активних досліджень. Особлива увага приділяється оптимальним стратегіям селекції пацієнтів, прогнозуванню результатів та післяопераційному догляду.
Тому метою нашого аналізу є оцінка периопераційних та віддалених результатів ДЕР при метастатичному білобарному ураженні КРР в умовах державного високоспеціалізованого центру.
МАТЕРІАЛИ ТА МЕТОДИ
Дизайн дослідження
Проведено ретроспективний аналіз проспективно-підтримуваної бази на основі Національного канцер-реєстру України, залучено 480 пацієнтів віком >18 років з верифікованими печінковими нерезектабельними колоректальними метастазами. Збір даних здійснювався на базі ДНП «Національний інститут раку» в період з 1 січня 2015 до 1 квітня 2024 р. Сформовано групу пацієнтів, яким виконано ДЕР (n=45) з білобарними метастазами в печінку.
Визначення показань до ДЕР відбувалося в межах мультидисциплінарного консиліуму (лікар-хірург, променевий терапевт, клінічний онколог). ДЕР підлягали пацієнти з множинними верифікованими білобарними печінковими колоректальними метастазами в печінку, завершеною ДЕР, досягненням повного видалення вогнищ у печінці та показниками FLR до загального об’єму печінки (total liver volume — TLV) (FLR / TLV) <25% та/або FLR до маси тіла співвідношення (Body Weight Ratio — BWR) (FLR / BWR) <0,5, а FLR / TLV <35% та/або FLR / BWR <0,7 при ушкодженій паренхімі печінки: стеатозі, фіброзі або хімієтерапевтичному ураженні печінки (синусоїдальному обструктивному синдромі або стеатогепатиті), що було запідозрено на радіологічному та/або лабораторному діагностичному етапі [10]. Критеріями вилучення із дослідження стала наявність позапечінкового місця розвитку хвороби, ізольована абляція (радіочастотна / мікрохвильова абляція (РЧА / МХА) або поєднання абляції із резекцією печінки.
Кінцеві точки дослідження
Первинні точки: безпосередні хірургічні результати, загальна виживаність та безрецидивний період виживаності.
Вторинні точки: пошук маркерів хірургічного прогнозу ДЕР.
Захворюваність і смертність оцінювалися впродовж 90 днів після 2-го етапу втручання згідно з класифікацією Clavien — Dindo [11].
Післяопераційну печінкову недостатність, біліарну фістулу та післяопераційну кровотечу діагностували згідно з критеріями Міжнародної дослідницької групи з хірургії печінки (International Study Group of Liver Surgery — ISGLS) [12].
Контроль проводився кожні 4 міс протягом перших 3 років, потім кожні 6 міс протягом наступних 2 років, а після цього кожні 12 міс.
Проаналізовано стандартні демографічні та клініко-патологічні дані, зокрема стать, вік, інформацію про ініціальний діагноз та неоад’ювантну терапію. Зібрані характеристики первинної пухлини містили наступні дані: локалізацію, регіонарне та віддалене поширення згідно з рекомендаціями щодо встановлення стадії Американського об’єднаного комітету з онкології (American Joint Committee on Cancer — AJCC) / Міжнародного союзу по боротьбі з онкологічними захворюваннями (Union for International Cancer Control — UICC) (T, N, M). Кількість метастазів у печінку на момент встановлення діагнозу оцінювали за допомогою передопераційної візуалізації. Аналіз FLR розраховувався за допомогою об’ємної комп’ютерної томографії (КТ). Функціональні резерви печінки оцінювали за шкалами Чайлда — Туркота — П’ю і Моделі для термінальної стадії захворювання печінки (Model for End Stage Liver Disease — MELD).
Порівняння хірургічних та онкологічних результатів проводилося за допомогою відповідності дослідження «випадок–контроль». Згідно з внутрішньою політикою ДНП «Національний інститут раку» ретроспективне дослідження не потребує затвердження етичного комітету.
Хірургічна техніка
ДЕР була пріоритетною опцією в разі неможливості R0 резекції печінки та/або недостатнього об’єму FLR для проведення одноетапної стратегії. Інтраопераційна ультразвукова діагностика використовувалася під час 1-го етапу хірургічного втручання з метою виявлення та видалення внутрішньопечінкових метастазів, неідентифікованих за допомогою передопераційної візуалізації. Під час 1-го та 2-го хірургічних етапів трансекція паренхіми проводилася за допомогою методу «Clamp crushing» та супроводжувалася використанням електрохірургічного інструментарію, кліпувальних приладів, атравматичного шовного матеріалу [13]. Також ми використовували апарат (ультразвуковий деструктор-аспіратор) «CUSA». Трансекцію здійснювали в умовах інтермітивного маневру Прінгла. Після виконання 1-го етапу ДЕР проводилася переоцінка FLR та оцінка онкологічної відповіді в разі проведення інтервального хімієтерапевтичного лікування. У випадку недостатньої гіпертрофії FLR, після ПВЕ, додатково проводилася високоселекційна емболізація сегментарних гілок ворітної вени (превалююча більшість повторних емболізацій виконували у Sg 4 печінки) [14, 15]. Ми зберігали принаймні 2 або більше суміжних сегментів печінки із відповідною судинною перфузією, венозним дренуванням, функціонуючою жовчодренажною системою [16, 17]. Передопераційна системна хімієтерапія проводилася в обсязі 4–6 курсів, лімітуючись досягненням стабілізації захворювання або часткової відповіді за Cистемою критеріїв оцінки відповіді солідних пухлин (Response evaluation criteria in solid tumours — RECIST) [18].
Встановлення об’єму печінки
Оцінка пухлинного навантаження та залишкового об’єму печінки відбувалася за допомогою спеціалізованого комп’ютерного забезпечення на основі КТ-дослідження. Оцінено сумарний об’єм печінки та її залишковий об’єм без врахування пухлинного об’єму.
Розраховано FLR / TLV і FLR / BWR. Хворим проводили післяопераційний контроль за допомогою КТ приблизно через 4 тиж після 1-го етапу і повторювали кожні 2 тиж до моменту досягнення достатнього FLR. Пацієнтам призначений другий етап операції, якщо об’єм печінки досяг FLR / TLV ≥20% та/або FLR / BWR ≥0,5 для осіб із здоровою паренхімою печінки або FLR / TLV щонайменше 35–40% та/або FLR / BWR ≥0,7, якщо підтверджено ушкодження паренхіми печінки.
Статистичний аналіз
Кількісні змінні виражені як середнє ± стандартне відхилення (SD) або медіана (діапазон). Якісні змінні виражені у вигляді кількості (відсотка). Для порівняння кількісних величин у групах розподілу використовували t-тест, непараметричний тест (U-критерій Манна – Уїтні). Статистично достовірними вважали величини при p <0,05. Виживаність розраховували за методом Каплана — Меєра. Статистичний аналіз виконували, використовуючи IBM SPSS® version 25.0 (IBM, Armonk, New York, USA).
РЕЗУЛЬТАТИ
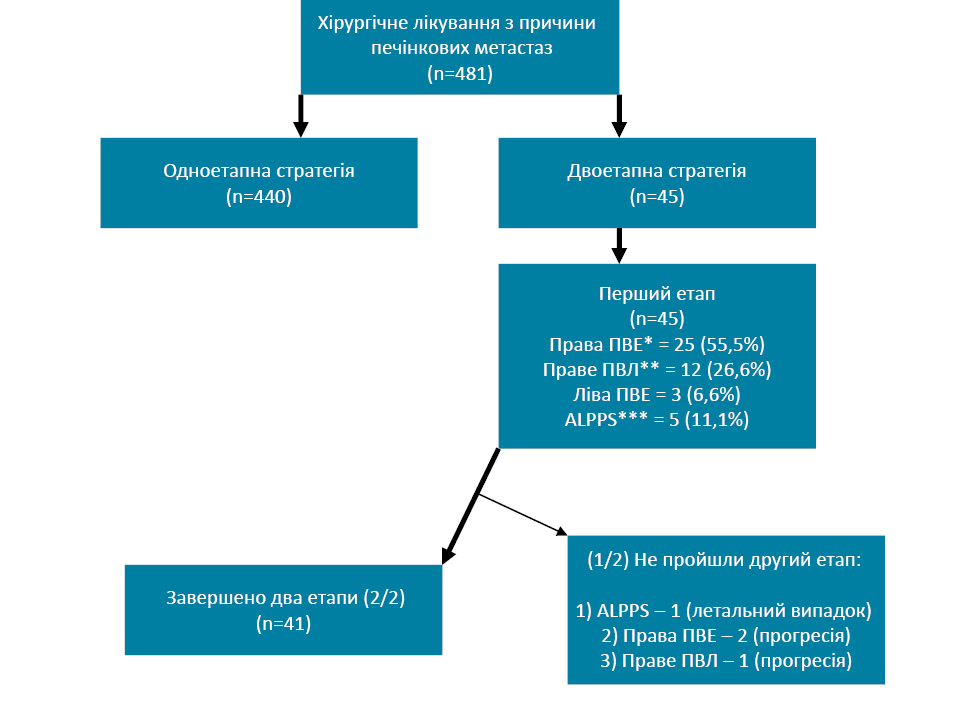
Відповідно до критеріїв залучення, у дослідженні охоплено 45 пацієнтів, проте 4 з них вибуло із дослідження з причини прогресії захворювання (7,2%) та летального випадку після 1-го етапу хірургічного лікування (2,4%). Блок-схема дослідження представлена на рис. 1.
Розподіл за статтю, віком, первинною локалізацією пухлини, регіонарним та віддаленим поширенням хвороби, неоад’ювантною системною терапією представлено в табл. 1.
| Клінічні характеристики | Двоетапна резекція |
| Стать | Чоловіки — 20 |
| Жінки — 21 | |
| Вік, років | 58 (25–75) |
| Локалізація пухлини, n (%) | |
|
6 (14,6) |
|
21 (51,2) |
|
2 (4,8) |
|
16 (39) |
| Характеристика пухлин, n (%) | |
| T1 | 0 (0,0) |
| Т2 | 3 (7,3) |
| T3 | 29 (70,7) |
| Т4 | 9 (21,9) |
| Ураження лімфатичних вузлів, n (%) | |
| N0 | 12 29,2) |
| N1 | 22 (53,6) |
| N2 | 17 (41,4) |
| Неоад’ювантна хімієтерапія | 38 (92,6) |
Гендерний розподіл пацієнтів, що увійшли в когорту досліджень: у 21 випадку були жінки (51,2%). Медіана віку становила 58 років (25–75 років).
Розподіл хворих за локалізацією первинної пухлини: права половина ободової кишки (n=6) — 14,6%, ліва половина ободової кишки (n=21) — 51,2%, поперечної ободової кишки (n=2) — 4,8% та пряма кишка (n=16) — 39%.
Згідно з TNM-AJCC (2017) розподіл первинної пухлини наступний: Т1 — (n=0), T2 — (n=3) 7,3%, T3 — (n=29) 70,7%, T4 — (n=9) 21,9%; за результатами розподілу уражень лімфатичних вузлів виявлено, що 12 пацієнтів (29,2%) мали статус N0, 22 (53,6%) — N1 і 17 (41,4%) — N2. Неоад’ювантну системну терапію проведено 38 хворим (92,6%).
Об’єм хірургічних втручань представлено в табл. 2.
| Велика резекція печінки | Двоетапна резекція |
|
28 (68,2) |
|
6 (14,6) |
|
3 (7,3) |
| ALPPS | |
|
2 (4,8) |
|
1 (2,4) |
|
1 (2,4) |
ДЕР: правобічна гемігепатектомія — 28 (68,2%), правобічна трисекціонектомія — 6 (14,6%), лівобічна трисекціонектомія — 3 (7,3%); ALPPS: правобічна гемігепатектомія — 2 (4,8%), правобічна трисекціонектомія — 1 (2,4%), лівобічна трисекціонектомія — 1 (2,4%).
Післяопераційні ускладнення та смертність
Середня тривалість перебування в стаціонарі після 1-го етапу ДЕР становила 6 діб (4–21), після 2-го етапу — 12 діб (7–61); після 1-го етапу ALPPS — 7 діб (6–9), після 2-го етапу ALPPS — 13 діб (9–17). Згідно з класифікацією Clavien — Dindo [19] серед найпоширеніших незначних (I–II ступеня) ускладнень ми виділяємо анемію І та ІІ ступеня тяжкості — n=16 (39%), затримка евакуаторної функції шлунка n=11 (26,8%), глибоку та поверхневу інфекцію післяопераційної (п/о) рани n=4 (9,7%), порушення електролітного балансу n=2 (4,8%). У 14 хворих (34,1%) після 2-го етапу хірургічного лікування проведено гемотрансфузію.
Після виконання 2-го етапу резекцію печінки без ускладнення проведено 17 пацієнтам (41,4%). У 22 пацієнтів 53,5% відмічалися ускладнення за Сlavien — Dindo ≥III, що наведені в табл. 3.
| Показники | Двоетапна резекція | ALPPS | p-value |
| Сlavien — Dindo ≥III | 19 (46,3) | 3 (7,2) | 0,02 |
| Біліарна нориця* | |||
|
1 (2,4) | 1 (2,4) | 0,01 |
|
3 (7,2) | 0 (0,0) | |
|
1 (2,4) | 0 (0,0) | |
| Печінкова недостатність* | |||
|
0 (0,0) | 1 (2,4) | |
|
3 (7,2) | 0 (0,0) | |
|
0 (0,0) | 0 (0,0) | |
| Кровотеча grade C* | 2 (4,8) | 0 (0,0) | |
| 90-денна смертність | 8 (19,5) | 2 (4,8) | 0,04 |
*Біліарна нориця, післяопераційна печінкова недостатність та післяопераційна кровотеча оцінювали за шкалою ISGLS.
Інтрагоспітальна смертність після 1-го етапу ALPPS становила 2,4%, причиною стала фульмінантна форма післяопераційної печінкової недостатності. Інтрагоспітальна смертність після 1-го етапу ДЕР становила 0 та 7,3% у пацієнтів, кому виконано 2-й етап хірургічного втручання. У першому випадку причиною смерті стала ТЕЛА магістральних гілок легеневих артерій, причиною 2-го летального випадку стала гостра серцево-судинна недостатність (трансмуральний інфаркт міокарда), причиною 3-го та 4-го летального випадку стала поліорганна недостатність на тлі сепсису. Показники смертності на 90-й день після 2-го етапу резекції печінки становлять 24,4%.
Причиною «drop-out» із досліджуваної когорти стали недосягнення відповідного об’єму FLR, прогресія захворювання, розвиток ускладнень після 1-го етапу хірургічного лікування, що унеможливлювали проведення 2-го етапу.
Виживаність
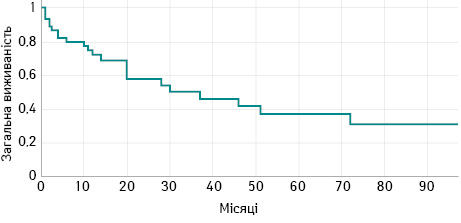
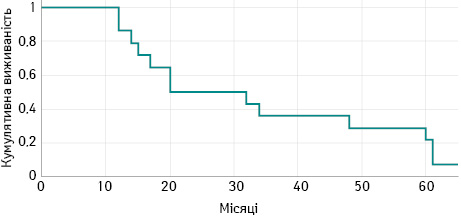
Медіана спостереження для усіх пацієнтів становила 28 міс (1–96 міс). Показник 5-річної загальної виживаності (ЗВ) становив 37±12% міс, медіана виживаності становила 30±6 міс (рис. 2). Кумулятивна 5-річна безрецидивна виживаність становить 21±5% (рис. 3). У той час як у 9,7% усіх хворих не змогли завершити 2-ге хірургічне втручання, тому вони виявилися в когорті «drop-out»і не пережили 5-річний період.
ОБГОВОРЕННЯ
Останніми трьома десятиріччями проводилися активні дебати щодо ефективності різних хірургічних стратегій лікування пацієнтів з білобарними метастазами в печінку. Наразі доведено, що резекція печінки достовірно має переваги над ізольованим використанням системного хімієтерапевтичного лікування в контексті метастатичного КРР та має показники 5-річної виживаності в діапазоні 40–58% [20–22]. Незважаючи на досвід багатьох спеціалізованих центрів у всьому світі, що повідомляють про оптимістичні короткострокові та віддалені результати, гетерогенний характер даних більшості світових наукових публікацій стимулював нас проаналізувати власні дані щодо використання цієї методики у високоспеціалізованому державному центрі в Україні. У нашому аналізі ми згрупували пацієнтів, яким виконано ДЕР та ALPPS в одну когорту, де кількість ALPPS (9,6%) була недостатньою для винесення цих осіб в окрему досліджувану когорту. Ми вважаємо таке згрупування доцільним, адже ALPPS та ДЕР є субтипами двоетапної стратегії хірургічного лікування колоректальних білобарних метастазів у печінку.
У нашому аналізі показники «upfront surgery» дорівнювали 7,4%, що відповідає схожим даним інших авторів (3,4–39,4%) [23–26]. Лише 7,2% усіх хворих отримали інтервальну хімієтерапію. Існують дослідження, які вказують на відсутність негативного впливу інтервальної хімієтерапії на гіпертрофію печінки [27, 28], проте немає даних про дослідження функціональної здатності печінки після проведення інтервального системного лікування. 92,8% усіх пацієнтів перейшли до 2-го етапу хірургічного лікування без використання інтервальної хімієтерапії. З метою попередження прогресії захворювання між етапами доцільним є скорочення часового проміжку між хірургічними етапами ДЕР, тому ALLPS має перевагу над ДЕР, адже функціональна адаптація виникає раніше тканинної гіпертрофії [29].
В отриманих нами результатах ускладнень після 2-го етапу ДЕР зафіксовано схожі референтні світові значення, у нашому аналізі цей показник відповідає 53,5%, D.A. Wicherts та співавт. (59%), але відрізняється від таких авторів, як J.M. Regimbeau та співавт. (25,1%) та S. Tsai та співавт. (25,7%) [30–32]. Таку ж відмінність між показниками 90-денної смертності (24,4%) ми виявили, порівнюючи результати D.A. Wicherts та співавт. (4,5%), S. Tsai та співавт. (5%), J.M. Regimbeau та співавт. (9,3%). Аналізуючи власні дані, ми виявили позитивну динаміку у вигляді зменшення кількості післяопераційних ускладнень, у 2015 р. вищевказані показники дорівнювали 75% та знизилися до позначки у 32% у 2023 р., ми це пов’язуємо із поліпшенням хірургічної техніки та адаптації усіх діагностично-терапевтичних служб, що залучені в процес лікування таких пацієнтів. Світові референтні показники 5-річної загальної виживаності становлять 31–50%, що схожі до нашого показника — 37% після ДЕР [33–35].
Ще однією проблемою в контексті ДЕР є активізація росту мікрометастазів під дією гіпоксичних та проангіогенних факторів, таких як ендотеліальний фактор росту (vascular endothelial growth factor — VEGF). Це може бути викликано артеріальною буферною відповіддю на ворітну венозну депривацію [35, 36]. Проте, одним зі шляхів уникнення цього ефекту є використання трансартеріальної хімієемболізації в комбінації з ПВЕ, але ця методика була вивчена в контексті гепатоцелюлярного раку та залишається недослідженою для осіб із білобарними колоректальними метастазами.
Хочемо відмітити, що хірургічне лікування в комбінації із системною поліхімієтерапією є найбільш доцільною опцією для пацієнтів із білобарними колоректальними печінковими метастазами, що достовірно підвищує безрецидивну та загальну виживаність пацієнтів. Мультидисциплінарний підхід залишається необхідною складовою для ретельного селекціонування та терапевтичного успіху. Проте з метою підвищення показників післяопераційної смертності, ускладнень та частки хворих, що не перейшли до 2-го етапу, — потрібні подальші рандомізовані дослідження для кращого встановлення критеріїв відбору пацієнтів, ролі портальної венозної депривації, передопераційної та інтервальної хімієтерапії для ДЕР та модифікованих підходів при ALPPS.
ВИСНОВКИ
ДЕР забезпечує задовільні онкологічні результати лікування пацієнтів із білобарними метастазами в печінку. Впровадження цієї методики в умовах ДНП «Національний інститут раку» дозволило підвищити показники 5-річної виживаності до рівня світових. Вважаємо, що мультидисциплінарний підхід використання двоетапної стратегії хірургічного лікування білобарних метастазів у печінку при КРР є безпечною методикою за умов дотримання сучасних стандартів у галузі хірургії печінки.
Конфлікт інтересів
Жоден з авторів статті не має конфлікту інтересів. Це дослідження виконане в межах ретроспективного аналізу.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R. L., Torre, L. A., & Jemal, A. (2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. Cancer Journal for Clinicians, 68(6), 394–424. doi: 10.3322/caac.21492.
2. Siegel, R., Naishadham, D., & Jemal, A. (2012). Cancer statistics. Cancer Journal for Clinicians, 62, 10–29. doi: 10.3322/caac.20138.
3. Turrini, O., Viret, F., Guiramand, J., Lelong, B., Bège, T., & Delpero, J. R. (2007). Strategies for the treatment of synchronous liver metastasis. European Journal of Surgical Oncology (EJSO), 33(6), 735–740. doi: 10.1016/j.ejso.2007.02.025.
4. Väyrynen, V., Wirta, E.‐V., Seppälä, T., Sihvo, E., Mecklin, J.‐P., Vasala, K., & Kellokumpu, I. (2020). Incidence and management of patients with colorectal cancer and synchronous and metachronous colorectal metastases: a population‐based study. BJS Open, 4(4), 685–692. doi: 10.1002/bjs5.50299.
5. Van der Geest, L. G. M., Lam-Boer, J., Koopman, M., Verhoef, C., Elferink, M. A. G., & de Wilt, J. H. W. (2015). Nationwide trends in incidence, treatment and survival of colorectal cancer patients with synchronous metastases. Clinical & Experimental Metastasis, 32(5), 457–465. doi: 10.1007/s10585-015-9719-0.
6. Engstrand, J., Nilsson, H., Strömberg, C., Jonas, E., & Freedman, J. (2018). Colorectal cancer liver metastases—A population-based study on incidence, management and survival. BMC Cancer, 18, 78. doi: 10.1186/s12885-017-3925-x.
7. Müller, P. C., Linecker, M., Kirimker, E. O., Oberkofler, C. E., Clavien, P. A., Balci, D. & Petrowsky, H. (2021). Induction of liver hypertrophy for extended liver surgery and partial liver transplantation: state of the art of parenchyma augmentation-assisted liver surgery. Langenbeck’s Archives of Surgery, 406, 2201–2215. doi: 10.1007/s00423-021-02148-2.
8. Brouquet, A., Abdalla, E. K., Kopetz, S., Garrett, C. R., Overman, M. J., & Eng, C. (2011). High survival rate after two-stage resection of advanced colorectal liver metastases: response-based selection and complete resection define outcome. Journal of Clinical Oncology, 29, 1083–1090. doi: 10.1200/JCO.2010.32.6132.
9. Pandanaboyana, S., Bell, R., Hidalgo, E., Toogood, G., Prasad, K. R., Bartlett, A., & Lodge, J. P. (2015). A systematic review and meta-analysis of portal vein ligation versus portal vein embolization for elective liver resection. Surgery, 157(4), 690–698. doi: 10.1016/j.surg.2014.12.009.
10. Maupoey Ibáñez, J., Montalvá Orón, E. M., Boscà Robledo, A., Camacho Ramírez, A., Hernando Sanz, A., Granero Castro, P., … López-Andújar, R. (2021). From conventional two-stage hepatectomy to ALPPS: Fifteen years of experience in a hepatobiliary surgery unit. Hepatobiliary & Pancreatic Diseases International, 20(6), 542–550. doi: 10.1016/j.hbpd.2021.08.001.
11. Dindo, D., Demartines, N., & Clavien, P. A. (2004). Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Annals of Surgery, 240(2), 205–213. doi: 10.1097/01.sla.0000133083.54934.ae.
12. Rahbari, N. N., Garden, O. J., Padbury, R., Brooke-Smith, M., Crawford, M., & Adam, R. (2011). Pos-thepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery, 149, 713–724. doi: 10.1016/j.surg.2010.10.001.
13. Aragon, R. J., & Solomon, N. L. (2012). Techniques of hepatic resection. Journal of Gastrointestinal Oncology, 3(1), 28–40. doi: 10.3978/j.issn.2078-6891.2012.006.
14. Madoff, D. C., Abdalla, E. K., Gupta, S., Wu, T. T., Morris, J. S., Denys, A., … Vauthey, J. N. (2005). Transhepatic ipsilat- eral right portal vein embolization extended to segment IV: improving hypertrophy and resection outcomes with spherical particles and coils. Journal of Vascular and Interventional Radiology, 16, 215–225. doi: 10.1097/01.RVI.0000147067.79223.85.
15. Kishi, Y., Madoff, D. C., Abdalla, E. K., Palavecino, M., Ribero, D., Chun, Y. S., & Vauthey, J. N. (2008). Is embolization of segment 4 portal veins before extended right hepatectomy justified? Surgery, 144, 744–751. doi: 10.1016/j.surg.2008.05.015.
16. Kishi, Y., Abdalla, E. K., Chun, Y. S., Zorzi, D., Madoff, D. C., Wallace, M. J., … Vauthey, J. N. (2009). Three hundred and one consecutive extended right hepatectomies: evaluation of outcome based on systematic liver volumetry. Annals of Surgery, 250, 540–548. doi: 10.1097/SLA.0b013e3181b674df.
17. Shindoh, J., Tzeng, C. W., Aloia, T. A., Curley, S. A., Zimmitti, G., Wei, S. H., Huang, S. Y., … Vauthey, J. N. (2013). Optimal future liver remnant in patients treated with extensive preoperative chemo-therapy for colorectal liver metastases. Annals of Surgical Oncology, 20, 2493–2500. doi: 10.1245/s10434-012-2864-7.
18. Therasse, P., Arbuck, S. G., Eisenhauer, E. A., Wanders, J., Kaplan, R. S., Rubinstein, L., … Gwyther, S. G. (2000). New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. Journal of the National Cancer Institute, 92(3), 205–216. doi: 10.1093/jnci/92.3.205. PMID: 10655437.
19. Wicherts, D. A., Miller, R., de Haas, R. J., Bitsakou, G., Vibert, E., Veilhan, L. A., … Adam, R. (2008). Long-term results of two-stage hepatectomy for irresectable colorectal cancer liver metastases. Annals of Surgery, 248, 994–1005. doi: 10.1097/SLA.0b013e3181907fd9.
20. Choti, M. A., Sitzmann, J. V., Tiburi, M. F., Sumetchotimetha, W., Rangsin, R., Schulick, R. D., … Cameron, J. L. (2002). Trends in long-term survival following liver resection for hepatic colorectal metastases. Annals of Surgery, 235, 759–766. doi: 10.1097/00000658-200206000-00002.
21. Abdalla, E. K., Vauthey, J.-N., Ellis, L. M., Ellis, V., Pollock, R., Broglio, K. R., … Curley, S. A. (2004). Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastases. Annals of Surgery, 239, 818–827. doi: 10.1097/01.sla.0000128305.90650.71.
22. Fernandez, F. G., Drebin, J. A., Linehan, D. C., Dehdashti, F., Siegel, B. A., & Strasberg, S. M. (2004). Five-year survival after resection of hepatic metastases from colorectal cancer in patients screened by Positron Emission Tomography with F-18 Fluorodeoxyglucose (FDG-PET). Annals of Surgery, 240, 438–450. doi: 10.1097/01.sla.0000138076.72547.b1.
23. Viganò, L., Torzilli, G., Cimino, M., Imai, K., Vibert, E., Donadon, M., & Adam, R. (2016). Drop-out between the two liver resections of two-stage hepatectomy. Patient selection or loss of chance? European Journal of Surgical Oncology, 42(9), 1385–1393. doi: 10.1016/j.ejso.2016.03.020.
24. Homayounfar, K., Liersch, T., Schuetze, G., Niessner, M., Goralczyk, A., Meller, J., … Lorf, T. (2009). Two-stage hepatectomy (R0) with portal vein ligation — towards curing patients with extended bilobular colorectal liver metastases. International Journal of Colorectal Disease, 24, 409–418. doi: 10.1007/s00384-008-0620-z.
25. Karoui, M., Vigano, L., Goyer, P., Ferrero, A., Luciani, A., Aglietta, M., … Cherqui, D. (2010). Combined first-stage hepatectomy and colorectal resection in a two-stage hepatectomy strategy for bilobar synchronous liver metastases. British Journal of Surgery, 97, 1354–1362. doi: 10.1002/bjs.7128.
26. Beal, I. K., Anthony, S., Papadopoulou, A., Hutchins, R., Fusai, G., Begent, R., … Davidson, B. (2006). Portal vein embolisation prior to hepatic resection for colorectal liver metastases and the effects of periprocedure chemotherapy. British Journal of Radiology, 79, 473–478. doi: 10.1259/bjr/29855825.
27. Goer´e, D., Farges, O., Leporrier, J., Sauvanet, A., Vilgrain, V., & Belghiti, J. (2006). Chemotherapy does not impair hypertrophy of the left liver after right portal vein obstruction. Journal of Gastrointestinal Surgery, 10, 365–370. doi: 10.1016/j.gassur.2005.09.001.
28. Uesaka, K., Nimura, Y., & Nagino, M. (1996). Changes in hepatic lobar function after right portal vein embolization. An appraisal by biliary indocyanine green excretion. Annals of Surgery, 223, 77–83. doi: 10.1097/00000658-199601000-00011.
29. Wicherts, D. A., Miller, R., de Haas, R. J., Bitsakou, G., Vibert, E., Veilhan, L. A., … Adam, R. (2008). Long-term results of two-stage hepatectomy for irresectable colorectal cancer liver metastases. Annals of Surgery, 248(6), 994–1005. doi: 10.1097/SLA.0b013e3181907fd9.
30. Tsai, S., Marques, H. P., de Jong, M. C., Mira, P., Ribeiro, V., Choti, M. A., … Pawlik, T. M. (2010). Two-stage strategy for patients with extensive bilateral colorectal liver metastases. HPB (Oxford), 12(4), 262–269. doi: 10.1111/j.1477-2574.2010.00161.x.
31. Regimbeau, J. M., Cosse, C., Kaiser, G., Hubert, C., Laurent, C., Lapointe, R., … Adam, R. (2017). Feasibility, safety and efficacy of two-stage hepatectomy for bilobar liver metastases of colorectal cancer: a LiverMetSurvey analysis. HPB (Oxford), 19(5), 396–405. doi: 10.1016/j.hpb.2017.01.008.
32. Togo, S., Nagano, Y., Masui, H., Tanaka, K., Miura, Y., Morioka, D., … Shimada, H. (2005). Two-stage hepatectomy for multiple bilobular liver metastases from colorectal cancer. Hepatogastroenterology, 52, 913–919.
33. Pamecha, V., Nedjat-Shokouhi, B., Gurusamy, K., Glantzounis, G. K., Sharma, D., & Davidson, B. R. (2008). Prospective evaluation of two-stage hepatectomy combined with selective portal vein embolisation and systemic chemotherapy for patients with unresectable bilobar colorectal liver metastases. Digestive Surgery, 25, 387–393. doi: 10.1159/000176063.
34. Chun, Y. S., Vauthey, J. N., Ribero, D., Donadon, M., Mullen, J. T., Eng, C., … Abdalla, E. K. (2007). Systemic chemotherapy and two-stage hepatectomy for extensive bilateral colorectal liver metastases: perioperative safety and survival. Journal of Gastrointestinal Surgery, 11, 1498–1504. doi: 10.1007/s11605-007-0272-2.
35. Naumov, G. N., Akslen, L. A., & Folkman, J. (2006). Role of angiogenesis in human tumor dormancy: animal models of the angiogenic switch. Cell Cycle, 5, 1779–1787. doi: 10.4161/cc.5.16.3018.
36. Yokoyama, Y., Nagino, M., & Nimura, Y. (2007). Mechanisms of hepatic regeneration following portal vein embolization and partial hepatectomy: a review. World Journal of Surgery, 31, 367–374. doi: 10.1007/s00268-006-0526-2.
Адреса для листування:
Микитюк Артем Ігорович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: mikityuk9797@gmail.com
Correspondence:
Artem Mykytyuk
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: mikityuk9797@gmail.com














Leave a comment