Дослідження впливу вільного та ліпосомального доксорубіцину на морфофункціональні характеристики клітин остеосаркоми Saos-2 при індукційній помірній гіпертермії
Орел В.Е.1, Дєдков А.Г.1, Остафійчук В.В.1, Колесник Д.Л.2, Дасюкевич О.Й.1, Рихальський О.Ю.1
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ, Україна
Резюме. Мета. Визначити особливості дії ліпосомального доксорубіцину (ЛДР) та вільного доксорубіцину (ВДР) при індукційній помірній гіпертермії (ІПГ) на морфофункціональні зміни клітин остеосаркоми людини лінії Saos-2 у дослідженнях in vitro. Об’єкт і методи. В експериментальних дослідженнях використані клітини ліній Saos-2 (ATCC HTB-85) з Клітинного банку ліній тканин людини і тварин Інституту експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України. Для ініціювання ІПГ клітини піддавалися впливу електромагнітного опромінення з частотою 42 МГц і потужністю 15 Вт протягом 30 хв. Морфофункціональні зміни клітин остеосаркоми Saos-2 під впливом ЛДР або ВДР при ІПГ досліджували методом проточної цитометрії, під час якої аналізували кількісні зміни показників прямого (FSC-A) та бокового розсіювання світла (SSC-A) клітинами. Стратегія гейтування під час цитометричного дослідження полягала у виділенні популяції мінімально пошкоджених клітин, виключенні клітинного дебрису на дот-плоті (Dot Plot) FSC-A/SSC-A та виключенні з аналізу дуплетів за допомогою дот-плоту FSC-A/FSC-H. Для кожного зразка проаналізовано не менше 25 000 подій. Аналіз отриманих даних проводили за допомогою програми CytExpert for DxFlex. Результати. Вплив ВДР зумовлював збільшення розміру клітин на 30% (р <0,05), а ЛДР — на 26% (р <0,05) порівняно з контрольною групою. Самостійний вплив ІПГ призводив до незначного, але статистично достовірного (на 1,5%, р <0,05) збільшення розміру клітин порівняно з контрольною групою. У групах, де використовували комбіновану дію ІПГ з ВДР, спостерігалося збільшення розміру клітин Saos-2 на 6% (р <0,05) порівняно з самостійною дією ВДР окремо і на 39% (р <0,05) відносно самостійного впливу ІПГ. У відповідь на вплив ЛДР з ІПГ зафіксовано збільшення розміру клітин щодо самостійного впливу ІПГ на 24% (р <0,05). У результатах аналізу змін гранулярності клітин зафіксовано, що вона зростала під впливом ВДР та ЛДР на 103% (р <0,05) та 97% (р <0,05) стосовно групи контролю відповідно. Самостійний вплив ІПГ підвищував гранулярність клітин остеосаркоми на 21,4% (р <0,05) порівняно з контрольною групою. Комплексний вплив препаратів з ІПГ спричиняв незначне, але статистично достовірне (р <0,05) збільшення гранулярності клітин на 6% лише у випадку ВДР. Вплив ЛДР самостійно та поєднано з ІПГ спричиняв менше збільшення розмірів та гранулярності клітин Saos-2, ніж ВДР самостійно чи в комбінації з ІПГ на 3% (р <0,05) та 7% (р <0,05) відповідно. Висновки. Встановлено, що поєднана дія ІПГ та ВДР має більший вплив на збільшення розміру та гранулярності клітин Saos-2, ніж самостійний вплив ВДР. Окремий вплив ЛДР та ЛДР у комбінації з ІПГ призводив до меншого збільшення розмірів та гранулярності клітин Saos-2, ніж ВДР самостійно або поєднано з ІПГ, що, ймовірно, зумовлене реалізацією більш високої цитотоксичної дії ВДР. Самостійний вплив ІПГ також призводив до збільшення розмірів та підвищення гранулярності клітин Saos-2 порівняно з контрольною групою.
Одержано 30.05.2024
Прийнято до друку 4.06.2024
DOI: 10.32471/clinicaloncology.2663-466X.54-2.32660
ВСТУП
Захворюваність на первинні злоякісні новоутворення кісток в Україні становить 1,2 випадку на 100 тис. населення. Незважаючи на те що це число майже не збільшувалося за останні 10 років, рівень смертності від саркоми кісток (СК) залишається високим. Серед хворих на остеогенну саркому і саркому Юїнга, які пройшли комбіноване лікування, межу в 5 років переживає 50–65%, а протягом 1-го року помирає 30% усіх хворих [1]. Основним методом лікування хворих на СК високого ступеня злоякісності є комбінація хіміотерапевтичного із застосуванням ВДР та хірургічного лікування [2, 3]. У 30% усіх випадків після проведеної інтенсивної хіміотерапії та хірургічної резекції можуть розвиватися віддалені метастази [4].
Для підвищення ефективності хіміотерапії злоякісних пухлин у якості сучасних лікарських форм хіміотерапевтичних агентів застосовують ЛДР, що міститься в пегільованих ліпосомальних наносферах. Завдяки цьому він довше циркулює в кровотоці та, як результат, більша кількість препарату досягає злоякісних клітин. У низці клінічних досліджень встановлено, що ЛДР проявляє нижчий ризик кардіотоксичності, що є поширеним побічним ефектом прийому ВДР [5]. Незважаючи на перспективи застосування ЛДР при лікуванні СК, усе ще існують проблеми щодо його клінічного застосування, які можна звести до зниження його проникних здібностей у тканини пухлини у випадку великих пухлин та можливість викликати хіміорезистентність [6].
Останніми роками зафіксовано, що неоад’ювантна хіміотерапія в поєднанні з регіонарною гіпертермією при місцево-поширених первинних саркомах або таких у стані рецидиву підвищує виживаність хворих [7]. У якості одного з таких методичних підходів використовують ІПГ. Вважається, що цей підхід може посилити протипухлинні ефекти доксорубіцину завдяки вибірковому підвищенню поглинання препарату пухлиною та зменшення вираженості системних побічних ефектів, зокрема кардіотоксичності [8–10]. Найбільш поширеними обмеженнями гіпертермії є ініціація синтезу білків теплового шоку, що може сприяти інвазивності пухлин, метастазуванню, блокуванню апоптозу або появі хіміорезистентності та загальній непереносимості підвищених температур деякими пацієнтами [11, 12].
Клітини остеосаркоми Saos-2 зазвичай використовуються як модель дослідження злоякісних новоутворень кісток in vitro для біологічної оцінки їхніх змін під впливом ВДР та ЛДР [13]. Однак на сьогодні все ще обмежені наукові докази щодо прямого впливу ІПГ самостійно чи поєднано з ЛДР або ВДР на морфофункціональні показники клітин лінії Saos-2.
МЕТА
Визначити особливості дії ЛДР або ВДР при ІПГ на морфофункціональні зміни клітин остеосаркоми людини лінії Saos-2 у дослідженнях in vitro.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
В експериментальних дослідженнях використані клітини ліній Saos-2 (ATCC HTB-85) із Клітинного банку ліній з тканин людини і тварин Інституту експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України. Клітини культивували в поживному середовищі DMEM/F12 (Sigma-Aldrich, Німеччина) з 10% фетальної сироватки теляти (ФСТ) (Sigma-Aldrich, Німеччина) і Antibiotic-Antimycotic (Sigma-Aldrich, США). Клітини культивували в пластиковому посуді для культури клітин (TPP, Швейцарія) у зволоженій атмосфері при 5% СО2 і 37 °С. Зміну середовища і пересів клітин проводили за стандартною методикою. Клітини пересівали після досягнення ними 90% моношару за допомогою розчину трипсин-EDTA (Sigma-Aldrich, Німеччина).
У дослідженні використовували ВДР «Ебеве Фарма» (Австрія) та ЛДР (Dr. Reddy’s Natco Pharma Ltd, Індія). У раніше опублікованих результатах нашого дослідження встановлено, що IC50 для ВДР дорівнювала 0,06 мкг/мл, а для ЛДР — 1,8 мкг/мл [14].
Для ініціювання ІПГ клітини піддавалися впливу електромагнітного опромінення з частотою 42 МГц і потужністю 15 Вт протягом 30 хв. Максимальне значення індукції магнітного поля (В) становило 500 мкТл, а максимальне значення напруженості електричного поля (Е) — 564 В/м. Температура не перевищувала 41,85 °С по краях чашки Петрі з клітинами Saos-2, а в її центрі вона становила 41,23 °С.
Клітини Saos-2 висаджували в чашки Петрі d=35 мм у концентрації 1,5•105 клітин/чашку в середовищі DMEM/F12 з додаванням 10% фетальної сироватки та Antibiotic-Antimycotic. Клітини культивували 24 год за стандартних умов (5% СО2, 100% вологість, 37 °С), після чого у відповідні чашки згідно зі схемою експерименту додавали ВДР (0,06 мкг/мл) або ЛДР (1,8 мкг/мл) та одразу після внесення препарату клітини відповідної групи піддавали дії електромагнітного опромінення. У якості контролю використовували клітини, до яких не додавали доксорубіцин і не проводили опромінення. Далі клітини інкубували ще 48 год за стандартних умов. Через 2 доби поживне середовище відбирали, клітини знімали із субстрату розчином трипсин-EDTA. Клітини центрифугували при 400 g протягом 10 хв. Відбирали надосад та промивали клітини 2 рази у 5 мл фосфатно-сольового буфера (Sigma-Aldrich, Німеччина) і знову центрифугували. Після промивання надосад декантували, а клітини ресуспендували в 500 мкл фосфатно-сольового буфера та аналізували за допомогою проточного цитофлуориметра DxFlex (Beckman Coulter). У межах проточної цитофлюориметрії досліджували кількісні зміни показника прямого розсіювання світла клітинами (FSC-A) та показника бокового розсіювання світла клітинами (SSC-A). Показник FSC-A характеризує розмір клітин, а показник SSC-A — комплексність структури клітин та їх гранулярність. Показник посилення (gain) для каналу FSC-A становив 20, а для каналу SSC-A — 50. Для кожної групи клітин дослідження проводили в 3 повторах. Стратегія гейтування під час цитометричного дослідження полягала у виділенні популяції мінімально пошкоджених клітин, виключенні клітинного дебрису на дот-плоті FSC-A/SSC-A та видаленні з аналізу дуплетів за допомогою дот-плоту FSC-A/FSC-H. Для кожного зразка проаналізовано не менше 25 000 подій. Аналіз отриманих даних проводили за допомогою програми CytExpert for DxFlex.
РЕЗУЛЬТАТИ ТА ОБГОВОРЕННЯ
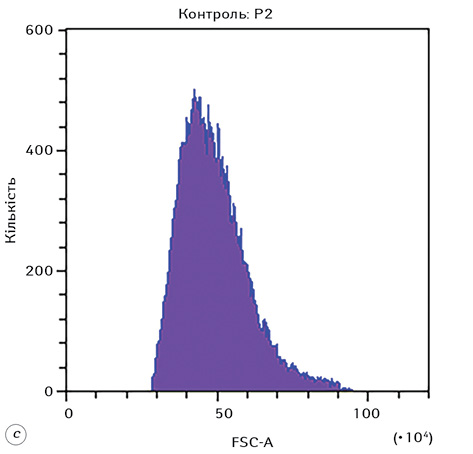
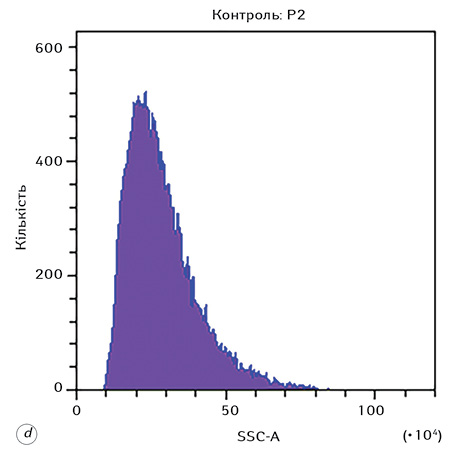
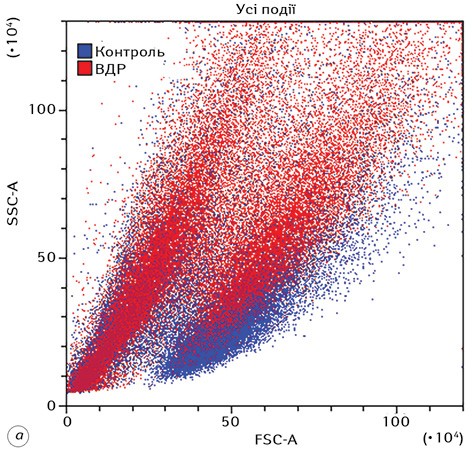
На рис. 1 наведено стратегію гейтування, яка використовувалася при дослідженні морфофункціональних показників клітин Saos-2 в експерименті. Представлено гейтування цільової популяції клітин (гейт Р1), проведення дискримінації дуплетів (гейт Р2), а також гістограми розподілу клітин за розміром та гранулярністю.
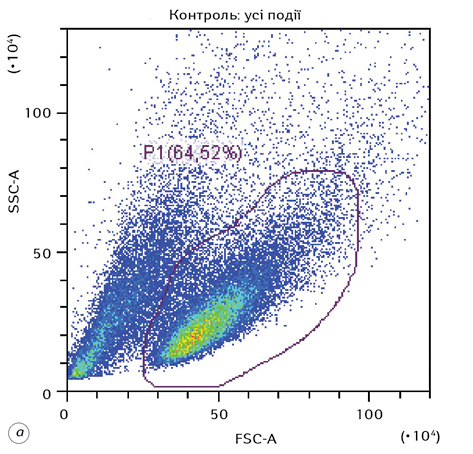
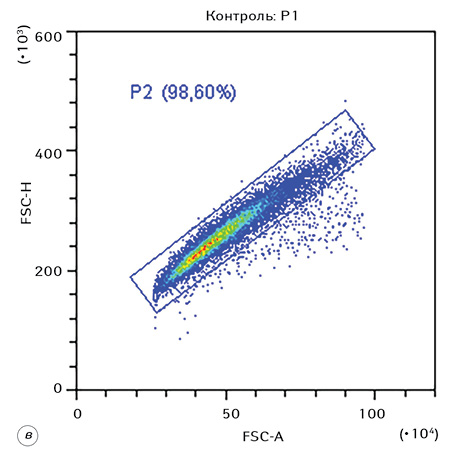
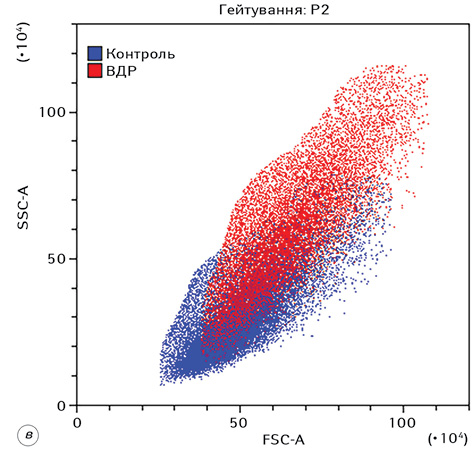
Комплексний вплив ВДР або ЛДР і ІПГ зумовлював суттєві зміни морфофункціональних характеристик клітин Saos-2. Для наочності на рис. 2 наведено накладений дот-плот FSC-A/SSC-A контрольних клітин (сині крапки) та клітин після дії ВДР (червоні крапки).
Гістограми розподілу FSC-A та SSC-A для всіх експериментальних груп наведено на рис. 3. З отриманих даних можна зробити висновок, що дія різних форм доксорубіцину на клітини Saos-2 призводить до суттєвого збільшення їх розміру та гранулярності, що, зі свого боку, зумовлено цитотоксичною дією відповідного хіміотерапевтичного агента.
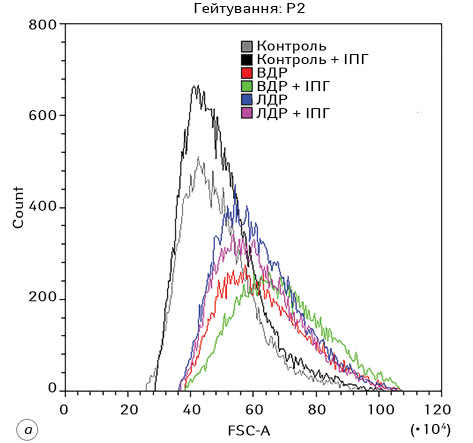
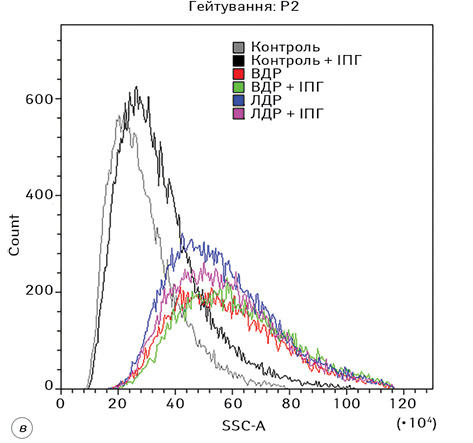
Результати статистичного аналізу комплексного впливу ВДР або ЛДР з ІПГ на морфофункціональні характеристики клітин остеосаркоми представлені на рис. 4. За допомогою аналізу змін розмірів клітин зафіксовано, що дія ВДР призводила до збільшення розміру клітин на 30% (р <0,05), а ЛДР — на 26% (р <0,05) порівняно з контрольною групою. Самостійний вплив ІПГ зумовлював незначне, але статистично достовірне (на 1,5%, р <0,05) збільшення розміру клітин порівняно з контрольною групою. У групах, де застосовували комбіновану дію ІПГ з ВДР, спостерігалося збільшення розміру клітин Saos-2 на 8% (р <0,05) порівняно із самостійною дією ВДР і на 39% (р <0,05) відносно самостійного ефекту ІПГ. У відповідь на дію ЛДР поєднано з ІПГ зафіксовано збільшення розміру клітин стосовно самостійної дії ІПГ на 24% (р <0,05).
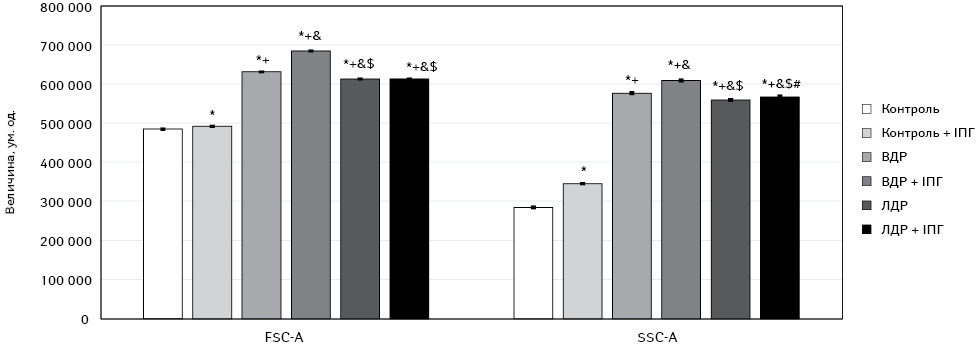
У результатах аналізу змін гранулярності клітин встановлено, що вона зростала під впливом ВДР та ЛДР на 103% (р <0,05) та 97% (р <0,05) щодо групи контролю відповідно. Самостійний ефект ІПГ підвищував гранулярність клітин остеосаркоми на 21,4% (р <0,05) порівняно з групою контролю. Комплексна дія препаратів з ІПГ чинила незначне (на 6%), але статистично достовірне (р <0,05) підвищення гранулярності клітин лише у випадку ВДР.
Дія ЛДР самостійно та поєднано з ІПГ чинила менш виражене збільшення розмірів і підвищення гранулярності клітин Saos-2, аніж ВДР самостійно або в комбінації з ІПГ (на 3% та 7% відповідно (р <0,05)).
У дослідженні виявлено, що обидві лікарські форми доксорубіцину та ІПГ впливали на морфофункціональні показники клітин остеосаркоми людини лінії Saos-2, змінюючи їхній розмір та гранулярність. Збільшення розмірів клітин Saos-2 під дією ВДР і ЛДР може бути зумовлене порушеннями проникності плазматичної мембрани клітин остеосаркоми або дією препаратів на просування клітин за фазами клітинного циклу [15]. Зростання гранулярності клітин Saos-2 можна розглядати як наслідок токсичної дії доксорубіцину або результат активації захисної аутофагії в злоякісних клітинах, що проявляється в значному збільшенні кількості внутрішньоклітинних аутофагосом та аутофаголізосом [16].
Розміри та гранулярність клітин Saos-2 у групах, де досліджувалася самостійна дія ВДР, були більшими, ніж у групах, де вивчалася дія ЛДР. Цей ефект, на нашу думку, міг бути зумовлений реалізацією більш високої цитотоксичної дії ВДР. Різницю в результатах, отриманих для різних форм препарату при поєднанні з ІПГ, можна пояснити тим, що основним протипухлинним агентом у всіх експериментах був доксорубіцин, який сприяє перевантаженню мітохондріального заліза шляхом окиснювально-відновного циклу між іонами Fe2+ і Fe3+. Окиснювально-відновні реакції за участю заліза індукують продукцію токсичних вільних радикалів за допомогою реакцій Фентона і Габера — Вейса [17]. Іони заліза мають магнітні властивості та можуть взаємодіяти з електромагнітним випромінюванням [18]. Поглинаючи енергію електромагнітного поля при проведенні ІПГ, іони заліза ініціюють як теплові, так і нетеплові ефекти. Теплові ефекти можуть індукувати коливання типу броунівського руху під дією зовнішнього змінного електромагнітного поля і в такий спосіб призводити до апоптозу шляхом підвищення температури пухлинних клітин до ~42 °С. Нетеплові магнітохімічні ефекти електромагнітних полів пов’язані з триплетно-синглетними спіновими переходами у вільнорадикальних парах. Залізо, наявне в злоякісних клітинах, спричиняє ініціацію процесів апоптозу та некрозу, діючи як джерело активних форм кисню в мітохондріях [19]. Особливості в ефектах комбінованого впливу різних форм доксорубіцину в комбінації з ІПГ на морфофункціональні характеристики можуть бути зумовлені тим, що ЛДР містить ліпіди з ланцюгами жирних кислот, які схильні до окиснення активними формами кисню [20], та можуть спричиняти виникнення зареєстрованих ефектів.
Методика проточної цитометрії, використана в цьому дослідженні, є ефективним засобом для аналізу навіть незначних кількісних змін у морфофункціональних характеристиках пухлинних клітин після хіміотерапевтичного лікування, хоча і надає обмежену інформацію щодо внутрішньоклітинних структур. Важливо зазначити, що морфологічні зміни є лише одним з аспектів оцінки відповіді на хіміотерапію. Більш широка інтерпретація цих змін потребує всебічного аналізу та врахування не тільки морфологічних змін, але й молекулярних та генетичних реакцій клітин на хіміотерапію [21], що є метою наступного етапу дослідження.
ВИСНОВКИ
У дослідженні виявлено, що вільна та ліпосомальна форми доксорубіцину й ІПГ впливали на морфофункціональні показники клітин остеосаркоми людини лінії Saos-2, змінюючи їх розмір та гранулярність. Самостійний вплив ІПГ ініціював збільшення на 1,5% (р <0,05) розмірів та підвищення гранулярності клітин Saos-2 на 21,4% (р <0,05) порівняно з контрольною групою. Під впливом ВДР та ЛДР гранулярність клітин Saos-2 зростала на 103% (р <0,05) та 97% (р <0,05) відносно групи контролю відповідно. При комбінованій дії ІПГ та ВДР встановлено збільшення на 8% (р <0,05) розмірів та на 6% (р <0,05) гранулярності клітин Saos-2 порівняно із самостійним впливом ВДР. Самостійний вплив ЛДР, а також у комбінації з ІПГ, ініціював менш виражене збільшення розмірів та гранулярності клітин Saos-2, аніж ВДР. Збільшення розмірів клітин Saos-2 під дією препаратів ВДР і ЛДР може бути зумовлене порушеннями проникності плазматичної мембрани клітин остеосаркоми або впливом препаратів на просування клітин за фазами клітинного циклу. Зростання гранулярності клітин Saos-2 можливо розглядати як наслідок токсичної дії доксорубіцину або результат активації в злоякісних клітинах захисної аутофагії, що проявляється в значному збільшенні кількості внутрішньоклітинних аутофагосом та аутофаголізосом.
Конфлікт інтересів: автори заявляють про відсутність конфлікту інтересів.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2023). Рак в Україні, 2021–2022. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. (Vol. 24). Кропивницький: Поліум.
2. Smrke, A., Anderson, P. M., Gulia, A., Gennatas, S., Huang, P. H., & Jones, R. L. (2021). Future Directions in the Treatment of Osteosarcoma. Cells, 10(1), 172. doi: 10.3390/cells10010172.
3. Wagner, M. J., Livingston, J. A., Patel, S. R., & Benjamin, R. S. (2016). Chemotherapy for Bone Sarcoma in Adults. Journal of Oncology Practice, 12(3), 208–216. doi: 10.1200/jop.2015.
4. Meyers, P. A., Heller, G., Healey, J., Huvos, A., Lane, J., Marcove, R., … Rosen, G. (1992). Chemotherapy for nonmetastatic osteogenic sarcoma: the Memorial Sloan-Kettering experience. Journal of Clinical Oncology, 10(1), 5–15. doi: 10.1200/jco.1992.10.1.5.
5. Trucco, M. M., Meyer, C. F., Thornton, K. A., Shah, P., Chen, A. R., Wilky, B. A., … Loeb, D. M. (2018). A phase II study of temsirolimus and liposomal doxorubicin for patients with recurrent and refractory bone and soft tissue sarcomas. Clinical Sarcoma Research, 8(1). doi: 10.1186/s13569-018-0107-9.
6. Giordano, F., Lenna, S., Rampado, R., Brozovich, A., Hirase, T., Tognon, M. G., … Taraballi, F. (2021). Nanodelivery Systems Face Challenges and Limitations in Bone Diseases Management. Advanced Therapeutics, 4(12), 2100152. doi: 10.1002/adtp.202100152.
7. Veltsista, P. D., Oberacker, E., Ademaj, A., Corradini, S., Eckert, F., Flörcken, A., … Ghadjar, P. (2023). Hyperthermia in the treatment of high-risk soft tissue sarcomas: a systematic review. International Journal of Hyperthermia, 40(1), 2236337. doi: 10.1080/02656736.2023.2236337.
8. Tsang, Y.-W., Chi, K.-H., Huang, C.-C., Chi, M.-S., Chiang, H.-C., Yang, K.-L., … Wang, Y.-S. (2019). Modulated electro-hyperthermia-enhanced liposomal drug uptake by cancer cells. International Journal of Nanomedicine, 14, 1269–1279. doi: 10.2147/ijn.s188791.
9. Nitica, S., Fizesan, I., Dudric, R., Loghin, F., Lucaciu, C. M., & Iacovita, C. (2022). Doxorubicin Loaded Thermosensitive Magneto-Liposomes Obtained by a Gel Hydration Technique: Characterization and In Vitro Magneto-Chemotherapeutic Effect Assessment. Pharmaceutics, 14(11), 2501. doi: 10.3390/pharmaceutics14112501.
10. Dvorak, J., Zoul, Z., Melichar, B., Petera, J., Vesely, P., Vosmik, M., & Dolezel, M. (2004). Liposomal Doxorubicin Combined with Regional Hyperthermia: Reducing Systemic Toxicity and Improving Locoregional Efficacy in the Treatment of Solid Tumors. Journal of Chemotherapy, 16(5), 34–36. doi: 10.1080/1120009x.2004.11782380.
11. Al-Jamal, W. T., & Kostarelos, K. (2022). Mild hyperthermia accelerates doxorubicin clearance from tumour-extravasated temperature-sensitive liposomes. Nanotheranostics, 6(3), 230–242. doi: 10.7150/ntno.61280.
12. Yang, K.-L., Huang, C.-C., Chi, M.-S., Chiang, H.-C., Wang, Y.-S., Hsia, C.-C., … Chi, K.-H. (2016). In vitro comparison of conventional hyperthermia and modulated electro-hyperthermia. Oncotarget, 7(51), 84082–84092. doi: 10.18632/oncotarget.11444.
13. Haghiralsadat, F., Amoabediny, G., Sheikhha, M., Forouzanfar, T., Mohammadnejad, A. J., Helder, M. N., & Zandieh-doulabi, B. (2017). A novel approach on drug delivery: investigation of a new nano-formulation of liposomal doxorubicin and biological evaluation of entrapped doxorubicin on various osteosarcoma cell lines. Cell Journa, 19(1), 55–65. doi: 10.22074/cellj.2017.4502.
14. Orel, V. E., Diedkov, A. G., Ostafiichuk, V. V., Lykhova, O. O., Kolesnyk, D. L., Orel, V. B., … Prosvietova, A. B. (2024). Combination Treatment with Liposomal Doxorubicin and Inductive Moderate Hyperthermia for Sarcoma Saos-2 Cells. Pharmaceuticals, 17(1), 133. doi: 10.3390/ph17010133.
15. Christowitz, C., Davis, T., Isaacs, A., van Niekerk, G., Hattingh, S., & Engelbrecht, A.-M. (2019). Mechanisms of doxorubicin-induced drug resistance and drug resistant tumour growth in a murine breast tumour model. BMC Cancer, 19(1), 757. doi: 10.1186/s12885-019-5939-z.
16. McGuirk, S., Audet-Delage, Y., Annis, M. G., Xue, Y., Vernier, M., Zhao, K., … St-Pierre, J. (2021). Resistance to different anthracycline chemotherapeutics elicits distinct and actionable primary metabolic dependencies in breast cancer. eLife, 10, e65150. doi: 10.7554/elife.65150.
17. Ichikawa, Y., Ghanefar, M., Bayeva, M., Wu, R., Khechaduri, A., Prasad, S. V. N., … Ardehali, H. (2014). Cardiotoxicity of doxorubicin is mediated through mitochondrial iron accumulation. Journal of Clinical Investigation, 124(2), 617–630. doi: 10.1172/jci72931.
18. Zhen, C., Zhang, G., Wang, S., Wang, J., & Shang, P. (2024). Electromagnetic fields regulate iron metabolism in living organisms: A review of effects and mechanism. Progress in Biophysics and Molecular Biology, 188, 43–54. doi: 10.1016/j.pbiomolbio.2024.03.001.
19. Santini, S. J., Cordone, V., Falone, S., Mijit, M., Tatone, C., Amicarelli, F., & Di Emidio, G. (2018). Role of Mitochondria in the Oxidative Stress Induced by Electromagnetic Fields: Focus on Reproductive Systems. Oxidative Medicine and Cellular Longevity, 2018, 5076271. doi: 10.1155/2018/5076271.
20. Rideau, E., Dimova, R., Schwille, P., Wurm, F. R., & Landfester, K. (2018). Liposomes and polymersomes: a comparative review towards cell mimicking. Chemical Society Reviews, 47(23), 8572–8610. doi: 10.1039/c8cs00162f.
21. Catitti, G., De Fabritiis, S., Brocco, D., Simeone, P., De Bellis, D., Vespa, S., … Lanuti, P. (2022). Flow Cytometry Detection of Anthracycline-Treated Breast Cancer Cells: An Optimized Protocol. Current Issues in Molecular Biology, 45(1), 164–174. doi: 10.3390/cimb45010013.
Адреса для листування:
Орел Валерій Еммануїлович
03022, м. Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: valerii.orel@unci.org.ua
Correspondence:
Valeriy Orel
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: valerii.orel@unci.org.ua














Leave a comment