CУЧАСНІ АСПЕКТИ ДІАГНОСТИКИ ПЕРВИННОГО ТА МЕТАСТАТИЧНОГО РАКУ ПЕЧІНКИ
Головко Т.С., Лаврик Г.В., Шевчук Л.А., Халілеєв О.О., Колеснік О.О., Лукашенко А.В., Бокай О.О., Руда Л.В.
Резюме. Проведено комплекс променевих методів дослідження, а саме: ультразвукове (УЗ) дослідження та спіральну комп’ютерну томографію (СКТ) у пацієнтів із первинним та метастатичним раком печінки. Застосування комплексу УЗ-методик для діагностики пухлин печінки дозволило отримати широку та повноцінну інформацію про структуру пухлини, розміри, розміщення у печінці, визначити наявність інвазії в судини та оцінити гемодинамічні порушення. Розроблено та впроваджено протокол СКТ-дослідження із застосуванням внутрішньовенного болюсного контрастування, оцінено результати в різні фази сканування. У результаті проведеної роботи проаналізовано та систематизовано найбільш інформативні та специфічні УЗ- та КТ-ознаки при злоякісних пухлинах печінки. Застосування комплексу УЗ- та КТ-досліджень дозволило уточнити розповсюдженість пухлини у печінці та за її межами, виявити наявність оклюзії, встановити її рівень та в цілому провести стадіювання злоякісного процесу.
 ВСТУП
ВСТУП
Розвиток сучасної діагностичної апаратури, широке її впровадження в провідних діагностичних та лікувальних центрах світу сприяло значному підвищенню рівня виявлення патології печінки. Але кількість діагностованих патологічних новоутворень збільшилася переважно за рахунок злоякісних пухлин. Своєчасна й точна діагностика злоякісних пухлин печінки — актуальна проблема сучасної клінічної онкогепатології [2].
Серед усіх первинних пухлин печінки частка гепатоцелюлярної карциноми (ГЦК) становить 85–90%. За даними ВООЗ, ГЦК входить до переліку 130 основних причин захворюваності та смертності населення, що потребують розробки та реалізації масштабних програм профілактики та лікування. Рак печінки (РП) посідає 6-те місце серед найбільш розповсюджених пухлин і 3-тє місце — серед причин онкологічної смертності. Захворюваність на РП в світі становить 560 тис., а смертність — до 550 тис. випадків на рік [1, 4, 10].
В Україні, за даними Національного канцер-реєстру, показник захворюваності на РП та позапечінкових жовчних проток упродовж останніх 3 років становив 2,4 випадку на 100 тис. чоловічого та 2,7 — жіночого населення, а показники смертності відповідно 3,9 та 2,2 на 100 тис. [16].
У 80% випадків РП розвивається на тлі цирозу різної етіології, у першу чергу вірусної. Також до хімічних етіологічних чинників відносять афлатоксин, продукти метаболізму алкоголю, оральні контрацептиви.
Численні посилання на джерела інформації щодо лікування первинного раку печінки (ПРП) демонструють досить суперечливі досягнуті результати, але радикальним однозначно є тільки хірургічний метод. Однак тільки у 20% пацієнтів можливе виконання операції. У більшості хворих застосовують куративні паліативні методи лікування, спрямовані на досягнення стабілізації чи часткової регресії пухлинного осередку в печінці. Стандартів терапевтичного лікування не розроблено, а курси поліхіміотерапії (ПХТ) призначають з урахуванням результатів клінічних та діагностичних досліджень [5, 14].
На момент встановлення діагнозу майже 20% онкологічних хворих мають метастатичне ураження печінки, у 50% метастази (МТС) виникають упродовж клінічного перебігу захворювання. У половини хворих причиною смерті є саме МТС в печінку за відсутності ураження пухлинним процесом інших органів.
Існує значний відсоток хворих на РП та метастатичне ураження печінки. Стрімкий перебіг захворювання, коротка тривалість життя, незадовільні результати лікування визначають актуальність проблеми, потребують практичного удосконалення існуючих та пошуку нових методів діагностики та лікування.
Аналіз наукових публікацій свідчить про широке застосування в клінічних умовах сучасних променевих методів дослідження (цифрова рентгенографія, ультразвукове дослідження (УЗД), спіральна комп’ютерна томографія (СКТ), магнітно-резонансна томографія (МРТ), однофотонна емісійна томографія (ОФЕКТ), позитронна емісійна томографія (ПЕТ). Впровадження нових методик променевої діагностики відкрило якісно нові перспективи для раннього та точного виявлення злоякісних новоутворень. СКТ, за рекомендаціями ВООЗ (з 2002 р.), доцільно застосовувати в якості методу стадіювання злоякісного процесу, а також для оцінки ефективності призначеного лікування [3, 9, 11, 12].
Сучасні вимоги до діагностичних радіологічних технологій потребують не тільки досягнення максимальної інформативності, а й максимального зниження променевого навантаження.
Цілком адекватним методом із цієї точки зору є застосування комплексу ультразвукових методик — як одного з найперспективніших напрямків, що розвивається в діагностичній радіології останнім часом. Ультразвукова апаратура останнього покоління пропонує цілий ряд додаткових режимів дослідження: кольорове допплерівське картування (КДК), енергетичне допплерівське картування (ЕДК), тканинну гармоніку, тривимірну реконструкцію, які дозволяють одержувати більш достовірне зображення тонких структур і судин, наочно відображати їхнє просторове розташування, взаємодію [6, 8].
За даними літератури показники чутливості та специфічності становлять від 78 до 93 % відповідно. Метод давно є традиційним при дослідженнях печінки, оскільки дозволяє виявити новоутворення, оцінити розміри, структуру і на перших етапах провести диференційну діагностику між злоякісним та доброякісним новоутворенням [7].
Комплексне УЗД для діагностики новоутворень печінки — це методика, що може бути додатковою, та яку застосовують у проміжках між обов’язковим виконанням СКТ чи МРТ. Деякі нюанси результатів УЗД впливають на обрану тактику лікування із подальшою її зміною [4, 6, 7, 8, 15].
Застосування СКТ для діагностики новоутворень печінки має суттєві переваги: у визначенні розміру пухлини, уточненні локалізації в печінці (з точною інтерпретацією ураження секторів (сегментів))А; взаєморозміщенні із прилеглими органами та нервово-судинними магістралями; у дослідженні складних анатомічних зон та виявлення МТС в інших органах — для стадіювання процесу. Точність СКТ у визначенні стану інвазії у магістральні судини, що проходять через чи поблизу об’ємних новоутворень, становить до 88,5–95,8% і залишається «золотим стандартом» у діагностиці МТС у легені (перевищуючи точність рентгенографії на 70–80%) та печінку (на 80–90%) [13, 17].
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Проведено обстеження пацієнтів із ПРП та МТС у печінку, що консультувалися та лікувалися у Національному інституті раку у 2000–2011 рр. та проаналізовано результати досліджень (проспективний аналіз). Дослідження проведено в обсязі комплексного УЗД із застосуванням методик в стандартних режимах сканування (В-режим), КДК, ЕДК та в спектральному допплерівському режимі.
Для виявлення гемодинамічних порушень у печінці були визначені параметри кровотоку у ворітній вені (ВВ) та загальній печінковій артерії (ЗПА), що характеризують артеріальне та портальне русло печінки.
Для кількісної оцінки допплерівських спектрів у ЗПА використовували наступні параметри: максимальну швидкість потоку Vmax (см/с), мінімальну швидкість кровотоку Vmin (cм/с), середню швидкість кровотоку Vmean (см/с), oб’ємну швидкість кровотоку Vvol (мл/хв). Для дослідження коровотоку по портальній вені реєстрували Vmean (см/с), Vvol (мл/хв).
СКТ-дослідження виконані із застосуванням внутрішньовенного болюсного підсилення з урахуванням фазності контрастування. У якості підсилення використано йодовмісний контрастний препарат із розрахунку 1,5–2 мл на 1 кг маси тіла пацієнта зі швидкістю введення 3–4 мл/с та переслідувач болюсу (40–60 мл ізотонічного розчину NaCl). Виконання КТ-ангіографії судин печінки передбачало застосування режимів болюс-трек, тест-болюс та синхронний старт.
Подальша обробка результатів СКТ-досліджень передбачала реконструкцію зображень зони інтересу з побудовою мультипланарних та тривимірних реконструкцій (MPR, MIP, SSD).
Ультразвукову та СКТ-семіотику зіставлено з клінічним перебігом хвороби та даними морфологічного дослідження.
При виконанні комплексного УЗД оцінювали кількість новоутворень, їх розміри, структуру, зв’язок із судинним та жовчевим руслами печінки, а також показники допплерометричних досліджень.
Виконання СКТ передбачало уточнення локалізації пухлини в печінці (з точною інтерпретацією ураження секторів (сегментів), вирахування площі ураження та виявлення МТС в інших органах — для стадіювання процесу.
Оцінку результатів УЗД та СКТ проводили візуально та за даними реконструйованих аксіальних, фронтальних та сагітальних проекцій.
Статистичну обробку отриманих результатів досліджень проведено із використанням Exel (MS Office 2003, XP) та програми STATISTICA 6.0.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Результати УЗД
При УЗД у всіх хворих із ПРП виявили новоутворення вузлового характеру, неоднорідної структури, з нерівними чіткими контурами, зниженої або підвищеної ехогенності з гіпо-, гіперехогенними включеннями, що деформували контури печінки (табл. 1).
Таблиця 1. Основні ультразвукові ознаки злоякісних пухлин печінки
| Ультразвукова семіотика злоякісних пухлин печінки | Частота ознак n (%) | |
|---|---|---|
| Уточнення при оцінці ультразвукових ознак | ||
| Форми | ||
| вузлова (нодулярна, експансивна) | один чи декілька вузлів різного розміру з чіткими краями відносно здорової паренхіми печінки | 48 (27,4) |
| масивна (інфільтративна) | солідна пухлина з лобарною чи білобарною локалізацією | 104 (59,4) |
| дифузна (мультифокальна) | дисемінація дрібних пухлинних осередків по всій паренхімі печінки | 23 (13,1) |
| Розмір, см | має значення для визначення обсягу (площі) ураження та оцінки ефективності лікування | 17 (9,7) |
| <3,0 | ||
| 3,1–4,0 | 22 (12,5) | |
| 4,1–5,0 | 23 (13,1) | |
| >5,0 | 113 (64,5) | |
| Локалізація | має значення для планування обсягу операції | 111 (63,4)/64 (35,4) |
| Права частка/ліва частка | ||
| Субкапсульна зона | 34 (19,4) | |
| Інтрапаренхіматозно | 171 (97,7) | |
| Структура — неоднорідна (переважно) | доцільно вказувати | |
| гіпоехогенна | 137 (78,2) | |
| гіперехогенна | 24 (13,7) | |
| анехогенна | 14 (7,9) | |
| Контури рівні/нерівні | доцільно вказувати | 55 (31,4)/120 (68,5) |
| Краї | 68 (38,8) | |
| чіткі (наявність «halo») | за рахунок стискання здорової паренхіми пухлиною (зона набряку) | |
| нечіткі | проліферація пухлини в здорову тканину печінки | 107 (61,1) |
| Капсула | 48 (27,4) | |
| визначається | при вузловій формі | |
| не визначається | при дифузній формі | 127 (72,5) |
| Васкуляризація | має значення для оцінки ефективності лікування | 86 (49,1) |
| помірно виражена | ||
| виражена | 89 (50,8) | |
| Гемодинамічні порушення в судинах печінки | завжди присутні, але мають різний ступінь вираженості. Ознака має значення для планування лікування та подальшої оцінки ефективності | 175 (100,0) |
Більшість сонографічних ознак стосуються масивної інфільтративної форми (59,4%) пухлини. Виявлені новоутворення у печінці мали розміри від 5,0 см та більше. Превалювали нерівні (68,5%) та нечіткі (61,1%) контури вузлів. Капсула визначалася у 27,4%, не визначалася у 72,5% спостережень. Ехоструктура новоутворень була у всіх випадках неоднорідна, у 78,2% — переважно гіпоехогенна, у 13,7% — переважно гіперехогенна за рахунок фіброзного компонента. Переважно анехогенна структура пухлини визначалася лише у 7,9% спостережень та представлена зонами некрозу (рис. 1).
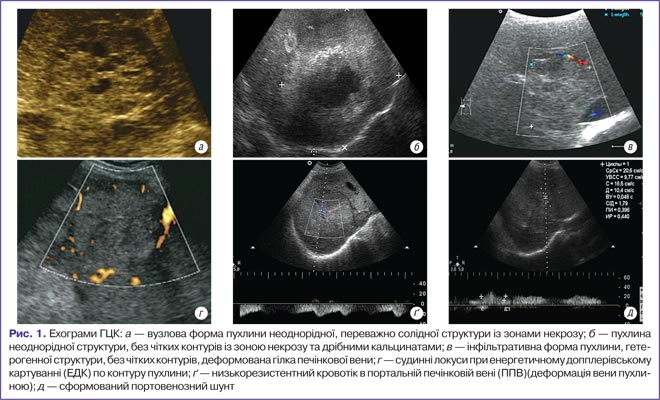
Точність УЗД у виявленні МТС досягає 86–95% [8]. Специфічних ультразвукових ознак МТС не існує, а варіабельність УЗД-зображень залежить від тканинного компонента, що превалює в структурі осередку: фіброз, кальцинація, слизовий компонент, судини, некроз чи крововилив (табл. 2). Тип клітин МТС відіграє другорядну роль в оцінці ультразвукової структури.
Таблиця 2. Варіанти ультразвукової структури МТС у печінці
| Ультразвукова структура МТС у печінці | Частота ознак n (%) | |
|---|---|---|
| Структура осередків | Уточнення ультразвукових симптомів | |
| Переважно гіпоехогенна | з гіперехогенним контуром, правильної округлої форми, негомогенної структури | 243 (62,7) |
| Переважно анехогенна, з дистальним підсиленням ультразвуку |
з наявністю псевдокапсули, ехогенними включеннями, крайовим послабленням ультразвукового сигналу (кістоподібні);з наявністю ізоехогенного пристінкового солідного компонента (кістозно-солідні) | 17 (4,3) |
| Типу «бичаче око» чи «мішень» |
правильної округлої форми, з гіперехогенним контуром, з анехогенною центральною зоною (зона некрозу) |
68 (17,5) |
| Переважно гіперехогенна | з чіткими контурами, неоднорідної структури, з гіпоехогенним обідком;з чіткими контурами, неоднорідної структури, з гіпоехогенним обідком та з наявністю кальцинатів | 15 (3,8) |
| Переважно ізоехогенна | негомогенної структури, з дистальним підсиленням ультразвуку, гіпоехогенним обідком та з латеральними тінями;негомогенної структури, з дистальним підсиленням ультразвуку, гіпоехогенним обідком, латеральними тінями та з наявністю кальцинатів | 13 (3,3) |
| Змішаної ехогенності | з нерівними контурами, хаотичним співвідношенням зон різної ехогенності, наявністю гіпоехогенного обідка;з нерівними контурами, хаотичним співвідношенням зон різної ехогенності, наявністю гіпоехогенного обідка та кальцинатів | 17 (4,3) |
| Складної структури | при розповсюдженому процесі в печінці (множинні осередки невизначеної структури, що зливаються в один пухлинний вузол), складно виявити судини та жовчні протоки | 14 (3,6) |
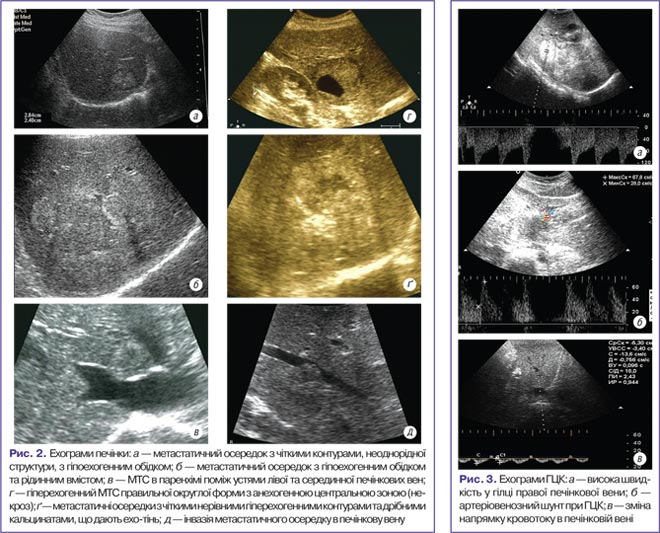
Аналіз представлених у табл. 2 даних показує, що класичним прикладом метастазування є наявність у печінці новоутворення вузлового типу, чітко окресленого, з гіперехогенною периферичною зоною та гіпоехогенною центральною частиною (за рахунок некрозу), із наявністю периферичного обідка «halo», спричиненого стисканням печінкової паренхіми або проліферацією пухлини в здорову тканину печінки (рис. 2).
При виявленні пухлинного процесу в печінці виникає необхідність застосування ангіологічних ультразвукових методик для:
- визначення наявності васкуляризації в пухлині;
- оцінки ступеня гемодинамічних порушень у судинах печінки;
- оцінки наявності та характеру васкуляризації в перифокальній зоні;
- визначення гемодинамічних порушень у пухлині та в судинах печінки упродовж періоду лікування (оцінка ефективності лікування).
Характерним феноменом кровотоку всередині пухлини є наявність колатерального типу, виявленого у 56,7% спостережень. Появу колатерального кровотоку обумовлює формування патологічної судинної сітки в тканині пухлини з багатьма розгалуженнями нелінійної форми, ділянками розширення та звуження окремих судинних сегментів. Такі форми сформованої судинної сітки призводять до виражених гемодинамічних та перфузійних порушень.
Вирішальну роль відіграють показники кровотоку (табл. 3) в судинах печінки, а саме в ЗПА та ВВ.
Таблиця 3. Показники кровотоку в основних судинах печінки у пацієнтів з ГЦК та МТС в порівнянні з нормою
| Параметри | Норма | ГЦК | МТС |
|---|---|---|---|
| Діаметр ЗПА, см | 0,31 ± 0,04 | 0,39 ± 0,05 | 0,45 ± 0,06 |
| Vmax ЗПА, см/с | 56,2 ± 9,3 | 65,6 ± 11,7 | 105,3 ± 21,9 |
| Vmin ЗПА, см/с | 20,3 ± 15,4 | 25,7 ± 5,4 | 38,8 ± 6,4 |
| Vmean ЗПА, см/с | 35,5 ± 12,8 | 36,7± 9,2 | 78,8 ± 5,6 |
| Vvol ЗПА, мл/хв | 154,3 ± 31,1 | 178,7 ± 58,6 | 225,6 ± 94,3 |
| Ri ЗПА | 0,67 ± 0,09 | 0,74 ± 0,02 | 0,54 ± 0,03 |
| Діаметр ВВ, см | 1,2 ± 0,12 | 1,4 ± 0,3 | 1,4 ± 0,07 |
| Vmean ВВ | 17,5 ± 2,2 | 134,4 ± 28,6 | 20,0 ± 1,9 |
| Vvol ВВ, мл/хв | 624,4 ± 185,4 | 503,7 ± 179,2 | 1038,3 ± 133,8 |
| Діаметр СВ, мм | 6,2 ± 0,3 | 8,3 ± 0,6 | 5,3 ± 0,8 |
| Діаметр ВБВ, мм | 8,7 ± 0,2 | 9,1 ± 0,3 | 8,7 ± 0,2 |
Показники гемодинамічних порушень залежать від локалізації пухлини в печінці відносно судин до пухлинного осередку, але тією чи іншою мірою присутні у всіх випадках. При КДК самої пухлини виявляють велику кількість судин різноспрямованого характеру з низькошвидкісним низькорезистентним типом кровотоку.
Симптоми портальної гіпертензії проявляються різним ступенем вираженості, але присутні у всіх випадках, залежать від локалізації пухлини в печінці, її розмірів, тривалості клінічного перебігу пухлинного процесу, наявності сформованого колатерального кровотоку, функціонального резерву печінки та проявів супутніх ускладнень.
При обструкції ВВ спостерігається зменшення портального кровотоку, розширення просвіту ЗПА та збільшення артеріального притоку крові. При КДК відзначають підвищення індексу артеріальної перфузії за рахунок збільшення об’єму кровотоку в ЗПА в межах 20–40% порівняно з нормою.
У пацієнтів із ГЦК відмічено: зменшення об’єму притоку по ВВ, збільшення діаметра селезінкова вена (СВ) та верхня брижова вена (ВБВ) (зміна напрямку кровотоку із гепатопетального на гепатофугальний та розвиток колатерального кровотоку). В артеріальному руслі незначне компенсаторне збільшення діаметра ЗПА та швидкості кровотоку, що свідчить про артеріалізацію кровотоку в печінці (рис. 2). Загальне збільшення притоку в печінку відбувається за рахунок розвитку мезопортальних колатералей, а також між артеріальним та венозним руслом — ділянки патологічного викиду крові (шунти). В зоні шунту кровотік має велику амплітуду з локалізацією максимуму спектрального розподілу біля нульової позначки, пульсового характеру. В дренуючих венах відмічено підвищення кровотоку з наявністю псевдоартеріальної пульсації.
У пацієнтів із метастатичним ураженням у печінці відзначено підвищення швидкості та збільшення об’єму артеріального притоку у ЗПА та ВВ.
При дослідженні діаметра ЗПА та швидкості кровотоку в ній з’ясували, що метастатичне ураження печінки призвело до значимих змін кровотоку, а саме до підвищення швидкісних характеристик (Vmax ЗПА=105,3±21,9 см/с) та збільшення діаметра ЗПА до 0,45±0,06 см (норма в межах 0,29–0,31 см).
У ВВ середня швидкість кровотоку була в межах норми (Vmean=20,0±1,9 см/с), та відзначали значне збільшення загального об’єму (Vvol=1038,3±133,8 мл/хв). При кольоровому та енергетичному картуванні в більшості випадків вдалося виявити пері- та інтранодулярний кровотік, що є результатом розвитку власних судин пухлини. Такі судини мають низький периферичний опір, при спектрографії реєструється низькорезистентний кровотік із вираженою пологістю систоло-діастолічних коливань.
При дослідженні таких судин за допомогою спектрального допплера діапазон швидкості кровотоку реєструвався в проміжку 20–60 см/с, RI в межах 0,2–0,4.
Результати КТ-досліджень
КТ-зображення печінки при ГЦК досить варіабельні, залежать від розмірів, типу росту пухлини, особливостей васкуляризації, гістологічної будови та наявності симптомів портальної гіпертензії (рис. 4).
Загальновизнано, що для виявлення пухлини найбільш інформативним є отримання КТ-сканів в артеріальну та венозну фазу. Сканування у відстрочену фазу є доцільними для гіперваскулярних форм новоутворень у печінці. У результаті проведених досліджень виявлено найбільш специфічні КТ-ознаки ГЦК (табл. 4).
Таблиця 4. Основні КТ-ознаки ГЦК
| КТ-семіотика злоякісних пухлин печінки | Частота ознак n (%) | |
| Основні форми | Уточнення при оцінці КТ-ознак | |
| Дифузна гіперденсна або змішаного характеру структура пухлини | в артеріальну фазу (мозаїчність структури) | 66 (86,8%) |
| Наявність гіперваскулярної зони по контуру пухлини | тільки в артеріальну фазу сканування (гіперденсна в артеріальну фазу та швидке вимивання контрасту при відстроченому скануванні) | 64 (84,2%) |
| Наявність гіподенсної зони (зон) | зони некрозу в центральній частині пухлини | 26 (34,2%) |
| Наявність центрального рубця | зони фіброзу в центральній частині пухлини | 32 (42,1%) |
| Наявність тромбозу | при пухлинах, розмір яких перевищує 5 см | 36 (47,3%) |
Тромбоз ВВ, обумовлений прямою пухлинною інвазією, є головною причиною передпечінкової форми портальної гіпертензії. Результати проведених досліджень та аналіз зображень демонструють, що тромбоз може бути частковим та повним із залученням у процес будь-якого відділу портальної системи. Аналіз зображень (рис. 5) дозволив встановити прямі та непрямі ознаки оклюзії ВВ.
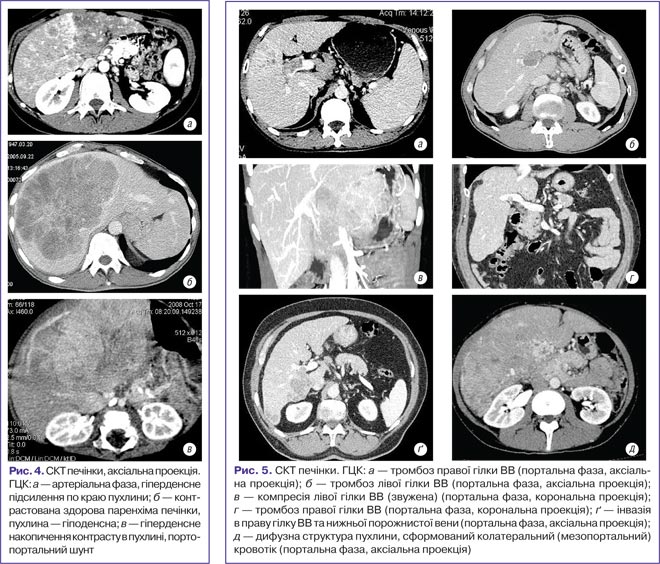
Прямі ознаки:
- деформація просвіту судини;
- відсутність зображення контрастованого сегмента судини;
- престенотичне розширення просвіту вени;
- розширення ураженого сегмента вени (>15 мм) та виповнення вени тромбом;
- наявність тромбу в просвіті судини;
- гіпер-/ гіподенсність тромбу у різні фази сканування;
- кальцинація стінки вени (визначає давність процесу).
Непрямі ознаки:
- спленомегалія;
- розширення просвіту селезінкової вени;
- наявність венозних колатералей;
- асцит;
- гіпотрофія/атрофія однієї з часток печінки (при первинних пухлинах печінки).
У результаті проведених досліджень були визначені варіанти оклюзії ВВ, котрі не суперечать хірургічній класифікації тромбозів ВВ:
- протрузія пухлини в просвіт ВВ з формуванням пухлинних тромбів;
- пряма інвазія пухлини в стінку судини;
- змішаний варіант — поєднання пухлинного тромбозу з інвазією пухлини в стінку ВВ.
Наявність пухлинного тромбозу призводить до хронічного дефіциту перфузії та розвитку атрофії периферичних відділів паренхіми печінки. У паренхімі печінки, у зоні зменшеного портального кровотоку, відмічається локальне підсилення паренхіми (зона тромбу, компресія чи стриктура ВВ та її гілок), гетерогенне підсилення периферичних відділів печінки (при кавернозній трансформації тромбованих гілок ВВ). У центральній зоні печінки переважно колатеральна циркуляція.
Більшість МТС у печінку при СКТ є гіподенсними. Доведено, що оцінювати результати СКТ-дослідження печінки на предмет виявлення МТС доцільно в портальну фазу. В артеріальну фазу спостерігається перифокальне накопичення контрасту, що є диференційно-діагностичною ознакою МТС (рис. 6).
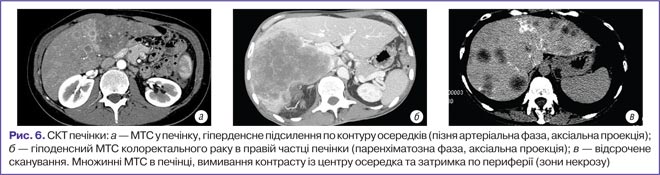
Результати проведених досліджень демонструють що, найбільш специфічними КТ-ознаками МТС слід вважати:
- гіподенсність відносно паренхіми печінки (до 95% спостережень);
- миттєве гомогенне контрастування осередків в артеріальну фазу (до 80% спостережень);
- появу периферичного гіперденсного обідка в артеріальну фазу з типовим симптомом периферичного вимивання контрасту та поступовим заповненням центральних відділів МТС (до 90% спостережень);
- швидке вимивання контрасту у венозну фазу — симптом «периферичного вимивання» (до 78% спостережень);
- ізоденсність МТС у відстрочену фазу сканування відносно паренхіми печінки (до 50% спостережень);
- осередки за типом мішені (зона некрозу в центральній частині МТС).
ВИСНОВКИ
Результати УЗД при первинному та метастатичному раку печінки дозволяють уточнити основні ехографічні ознаки, що характеризують пухлинний процес, виділити головні та другорядні. Застосування комплексу ультразвукових методик для виявлення пухлин печінки є правильним напрямком, що дає широку та повноцінну інформацію про наявність пухлини, її структуру, розміри та розміщення у печінці, зв’язок із судинами. Достовірно точно можна визначити ступінь інвазії в судини та оцінити гемодинамічні порушення. Оцінка показників кровотоку в судинах печінки відіграє головну роль в інтерпретації стану судинного русла та сприяє визначенню в диференційній діагностиці пухлин печінки.
У результаті проведеної роботи впроваджено методику СКТ із застосуванням контрастування та оцінено результати в різні фази сканування. Оцінено та систематизовано найбільш інформативні та специфічні КТ-симптоми при новоутвореннях у печінці. Результати КТ-досліджень дозволили уточнити розповсюдженість процесу у печінці та поза її межами, наявність оклюзії, її рівень.
Застосування комплексу УЗД, КТ-досліджень у пацієнтів із первинним та метастатичним раком печінки дозволило уточнити розповсюдженість пухлинного процесу, взяти участь у плануванні обсягу оперативного лікування, оцінити радикальність його виконання, післяопераційні зміни в органі та подальший перебіг захворювання.
ЛІТЕРАТУРА
1. Bipat S., van Leeuwen M.S., Comans E.F.I. et al. (2006) Colorectal Liver Metastases: CT, MR Imaging, and PET for Diagnosis — Meta-Analysis. Radiology, Vol. 237: 123–131.
2. Current techniques of computed tomography. Helical CT, Multidetector CT, and 3D reconstruction. Clin. Liver Dis. 2002, 6: 29–51.
3. Donato P., Coelho P., Rodrigues H. et al. (2007) Normal vascular and biliary hepatic anatomy: 3D demonstration by multidetector CT. Surg. Radiol. Anat., Vol. 29: 575–582.
4. Guan Y., Sun L., Zhou X. et al. (2004) Hepatocellular carcinoma treated with interventional procedures: CT and MRT follow-up. World J. Gastroenterol., 24(10): 3543–3548.
5. Kim H.C. (2003) Preoperative Evaluation of Hepatocellular Carcinoma. AJR, 18: 1593–1599.
6. Maconi G., Bianchi Porro G. (2007) Ultrasound of the gastrointestinal tract. Milano: Springer, 230 p.
7. Numata K., Isozaki T., Morimoto M. et al. (2006) Prospective study of differential diagnosis of hepatic tumors bu pattern-based classification of contrast-enhanced sonography. World J. Gastroenterol., 39(12): 6290–6298.
8. Leen E., Ceccotti P., Moug S., Glen P. et al. (2006) Potential value of contrast-enhanced intraoperative ultrasonography during partial hepatectomy for metastases. Ann. Surg., 2(243): 236–240.
9. Shahid M. Hussain (2007) Liver MRI. Berlin. Springer-Verlag, 250 р.
10. Гастроэнтерология: национальное руководство/под ред. В.Т. Ивашкина, Т.Л. Лапиной. − М. : ГЭОТАР-Медиа, 2008, 345 с.
11. Guadagni S., Pizzutilli A., Mancini E. еt al. (2000) Significance of duplex/colour Doppler sonography in hepatic arterial chemotherapy for patients with liver metastases from colorectal carcinoma. Eur. J. Surg. Oncol., 26: 381–386.
12. Класифікація TNM, 6-те вид.(2002) Довідник онколога. Вип. 3 / упорядник Я.В. Шпарик. — Львів: 43–44.
13. Минимальные клинические рекомендации Европейского общества клинической онкологии (ESMO). − М., 2010, 436 с.
14. Лучевая диагностика заболеваний печени (МРТ, КТ, УЗИ, ОФЭКТ и ПЭТ): руководство для врачей / под ред. Е. Труфанова. − М. : ГЭОТАР-Медиа, 2007, 264 с.
15. Прокоп М. (2007) Спиральная компьютерная томография/под ред. А.В. Зубарева, Ш.Ш. Шотемора. — М. : МЕДпресс-информ, 2, 712 с.
16. Рак в Україні, 2009–2010. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. — К., 2011,. — № 12. — 116 с.
17. Cтандарти діагностики та лікування онкологічних хворих : затверджено наказом МОЗ України від 17.09.2007 №554. − К., 2007. — 200 с.
Cовременные аспекты диагностики первичного и метастатического рака печени
Национальный институт рака, Киев
Резюме. Проведен комплекс лучевых методов исследований, а именно: ультразвуковое (УЗ) исследование и спиральная копьютерная томография (СКТ) у пациентов с первичным и метастатическим раком печени. Применение комплекса УЗ-методик при выявлении опухолей печени позволило получить широкую и полноценную информацию о структуре опухоли, размерах, расположении в печени, определить наличие инвазии в сосуды и оценить гемодинамические нарушения. Разработан и применен протокол СКТ-исследования с использованием внутривенного болюсного контрастирования, оценены результаты в различные фазы сканирования. В результате проведенной работы оценены и систематизированы наиболее информативные и специфические УЗ- и КТ-симптомы при злокачественных опухолях печени. Использование комплекса УЗ- та КТ-исследований позволило уточнить распространенность опухоли в печени, вне ее, выявить наличие окклюзии, установить ее уровень и в целом провести стадирование злокачественного процесса.
рак печени, метастазы, ультразвуковая диагностика, компьютерная томография.














Leave a comment