Роль пухлинного мікрооточення в прогнозуванні виживаності пацієнтів з аденокарциномою товстої кишки І–ІІІ стадій
Резюме. Вступ. Колоректальний рак (КРР) є однією з основних причин захворюваності та смертності від онкопатології у світі. Метою цієї роботи є вивчення прогностичної цінності мікрооточення пухлини у хворих на КРР I–III стадій. Матеріали та методи. Ретроспективне дослідження за участю 183 пацієнтів з колоректальною аденокарциномою I–III стадій. Середній період спостереження становив 3,6 року для показника загальної виживаності (ЗВ). Результати. За допомогою кривих Каплана — Меєра встановлено, що різниця в ЗВ між групами з низьким відсотком пухлинно-стромального співвідношення (ПСС) і високим відсотком ПСС була достовірною (р=0,006); різниця в ЗВ між групами А, В і С (з пухлино-інфільтруючими лімфоцитами (ПІЛ)) є статистично достовірною (p=0,017). На основі багатовимірної моделі пропорційної регресії Кокса ПСС можна вважати незалежним прогностичним фактором, який впливає на ЗВ (р=0,012). Висновки. Колоректальні аденокарциноми з високим ПСС мають нижчий показник ЗВ порівняно з пухлинами з низьким ПСС. ПІЛ мають великий потенціал як прогностичний інструмент і потребують більш глибокого вивчення.
Одержано 30.04.2024
Прийнято до друку 31.05.2024
DOI: 10.32471/clinicaloncology.2663-466X.54-2.32616
ВСТУП
КРР залишається незмінно актуальною проблемою, адже захворюваність стабільно зростає незалежно від статі. КРР є другою основною причиною смертності, пов’язаної з раком [1]. Також важливо відмітити значний економічний вплив КРР через витрати у сфері охорони здоров’я, пов’язані з тривалою втратою працездатності та передчасною смертністю [2]. Не менш важливим є розв’язання питання щодо стратегії лікування, зокрема призначення ад’ювантної хіміотерапії (АХ). Cтратегія її призначення для локалізованих форм КРР залишається дискутабельною. Найбільш чітко встановлені рекомендації щодо призначення АХ для КРР з поширенням у лімфатичні вузли, проте з огляду на підвищені рівні побічних ефектів АХ слід також коригувати кількість та тривалість курсів [3]. З цієї причини пошук додаткових діагностичних інструментів для визначення пацієнтів з вищими рівнями ризику необхідний для покращення діагностики та вибору стратегії лікування.
Сьогодні численні дослідники сконцентровані на вивченні пухлинного мікрооточення (ПМО) та його ролі в пухлинній прогресії [4]. Однією з найбільш багатообіцяючих характеристик ПМО в якості прогностичного інструменту є ПСС. У дослідженнях виявлений великий потенціал ПСС як прогностичного інструменту не лише для КРР, але й для інших нозологій, таких як новоутворення молочної, підшлункової залоз та легень [5–8]. Окрім того, у дослідженнях зафіксовано, що високий показник ПСС був асоційований з наявністю метастазів у лімфатичні вузли, а також ПСС додатково є провісником резистентності до АХ після хірургічного видалення пухлини [9]. Завдяки можливості оцінювання ПСС під час рутинного діагностичного дослідження зразків пухлин без додаткових витрат часу та ресурсів ПСС можна розглядати як додатковий інструмент в ухваленні рішення щодо стратегії лікування пацієнта [10].
Окремої уваги заслуговують ПІЛ, які є ключем до розуміння імунної взаємодії «хазяїн — пухлина». Прослідковується чіткий взаємозв’язок між імунною відповіддю хазяїна та процесами розвитку і росту новоутворення [11]. Аналогічно до ПСС ПІЛ можна оцінювати під час рутинного гістологічного дослідження, він зарекомендував себе як цінну характеристику оцінки прогнозу виживаності хворих з раком гортані та молочної залози, пацієнти з великою кількістю ПІЛ мають кращі показники ЗВ порівняно з особами, що мають малу кількість ПІЛ [12, 13].
МЕТА
Визначити вплив ПСС та ПІЛ на ЗВ пацієнтів із КРР I–III стадій.
МАТЕРІАЛИ ТА МЕТОДИ
Для цього ретроспективного дослідження використано 183 парафінових блоки зразків пухлин від пацієнтів з діагнозом аденокарциноми товстої кишки. У дослідження залучені пацієнти з аденокарциномою товстої кишки I–III стадій. З дослідження виключено хворих з віддаленими метастазами.
Дослідження схвалено біоетичною комісією (експертний висновок від 18.01.2019 р. № 118).
З медичних записів зібрано наступні дані: вік пацієнта, патологічна стадія за класифікацією TNM та дата останнього спостереження чи смерті хворого. Оцінювання морфологічних характеристик проводилося на гістологічних скельцях, забарвлених H&E: визначали гістологічний тип пухлини, ступінь диференціювання (G), брунькування пухлини, ПСС, ПІЛ та наявність некрозу (табл. 1).
| Параметр | Кількість | |
| N=183 пацієнтів | % | |
| Вік
≤40 >40, <60 ≥60 |
2 41 140 |
1,1 22,4 76,5 |
| Стадія
I ІІ ІІІ |
11 107 65 |
6,0 58,5 35,5 |
| Гістологічний тип
Аденокарцинома Муцинозна аденокарцинома Слизопродукувальна аденокарцинома Перснеподібно-клітинна карцинома |
153 10 13 3 |
85,8 5,5 7,1 1,6 |
| pT (Пухлина)
рТ2 рТ3 рТ4 |
14 135 34 |
7,6 73,8 18,6 |
| pN (Лімфатичні вузли)
рN0 рN1 рN2 |
118 50 15 |
64,5 27,3 8,2 |
| Ступінь диференціювання
G1 G2 G3 |
12 162 9 |
6,6 88,5 4,9 |
| Наявність некрозу
Так Ні |
49 134 |
26,8 73,2 |
| ПСС
Низький відсоток строми (<50%) Високий відсоток строми (≥50%) |
119 64 |
65,0 35,0 |
| ПІЛ
Група A (0–9%) Група B (10–39%) Група C (40–100%) |
56 90 37 |
30,6 49,2 20,2 |
| Пухлинне брунькування
Мала кількість брунькування Помірне брунькування Значна кількість брунькування |
162 13 8 |
88,5 7,1 4,4 |
| Виживаність
Живий Помер |
150 33 |
82,0 18,0 |
Гістологічний тип та ступінь диференціювання пухлин визначено згідно з Класифікацією пухлин травного тракту (5-те видання) Всесвітньої організації охорони здоров’я (ВООЗ), 2019 р. [14]. ПСС оцінювали згідно з рекомендаціями, запропонованими Г.В. Пельт та співавт. [10]. ПСС оцінювали при 10-кратному збільшенні в зонах з найбільшою кількістю строми як відсоткове співвідношення кількості строми до кількості пухлинних клітин, яке підвищується на 10%. Ділянка для оцінки ПСС повинна бути вільною від крововиливів і некрозу, а клітини пухлини мають бути видимі з усіх 4 сторін поля зору. Пухлини з ≥50% строми вважаються такими з високим показником ПСС; <50% строми — з низьким показником ПСС відповідно (рис. 1–2).
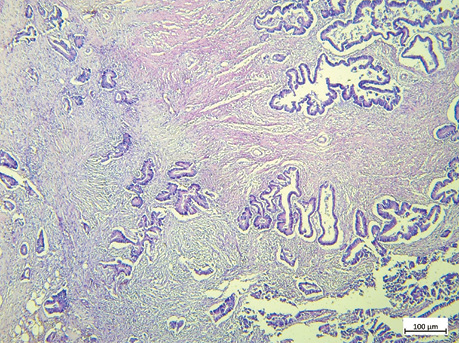
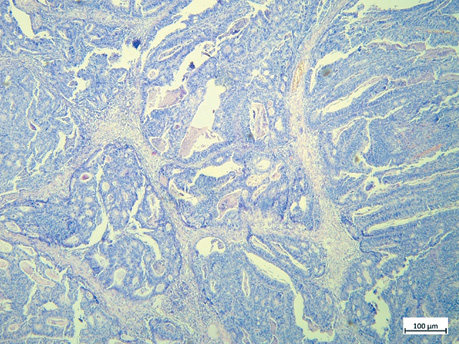
ПІЛ підраховували на звичайних гістологічних скельцях H&E відповідно до методології, запропонованої Міжнародною робочою групою з оцінки ПІЛ при раку молочної залози. ПІЛ відображена у відсотковому співвідношенні площі пухлинної строми до площі, зайнятої лімфоцитами. Відповідно до відсоткового співвідношення виокремлено наступні групи: група А — ПІЛ 0–9%, група В — ПІЛ 10–39%, група С — ПІЛ >40% (рис. 3–5) [15].
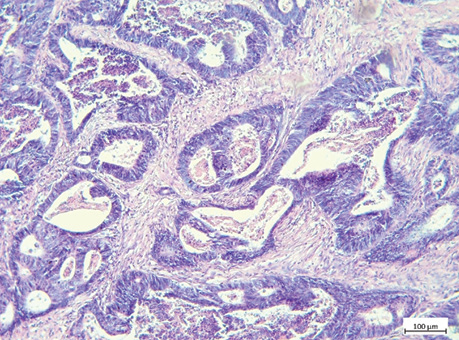
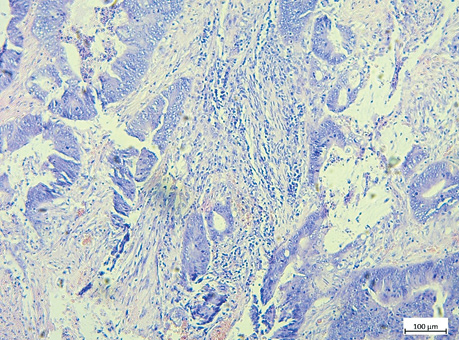
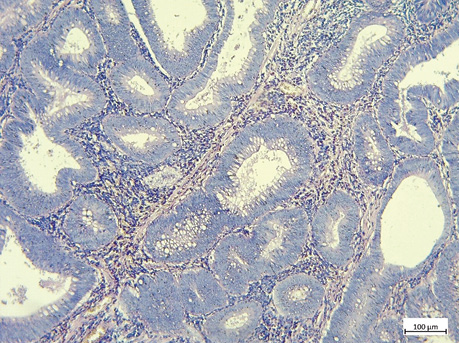
Усі зразки оцінювали два незалежних патологи для визначення рівня погодженості в оцінці ПСС та ПІЛ. Обидва патологи не мали доступу до клінічних даних пацієнтів та отримали однакові рекомендації, наведені вище.
Статистичний аналіз проводили за допомогою програмного пакета EZR 1.35 (версія статистичного програмного забезпечення R 3.4.3. R Foundation for Statistical Computing. Відень, Австрія) [16]. Для аналізу даних про виживаність використовувався метод Каплана — Меєра з логарифмічним ранговим тестом. Показники ЗВ оцінювали за однофакторною та багатофакторною моделями пропорційної регресії ризику Кокса. Для визначення узгодженості між патологами використовувався коефіцієнт Каппа Коена (k). k <0,20 вважався низьким рівнем згоди; k=0,21–0,41 — справедливий; k=0,41–0,61 — помірний; k=0,61–0,81 — високий; k >0,81 — відповідно, майже ідеальний. p-значення <0,05 вважалися значущими.
РЕЗУЛЬТАТИ
Досліджено 183 зразки аденокарциноми товстої кишки. Середня тривалість ЗВ становила 3,6 року (діапазон 0,08–7,3 року).
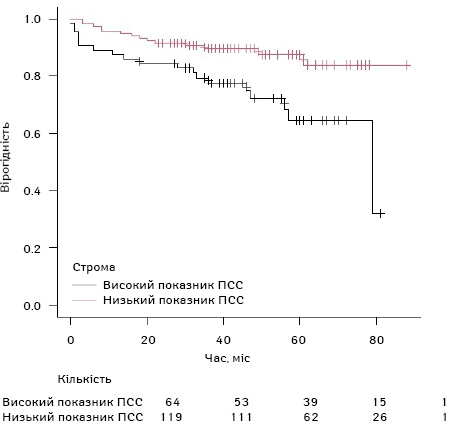
1-річна ЗВ у пацієнтів з аденокарциномою товстої кишки становить 92,9%±1,8%; 2-річна ЗВ — 89,1%±2,3%; 3-річна ЗВ становить 85,3%±2,6%. У групі з низьким показником ПСС 1-річна ЗВ становила 95,0±2,0%; 2-річна ЗВ — 91,6±2,5%; 3-річна ЗВ — 89,6±2,8%. У групі з високим ПСС 1-річна ЗВ становила 87,5±4,1%; 2-річна ЗВ — 84,4±4,5%; 3-річна ЗВ — 77,6±5,2%. За допомогою кривих Каплана — Меєра встановлено, що різниця в ЗВ між групами з низьким показником ПСС та високим була статистично достовірною (p=0,006) (рис. 6).
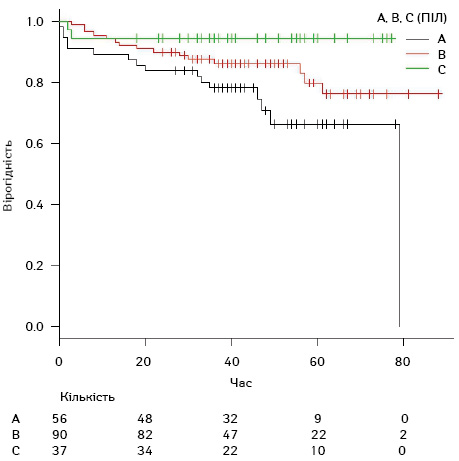
Відповідно, для ПІЛ у групі А (ПІЛ 0–9%) 1-річна ЗВ становила 89,3±4,1%; 2-річна ЗВ — 83,9±4,9%; 3-річна ЗВ — 78,2±5,5%. У групі В (ПІЛ 10–39%) 1-річна ЗВ становила 94,4± 2,4%; 2-річна ЗВ — 90,0±3,1%; 3-річна ЗВ — 86,2±3,7%. У групі С (ПІЛ >40%) 1-річна ЗВ становила 94,6±3,7%. За допомогою кривих Каплана — Меєра зафіксовано, що різниця в ЗВ між групами А, В і С є статистично достовірною (p=0,017) (рис. 7).
Згідно з однофакторною моделлю пропорційної регресії ризиків Кокса показники виживання в групі з низьким відсотком ПСС є значно вищими порівняно з групою з високим відсотком ПСС (коефіцієнт ризику (КР) 0,39; 95% довірчий інтервал (ДІ) 0,19–0,79; p=0,008) (табл. 2). ПІЛ має статистично значущий вплив на показники виживаності в групі C порівняно з групою A (p=0,019). Показники ЗВ для групи з підвищеним вмістом ПІЛ (>40%, група C) (КР 0,17; 95% ДІ 0,03–0,75; p=0,019). Крім того, наявність метастазів у лімфатичні вузли pN (загальний p=0,001) і стадія (загальний p=0,015) зумовили статистично значущий вплив на ЗВ (див. табл. 2).
Таблиця 2. Одноваріантний регресійний аналіз Кокса факторів, що прогнозують ЗВ при КРР
| Параметр | ЗВ | ||
| КР | ДI | p-значення | |
| Стадія
I ІІ ІІІ |
Референтне 1,716 3,25 |
0,15–8,96 0,43–24,31 |
0,015 0,883 0,250 |
| рТ (Пухлина)
рТ2 рТ3 рТ4 |
Референтне 2,26 3,33 |
0,30–16,74 0,42–26,33 |
0,411 0,426 0,255 |
| рN (Лімфатичні вузли)
рN0 рN1 рN2 |
Референтне 2,21 5,44 |
1,01–4,84 2,17–13,69 |
0,001 0,048 <0,001 |
| Гістологічний тип
Аденокарцинома Муцинозна аденокарцинома Слизопродукувальна аденокарцинома Перснеподібно-клітинна карцинома |
Референтне 0,59 0,93 2,26 |
0,08–4,32 0,22–3,92 0,31–16,69 |
0,811 0,601 0,922 0,423 |
| Ступінь диференціювання
G1 G2 G3 |
Референтне 1,73 2,33 |
0,23–12,75 0,211–25,79 |
0,787 0,592 0,489 |
| Наявність некрозу
Так Ні |
Референтне 0,52 |
0,20–1,35 |
0,179 |
| ПСС
Низький відсоток строми (<50%) Високий відсоток строми (≥50%) |
Референтне 0,39 |
0,19–0,79 |
0,008 |
| ПІЛ
Група A (0–9%) Група B (10–39%) Група C (>40%) |
Референтне 0,53 0,17 |
0,26–1,07 0,03–0,75 |
0,029 0,078 0,019 |
| Пухлинне брунькування
Мала кількість брунькування Помірне брунькування Висока кількість брунькування |
Референтне 1,29 0,71 |
0,23–7,07 0,16–3,12 |
0,534 0,771 0,655 |
У результаті багатоваріантного аналізу моделі пропорційної регресії ризику Кокса з використанням інформаційного критерію Акаіке (Akaike information criterion — AIC) для поетапного відбору значущих прогностичних критеріїв встановлено, що ПСС (p=0,011) і наявність метастазів у лімфатичні вузли pN (p=0,001) мають найбільший вплив на ЗВ (табл. 3). Отже, ПСС можна розглядати як незалежний прогностичний фактор. Проте група С (ПІЛ >40%) втратила статистичну значущість впливу на ЗВ (р=0,062).
| Параметр | ЗВ | ||
| КР | ДI | p-значення | |
| ПСС
Низький відсоток строми (<50%) Високий відсоток строми (≥50%) |
Референтне 0,40 |
0,20–0,82 |
0,011 |
| рN (Лімфатичні вузли)
рN0 рN1 рN2 |
Референтне 2,10 5,32 |
0,95–4,61 2,11–13,39 |
0,001 0,064 <0,001 |
ПСС оцінено однаково у 158 із 183 випадків обома патологами, і загальний рівень погодження становив 86%. Очікувана частота погодження, яку можна було очікувати випадково, розрахована за допомогою тесту xі-квадрат Пірсона: вона становила 24,13 для групи з високим відсотком ПСС; 74,13 — для групи з низьким відсотком ПСС. k становив 0,70, що є високим рівнем погодження між патологоанатомами, які оцінюють ПСС.
ПІЛ оцінено однаково у 162 із 183 випадків обома патологами, і загальний рівень погодження становив 86,9%. Очікувана частота погодження, яку можна було очікувати випадково, розрахована за допомогою тесту xі-квадрат Пірсона: вона становила 19,33 для групи А (ПІЛ 0–9%); 42,79 — для групи В (ПІЛ 10–39%); 6,68 — для групи С (ПІЛ >40%). k становив 0,78, що є високим рівнем погодження між патологоанатомами, які оцінюють ПІЛ.
ОБГОВОРЕННЯ
Зміни ПМО доволі яскраві. Пухлинну строму (ПС) слід вважати одним із ключових компонентів ПМО. Розвиток ПС спочатку залежить від секреції факторів росту та протеаз, що запускаються раковими клітинами. Водночас «рекрутовані» пухлиною клітини запалення виділяють численні запальні цитокіни та активують гемопоетичні клітини, індукуючи запалення, що призводить до стимулювання прогресії та поширення онкопатології [17]. Більш глибокий погляд на ПМО може допомогти зрозуміти роль ПС у прогресуванні раку.
ПМО слід розглядати як складну «екосистему», що складається з пухлиноасоційованих фібробластів (ПАФ), імунних і запальних клітин, ендотеліальних клітин, перицитів, клітин кісткового мозку, адипоцитів, мезенхімальних стовбурових клітин і позаклітинного матриксу (ПКМ) [18, 19]. Інтенсивні взаємодії строми та епітелію можуть пояснити вплив ПМО на сприяння прогресуванню пухлини. Зокрема, одним із ключових «гравців» у цій взаємодії є ПАФ, які відрізняються від нормальних фібробластів. ПАФ здатні до дуже швидкої проліферації, збільшення вироблення колагену, модуляторів ПКМ і вивільнення факторів росту. Примітно, що ПАФ можна розпізнати за так званим «активованим фенотипом», але він не ідентичний серед популяції ПАФ [20, 21]. ПАФ можуть виробляти широкий спектр молекулярних маркерів, і профілі цих маркерів можуть бути різними. Найчастіше ПАФ експресують α-актин гладких м’язів (α-АГМ), віментин, специфічний білок фібробластів (СБФ) і білок активації фібробластів (БАФ), рецептор тромбоцитарного фактора росту-α і -ß (РТФР-α і РТФР-ß), фактор росту фібробластів-2 (ФРФ-2), фактор росту ендотелію судин (ФРЕС), епідермальний фактор росту (ЕФР), трансформуючий фактор росту-ß (ТФР-ß), і вивільняють цитокіни та хемокіни, загалом сприяючи промоції розвитку і поширенню ПС [20, 21].
Важливо відмітити роль ПКМ як складової ПС. Він працює не лише як підтримувальна основа для пухлинних клітин, але й як середовище для їх поширення. Розростання та ущільнення ПС відбувається в основному через ремоделювання ПКМ та стимуляцію колагену І типу під впливом каскаду взаємодій вивільнених злоякісними клітинами матриксних металопротеїназ (MMП) та інших протеаз, що містяться в ПКМ. Фактори росту та хемокіни, що містяться в ПКМ, створюють сприятливі умови для пухлинно-стромальної взаємодії, яка призводить до поширення ракових клітин через клітинну адгезію [22, 23].
Загалом значущість оцінювання ПСС в якості прогностичного фактора висвітлена в численних дослідженнях для різних злоякісних новоутворень [7, 8, 24, 25]. Кай Ван та співавт. у дослідженні ПСС плоскоклітинного раку стравоходу встановили, що 3-річна ЗВ для групи з низьким відсотком ПСС становила 64% і 23% — для групи з високим відсотком ПСС відповідно [25]. Подібні результати отримані при дослідженні ПСС при раку молочної залози, 3-річна ЗВ для групи з низьким показником ПСС становила 86,9% і 75,6% для групи з високим ПСС [7]. A. Huijbers та співавт. вивчали прогностичну цінність ПСС для раку товстої кишки II–III стадій у дослідженні VICTOR і зафіксували, що 5-річна ЗВ становила 69% для пухлин з високим ПСС і 83,4% — для пухлин з низьким ПСС [26]. Наші результати також підтверджують дані наукової літератури, отримані іншими дослідницькими групами: 3-річна ЗВ у групі з низьким ПСС становила 89,6% і 77,6% — для високого ПСС відповідно. Це підтверджує ідею про те, що строма є вагомим компонентом ПМО та її варто брати до уваги під час дослідження новоутворення та оцінки прогнозу.
Методика оцінки ПСС легко відтворюється та існує в кількох варіаціях, які показали значущість впливу на ЗВ [11, 27]. Методика оцінювання ПСС не потребує додаткових приготувань і витрат та може бути впроваджена в повсякденну роботу патологоанатомів як додатковий прогностичний інструмент для пацієнтів з КРР.
Важливою є оцінка ПІЛ, адже пухлинна прогресія відбувається також через втрату рівноваги процесів агресивного росту пухлини та імунної відповіді організму [28]. Клітинний склад ПІЛ та співвідношення обсягів субпопуляцій клітин варіює, проте основними компонентами ПІЛ зазвичай є макрофаги, нейтрофіли, натуральні кілери (NK), супресорні клітини мієлоїдного походження (myeloid-derived suppressor cells — MDSC), Т-, В-лімфоцити та інші клітини [28–31]. Основні функції, які виконує кожна субпопуляція, звичайно ж, залежать від їх біологічної ролі, але під впливом міжклітинних взаємодій вони можуть виконувати інші нетипові функції. Наприклад, деякі субпопуляції В-клітин можуть відігравати подвійну роль у взаємодії з пухлиною і проявляти як протипухлинну, так і пухлиностимулювальну активність [32]. Т-лімфоцити проявляють характерну протипухлинну активність. Після активації CD8+ Т-лімфоцити здатні розрізняти та прямо лізувати клітини пухлини. Залежно від диференціації після активації CD4+ Т-лімфоцити здатні чинити різноманітний протипухлинний вплив, завдяки вивільненню різноманітних цитокінів промотувати чи інгібувати протипухлинну активність [33]. Через це цілком зрозуміло, чому значна кількість досліджень сконцентрована на поглибленому вивченні впливу різних субпопуляцій лімфоцитів та їх співвідношення на показник виживаності. До прикладу, В. Ху та співавт. [34] у своєму дослідженні виявили, що ізольована інтенсивна інфільтрація CD8+ Т-лімфоцитами та інфільтрація одночасно CD8+ і CD103+ Т-лімфоцитами може слугувати незалежним прогностичним маркером для пацієнтів з КРР. Окрім того, Й. Тао та співавт. [35] підтверджують, що значна інфільтрація пухлин товстої кишки CD8+ Т-лімфоцитами ізольовано та інтенсивна інфільтрація CD4+ та CD8+ Т-лімфоцитами одночасно потенційно прогнозують вищу виживаність для пацієнтів з КРР. Проте визначення конкретних субпопуляцій запального інфільтрату потребує додаткових часових та матеріальних затрат.
У цьому дослідженні ми намагалися оцінити прогностичну цінність ПІЛ для ЗВ без лімфоцитарного розподілу на субпопуляції. Виявлено цінність показника ПІЛ в якості незалежного прогностичного маркера для різних підтипів карцином молочної залози та тричі негативної карциноми зокрема [13, 36, 37]. Цей метод може застосовуватися під час рутинного гістологічного дослідження, тому він не потребує додаткових витрат. За допомогою кривих Каплана — Меєра встановлено, що різниця в ЗВ між групами з різним ПІЛ є статистично достовірною (p=0,017). Крім того, у результаті моноваріантного аналізу регресійної моделі Кокса зафіксовано статистично достовірно вищу ЗВ для групи С (з великою кількістю ПІЛ >40%), проте при мультиваріантному аналізі регресійної моделі Кокса встановлено, що ми не можемо його вважати незалежним прогностичним фактором (р=0,062).
Наше дослідження має кілька обмежень. Це ретроспективне дослідження, яке охоплювало пацієнтів з 2012 до 2020 рр. Протягом цього періоду стратегії терапії відрізнялися, тому хворі мали відмінності протоколів лікування, а також кількості циклів хіміотерапії. Оцінку ПСС проводили лише для аденокарцином, тому питання про вплив ПСС на більш рідкісні гістологічні підтипи КРР залишається неясним і потребує подальшого дослідження.
ВИСНОВКИ
ПМО є важливим чинником прогресії пухлини, тому його слід ретельно вивчати як прогностичний інструмент. ПСС можна розглядати як незалежний прогностичний фактор для КРК і легко оцінити під час рутинного гістологічного дослідження. ПІЛ мають значний потенціал в якості прогностичного фактора для КРР, хоча і не виявилися незалежною прогностичною ознакою та потребують більш детального та поглибленого вивчення. Існує високий рівень погодженості між патологами в оцінці ПСС та ПІЛ.
Конфлікт інтересів: автори заявляють про відсутність конфлікту інтересів.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Cancer Today. Iarc.fr. Accessed March 18, 2024. Retrieved from: gco.iarc.fr/today/data/factsheets/cancers/8-Colon-fact-sheet.pdf.
2. Henderson, R. H., French, D., Maughan, T., Adams, R., Allemani, C., Minicozzi, P., … Lawler, M. (2021). The economic burden of colorectal cancer across Europe: a population-based cost-of-illness study. Lancet. Gastroenterology & Hepatology, 6(9), 709–722. doi.org/10.1016/S2468-1253(21)00147-3.
3. Gelibter, A. J., Caponnetto, S., Urbano, F., Emiliani, A., Scagnoli, S., Sirgiovanni, G., … Cortesi, E. (2019). Adjuvant chemotherapy in resected colon cancer: When, how and how long? Surgical Oncology, 30, 100–107. doi.org/10.1016/j.suronc.2019.06.003.
4. Chen, Y., Zheng, X., & Wu, C. (2021). The Role of the Tumor Microenvironment and Treatment Strategies in Colorectal Cancer. Frontiers in Immunology, 12, 792691. doi.org/10.3389/fimmu.2021.792691.
5. Chen, Y., Wang, W., Jiang, B., Yao, L., Xia, F., & Li, X. (2020). Integrating Tumor Stroma Biomarkers With Clinical Indicators for Colon Cancer Survival Stratification. Frontiers in Medicine, 7, 584747. doi.org/10.3389/fmed.2020.584747.
6. Gao, J., Shen, Z., Deng, Z., & Mei, L. (2021). Impact of Tumor-Stroma Ratio on the Prognosis of Colorectal Cancer: A Systematic Review. Frontiers in Oncology, 11, 738080. doi.org/10.3389/fonc.2021.738080.
7. Zakhartseva, L. M., & Yanovytska, M. A. (2021). Prognostic value of tumor stroma ratio in triple negative breast cancer. Wiadomosci Lekarskie, 74(3 cz 2), 565–571.
8. Smit, M. A., Philipsen, M. W., Postmus, P. E., Putter, H., Tollenaar, R. A., Cohen, D., & Mesker, W. E. (2020). The prognostic value of the tumor-stroma ratio in squamous cell lung cancer, a cohort study. Cancer Treatment and Research Communications, 25, 100247. doi.org/10.1016/j.ctarc.2020.100247.
9. Strous, M. T. A., Faes, T. K. E., Gubbels, A. L. H. M., van der Linden, R. L. A., Mesker, W. E., Bosscha, K., … de Bruïne, A. P. (2022). A high tumour-stroma ratio (TSR) in colon tumours and its metastatic lymph nodes predicts poor cancer-free survival and chemo resistance. Clinical & Translational oncology, 24(6), 1047–1058. doi.org/10.1007/s12094-021-02746-y.
10. van Pelt, G. W., Kjær-Frifeldt, S., van Krieken, J. H. J. M., Al Dieri, R., Morreau, H., Tollenaar, R. A. E. M., … Mesker, W. E. (2018). Scoring the tumor-stroma ratio in colon cancer: procedure and recommendations. Virchows Archiv : an International Journal of Pathology, 473(4), 405–412. doi.org/10.1007/s00428-018-2408-z.
11. Hanahan, D., & Weinberg, R. A. (2011). Hallmarks of cancer: the next generation. Cell, 144(5), 646–674. doi.org/10.1016/j.cell.2011.02.013.
12. Rodrigo, J. P., Sánchez-Canteli, M., López, F., Wolf, G. T., Hernández-Prera, J. C., Williams, M. D., … Ferlito, A. (2021). Tumor-Infiltrating Lymphocytes in the Tumor Microenvironment of Laryngeal Squamous Cell Carcinoma: Systematic Review and Meta-Analysis. Biomedicines, 9(5), 486. doi.org/10.3390/biomedicines9050486.
13. Zakhartseva, L. M., & Yanovytska, M. O. (2020). Tumor-infiltrating lymphocytes in triple negative breast cancer. Pathologia, 0(3). doi.org/10.14739/2310-1237.2020.3.221722.
14. Volkan, A. N., Abbas, A., & Shinici, A. (Eds.). (2019). WHO classification of tumours of the digestive system (5th ed., vol. 3). Lyon : International Agency for Research on Cancer.
15. Salgado, R., Denkert, C., Demaria, S., Sirtaine, N., Klauschen, F., Pruneri, G., … Loi, S. (2015). The evaluation of tumor-infiltrating lymphocytes (TILs) in breast cancer: recommendations by an International TILs Working Group 2014. Annals of Oncology, 26(2), 259–271. doi.org/10.1093/annonc/mdu450.
16. Kanda, Y. (2013). Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplantation, 48(3), 452–458. doi.org/10.1038/bmt.2012.244.
17. Mueller, M. M., & Fusenig, N. E. (2004). Friends or foes — bipolar effects of the tumour stroma in cancer. Nature reviews. Cancer, 4(11), 839–849. doi.org/10.1038/nrc1477.
18. Balkwill, F. R., Capasso, M., & Hagemann, T. (2012). The tumor microenvironment at a glance. Journal of Cell Science, 125(23), 5591–5596. doi.org/10.1242/jcs.116392.
19. Raffaghello, L., & Dazzi, F. (2015). Classification and biology of tumour associated stromal cells. Immunology Letters, 168(2), 175–182. doi.org/10.1016/j.imlet.2015.06.016.
20. Tripathi, M., Billet, S., & Bhowmick, N. A. (2012). Understanding the role of stromal fibroblasts in cancer progression. Cell Adhesion & Migration, 6(3), 231–235. doi.org/10.4161/cam.20419.
21. Öhlund, D., Elyada, E., & Tuveson, D. (2014). Fibroblast heterogeneity in the cancer wound. Journal of Experimental Medicine, 211(8), 1503–1523. doi.org/10.1084/jem.20140692.
22. Massagué, J., & Ganesh, K. (2021). Metastasis-Initiating Cells and Ecosystems. Cancer Discovery, 11(4), 971–994. doi.org/10.1158/2159-8290.CD-21-0010.
23. Levental, K. R., Yu, H., Kass, L., Lakins, J. N., Egeblad, M., Erler, J. T., … Weaver, V. M. (2009). Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell, 139(5), 891–906. doi.org/10.1016/j.cell.2009.10.027.
24. Li, H., Yuan, S. L., Han, Z. Z., Huang, J., Cui, L., Jiang, C. Q., & Zhang, Y. (2017). Prognostic significance of the tumor-stroma ratio in gallbladder cancer. Neoplasma, 64(4), 588–593. doi.org/10.4149/neo_2017_413.
25. Wang, K., Ma, W., Wang, J., Yu, L., Zhang, X., Wang, Z., … Cheng, Y. (2012). Tumor-stroma ratio is an independent predictor for survival in esophageal squamous cell carcinoma. Journal of Thoracic Oncology, 7(9), 1457–1461. doi.org/10.1097/JTO.0b013e318260dfe8.
26. Huijbers, A., Tollenaar, R. A., v Pelt, G. W., Zeestraten, E. C., Dutton, S., McConkey, C. C., … Mesker, W. E. (2013). The proportion of tumor-stroma as a strong prognosticator for stage II and III colon cancer patients: validation in the VICTOR trial. Annals of Oncology, 24(1), 179–185. doi.org/10.1093/annonc/mds246.
27. Mesker, W. E., Junggeburt, J. M., Szuhai, K., de Heer, P., Morreau, H., Tanke, H. J., & Tollenaar, R. A. (2007). The carcinoma-stromal ratio of colon carcinoma is an independent factor for survival compared to lymph node status and tumor stage. Cellular Oncology, 29(5), 387–398. doi.org/10.1155/2007/175276.
28. Lin, B., Du, L., Li, H., Zhu, X., Cui, L., & Li, X. (2020). Tumor-infiltrating lymphocytes: Warriors fight against tumors powerfully. Biomedicine & Pharmacotherapy, 132, 110873. doi.org/10.1016/j.biopha.2020.110873.
29. Kim, J., & Bae, J. S. (2016). Tumor-Associated Macrophages and Neutrophils in Tumor Microenvironment. Mediators of Inflammation, 2016, 6058147. doi.org/10.1155/2016/6058147.
30. Hadrup, S., Donia, M., & Thor Straten, P. (2013). Effector CD4 and CD8 T cells and their role in the tumor microenvironment. Cancer Microenvironment, 6(2), 123–133. doi.org/10.1007/s12307-012-0127-6.
31. Park, Y. J., Song, B., Kim, Y. S., Kim, E. K., Lee, J. M., Lee, G. E., … Kang, C. Y. (2013). Tumor microenvironmental conversion of natural killer cells into myeloid-derived suppressor cells. Cancer Research, 73(18), 5669–5681. doi.org/10.1158/0008-5472.CAN-13-0545.
32. Germain, C., Gnjatic, S., Tamzalit, F., Knockaert, S., Remark, R., Goc, J., … Dieu-Nosjean, M. C. (2014). Presence of B cells in tertiary lymphoid structures is associated with a protective immunity in patients with lung cancer. American Journal of Respiratory And Critical Care Medicine, 189(7), 832–844. doi.org/10.1164/rccm.201309-1611OC.
33. Pernot, S., Terme, M., Voron, T., Colussi, O., Marcheteau, E., Tartour, E., & Taieb, J. (2014). Colorectal cancer and immunity: what we know and perspectives. World Journal of Gastroenterology, 20(14), 3738–3750. doi.org/10.3748/wjg.v20.i14.3738.
34. Hu, W., Sun, R., Chen, L., Zheng, X., & Jiang, J. (2019). Prognostic significance of resident CD103+CD8+ T cells in human colorectal cancer tissues. Acta Histochemica, 121(5), 657–663. doi.org/10.1016/j.acthis.2019.05.009.
35. Tao, Y., & Xie, Y. (2024). Prognostic impact of CD4+ and CD8+ tumor-infiltrating lymphocytes in patients with colorectal cancer. Acta Chirurgica Belgica, 124(1), 35–40. doi.org/10.1080/00015458.2023.2180712.
36. Denkert, C., von Minckwitz, G., Darb-Esfahani, S., Lederer, B., Heppner, B. I., Weber, K. E., … Loibl, S. (2018). Tumour-infiltrating lymphocytes and prognosis in different subtypes of breast cancer: a pooled analysis of 3771 patients treated with neoadjuvant therapy. Lancet. Oncology, 19(1), 40–50. doi.org/10.1016/S1470-2045(17)30904-X.
37. Dülgar, Ö., İlvan, Ş., & Turna, Z. H. (2020). Prognostic Factors and Tumor Infiltrating Lymphocytes in Triple Negative Breast Cancer. European Journal of Breast Health, 16(4), 276–281. doi.org/10.5152/ejbh.2020.5305.
Адреса для листування:
Шкурупій Богдана Миколаївна
04174, м. Київ, вул. Салютна, 2, буд. 9, кв. 1
E-mail: bogdana.sulimenko@gmail.com
Correspondence:
Bogdana Shkurupii
2 ap., 1 Salutna str., Kyiv, 04174
E-mail: bogdana.sulimenko@gmail.com














Leave a comment