Оцінка профілю токсичності та безпеки інтеграції метформіну в неоад’ювантну хіміотерапію раку молочної залози
- 1Комунальне некомерційне підприємство «Міська клінічна лікарня № 4» Дніпровської міської ради, Україна
- 2Дніпровський державний медичний університет, Україна
Резюме. Вступ. Кафедра онкології та медичної радіології Дніпровського державного медичного університету досліджує вплив метформіну на системне лікування раку молочної залози (РМЗ), зокрема його здатність модифікувати цитостатичний ефект хіміотерапевтичних агентів та зменшувати вираженість їх побічної дії. Метформін, що регулює проліферацію пухлинних клітин і знижує їх резистентність, також впливає на багато систем організму, включно з протизапальними та імуномодулювальними властивостями, хоча й може викликати гастроінтестинальні та гематологічні побічні ефекти. Його інтеграція до неоад’ювантної терапії значно підвищує відсоток повної патологічної відповіді з 12 до 27% (p <0,001), підкреслюючи потенціал у підвищенні результатів терапевтичного пошкодження. Вивчення профілю токсичності з хіміопрепаратами є критично важливим для подальших досліджень метформіну в онкології. Мета. Вивчення профілю клінічної токсичності та безпеки інтеграції метформіну до неоад’ювантної хіміотерапії (НАХТ) РМЗ. Матеріали і методи. Розглянуто побічні дії застосування метформіну в комбінації з НАХТ у 128 хворих на РМЗ I–III стадій. Середній вік пацієнтів становив 51,86 року (95% довірчий інтервал (ДІ) 49,73–53,99). Акцентувалася увага на щокурсовому моніторингу негативних явищ (НЯ), визначенні їх ступенів та дослідженні взаємозалежності. Пацієнти рандомізовані на 3 групи: 1-ша — контрольна, що отримувала стандартне лікування, 2-га — експериментальна, що поєднувала стандартне лікування та метформін у дозуванні 500 мг тричі на добу, та 3-тя — експериментальна, якій призначено комбінацію стандартного лікування та метформіну в дозуванні 850 мг двічі на добу. Результати дослідження. У дослідженні проаналізовані такі найчастіші ускладнення хіміотерапії (ХТ) РМЗ, як нейтропенія, діарея та нейропатія, загальна слабкість. Ступінь тяжкості симптомів оцінювали згідно із Загальними термінологічними критеріями Національного інституту раку щодо небажаних явищ (National Cancer Institute Common Terminology Criteria for Adverse Events — NCI CTCAE v5.0). Основні методи контролю нейтропенії включали щотижневу оцінку клінічного аналізу крові. Виявлено, що середній ступінь нейтропенії коливався від легкого до середнього залежно від курсу і групи, але загальний вплив метформіну на розвиток тяжкої форми нейтропенії був статистично незначущим (p >0,05), та відмічено загальну тенденцію до зниження середнього ступеня цього ускладнення з кожним наступним курсом лікування (p <0,001). За результатами оцінки проявів діареї встановлено, що взаємозв’язок між дозуванням метформіну та розвитком діареї був статистично значущим лише на 1-му курсі (p <0,05), без значущих зв’язків у подальших. За допомогою двофакторного дисперсійного аналізу зафіксовано, що протоколи лікування та дозування метформіну не мали статистично значущого впливу на розвиток чи тяжкість діареї (p >0,05). Також проведено аналіз зв’язку між курсом лікування та ступенем полінейропатії, де виявлено помірний зв’язок, який підтверджує підвищення ризику розвитку полінейропатії з кількістю пройдених курсів лікування (p <0,001). Однак зміни в ступені нейтропенії, діареї та полінейропатії не були значуще пов’язаними з різними дозуваннями метформіну. Висновки. Результати дослідження підтверджують важливість моніторингу гематологічних параметрів і потенційно корисну роль метформіну в зниженні певних хіміотерапевтичних ускладнень, хоча його вплив на більш тяжкі ступені, наприклад, нейтропенії, виявився обмеженим (p >0,05). Впровадження цього модифікатора асоціювалося з розвитком діареї при 1-му курсі лікування (p <0,05), але, починаючи з 2-го курсу, не зафіксовано звʼ’язку між подальшим використанням метформіну та цим ускладненням. Тяжкість нудоти варіювала в групах дослідження та була дещо нижчою в експериментальних групах дослідження: середні показники в 1-й експериментальній групі (500 мг метформіну) — від 0,2 до 0,54, в другій експериментальній групі (850 мг метформіну) — від 0,31 до 0,76, а в контрольній групі — від 0,5 до 0,93. Включення метформіну в клінічні протоколи може бути розглянуто як стратегічний крок для підвищення результатів лікування, однак кінцеве рішення повинно базуватися на індивідуальному аналізі кожного клінічного випадку та додаткових даних з інших досліджень.
Одержано 13.05.202
Прийнято до друку 30.05.2024
DOI: 10.32471/clinicaloncology.2663-466X.54-2.32574
ВСТУП
Профіль токсичності хіміотерапевтичного лікування має багатофакторну залежність: лікарські засоби, дозування, дозоінтенсивність, коморбідність, вік тощо. Ретельний моніторинг стану хворого, вчасна профілактика НЯ можуть значно покращити якість життя пацієнтів, що проходять цитотоксичну терапію [1].
Зазвичай основними причинами ургентної госпіталізації або корекції амбулаторного введення/лікування є ускладнення III—IV стадій за NCI CTCAE v5.0, що загрожують життю пацієнта або потребують інтенсивного лікування: нейтропенія/фебрильна нейтропенія/інфекція, анемія, тромбоцитопенія, нудота та втрата апетиту/зміна харчової поведінки, зневоднення через блювання або діарею, гострі тромбози глибоких вен або тромбоемболія легеневої артерії (ТЕЛА), порушення харчування, полінейропатія, легенева токсичність, больовий синдром, загальна втома/інтоксикаційний синдром, кардіотоксичність.
Найпоширенішими НЯ є зміни показників крові: лейкопенія, нейтропенія, анемія та тромбоцитопенія. Більшість осіб, які проходять лікування комбінованою ХТ, зазнають легкого або помірного падіння рівня лейкоцитів/нейтрофілів протягом 5–14 днів після кожного лікувального циклу. Ці показники зазвичай відновлюються до початку наступного курсу без стимулювання кісткового мозку або з використанням гранулоцитарних колонієстимулюючих факторів (Г-КСФ). Проте у випадках, коли це зниження є гострим або довготривалим, значно підвищується ризик розвитку лихоманки або системної інфекції, що становить загрозу для життя. Схеми, що зазвичай використовуються в неоад’ювантному режимі терапії РМЗ, включають застосування антрациклінів, таксанів та препаратів платини, мають близько 20% ризик розвитку фебрильної нейтропенії [2–4]. Зазначається збільшена летальність серед онкологічних пацієнтів з епізодами фебрильної нейтропенії (співвідношення ризику 0,93; 95% ДІ 0,90–0,96; різниця абсолютного ризику 3,2%; 95% ДІ –2,1% — –4,2%) [5]. Враховуючи ризики, пацієнтам, які проходять ХТ із застосуванням таксанів (такі комбінації, як TAC (доцетаксел, доксорубіцин, циклофосфамід), ТР (доцетаксел + карбоплатин) та TC (паклітаксел + карбоплатин)) або дозоінтенсивне (dose-dense) лікування в разі розвитку нейтропенічної гарячки в попередньому циклі, для зниження ризику повторного розвитку цього ускладнення призначають профілактичне введення Г-КСФ. Такий підхід використовується з метою скорочення періоду нейтропенії та зниження ризику розвитку лихоманки на тлі нейтропенії.
Іншим побічним ефектом, зв’язаним із проведенням ХТ, є нудота та блювання (хіміоіндукована нудота/блювання — ХІНБ). Хоча стандартна премедикація та постмедикація передбачає введення протиблювальних ліків, таких як ондансетрон, палоносетрон, гранісетрон або тропісетрон, у багатьох випадках цього може виявитися недостатньо.
Ці медикаменти можуть застосовуватися як окремо, так і в комбінаціях залежно від ступеня еметогенності конкретного хіміотерапевтичного режиму та його потенціалу викликати гострий та відстрочений синдром нудоти/блювання, а також індивідуальної реакції пацієнта. Більшість протоколів спеціального протипухлинного лікування, асоційованих з відстроченим ХІНБ, характеризуються підвищеною еметогенністю (підвищеним ризиком), проте деякі препарати із помірним ризиком розвитку цього НЯ також здатні викликати цей синдром середнього або тяжкого ступеня. Так, лікарські засоби — антагоністи NK1R (претупітант, нетупітант), дексаметазон і антагоністи 5-HT3 (ондансетрон, тропісетрон, гранісетрон, палоносетрон) рекомендовані для більшості пацієнтів, які проходять лікування високоеметогенними хіміотерапевтичними засобами. Найкращий спосіб запобігти розвитку затриманого синдрому ХІНБ — це почати ХТ лікування поєднано з антагоністами NK1R (нетупітант) з дексаметазоном і антагоністом 5-HT3 (палоносетроном або ондансетроном), додавши оланзапін на 1-й день курсу, а потім продовжити приймати дексаметазон протягом 2–4 днів з оланзапіном [6].
Основна частина клінічних досліджень ХІНБ фокусується на внутрішньовенних методах ХТ, що залишає прогалину у знаннях щодо профілактики ХІНБ при застосуванні пероральних хіміотерапевтичних препаратів. Враховуючи це, на сьогодні існує необхідність у подальших дослідженнях для розробки відповідних рекомендацій щодо ефективної протиблювальної профілактики в цьому контексті. Терапія віддаленого синдрому ХІНБ зазвичай лікується амбулаторно при незначних та помірних проявах. Найбільш поширеною схемою є використання ондансетрону або гранісетрону поєднано із дексаметазоном та опційним додаванням оланзапіну [7].
НЯ, що значно впливає на загальний стан хворого, у контексті дослідження, є системна ХТ-індукована полінейропатія (ХІПП). В оновлених рекомендаціях Американського товариства клінічної онкології (American Society of Clinical Oncology — ASCO) констатують, що токсичність, асоційована із застосуванням таксанів, є однією з найпоширеніших груп препаратів для НАХТ РМЗ, пов’язана з ризиком розвитку як моторної, так і сенсорної нейропатії. Цей ризик залежить від дозування і схеми лікування та має кумулятивний характер. Нейропатія середнього та тяжкого ступенів розвивається у значної частки пацієнтів. У 25–30% хворих, що отримують паклітаксел, розвивається нейропатія II–IV ступеня за класифікацією NCI CTCAE v5.0, тоді як при застосуванні доцетакселу цей показник становить 15–20%. Тяжкі форми нейропатії II–IV ступеня відмічають до 10 та до 5% відповідно [8].
Своєчасне розпізнавання ранніх проявів полінейропатії, коригування дозування ХТ або тимчасове припинення лікування можуть пом’якшити або навіть запобігти подальшому розвитку симптомів. Після припинення або закінчення лікування вираженість симптомів, зазвичай, поступово зменшується, хоча в тяжких випадках одужання може бути неповним. Важливо зазначити, що паклітаксел також може спричинити гострий больовий синдром через 24–48 год після введення. Застосування нестероїдних протизапальних препаратів (НПЗП) поєднано з дексаметазоном та дулоксетином зазвичай допомагає швидко усунути симптоми. Згідно з чинними протоколами Австралійської спілки медичних онкологів (Medical Oncology Group of Australia — MOGA) (рекомендації eviQ) рекомендована постмедикація дексаметазоном на 2-й та 3-й день курсу [9].
Щодо лікування ХІПП, дулоксетин є ефективною опцією, тоді як інші засоби, такі як габапентин та трициклічні антидепресанти, не виявляють однозначної доказової користі [10]. Проте в ситуаціях з обмеженими альтернативами спроба терапії цими препаратами може бути виправдана. Пацієнтам зі значним накопиченням симптомів і функціональним дефіцитом рекомендується розглядати зниження дози спеціального лікування як стратегію корекції НЯ, зокрема й полінейропатії.
Одним з лікарських засобів, які мають доведений антиполінейропатичний ефект, є метформін. У дослідженні В.М. El-Fatatry та співавт. щодо оксаліплатин-асоційованої полінейропатії, група пацієнтів, що приймала метформін, мала значно меншу кількість випадків розвитку ускладнень II та III ступенів (60% проти 95%, p=0,009) [11], а середні рівні біохімічних маркерів нейротоксичності були значно нижчими в групі метформіну при вимірюванні після 6-го та 12-го курсів лікування.
Проте вивчення метформіну достатньо обмежене, а в оновлених рекомендаціях ASCO 2020 р. поки що стверджується, що лікарі не повинні пропонувати метформін для профілактики хіміоіндукованої полінейропатії у пацієнтів, які отримують терапію нейротоксичними агентами [12].
Діарея під час ХТ є ще одним складним та багатофакторним побічним ефектом, який трапляється у більшої частки пацієнтів. Хіміотерапевтичні препарати, які застосовують для боротьби з раковими клітинами, не є селективними у своїй дії. Вони також можуть впливати на здорові клітини, зокрема на клітини слизової оболонки шлунково-кишкового тракту. Це може призвести до розладів шлунково-кишкової системи, зниження її здатності всмоктувати воду і поживні речовини, що й спричиняє діарею. Крім того, зміни, що відбуваються в мікрофлорі кишечнику внаслідок ХТ, можуть порушити нормальний баланс бактерій. Це, зі свого боку, сприяє розвитку діареї, оскільки здоровий баланс мікрофлори є ключовим для правильної роботи травної системи [13].
Зниження імунної відповіді організму під час ХТ підвищує ризик розвитку інфекцій, які можуть спричинити або підвищити тяжкість діареї. Однією з таких причин може бути нейтропенія, викликана застосуванням цитостатичних препаратів.
До факторів, які впливають на розвиток діареї, також належить взаємодія з іншими ліками та зміни в харчуванні, які можуть виникнути під час лікування. Не менш важливим є емоційний стан пацієнта, адже стрес і тривога можуть впливати на роботу травної системи, спричиняючи розвиток або підвищуючи ступінь тяжкості діареї (синдром подразненого кишечнику) [14].
Модифікація ефектів системного лікування РМЗ, зокрема і зменшення кількості НЯ терапії, є предметом вивчення кафедри онкології та медичної радіології Дніпровського державного медичного університету [15]. Метформін, що впливає на регуляцію проліферації пухлин і знижує розвиток резистентності в клітинах РМЗ, є одним з модифікаторів дії хіміотерапевтичних агентів [16]. М.А. Galal та співавт. в оглядовому метааналізі ролі метформіну в онкології доводять, що він може пригнічувати різні сигнальні шляхи, зокрема РМЗ. Застосування метформіну асоціювалося з отриманням більшого терапевтичного ураження пухлини, підвищенням показників загальної виживаності. Ці дослідження підкреслюють багатогранну роль метформіну в терапії РМЗ, вказуючи на його потенціал [17]. До того ж метформін має багатовекторну дію, зокрема на слизову оболонку шлунково-кишкового тракту, печінку, мікробіоту, зумовлює протизапальні та імуномодулювальні властивості [18], але при цьому може сприяти розвитку низки гастроентерологічних [19] НЯ, що обмежують його застосування.
Беручи до уваги НЯ ХТ, що, зокрема, пов’язані з додаванням до неї метформіну, механізми розвитку інтестинальних симптомів дослідили L.X. Cubeddu та співавт. в дослідженні ефектів цього препарату. У його результатах доведено, що низька концентрація метформіну (підпорогова активація аденозинмонофосфат-активованої протеїнкінази) стимулює вивільнення 5-гідрокситриптаміну (5-HT) у зразках біопсії тканини слизової оболонки дванадцятипалої кишки людини, що може пояснити діарею та блювання через центральну нервову систему. Однак антагоністи рецепторів 5-НТ3 не впливають на стимульоване метформіном вивільнення 5-НТ3 у лабораторних зразках або розвиток діареї у пацієнтів, яким призначено метформін [20, 21].
Враховуючи вищесказане, вивчення профілю токсичності комбінацій хіміопрепаратів поєднано з метформіном є вкрай важливою умовою його подальших досліджень.
МЕТА
Вивчення профілю клінічної токсичності та безпеки інтеграції метформіну до НАХТ РМЗ.
МАТЕРІАЛИ І МЕТОДИ
У дослідження залучено 128 хворих на РМЗ, які лікувалися в Комунальному некомерційному підприємстві «Міська клінічна лікарня № 4» Дніпровської міської ради в період з листопада 2020 до лютого 2024 р., на початку терапії мали стадії І–ІІІ (T1-4, N1-3, M0, G1-3 згідно з Керівництвом щодо стадіювання раку (Cancer Staging Manual) Об’єднаного американського комітету з раку (American Joint Committee on Cancer — AJCC), 8-ма редакція від 2018 р.), що потребували НАПХТ за рішенням міждисциплінарної команди (МДК) (наказ по закладу № 31). Середній вік становив 51,86 року (95% ДІ 49,73–53,99), а мінімальний — 36 років. Для встановлення стадії використовувалося мануальне обстеження, рентгенологічне дослідження (мамографія, комп’ютерна томографія (КТ) з внутрішньовенним контрастуванням), ультразвукова діагностика (УЗД) та дані гістологічного та імуногістохімічного досліджень. Цукровий діабет (будь-якого типу) та застосування метформіну з метою його лікування або з іншою метою були критеріями виключення з дослідження.
Усіх хворих розподілено на 3 групи: перша група отримала стандартну НАХТ з додаванням метформіну в дозі 500 мг тричі на добу, друга — стандартну НАХТ та метформін у дозуванні 850 мг двічі на добу, а третя контрольна група отримала тільки стандартну НАХТ. Стандартна НАХТ включала 5 варіантів лікування із застосуванням антрациклінів, без антрациклінів та за необхідності з додаванням трастузумабу. Біологічне профілювання пухлини проводилося шляхом імуногістохімічного дослідження, у разі потреби проводилася флюоресцентна in situ гібридизація для уточнення наявності ампліфікації HER2. Тактика лікування узгоджувалася мультидисциплінарною командою лікарні. У лікуванні не застосовувалися дозоінтенсивні режими, пертузумаб або імунотерапія. Залежно від клінічної індикації пацієнта, підтипу його пухлинного процесу, кардіологічного анамнезу (кардіологічного скринінгу, що включає УЗД серця та електрокардіографію) обирався або протокол лікування на основі антрациклінів, або без їх застосування. Для хворих із Her-2/neu або люмінальним В Her-2/neu позитивним РМЗ підхід до вибору схеми такий же самий, але з додаванням трастузумабу.
Лабораторний контроль проводиться щотижнево, оцінка клініко-симптоматичних даних — кожні 3 тиж (під час проведення курсу ХТ). Після проходження всього передопераційного етапу лікування хворі заповнювали спеціально розроблену гугл-форму для оцінки симптомів та наслідків проведеного лікування.
Хірургічне лікування з наступним гістологічним дослідженням пухлини проводилося не раніше 21 дня та не пізніше 42 днів від проведення останнього курсу ХТ за умови повноцінного соматичного та лабораторного відновлення пацієнта. Найчастіше операцію виконували протягом 4-го тиж після закінчення НАХТ. Усі хворі, що були включені в дослідження, отримували лікування на основі таксанів із додаванням або без антрациклінів (4АС + 4Т або 4АС +12Т, 4–8к ТС) з додаванням або без трастузумабу (залежно від гіперекспресії або ампліфікації HER2).
Статистична обробка проводилася за допомогою надбудови StatPlus v7.8.4 (Build 01/05/2022)/Українська Excel PC 16.0.17328.20184/uk-UAMicrosoft Edge @ Windows NT 10.0, IBM SPSS Statistic v27.0.1.0., Minitab 19. Product version: Minitab® 19.1.1 (64-bit). Для візуалізації графіків, вторинного статистичного розрахунку, а також написання коду (мова програмування pyton), використано програмне забезпечення PyCharm v2023.3 із використанням відповідних бібліотек: autograd v1.6.2, autograd-gamma v0.5.0, contourpy v1.2.0, cycler v0.12.1, fonttools v4.50.0, formulaic v1.0.1, future v1.0.0, interface-meta v1.3.0, kiwisolver v1.4.5, lifelines v0.28.0, matplotlib v3.8.3, numpy v1.26.4, packaging v24.0, pandas v2.2.1, pillow v10.2.0, pip v23.2.1, pyparsing v3.1.2, python-dateutil v2.9.0.post0, pytz v2024.1, scipy v1.12.0, six v1.16.0, typing_extensions 4.10.0, tzdata v2024.1, wrapt v1.16.0.
Для оцінки результатів дослідження проводився статистичний аналіз, до якого належало використання стандартних методів описової та аналітичної (параметричної та непараметричної) статистики, а також багатовимірний аналіз, регресійний аналіз, логістичний аналіз та формування алгоритму випадкового лісу для формування математичної моделі.
Перевірка гіпотези щодо нормальності розподілу кількісних ознак проводилася за критеріями Шапіро — Уїлка та Колмогорова — Смірнова, перевірка рівності дисперсії — за критеріями Фішера. Для опису варіації кількісних ознак при нормальному розподілі використовували середню арифметичну (M), стандартне відхилення (SD) та 95% ДІ; при асиметричному — медіану (Ме), інтерквартильний розмах (25%; 75%) та 95% ДІ медіани. Критичний рівень статистичної значущості відмінностей для критерію Шапіро — Уїлка становив р <0,05, для інших критеріїв використовували 3 рівні — р <0,05; р <0,01 та р <0,001.
Для якісних ознак розраховувалися відносні показники — інтенсивні (частоти), екстенсивні (%). 95% ДІ для відносних величин розраховувався за методом нормальної апроксимації Вальда.
Для визначення взаємозв’язку між досліджуваними параметрами використовувалися методи одно-, дво- та трифакторного дисперсійного аналізу (analysis of variance — ANOVA) з використанням пост-гок критеріїв Шеффе, Бонферроні, Фішера LSD та Тьюкі — Крамера для нормального розподілення ознаки, а для ненормального розподілення тест Краскела — Уолліса. Оцінювання достовірності впливу фактора на досліджуваний параметр визначається за критерієм p-value, він приймався як значущий, якщо становив p <0,05.
Отримано персональну згоду пацієнта на обробку персональних даних, проведення лікування, діагностичні процедури, зокрема інвазійні, форма згідно з наказом Міністерства охорони здоров’я (МОЗ) України від 29.09.2012 р. № 751. Враховуючи, що дані, представлені в цій роботі, є частиною науково-дослідницької роботи кафедри онкології та медичної радіології Дніпровського державного медичного університету, у кожного хворого зібрано інформовану згоду на участь у дослідженні, зокрема й проведення анкетування за допомогою гугл-форм щодо НЯ лікування.
РЕЗУЛЬТАТИ ТА ОБГОВОРЕННЯ
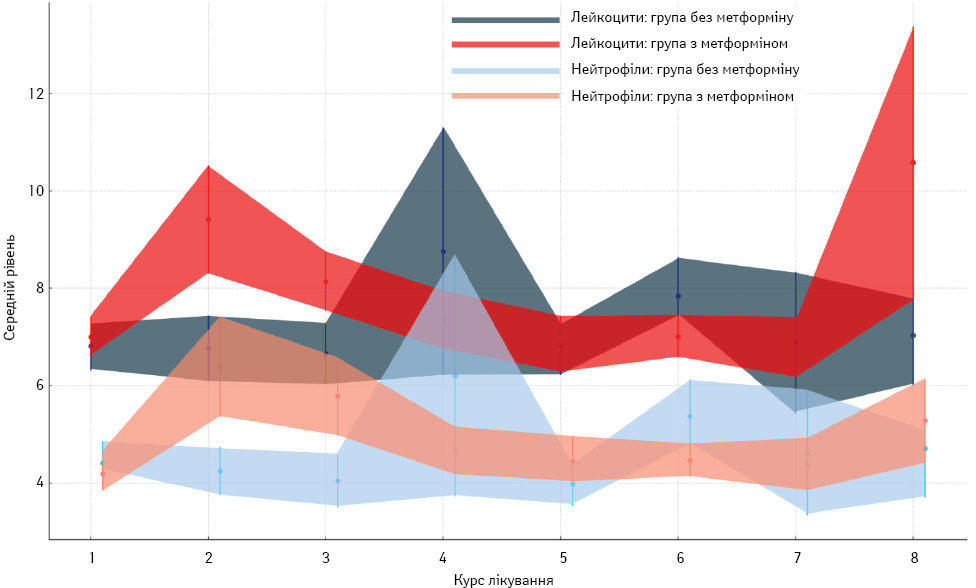
Одним з найбільш частих НЯ проведення цитостатичного лікування є зниження загальної кількості лейкоцитів та нейтрофілів. Ризики розвитку гематологічних ускладнень у хворих на РМЗ при проходженні НАХТ у дослідженні контролювалися щотижнево методом оцінки клінічного аналізу крові з лейкоформулою. При зниженні показників нейтрофілів нижче II ступеня (<1,5) проводилася терапія Г-КСФ через ризик розвитку фебрильної нейтропенії із подальшим превентивним застосуванням філграстиму в період 24–72 год після введення цитостатичних ЛЗ. При розвитку нейтропенії III та IV ступенів проводився моніторинг температури тіла та при розвитку гарячки призначалася антибіотикотерапія. Загальний розподіл ступенів нейтропенії представлено на рис. 1 та 2. За розподілом у контрольній групі (без використання метформіну) середній ступінь нейтропенії змінюється від 0,66 (8-й курс) до 1,97 (4-й курс). У першій експериментальній групі (метформін 500 мг тричі на добу) середній ступінь нейтропенії змінювався від 0,70 (8-й курс) до 1,76 (4-й курс). У другій експериментальній групі (метформін 850 мг двічі на добу) середній ступінь нейтропенії змінювався від 0,79 (8-й курс) до 2,00 (2-й курс). Мінімальні та максимальні значення для всіх груп дослідження становили від 0 до IV ступеня (рис. 1).
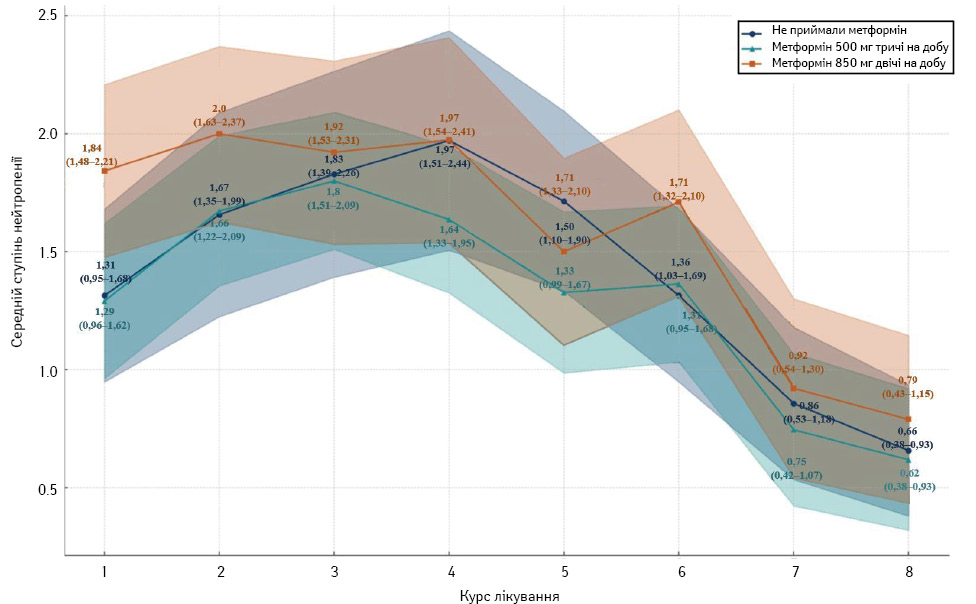
При регресійному аналізі для оцінювання взаємозв’язку між групою прийому метформіну, курсом лікування та ступенем тяжкості нейтропенії встановлений коефіцієнт для групи метформіну становить 0,0874 (p >0,05). Це свідчить про статистично не значущий вплив між інтеграцією метформіну до НАХТ та ризиком розвитку більш тяжкого ступеня нейтропенії, а коефіцієнт для кожного наступного курсу лікування становив −0,1390 (p <0,001), що свідчить про достовірне зниження ступеня зниження гранулоцитів з кожним наступним курсом терапії.
Втім, коефіцієнт детермінації значно занижений (R-squared=0,067), що пояснює лише 6,7% варіації у ступенях тяжкості нейтропенії. Це вказує на наявність інших факторів, які також можуть впливати на ступінь цього гематологічного ускладнення, крім групи метформіну та номера курсу. Враховуючи, що між групами дослідження не виявлено статистичної різниці в ступенях прояву нейтропенії, середні показники лейкоцитів та нейтрофілів перед початком кожного курсу лікування відображені на рис. 2, а розподіл ступенів нейтропенії впродовж усіх курсів терапії наведено на рис. 3.
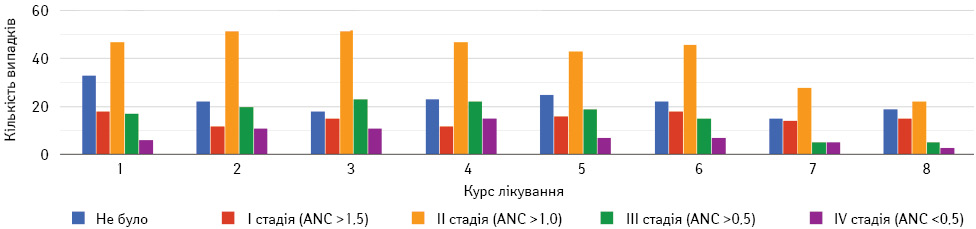
Згідно з проведеним статистичним аналізом, метформін не впливає на ризик розвитку фебрильної нейтропенії та не потенціює більш виражений ступінь цього ускладнення. Методи превенції та боротьби з цим НЯ такі самі, як й при стандартній цитостатичній терапії, та потребують такого ж моніторингу стану хворого.
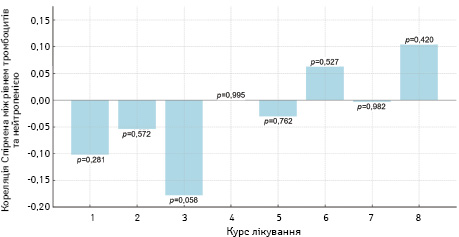
Іншим питанням є оцінка ступенів тромбоцитопенії через селективне пригнічення роботи Г-КСФ, зокрема й пролонгованої дії, тому оцінка ступенів її розвитку та залежність від нейтропенії є важливим питанням дослідження. У всіх курсах лікування p-значення >0,05, що вказує на відсутність статистично значущої кореляції між рівнем тромбоцитів та фебрильною нейтропенією. Проте найнижче p-значення відмічалося у хворих під час 3-го курсу НАХТ (p=0,058), що хоч і близьке до порогу в 0,05, усе ж не досягає статистичної значущості. Відмічаються деякі коливання між курсами, але оскільки всі p >0,05 перевищують порогове значення, це не вказує на наявність явної тенденції або взаємозв’язку. За допомогою кореляційного аналізу Спірмена (рис. 4) встановлена відсутність статистичного зв’язку між рівнем тромбоцитів і ступенем тяжкості нейтропенії. Враховуючи те, що жоден пацієнт у дослідженні не мав тяжкого або середнього ступеня тромбоцитопенії, подальше визначення статистичного зв’язку між рівнями тромбоцитів та гранулоцитів серед груп дослідження не проводилося.
Як зафіксовано в дослідженні, деякі пацієнти мали діарею легкого та середнього ступенів. Це НЯ досягло найбільшої вираженості під час 1-го курсу лікування з поступовим зменшенням у наступних курсах. Найчастіше розвивалася діарея I ступеня NCI CTCAE v5.0 (w.5) — 39,06% (n=50), значно менше II ступеня — 5,47% (n=7) та ще менше III ступеня — 1,56% (n=2), що також встановлено при розрахунку відношення шансів (odds ratio (OR) 3,1354; 95% ДІ 1,2409–7,9223, p <0,05). Жодного випадку діареї IV ступеня не відмічено. Розвиток діареї був статистично значуще виявлений тільки під час 1-го курсу лікування незалежно від дозування, що асоціювалося з першим застосуванням метформіну (U статистика=2084, p <0,05). При подальшому спостереженні та аналізі середніх показників вираженості проявів та частоти діареї не були вищими, ніж у групі контролю. У контрольній групі дослідження найвища середня тяжкість діареї відмічалася на 1-му курсі з поступовим зниженням у наступних курсах. В усіх групах дослідження середній прояв діареї мав тенденцію до зниження впродовж усього курсу НАХТ. В експериментальних групах «Метформін 500 мг тричі на добу» та «Метформін 850 мг двічі на добу» варіація середніх значень від 0,56 та 0,66 на 1-му курсі лікування до 0,09 та 0,16 на останньому курсі відповідна до деяких коливань (рис. 5).
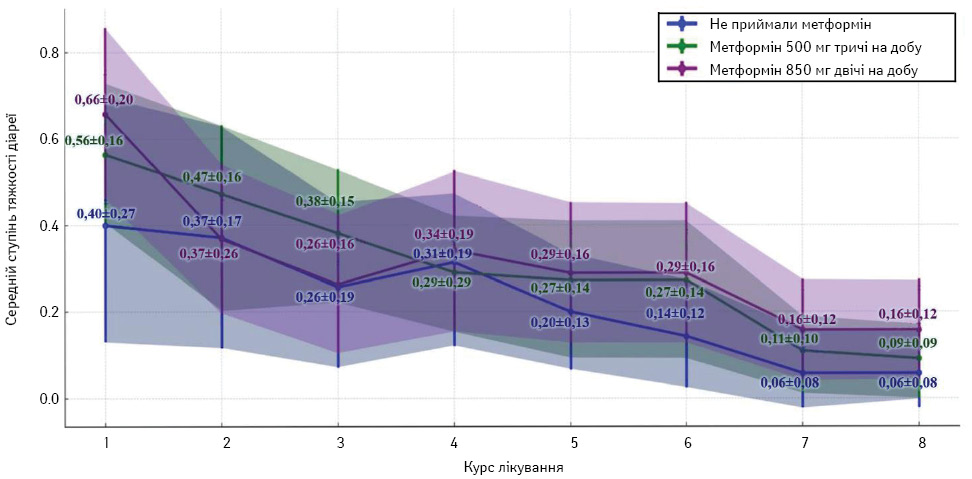
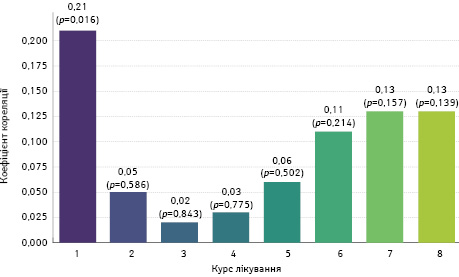
Враховуючи ненормальності розподілу ознак (критерій Шапіро —Уїлка р <0,05), проведено кореляційний аналіз Крускала — Волліса та визначено низький, але достовірний зв’язок між діареєю та дозуванням метформіну 0,21 (p <0,05). Починаючи з 2-го курсу лікування, статистичної значущої різниці між групами не виявлено (p >0,05). Проведено подальший статистичний аналіз для виявлення залежності між розвитком діареї та хіміотерапевтичних інтервенцій. Різні протоколи НАХТ не асоціювалися з більш вираженим проявом НЯ або з підвищенням його частоти (p >0,05). Залежність ступеня діареї від дозування метформіну проведено за допомогою кореляційного аналізу Спірмена. Встановлено, що різні дози метформіну не потенціюють більш виражену діарею. Не знайдено доказів того, що різні умови лікування чи дозування метформіну мали статистично значущий вплив на ступінь діареї у пацієнтів.
Загальний розподіл цього симптому в дослідженні відображено на рис. 6. Зазвичай розвиток діареї відмічався впродовж 1-го тиж 1-го курсу НАХТ, що потребувало виключення фебрильної нейтропенії/нейтропенії. Стандартним алгоритмом дії було наступне:
1) припинення застосування метформіну на 4 дні;
2) прийом лопераміду, що зазначено в офіційній інструкції;
3) рясне пиття, якщо діарея II або вище ступеня;
4) контроль клінічного аналізу крові.
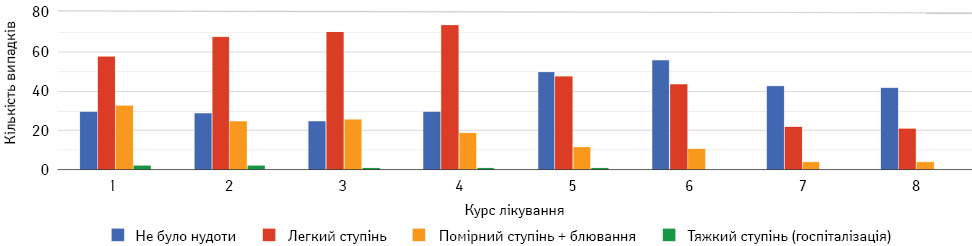
Нудота є поширеним симптомом проведення спеціального протипухлинного лікування. Протоколи терапії, що використовувалися в дослідженні, мають високий еметогенний потенціал, а розподіл симптому в загальній вибірці представлено на рис. 7.
При статистичному аналізі використовувалася градація симптомів від 0 (відсутній симптом) до 3 (тяжкий перебіг ХІНБ) NCI CTCAE v5.0. У контрольній групі середні показники ступеня тяжкості нудоти коливаються від 0,5 до 0,93 на різних курсах, а медіани варіюють від 0,5 до 1, що вказує на загальну наявність симптому. Серед першої експериментальної групи середні значення варіюють від 0,2 до 0,54, що нижче, ніж у контрольній групі, а медіани переважно на рівні 0 або 1 з нижчими показниками на пізніших курсах. Слід зазначити, що мінімальні та максимальні показники фіксують, що є курси з відсутністю нудоти. Серед 2-ї експериментальної групи (метформін 850 мг двічі на добу) середні значення тяжкості нудоти варіюють від 0,31 до 0,76, що також нижче, ніж у контрольній групі, медіани варіюють від 0 до 1 з відносно низькими значеннями на пізніших курсах. Зменшення вираженості середніх проявів симптому, починаючи з 5-го курсу НАХТ, пов’язано із застосуванням паклітакселу в монорежимі, що відповідає його профілю токсичності (рис. 8).
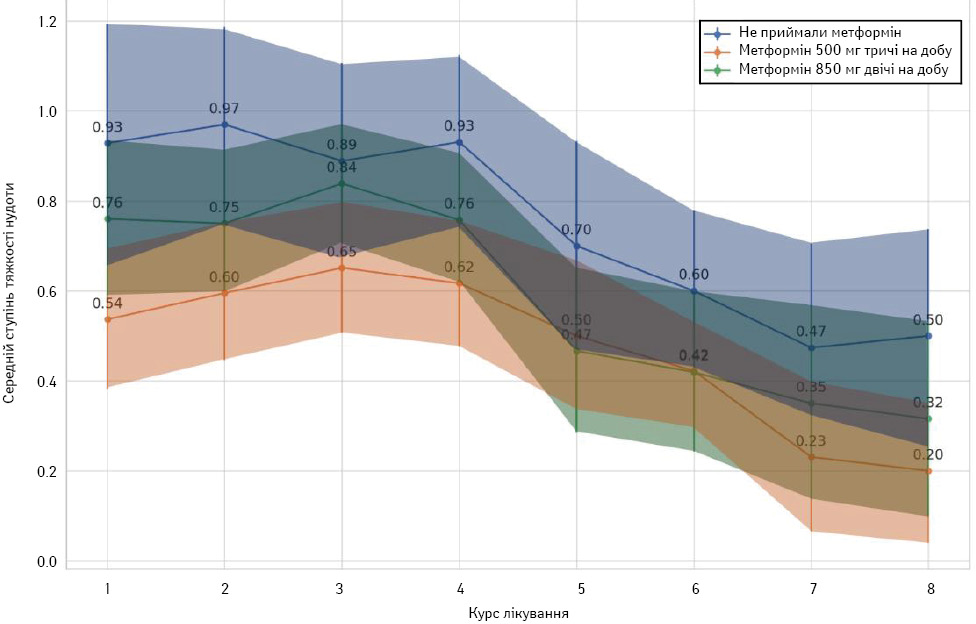
Прийом метформіну може виявитися корисною опцією для зниження середнього рівня та варіативності нудоти, особливо в групі з дозуванням 500 мг тричі на добу. Варіабельність та максимальні показники є ознаками того, що, хоча метформін може допомогти знизити загальний ступінь тяжкості нудоти, індивідуальні випадки тяжкого прояву симптому все ще можливі, тому це не нівелює проведення базової антиеметичної терапії та контролю симптому у відстрочений період.
У результатах кореляційного аналізу Спірмена встановлено монотонну залежність між рівнями тяжкості нудоти серед різних груп дослідження на всіх курсах НАХТ. Так, між групою «Не приймали метформін» та групою «Метформін 500 мг тричі на добу» кореляція становить 0,81 (p=0,01), що вказує на доволі сильний позитивний зв’язок. Між групою «Не приймають метформін» та групою «Метформін 850 мг двічі на добу» кореляція становить 0,74 (p <0,05), що також вказує на сильний позитивний зв’язок, але трохи слабший порівняно з 1-ю групою. Між групами «Метформін 500 мг тричі на добу» та «Метформін 850 мг двічі на добу» кореляція становить 0,93 (p <0,0001), що вказує на дуже сильний позитивний зв’язок. У результатах зафіксовано, що патерни змін ступеня тяжкості нудоти схожі між групами, що приймали метформін, та вказує на те, що він має схожий вплив зниження ХІНБ, хоча потрібні подальші дослідження для більш точних висновків.
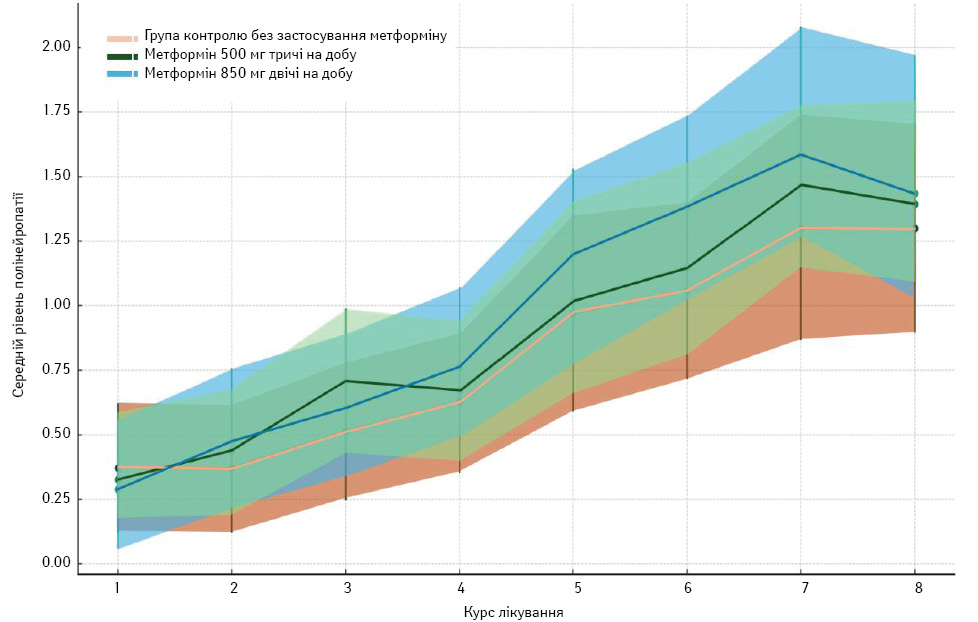
Зазвичай цитостатичними препаратами з нейротоксичним ефектом є паклітаксел та доцетаксел. Зазначено, що метформін може знижувати ступінь полінейропатії, проте рівні розвитку цього ускладнення не були статистично значущими. Незважаючи на інтеграцію до схем лікування лікарських засобів, що знижують ступінь або можуть вилікувати полінейропатію, загальна тенденція все ж до збільшення середніх рівнів вираженості цього ускладнення не тільки в контексті цього дослідження.
При кореляційному аналізі за Спірменом між курсом лікування та ступенем патоморфозу коефіцієнт становив 0,413 (p <0,001), що вказує на помірний зв’язок з прогресуванням полінейропатії на тлі проведення цитостатичного лікування. Вираженої різниці між групами дослідження та динамікою розвитку полінейропатії не виявлено (рис. 9). Серед груп дослідження кореляція за Спірменом становила в контрольній групі 0,389 (p <0,001), першій експериментальній групі — 0,414 (p <0,001), а в другій експериментальній групі — 0,432 (p <0,001), що підтверджує статистично значущу помірно-позитивну кореляцію.
Для проведення клінічних досліджень різних методів терапії злоякісних новоутворень слід використовувати стандартні критерії для вимірювання впливу хвороби на повсякденну активність пацієнта. Одним із таких інструментів є шкала PS ECOG. Вона характеризує рівень функціонального стану хворого з урахуванням його фізичної активності та спроможності догляду за собою. Середній розподіл зниження фізичної активності пацієнтів у дослідженні залежно від курсу лікування відображено на рис. 10.
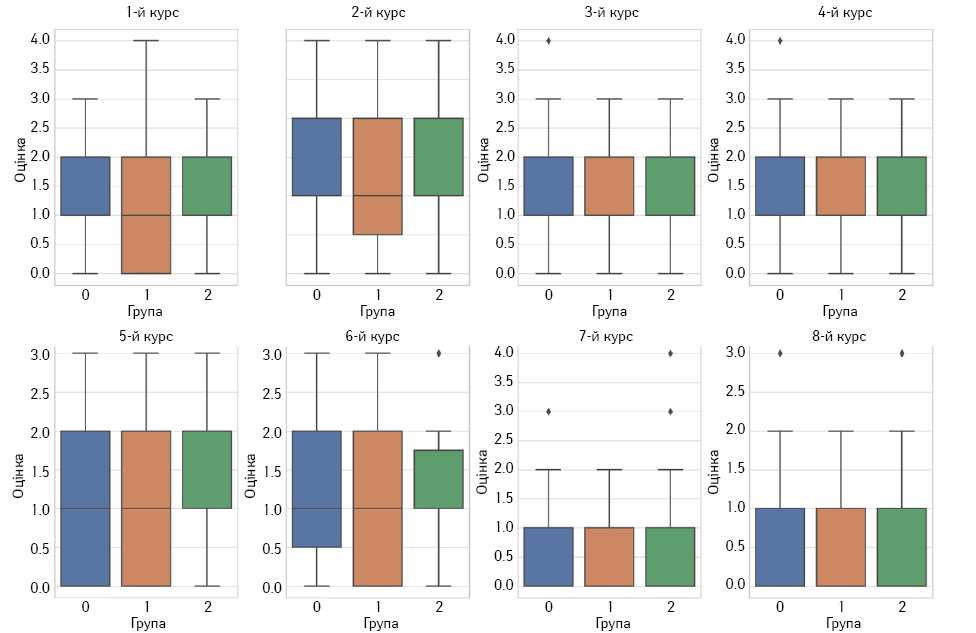
При статистичному аналізі першочергово перевірено нормальність розподілу. За результатами тесту Шапіро — Уїлка розподіли оцінок PS ECOG між курсами НАХТ у всіх групах мають p <0,05, що відкидає нульову гіпотезу про нормальність розподілу, тому для подальшого порівняння використовувався аналіз Крускала — Волліса та за його результатами p-value >0,05 для всіх курсів та ECOG-статусу. Це означає, що не знайдено статистично значущих відмінностей між 3 групами дослідження щодо кожного з курсів лікування. З цього можна зробити висновок, що курси НАХТ мають схожий вплив на пацієнтів у всіх 3 групах незалежно від дозування метформіну або відсутності його прийому.
Аналізи результатів кореляційного аналізу Крускела — Волліса та Спірмена між рівнями загальної слабкості (за шкалою PS ECOG) та нейтропенією за курсами терапії, дозволяє зробити наступні висновки:
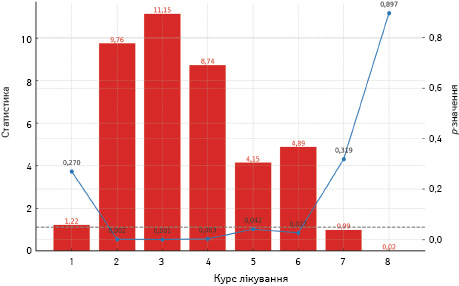
- показники аналізу Крускала — Волліса вказують на статистично значущі відмінності між групами для 2–6 курсів, що свідчить про наявність відмінностей у розподілі рівнів PS ECOG і нейтропенії (рис. 11). Особливо сильні відмінності фіксуються в 2-му та 3-му курсах, де p-значення є надзвичайно низькими. Проте для 1-го, 7-го, і 8-го курсів значущих відмінностей не виявлено, що може свідчити про більш однорідний вплив цих курсів терапії на спостережувані показники. Показники кореляції Спірмена свідчать про позитивний кореляційний зв’язок від помірного до сильного між загальною слабкістю і нейтропенією в усіх курсах, що фіксує тенденцію до збільшення 1-го показника при збільшенні іншого. Найсильніший кореляційний звʼязок відмічається у 7-му курсі з коефіцієнтом 0,419. Це може бути ознакою зростання впливу нейтропенії на ECOG-статус у цей період лікування. Усі курси мають статистично значущі p-значення, що підтверджує надійність виявлених кореляцій.
Клінічна імплементація. Метформін виявився перспективною опцією, що може інтегруватися до системної терапії РМЗ. У дослідженні цього лікарського засобу встановлено, що він не призводить до статистично значущого підвищення ступеня тяжкості нейтропенії та сприяє більш стабільному рівню гранулоцитів під час курсів НАХТ. Це забезпечує потенційне зниження ризику розвитку фебрильної нейтропенії та можливість зниження потреби у використанні Г-КСФ та філграстиму, які є стандартними методами профілактики та лікування нейтропенії. Його основним НЯ є розвиток діареї на 1-му курсі лікування, що визначається як перший контакт з препаратом. Це визначає необхідність забезпечення регулярного моніторингу пацієнтів для своєчасного виявлення і корекції гастроінтестинальних симптомів та загальної слабкості, а застосування препаратів терапії супроводу корекції побічних ефектів може значно поліпшити загальний стан хворих. Не виявлено статистично значущого зв’язку між групами дослідження, що приймали додатково метформін та без його застосування, тому такі симптоми, як нудота, загальна слабкість, діарея, починаючи з 2-го курсу НАХТ, нейтропенії та тромбоцитопенії потребують загальновизначеного підходу до корекції.
Клінічні рекомендації на основі цих результатів можуть включати розгляд додавання метформіну як допоміжного засобу до стандартного протоколу НАХТ у пацієнтів з РМЗ. Втім, потрібні подальші дослідження для оцінки впливу метформіну на інші важливі аспекти лікування раку, такі як ефективність ХТ, а в контексті неоад’ювантного лікування РМЗ — це оцінка безподійної виживаності. Так, включення метформіну в клінічні протоколи може бути розглянуто як стратегічний крок для підвищення результатів терапії, однак кінцеве рішення повинно базуватися на індивідуальному аналізі кожного клінічного випадку та додаткових даних з інших досліджень.
ВИСНОВКИ
Інтеграція метформіну до системної НАХТ РМЗ статистично достовірно збільшує досягнення повної морфологічної відповіді. Аналіз профілю токсичності підкреслює важливість динамічного моніторингу як клінічного стану хворих та їх скарг, так і лабораторних показників. Модифікація метформіном НАХТ не підвищувала частоти та вираженості більшості побічних явищ. Діарея, переважно легкого ступеня, була найбільш вираженою тільки під час 1-го курсу лікування та статистично пов’язана з додаванням метформіну (p <0,05). У пацієнтів з експериментальних груп дослідження симптоми ХІНБ були менш виражені, ніж у групі контролю. Ступінь тяжкості нудоти варіювала в групах дослідження та була дещо нижчою в експериментальних групах дослідження: середні показники в першій експериментальній групі (500 мг метформіну) — від 0,2 до 0,54, в другій експериментальній групі (850 мг метформіну) — від 0,31 до 0,76, а в контрольній групі — від 0,5 до 0,93. Згідно з аналізом інформації з наукової літератури, метформін може знижувати ступінь ХІПП, проте не помічено статистично-значущої різниці між групами дослідження (p >0,05). Загальна тенденція до підвищення рівнів полінейропатії при цитостатичному лікуванні, що асоційовано з використанням препаратів групи таксанів (p <0,001). Не встановлено суттєвого впливу на функціональний стан пацієнтів у всіх 3 групах дослідження (p >0,05). Враховуючи його безпечний профіль токсичності, вплив на досягнення морфологічної відповіді, метформін може бути включений до протоколу лікування РМЗ як метод модифікації ефекту ХТ.
Інформація щодо конфлікту інтересів. Автори заявляють про відсутність конфлікту інтересів.
Захист людини і тварин при проведенні наукового дослідження. Робота є частиною дисертації та фрагментом планової комплексної науково-дослідної роботи кафедри онкології і медичної радіології Державного закладу «Дніпровський державний медичний університет», «Удосконалення персоніфікованих методів системного лікування з урахуванням їх клінічних та молекулярно-генетичних характеристик», номер держреєстрації 0117 U 003384, термін виконання: 01.2017–11.2022». Засідання Комітету з питань біомедичної етики від 07.12.2020 р.
До роботи не належать нетрадиційні втручання на людині. Ризик для суб’єктів дослідження під час виконання роботи відсутній. Учасники, що залучаються в дослідження, інформуються про всі аспекти, пов’язані з метою, задачами, методиками та очікуваною користю дослідження. Лабораторні та інструментальні методи дослідження є загальноприйнятими, препарати, що будуть використані, дозволені до застосування. Експериментальні дослідження на людині не проводилися. Робота відповідає всім вимогам морально-етичних норм Міжнародної ради з питань гармонізації, правил належної клінічної практики (International Council on Harmonisation — ICH/good clinical practice — GCP), Гельсінської декларації (1975 р.), Конвенції Ради Європи з прав людини і біомедицини, а також законодавства України.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Hassett, M. J., O’Malley, A. J., Pakes, J. R., Newhouse, J. P., & Earle, C. C. (2006). Frequency and cost of chemotherapy-related serious adverse effects in a population sample of women with breast cancer. Journal of the National Cancer Institute, 98(16), 1108–1117. doi.org/10.1093/jnci/djj305.
2. Smith, T. J., Bohlke, K., Lyman, G. H., Carson, K. R., Crawford, J., Cross, S. J., … American Society of Clinical Oncology (2015). Recommendations for the Use of WBC Growth Factors: American Society of Clinical Oncology Clinical Practice Guideline Update. Journal of clinical oncology: official journal of the American Society of Clinical Oncology, 33(28), 3199–3212. doi.org/10.1200/JCO.2015.62.3488.
3. NCCN Clinical Practice Guidelines in Oncology: Myeloid Growth Factors, Version 1.2012. http://www.nccn.org/professionals/physician_gls/pdf/myeloid_growth.pdf (переглянуто 21 травня 2012 р.).
4. Klastersky, J., de Naurois, J., Rolston, K., Rapoport, B., Maschmeyer, G., Aapro, M., … ESMO Guidelines Committee (2016). Management of febrile neutropaenia: ESMO Clinical Practice Guidelines. Annals of oncology: official journal of the European Society for Medical Oncology, 27(5), v111–v118. doi.org/10.1093/annonc/mdw325.
5. Lyman, G. H., Dale, D. C., Culakova, E., Poniewierski, M. S., Wolff, D. A., Kuderer, N. M., … Crawford, J. (2013). The impact of the granulocyte colony-stimulating factor on chemotherapy dose intensity and cancer survival: a systematic review and meta-analysis of randomized controlled trials. Annals of oncology: official journal of the European Society for Medical Oncology, 24(10), 2475–2484. doi.org/10.1093/annonc/mdt226.
6. Okada, Y., Oba, K., Furukawa, N., Kosaka, Y., Okita, K., Yuki, S., … Aapro, M. (2019). One-Day Versus Three-Day Dexamethasone in Combination with Palonosetron for the Prevention of Chemotherapy-Induced Nausea and Vomiting: A Systematic Review and Individual Patient Data-Based Meta-Analysis. The oncologist, 24(12), 1593–1600. doi.org/10.1634/theoncologist.2019-0133.
7. Latreille, J., Pater, J., Johnston, D., Laberge, F., Stewart, D., Rusthoven, J., … Zee, B. (1998). Use of dexamethasone and granisetron in the control of delayed emesis for patients who receive highly emetogenic chemotherapy. National Cancer Institute of Canada Clinical Trials Group. Journal of clinical oncology: official journal of the American Society of Clinical Oncology, 16(3), 1174–1178. doi.org/10.1200/JCO.1998.16.3.1174.
8. Loprinzi, C. L., Lacchetti, C., Bleeker, J., Cavaletti, G., Chauhan, C., Hertz, D. L., … Hershman, D. L. (2020). Prevention and Management of Chemotherapy-Induced Peripheral Neuropathy in Survivors of Adult Cancers: ASCO Guideline Update. Journal of clinical oncology: official journal of the American Society of Clinical Oncology, 38(28), 3325–3348. doi.org/10.1200/JCO.20.01399.
9. Nitz, U., Gluz, O., Clemens, M., Malter, W., Reimer, T., Nuding, B., … Harbeck N. (2019). West German Study PlanB Trial: Adjuvant Four Cycles of Epirubicin and Cyclophosphamide Plus Docetaxel Versus Six Cycles of Docetaxel and Cyclophosphamide in HER2-Negative Early Breast Cancer. J. Clin. Oncol., 37(10), 799–808.
10. Loprinzi, C. L., Lacchetti, C., Bleeker, J., Cavaletti, G., Chauhan, C., Hertz, D. L., … Hershman, D. L. (2020). Prevention and Management of Chemotherapy-Induced Peripheral Neuropathy in Survivors of Adult Cancers: ASCO Guideline Update. JCO, 38, 3325–3348. Doi: 10.1200/JCO.20.01399.
11. El-Fatatry, B. M., Ibrahim, O. M., Hussien, F. Z., & Mostafa, T. M. (2018). Role of metformin in oxaliplatin-induced peripheral neuropathy in patients with stage III colorectal cancer: randomized, controlled study. International journal of colorectal disease, 33(12), 1675–1683. doi.org/10.1007/s00384-018-3104-9.
12. Sato, M. T., Hasegawa, T., Noma, H., Sugita, H., & Ota, E. (2023). Efficacy and safety of drug therapy for the prevention and treatment of chemotherapy-induced peripheral neuropathy: a protocol for a systematic review and network meta-analysis. BMJ Open,13(9), e070645. doi: 10.1136/bmjopen-2022-070645. PMID: 37699621; PMCID: PMC10503317.
13. Álvarez-Mercado, A. I., Del Valle Cano, A., Fernández, M. F., & Fontana L. (2023). Gut Microbiota and Breast Cancer: The Dual Role of Microbes. Cancers (Basel),15(2), 443. doi: 10.3390/cancers15020443. PMID: 36672391; PMCID: PMC9856390.
14. Kulecka, M., Zeber-Lubecka, N., Bałabas, A., Czarnowski, P., Bagińska, K., Głowienka, M., … Ostrowski, J. (2023). Diarrheal-associated gut dysbiosis in cancer and inflammatory bowel disease patients is exacerbated by Clostridioides difficile infection. Front. Cell. Infect. Microbiol., 13, 1190910. doi: 10.3389/fcimb.2023.1190910.
15. Bondarenko, I., El Hajj, M. H., Cherednichenko, N., Khodzhuzh Mohammad, I. M., & Prokhach, A. (2023). Scientific research of the Department of Oncology and Medical Radiology of Dnipro State Medical University. Radiation Diagnostics, Radiation Therapy, 13(4). doi.org/10.37336/2707-0700-2022-4-1.
16. Avierin, D. I., & Zavizion, V. F. (2023). Metformin as adjuvant option for systemic treatment of breast cancer. Medical Perspectives/Medičnì Perspektivi, 28(4).
17. Galal, M. A., Al-Rimawi, M., Hajeer, A., Dahman, H., Alouch, S., & Aljada, A. (2024). Metformin: A Dual-Role Player in Cancer Treatment and Prevention. International Journal of Molecular Sciences, 25(7), 4083. doi.org/10.3390/ijms25074083.
18. Foretz, М., Guigas, В., & Viollet, В. (2023). Metformin: update on mechanisms of action and repurposing potential. Nat. Rev. Endocrinol.,19(8), 460–476. doi: 10.1038/s41574-023-00833-4.
19. Nabrdalik, K., Skonieczna-Żydecka, K., Irlik, K., Hendel, M., Kwiendacz, H., Łoniewski, I., … Lip, G. Y. H. (2022). Gastrointestinal adverse events of metformin treatment in patients with type 2 diabetes mellitus: A systematic review, meta-analysis and meta-regression of randomized controlled trials. Front Endocrinol. (Lausanne),13, 975912. doi: 10.3389/fendo.2022.975912. PMID: 36187122; PMCID: PMC9524196.
20. Cubeddu, L. X., Bönisch, H., Göthert, M., Molderings, G., Racke, K., Ramadori, G., … & Schwörer, H. (2000). Effects of metformin on intestinal 5-hydroxytryptamine (5-HT) release and on 5-HT 3 receptors. Naunyn-Schmiedeberg’s archives of pharmacology, 361, 85–91.
21. Hoffmann, I. S., Roa, M., Torrico, F., & Cubeddu, L. X. (2003). Ondansetron and metformin-induced gastrointestinal side effects. American journal of therapeutics, 10(6), 447–451. doi.org/10.1097/00045391-200311000-00012.
Адреса для листування:
Аверін Дмитро Ігорович
49044, Дніпро, вул. В. Вернадського, 9
Дніпровський державний медичний університет
E-mail: avierin@ukr.net
Correspondence:
Dmytro Avierin
9 Volodymyr Vernadsky str., Dnipro, 49044
Dnipro State Medical University
E-mail: avierin@ukr.net














Leave a comment