Реконструкція м’яких тканин попереково-крижового відділу хребта після видалення пухлини
Жернов О.А., Ковальчук О.І., Циганков В.П.
Резюме. Вступ. Телеангіектатична остеосаркома (ТОС) хребта є рідкісним підтипом остеосарком і становить лише 0,08% усіх первинних сарком. ТОС характеризується множинними, аневризмально розширеними, заповненими кров’ю порожнинами з високозлоякісними саркоматозними клітинами в периферичному обідку та перегородках. Локалізація ТОС у попереково-крижовому відділі хребта призводить до стійких і незворотних неврологічних змін з боку нижніх кінцівок і тазових органів. Стандартом лікування багатьох онкологічних захворювань кісток і покривних тканин є комбіноване лікування. Обширна резекція злоякісних пухлин разом з ураженими навколишніми тканинами, проведення променевої терапії з розвитком дегенеративно-дистрофічних змін, оголенням кістково-зв’язкових структур хребта або спинного мозку, променевих дерматитів і некрозів, порушенням репаративних процесів призводять до складних дефектів. Мета. Вивчити та оцінити ефективність хірургічного лікування складних дефектів м’яких тканин попереково-крижового відділу хребта після видалення пухлини для наведеного клінічного випадку. Матеріали і методи. Представлений клінічний випадок закриття дефектів м’яких тканин попереково-крижово-куприкової ділянки із застосуванням двосторонніх розширених перфорантних попереково-пахових пропелерних клаптів. Висновки. Представлене клінічне спостереження підтверджує складність терапії тяжких дефектів попереково-крижово-куприкової ділянки після видалення телеангіоектатичної остеосаркоми і підкреслює важливість вибору правильної тактики хірургічного лікування останніх.
Одержано 17.04.2024
Прийнято до друку 7.05.2024
DOI: 10.32471/clinicaloncology.2663-466X.54-2.32448
ВСТУП
Стандартом терапії багатьох онкологічних захворювань кісток і покривних тканин є комбіноване лікування. Обширна резекція злоякісних пухлин разом з ураженими навколишніми тканинами, проведення променевої терапії з розвитком дегенеративно-дистрофічних змін, оголенням кістково-зв’язкових структур хребта або спинного мозку, променевих дерматитів і некрозів, порушенням репаративних процесів призводять до складних дефектів [1].
Рани поперекового відділу, які розвинулися після резекції новоутворень, можуть бути особливо складними, тому вкрай важливо закрити такі дефекти добре васкуляризованими тканинами [2, 3].
Для пластики дефектів спини використовують шкірно-жирові, шкірно-м’язові, перфорантні та мікрохірургічні клапті. Однак обмежена дуга ротації клаптів, невелика їх площина, важка доступність до реципієнтних судин не завжди досягають мети реконструкції [4, 5].
У роботі охарактеризовано використання двосторонніх розширених перфорантних попереково-пахових пропелерних клаптів.
Клінічний випадок
Пацієнт 32 років звернувся з великим дефектом м’яких тканин попереково-крижово-куприкової ділянки. З анамнезу відомо, що у 2019 р. прооперований у нейрохірургічному закладі через телеангіоектатичну остеосаркому (ТОС) попереково-крижового відділу хребта. Однак через 1,5 року розвинувся рецидив пухлини, з’явилася нижня параплегія, порушення функції тазових органів. Проведена неоад’ювантна хіміотерапія за протоколом та локальна променева терапія. Здійснена повторна резекція пухлини. Це сприяло відновленню рухів у нижніх кінцівках та функції тазових органів. У післяопераційний період розвинувся некроз м’яких тканин у місці втручання з оголенням крижової та куприкової кісток.
При надходженні пацієнт відмічає слабкість м’язів нижніх кінцівок, часткове порушення рухів, пересувається за допомогою милиць. Функція органів малого таза не порушена. Локально в попереково-крижово-куприковій зоні відмічається великий рановий дефект розміром 22×20 см (440 см²), поширюючись від L5 до нижньої частини куприка. Краї рани нерівні, підриті, місцями з ввернутим донизу епідермальним шаром. Дно дефекту представлено прилеглою крижовою, а в нижньому відділі — куприковою кістками. Поверхня крижової кістки нерівна, рясно вкрита фібринозним нашаруванням. Більша частина кістки має ділянки некрозів. З глибоких шарів відмічаються серозно-гнійні виділення. М’які тканини навколо рани дистрофічно змінені, потоншені. Шкіра гіперпігментована, підшкірна клітковина атрофована, у деяких місцях відсутня (рис. 1).
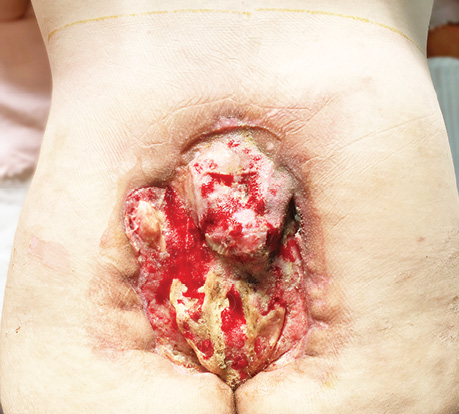
Враховуючи потребу надійного закриття ранового дефекту, а також дегенеративно-дистрофічні зміни прилеглих тканин, запланована реконструкція з використанням 2 пропелерних перфорантних клаптів з обох боків на основі поперекових артерій.
Після ультразвукового доплерівського дослідження поперекових перфорантів, найбільш придатними судинами в цьому випадку були перфоранти четвертих поперекових артерій (L4). Однак, враховуючи довжину дефекту, анатомічні розміри стандартних перфорантних клаптів L4 можуть бути недостатніми. Вирішено здійснити подовження клаптів завдяки підключенню судинного русла перфорантів глибокої та поверхневої артерій, що огинають клубову кістку (рис. 2).
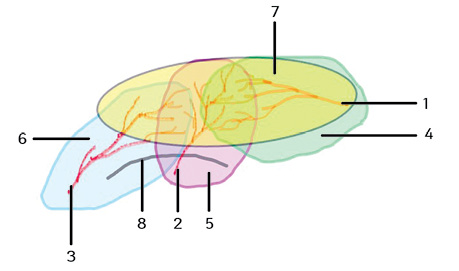
Для кращої перебудови судинного русла між перфорантами та підвищення рівня виживаності майбутніх клаптів вирішено здійснити їх хірургічне тренування.
У передопераційний період здійснили маркування клаптів. Їхнє розміщення планували в поперечно-косому напрямку донизу. Точка виходу L4 перфоранта знаходилася латерально на 9 см від остистого відростка 4-го поперекового хребця по краю м’яза-випрямляча хребта. Медіальне весло пропелерного клаптя розміщувалося на 2 см від лінії остистих відростків. Межа основного латерального весла сягала середини пахової зв’язки.
Техніка операції. Хірургічне лікування складалося з 3 етапів (з урахуванням хронічної анемії). На 1-му етапі формували розширений пропелерний клапоть з лівої сторони. Згідно з передопераційною розміткою, шкірно-фасціальний клапоть піднімали з латеральної сторони, включно з поперековою фасцією до місця виходу перфорантних судин разом з нервовою шкірною гілкою. Розміри клаптя становили 25×14 см (350 см²) При цьому судини повністю не виділяли і залишили підшкірну основу діаметром 3 см навколо (рис. 3).
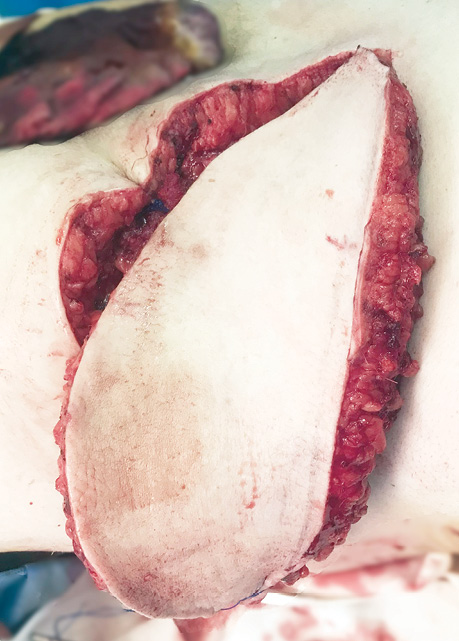
Після підйому тканин на донорську рану накладали силіконову прокладку, клапоть вкладали на місце і фіксували краї окремими швами. Через 3 доби здійснили 2-й етап — формування подібного розширеного перфорантного пропелерного клаптя з правого боку. Розміри клаптя становили 26×15 см (390 см²).
3-й, основний етап здійснили через 1 тиж після підняття першого клаптя. Виконали широку обробку крижової кістки і дна рани з видаленням патологічних кістозних утворень у кістці. Висічені краї рани. Після зняття фіксувальних швів клапті були підняті. Їх життєздатність не порушена. За допомогою гідроножа «Versajet Hydrosurgery System» (Smith and Nephew) виконано висічення фіброзно-змінених тканин на внутрішній поверхні клаптів, а також дебридмент дефекту (рис. 4, 5).
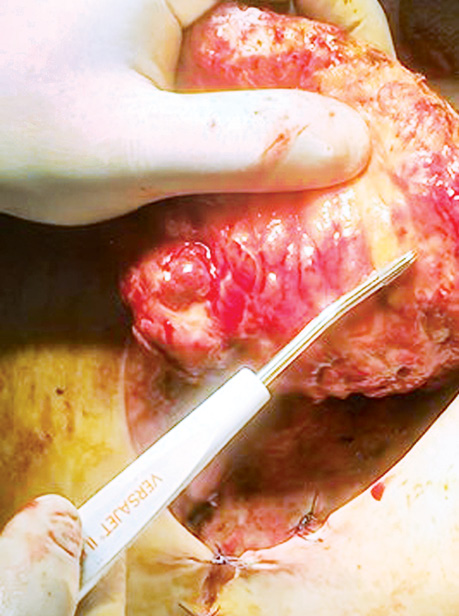
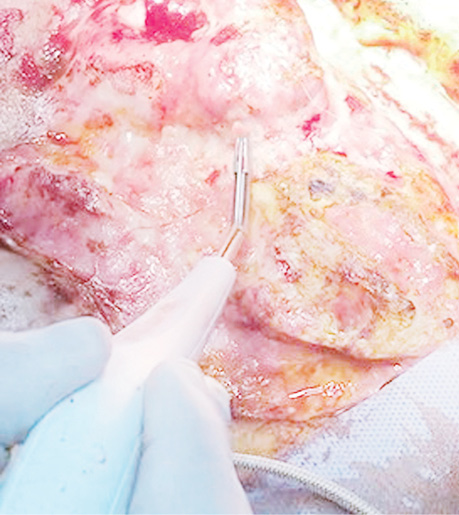
Щоб закрити дефект, клапті були повернуті на 90° праворуч і на 100° ліворуч, забезпечуючи покриття рани великою кількістю жирової клітковини. Товсті жирові покриви забезпечили заповнення всіх нерівностей і заглиблень у кістці.
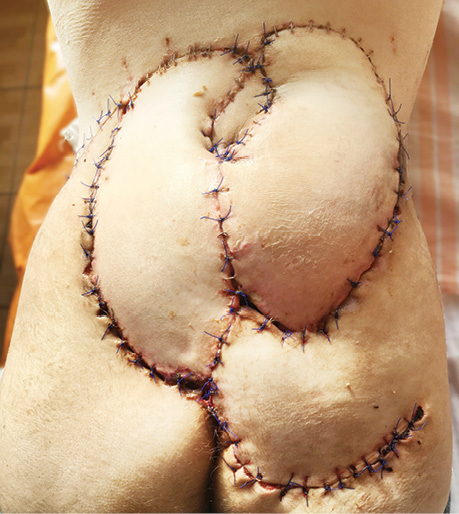
Однак, незважаючи на велику довжину правого клаптя, нижню частину навпроти нього закрити не вдалося. Для закриття цього дефекту у верхній правій частині сідничної зони сформований ротаційний клапоть 16×10 см з включенням перфоранта верхньої сідничної артерії в основі. Після ротації клаптя вдалося закрити нижню частину ранового дефекту. Клапті зафіксовані окремими швами до краю дефекту. Донорські ділянки первинно ушиті після часткової мобілізації країв ран. Антибактеріальна терапія проводилася відповідно до чутливості мікрофлори.
Загоєння ран відбулося первинно. Ускладнень не відмічалося (рис. 6).
ОБГОВОРЕННЯ
ТОС хребта є рідкісним підтипом остеосарком і становить лише 0,08% усіх первинних сарком [6–8]. ТОС характеризується множинними, аневризматично розширеними, заповненими кров’ю порожнинами з високозлоякісними саркоматозними клітинами в периферичному обідку та перегородках [9, 10]. Локалізація ТОС у попереково-крижовому відділі хребта призводить до стійких і незворотних неврологічних змін з боку нижніх кінцівок і тазових органів. У таких випадках для покращення якості життя пацієнтів резекція новоутворення з подальшою хіміо- та променевою терапією стає терапією вибору. Однак подальше рецидивування потребує повторних резекцій, що призводить до розвитку великих дефектів м’яких тканин, оголення кістково-зв’язкових структур, інфікування та порушень якості життя.
Є кілька варіантів закриття попереково-крижових дефектів спини з використанням шкірних ротаційних клаптів з включенням фасцій, м’язів або перфорантних клаптів у вигляді V–Y просування. Вільний клапоть може бути обмеженим через відсутність реципієнтних судин. Однак особливості анатомічної будови покривних тканин ділянки — низька еластичність шкіри, щільне прилягання до глибоких структур у низці випадків ускладнює їхнє використання [11].
H. Kato та співавт. у 1999 р. вперше опублікували роботу на основі анатомічних і клінічних досліджень про використання острівцевого клаптя на основі перфоранта поперекової артерії для пластики дефекту крижів [12]. У більш пізніх повідомленнях перфорантні клапті поперекових артерій використовували для невеликих дефектів різних ділянок хребта [13, 14].
У нашій роботі згідно з дослідженнями інших авторів [15] визначена точка виходу перфоранта L4 знаходилася на 9 см латерально від середньої лінії хребта в проєкції латерального краю м’яза-випрямляча хребта. Територія кровозабезпечення перфорантом L4 поширюється від середньої лінії спини до передньої верхньої осі клубової кістки. Ширина ділянки становить 10–12 см.
Як відомо з досліджень [4], задньо-бічна поверхня тулуба в поперековому відділі забезпечується перфорантами задніх поперекових артерій, верхньої сідничної артерії, глибокої та поверхневої артерій, що огинають клубову кістку [12]. Згідно з теорією ангіо- та перфорасом судинні русла перфорантів перекривають суміжні перфорантні ділянки, утворюючи анастомози опору. Ці судинні зв’язки розкриваються під час хірургічного тренування з формуванням відстрочених клаптів. Цей феномен дозволяє перебудовувати кровотік у клаптях по осьовому типу і включати в останні додаткові судинні мережі прилеглих перфорантних ділянок. Це збільшувало розміри клаптів і підвищувало їхню виживаність [16, 17].
У роботі ми застосували такий підхід, що дозволило закрити великий рановий дефект. Недоліком використання таких клаптів є коротка судинна ніжка, яка дещо обмежувала вісь обертання. Для захисту судин і включення шкірних нервів для збереження чутливості клаптів навколо ніжки залишали жирову муфту.
ВИСНОВКИ
Телеангіоектатична остеосаркома поперекового відділу хребта при ураженні нервових корінців супроводжується тяжкими формами нейросоматичних порушень. Видалення пухлини, хіміо- та променева терапія викликає розвиток великих дефектів із залученням покривних тканин, кісток і нервових утворень. Для закриття дефектів потребуються клапті з хорошим власним кровообігом. Перфорантні пропелерні клапті L4 мають багато переваг перед іншими методами пластики із забезпеченням мінімального рівня захворюваності донорської ділянки. Для збільшення розмірів клаптів і підвищення їх виживаності доцільно використовувати метод відстрочення клаптя.
Текстуральні властивості клаптів дозволяють відновити дефект за принципом «подібного на подібне» з хорошим анатомо-функціональним результатом.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Kvasha, M. S., Zhernov, O. A., Molotkovets, V. Y., Kvasha, O. M., Ukrainets, O. V., Dashchakovskyi, A. V., & Mosiichuk, S. S. (2017). Reconstruction of complex soft tissues defects of the cranial vault in neurooncological patients. Ukrainskyi neirokhirurhichnyi zhurnal, 3, 24–29. doi: 10.25305/unj.112099.
2. Ilaslan, H., Sundaram, M., Unni, K. K., & Shives, T. C. (2004). Primary vertebral osteosarcoma: imaging findings. Radiology, 230(3), 697–702. doi: 10.1148/radiol.2303030226.
3. Jeyarani, G., Jayaraman, D., Menon, G., Harshavardhaan, J. G., Rajendiran, S., & Murali, A. (2021). Telangiectatic Osteosarcoma in a Young Child — A Case Report and Review of the Literature. Journal of Orthopaedic Case Reports, 11(6), 72–75. doi: 10.13107/jocr.2021.v11.i06.2264.
4. Daly, L., Amador, R. O., Shin, J. H., Bojovic, Br., & Eberlin, K. R. (2019). Reconstruction of Lumbar Spinal Defects: Case Series, Literature Review, and Treatment Algorithm. Plastic and Reconstructive Surgery, 7(1), e2089. doi: 10.1097/GOX.0000000000002089.
5. Kimura, H., Nasu, W., Kashiwa, K., & Kobayashi, S. (2013). Reconstruction of the sacral region using the lumbo-gluteal sensory flap. Journal of Plastic, Reconstructive and Aesthetic Surgery, 66(2), 239–42. doi: 10.1016/j.bjps.2012.08.047.
6. Murphey, M. D., wan Jaovisidha, S., Temple, H. T., Gannon, F. H., Jelinek, J. S., & Malawer, M. M. (2003) Telangiectatic osteosarcoma: radiologic-pathologic comparison. Radiology, 229(2), 545–553. doi: 10.1148/radiol.2292021130.
7. Weiss, A., Khoury, J. D., Hoffer, F. A., Wu, J., Billups, C. A., Heck, R. K., … Daw, N. C. (2007). Telangiectatic osteosarcoma: the St. Jude Children’s Research Hospital’s experience. Cancer, 109(8), 1627–1637. doi: 10.1002/cncr.22574.
8. Strauss, S. J., Frezza, A. M., Abecassis, N., Bajpai, J., Bauer, S., Biagini, R., … Bonvalot, S. (2021). Bone sarcomas: ESMO-EURACAN-GENTURIS-ERN PaedCan Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology, 32, 1520–1536. doi: 10.1016/j.annonc.2021.08.1995.
9. Liu, J. J., Liu, S., Wang, J. G., Zhu, W., Hua, Y. Q., Sun, W., & Cai, Z. D. (2013). Telangiectatic osteosarcoma: a review of literature. OncoTargets and Therapy, 6, 593–602. doi: 10.2147/OTT.S41351.
10. Jeyarani, G., Jayaraman, D., Menon, G., Harshavardhaan, J. G., Rajendiran, S., & Murali, A. (2021). Telangiectatic Osteosarcoma in a Young Child — A Case Report and Review of the Literature. Journal of Orthopaedic Case Reports, 11(6), 72–75. doi: 10.13107/jocr.2021.v11.i06.2264.
11. Kedar, D. J., Pak, C. J., Suh, H. P., & Hong, J. P. (2020). Propeller Flaps in the Posterior Trunk. Seminars in Plastic Surgery, 34(3), 176–183. doi: 10.1055/s-0040-1714086.
12. Kato, H., Hasegawa, M., Takada, T., & Torii, S. (1999). The lumbar artery perforator based island flap: anatomical study and case reports. British Journal of Plastic Surgery, 52(7), 541–546. doi: 10.1054/bjps.1999.3120.
13. Atik, B., Tan, O., Mutaf, M., Senel, B., Yilmaz, N., & Kiymaz, N. (2008). Skin perforators of back region: anatomical study and clinical applications. Annals of Plastic Surgery, 60(1), 70–75. doi: 10.1097/01.sap.0000263452.23901.ba.
14. Zhao, R., Zhang, X., Yang, X., & Zhao, Z. (2023). Modified fourth lumbar artery local perforator flap: an alternative for reconstruction of nonhealing lumbosacral spinal defects. BMC Surgery, 23(1), 10. doi.org/10.1186/s12893-023-01909-8.
15. di Summa, P. G., Schaffer, C., Zaugg, P., Bauquis, O., & Raffoul, W. (2016). Lumbar artery perforator (LAP) flap: a salvage tool for extended lumbo-sacral necrosis after bilateral internal iliac arteries embolization. Case Reports in Plastic Surgery and Hand Surgery, 3(1), 20–24. doi: 10.3109/23320885.2016.1166965.
16. Taylor, G. I., & Palmer, J. H. (1987). The vascular territories (angiosomes) of the body: experimental study and clinical applications. British Journal of Plastic Surgery, 40(2), 113–141. doi: 10.1016/0007-1226(87)90185-8.
17. Saint-Cyr, M., Wong, C., Schaverien, M., Mojallal, A., & Rohrich, R. J. (2009). The perforasome theory: vascular anatomy and clinical implications. Plastic and Reconstructive Surgery, 124(5), 1529–1544. doi: 10.1097/PRS.0b013e3181b98a6c.
Адреса для листування:
Ковальчук Олександр Ігорович
02055, Київ, вул. Анни Ахматової, 17, кв. 5
E-mail: o.kovalchuk@nuozu.edu.ua
Correspondence:
Oleksandr Kovalchuk
5 apt., 17 Anna Akhmatova str., Kyiv, 02055
E-mail: o.kovalchuk@nuozu.edu.ua














Leave a comment