Сучасні аспекти діагностики та лікування раку нирки II–III стадій
Резюме. Останніми десятиріччями відмічається підвищення частоти виявлення раку нирки в багатьох країнах світу, що може бути пов’язано з покращенням методів діагностики захворювання та зростанням уваги науковців до цього типу новоутворень. У межах сателітного симпозіуму «Відправ рак у нокаут» Міжнародної науково-практичної конференції «СОУУ–2024. Досягнення і перспективи в лікуванні пухлин та захворювань сечостатевої системи» першу доповідь представив провідний науковий співробітник Державного некомерційного підприємства (ДНП) «Національний інститут раку», доктор медичних наук Олександр Едуардович Стаховський, який розповів про нову класифікацію Всесвітньої організації охорони здоров’я (ВООЗ) 2022 р., яка може бути основою для поліпшення прогнозу перебігу раку нирки та розвитку більш персоналізованих та молекулярно обґрунтованих методів терапії онкопатології в майбутньому. Професор кафедри урології, нефрології та андрології Харківського національного медичного університету, завідувач відділення урології Харківського обласного клінічного центру урології та нефрології ім. В.І. Шаповала, доктор медичних наук Дмитро Володимирович Щукін у своїй доповіді висвітлив тактику лікування пухлини нирки II–III стадій залежно від імовірності розвитку рецидиву. Особливу увагу доповідач зосередив на тому, що в результаті доcлідження KEYNOTE-564 за участю пацієнтів з нирково-клітинною карциномою (НКК) та підвищеним ризиком розвитку рецидиву після операції встановлено суттєву перевагу застосування інгібітора PD-1 (пембролізумабу) в ад’ювантному режимі щодо показника безрецидивної виживаності (БРВ) та загальної виживаності (ЗВ), що є величезним проривом у лікуванні осіб з НКК. Так, у межах сателітного симпозіуму «Відправ рак у нокаут» Міжнародної науково-практичної конференції «СОУУ–2024. Досягнення і перспективи в лікуванні пухлин та захворювань сечостатевої системи» зроблено акцент на значенні гістологічної будови новоутворення нирки в прогнозі перебігу НКК, а також на сучасних можливостях ад’ювантної терапії онкопатології.
DOI: 10.32471/clinicaloncology.2663-466X.54-2.32426
 Останніми десятиріччями відмічається підвищення частоти виявлення раку нирки в багатьох країнах світу, що може бути пов’язано з покращенням методів діагностики захворювання та зростанням уваги науковців до цього типу раку. Так, за ініціативи ДНП «Національний інститут раку», ГО «Спілка онкоурологів України» (СОУУ), Центру сучасної урології, Українського медичного міждисциплінарного альянсу «Хелсхаб» 19–20 квітня 2024 р. в Києві проведено Міжнародну науково-практичну конференцію «СОУУ–2024. Досягнення і перспективи в лікуванні пухлин та захворювань сечостатевої системи» у змішаному форматі. У межах заходу окрему увагу варто приділити сателітному симпозіуму «Відправ рак у нокаут», першу доповідь якого присвячено епідеміології, діагностичним модальностям та значенню гістологічної будови пухлини нирки для прогнозу перебігу НКК, яку висвітлив провідний науковий співробітник Національного інституту раку, доктор медичних наук Олександр Едуардович Стаховський.
Останніми десятиріччями відмічається підвищення частоти виявлення раку нирки в багатьох країнах світу, що може бути пов’язано з покращенням методів діагностики захворювання та зростанням уваги науковців до цього типу раку. Так, за ініціативи ДНП «Національний інститут раку», ГО «Спілка онкоурологів України» (СОУУ), Центру сучасної урології, Українського медичного міждисциплінарного альянсу «Хелсхаб» 19–20 квітня 2024 р. в Києві проведено Міжнародну науково-практичну конференцію «СОУУ–2024. Досягнення і перспективи в лікуванні пухлин та захворювань сечостатевої системи» у змішаному форматі. У межах заходу окрему увагу варто приділити сателітному симпозіуму «Відправ рак у нокаут», першу доповідь якого присвячено епідеміології, діагностичним модальностям та значенню гістологічної будови пухлини нирки для прогнозу перебігу НКК, яку висвітлив провідний науковий співробітник Національного інституту раку, доктор медичних наук Олександр Едуардович Стаховський.
Згідно з даними L. Bukavina та співавт. (2022) країни Північної Америки, Європи, Австралії та Нової Зеландії належать до країн, в яких фіксується найвищий рівень захворюваності на рак нирки. Щорічно в Україні реєструють близько 4000 нових випадків раку нирки, при цьому у чоловіків ця онкопатологія виявляється частіше. У розвитку цього захворювання важливу роль відіграють модифіковані фактори ризику, а саме наявність ожиріння, артеріальної гіпертензії, хронічної ниркової недостатності, цукрового діабету, куріння та чинники навколишнього середовища. Іншими факторами підвищеного ризику захворюваності на рак нирки є вік, чоловіча стать, етнічна приналежність, наявність генетичної схильності до онкопатології та ін. У 2022 р. ВООЗ ухвалено нову гістологічну класифікацію нирково-клітинних пухлин, згідно з якою виділяють світлоклітинну НКК, мультилокулярну кістозну ниркову неоплазію, папілярні аденому та НКК, онкоцитому, хромофобну НКК, інші онкоцитарні пухлини нирки, карциному зі збиральних трубочок, світлоклітинну папілярну пухлину, муцинозну тубулярну та веретеноклітинну карциному, тубулокістозну НКК, еозинофільну солідну та кістозну НКК (папілярну НКК), метанефричну аденому, змішану епітеліальну та стромальну пухлину, епітеліоїдну ангіоміоліпому, класичну ангіоміоліпому. Додатково до цієї групи належить група молекулярно визначених НКК, таких як НКК з транслокацією TFE3, ампліфікацією TFEB, транслокацією TFEB, транслокацією ALK, мутацією ELOC та SMARCB1-дефіцитну, FH-дефіцитну та SDHB-дефіцитну.
Згідно з даними Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN) майже при всіх стадіях пухлини нирки показаним є хірургічне втручання, серед яких частіше перевагу надають органозберігаючим втручанням та максимальному досягненню відсутності ішемічних порушень при їх проведенні, оскільки розвиток ішемії може викликати зниження функції нирок та спричинити розвиток хронічної ниркової недостатності.
В основі діагностики ниркових утворень лежить проведення ультразвукової діагностики (УЗД), комп’ютерної томографії (КТ) 3 зон з контрастом або магнітно-резонансної терапії (МРТ). За наявності показань можна виконати остеосцинтиграфію, МРТ головного мозку чи біопсію. У випадку підозри наявності уротеліальної карциноми хворому слід провести цистоскопію, візуалізацію верхніх сечових шляхів та в разі потреби — біопсію. При множинних пухлинах нирок у пацієнтів молодого віку варто розглянути виконання генетичних досліджень. У Національному інституті раку широко використовують нефрометрію з метою кількісної оцінки пухлини нирки, адже такі розрахункові системи, як RENAL, PADUA та С-індекс допомагають стандартизувати оцінку новоутворення та покращити клінічне та анатомічне рапортування у випадку, коли слід оцінити хірургічну складність проведення оперативного втручання в різних когортах пацієнтів. Сьогодні проводиться також валідація розрахункової системи Національного інституту раку України — NCIU, за допомогою якої можна визначити показання до проведення резекції нирки чи нефректомії на основі оцінки локалізації пухлини та об’єму залишкової функціонуючої паренхіми нирки. У випадку, якщо об’єм залишкової паренхіми нирки становить більше ніж 50%, потрібно розглянути проведення органозберігаючого оперативного втручання.
Проведення біопсії з метою гістологічної характеристики пухлини слід розглядати у випадку, коли її виконання може вплинути на клінічне рішення щодо лікування. Виконання біопсії показане при доброякісній або злоякісній пухлині (онкоцитомі або НКК), або індолентній, або високоагресивній пухлині. Проте біопсія не відіграє ролі у стадіюванні новоутворення, адже при її проведенні враховуються результати методів візуалізації, які не містять достатньої інформації про гістологічну будову пухлини нирки. У результатах дослідження C. Choudhari та співавт. (2009) зафіксовано, що проведення гістологічної оцінки за даними КТ не є надійним інструментом диференційної діагностики між онкоцитомою та НКК. A.B. Rosenkrantz та співавт. (2010) зазначають, що МРТ не є надійним інструментом диференційної діагностики між гістологічними підтипами раку нирки, тому сьогодні біопсія залишається стандартом гістологічної діагностики пухлин нирки. У даних системного аналізу A. Volpe (2012) відмічено, що рівень конкордантності результатів біопсії пухлини перед операцією з отриманими даними гістологічного матеріалу в післяопераційний період становить 90,2%, а при маленьких пухлинах нирки — 96%. Особливостями маленьких пухлин нирки є те, що їх розмір є меншим, ніж 4 см у діаметрі, більшість з них є доброякісними, при цьому вони ростуть повільно (4–8 мм для НКК) та рідко метастазують. У результатах досліджень I.S. Gill та співавт. (2007), R.E. Link та співавт. (2005), R. Venkatesh та співавт. (2006), B.M. Benway та співавт. (2010) та H. Zargar та співавт. (2014) зафіксовано, що при середньому розмірі пухлини <3 см відсоток доброякісності патології сягає 35%. В аспекті діагностики доброякісних та злоякісних пухлин нирки окреме місце за даними дослідження B.M. Shuch та співавт. (2023) належить 89Zr-DFO-гірентуксимабу, в основі якого знаходиться поєднання слаборадіоактивної молекули під назвою «цирконій (Zr)89» із гірентуксимабом (антитілом, що зв’язується з ферментом карбоангідразою IX). 89Zr-DFO-гірентуксимаб зв’язується з карбоангідразою IX у ракових пухлинах нирки та може допомогти провести диференційну діагностику між раком нирки та нормальною тканиною органа. У дослідження III фази Zircon залучено пацієнтів, яким заплановано часткову нефректомію протягом 90 днів, проте за 10 днів до операції вони отримували 89Zr-DFO-гірентуксимаб з подальшим проведенням позитронно-емісійної томографії (ПЕТ)/КТ через 5 днів. У результатах дослідження виявлено, що середня чутливість методу становила 85,5%, а середня точність — 86%, що свідчить про перспективи цього методу діагностики в ідентифікації раку нирки (Shuch B.M. et al., 2023). Проте в українських реаліях доступним методом діагностики є біопсія, яка має низку недоліків, таких як інвазивність процедури, гетерогенність пухлини та потенційний «вихід» пухлинних клітин (перехід зі стану спокою до активної колонізації вторинних сайтів).
Отже, нова класифікація ВООЗ 2022 р. є високим стандартом класифікації раку нирки, що може бути основою для розвитку більш персоналізованих та молекулярно обґрунтованих методів терапії пухлин нирки в майбутньому, що може покращити прогноз для пацієнтів та забезпечити більш ефективне лікування. Крім того, хірургія сьогодні залишається активним методом терапії раку нирки з акцентом на малоінвазивність, проте цей підхід може змінитися в майбутньому з появою нових технологій та методів лікування.
 Професор кафедри урології, нефрології та андрології Харківського національного медичного університету, завідувач відділення урології Харківського обласного клінічного центру урології та нефрології ім. В.І. Шаповала, доктор медичних наук Дмитро Володимирович Щукін висвітлив тему тактики лікування раку нирки II–III стадій залежно від імовірності розвитку рецидиву.
Професор кафедри урології, нефрології та андрології Харківського національного медичного університету, завідувач відділення урології Харківського обласного клінічного центру урології та нефрології ім. В.І. Шаповала, доктор медичних наук Дмитро Володимирович Щукін висвітлив тему тактики лікування раку нирки II–III стадій залежно від імовірності розвитку рецидиву.
Протягом попередніх років ризик розвитку метастазів при НКК становив 30%, проте сьогодні цей показник становить 12–16% (Siegel R.L. et al., 2020). Проведення таргетної та імунотерапії сприяло значному підвищенню показників ЗВ пацієнтів з метастатичним НКК (мНКК). Станом на 2005 р. медіана ЗВ при проведенні таргетної терапії не перевищувала 1 року, проте сьогодні в процесі проведення комбінованої терапії (інгібіторами тирозинкінази (ІТК) та інгібіторами імунних контрольних точок (ІКТ)) цей показник сягає 5 років, що свідчить про досягнення прогресу в лікуванні мНКК (Motzer R.J. et al., 2002; Motzer R.J. et al., 2022). Проте однією з проблем терапії таких хворих є те, що більшість з них не відповідають на первинну терапію, а також те, що у них часто розвивається резистентність до лікування (Psutka S., 2024). Із цієї причини терапія мНКК потребує інтенсифікації та залишається складним і невирішеним питанням. Однак існує сучасний підхід у веденні пацієнтів з НКК, який полягає в превенції розвитку метастазів шляхом проведення ад’ювантної терапії, яка призначається після проведення радикальної операції, метою якої є ліквідація віддалених мікрометастазів, що дозволяє підвищити рівні БРВ та ЗВ хворих, а в ідеалі — досягти їх повного одужання. Наразі відомо, що метастазування після оперативного втручання виникає у близько 30% (95% довірчий інтервал (ДІ) 20–50%) усіх пацієнтів з НКК (Siegel R.L. et al., 2020). Згідно з даними N. Chowdhury та співавт. (2020) 5-річна канцер-специфічна виживаність осіб з I та II стадіями хвороби за Міжнародною класифікацією стадій злоякісних новоутворень TNM становить 93%, зі стадією IІІ — 71% та стадією IV — 14% відповідно, що пов’язано з тим, що у близько 40% усіх пацієнтів після хірургічного лікування фіксується рецидив захворювання. Такий відносно підвищений ризик метастазування після операції свідчить про те, що у багатьох осіб з локалізованою НКК під час нефректомії вже може бути наявна мікрометастатична патологія. Незважаючи на початкову неметастатичну стадію НКК, значна кількість хворих, у яких розвивається прогресування після виконання нефректомії, підтверджує потребу в призначенні ад’ювантної терапії (Chowdhury N. et al., 2020). У всьому світі проведено 5 рандомізованих контрольованих досліджень III фази щодо ролі ІТК в ад’ювантному лікуванні, які надали суперечливі результати щодо підвищення рівня БРВ. У жодному з цих досліджень не виявлено переваг щодо ЗВ (Chowdhury N. et al., 2021). Проте єдиним дослідженням, в якому представлене статистично значуще підвищення медіани БРВ без переваг щодо показника ЗВ, стало дослідження S-TRAC, результати якого опубліковані у 2016 р. В отриманих даних дослідження встановлено, що сунітиніб може бути варіантом ад’ювантної терапії у пацієнтів групи підвищеного ризику розвитку рецидиву НКК після нефректомії. Сучасним напрямком ад’ювантної терапії НКК є прийом ІКТ, у досвіді застосування яких зафіксовано їх ефективність та сприятливий профіль безпеки в лікуванні пацієнтів з первинною онкопатологією, а також у випадку рефрактерності НКК до таргетної терапії антагоністами тканинного ендотеліального фактора росту. Усе це сприяло ініціюванню вивчення цих лікарських засобів як потенційних ад’ювантних агентів, механізм дії яких полягає в очищенні організму людини від циркулюючих пухлинних клітин або мікрометастатичних депозитів завдяки посиленню імунної відповіді на пухлину шляхом блокади рецептора PD-1 або ліганда рецептора PD-L1.
Вивчення ад’ювантної терапії проводилося у 5 дослідженнях, з яких 1 є не завершеним. Проте з 4 завершених клінічних досліджень успішним було тільки 1 — KEYNOTE-564, яке охоплювало пацієнтів з НКК з підвищеним ризиком розвитку рецидиву та наявністю/відсутністю попередньої метастазектомії. Учасників дослідження рандомізовано в групу прийому пембролізумабу в дозі 200 мг внутрішньовенно 1 р/3 тиж чи групу отримання плацебо (Choueiri T.K. et al., 2021). Лікування тривало до 1 року або розвитку рецидиву захворювання чи неприйнятних проявів токсичності. Первинною кінцевою точкою була БРВ за оцінкою дослідника та вторинною — ЗВ та безпека. Учасників дослідження розподілено в групи ризику прогресії патології. У дослідження залучені хворі з різним ризиком прогресування, а саме пацієнти з помірно підвищеним ризиком, хворі з підвищеним ризиком та учасники, в яких не виявлено ознак захворювання після повної резекції первинної пухлини, проте відмічався розвиток метастазів у м’які тканини в період ≤1 року після нефректомії. До групи помірно підвищеного ризику належали пацієнти з pT2 N0 G4 та наявністю або відсутністю саркоматоїдного компонента, а також хворі зі стадією патології pT3 N0 та будь-якою гістологічною градацією. У групу підвищеного ризику залучали осіб зі стадією pT4 NO з будь-якою гістологічною градацією або пацієнтів з будь-якою T-стадією та наявністю лімфатичних метастазів. До 3-ї групи належали хворі з M1 NED, в яких не виявлено ознак онкопатології після повної резекції первинної пухлини, проте фіксувався розвиток метастазів у м’які тканини в період ≤1 року після нефректомії. Більшу частку пацієнтів у дослідженні становили пацієнти групи помірно підвищеного ризику. При 1-му проміжному аналізі встановлено переваги пембролізумабу щодо показника БРВ порівняно з плацебо в групі осіб помірно підвищеного чи підвищеного ризику розвитку рецидиву НКК після нефректомії з або без резекції метастатичних вогнищ (БРП через 24 міс становила 77,3% у групі пембролізумабу проти 68,1% у групі плацебо; відношення ризиків (ВР) 0,68; 95% ДІ 0,53–0,87; p=0,002) (Choueiri T. et al., 2021). При другому проміжному аналізі (період спостереження становив 30 міс) тенденція щодо переваг пембролізумабу щодо показника БРВ порівняно з плацебо зберігалася (ВР 0,63; 95% ДІ 0,50–0,80) (Powles T. et al., 2023) (рис. 1).
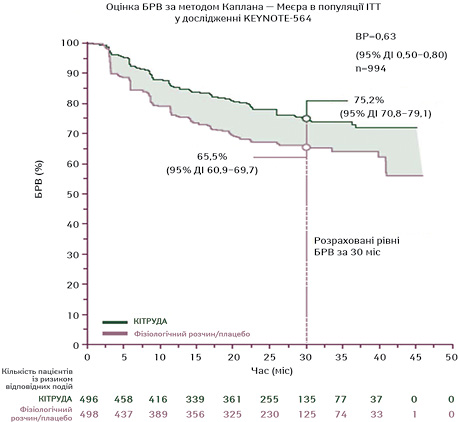
При підгруповому аналізі переваги пембролізумабу щодо показника БРВ фіксували в усіх 3 групах ризику. Крім того, ризик розвитку рецидиву або смерті був нижчим на 50% у європеоїдної раси учасників. Цього року отримано результати 3-го проміжного аналізу (медіана періоду спостереження становила 57 міс) щодо показника ЗВ, в якому було показано, що пембролізумаб є першим препаратом ад’ювантної терапії, який продемонстрував переваги ЗВ при НКК (ВР 0,62; 95% ДІ 0,44–0,87; p=0,005). Рівень ЗВ через 48 міс становив 91,2% у групі пембролізумабу порівняно з 86,0% у групі плацебо, а також в усіх підгрупах дослідження (Choueiri T.K. et al., 2024) (рис. 2).
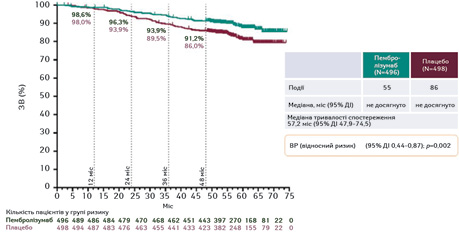
Встановлено також підвищення рівня БРВ, що відповідало всім попереднім проміжним аналізам (ВР 0,72; 95% ДІ 0,59–0,87). Крім того, цей препарат є першим ІКТ, який в ад’юванті підвищує показник виживаності при будь-якій пухлині сечостатевої системи. У результаті дослідження також виявлено, що побічні ефекти (ПЕ) III–IV ступенів траплялися у 19% усіх випадків та тільки у 8% усіх пацієнтів відмічалася необхідність прийому кортикостероїдів.
Так, ад’ювантний прийом пембролізумабу значно підвищує рівень ЗВ хворих порівняно з плацебо у осіб з підвищеним ризиком розвитку рецидиву після операції, що включає зниження ризику смерті на 38% та підвищення показника виживаності у ключових групах ризику. Проте фундаментальним аспектом ад’ювантної терапії є виявлення пацієнтів з підвищеним ризиком розвитку рецидиву, які можуть отримати максимальну користь від неї, щоб позбавити хворих з низьким ризиком від несприятливих ефектів такого лікування. Відбір пацієнтів для проведення ад’ювантної терапії є непростим завданням. Відомо, що такі прогностичні інструменти, як стадія за класифікацією TNM, функціональний статус за шкалою Східної кооперативної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) та розмір новоутворення, є цінними прогностичними інструментами в оцінці ефективності ад’ювантної терапії, проте їх точність обмежена (Hyung L. et al., 2004; Zisman A. et al., 2001). З метою підвищення точності прогнозу розроблено номограми, більшість з яких включає такі параметри, як TNM, функціональний статус за ECOG, вік хворого, розмір пухлини, її гістологічну градацію, наявність некрозу чи венозного поширення. Проте існує низка недоліків, пов’язаних з використанням номограм, таких як те, що розміри популяції оцінки їх ефективності були недостатньо великими, часто їх результати базувалися на моноцентрових даних, а також те, що точність їх є неоднозначною. Проте перспективними прогностичними методами оцінки користі від проведення ад’ювантної терапії є використання комбінації клінічних та молекулярно-генетичних маркерів.
У проспективному клінічному дослідженні MOSCATO 01 здійснено оцінку клінічних переваг геномного аналізу для підвищення результатів у пацієнтів з пізніми стадіями раку. Основною метою дослідження зазначено оцінку клінічної користі, виміряну за рівнем відсотка пацієнтів, у яких ВБП на підібраній терапії (ВБП2) за даними геномного аналізу у 1,3 раза довша, ніж при попередній терапії (ВБП1). У результатах дослідження зафіксовано, що проведення ад’ювантної терапії буде корисним у 37% всіх пацієнтів, однак у реальних умовах тільки у 17,4% відмічався позитивний ефект від лікування. Результати були ще більш невтішними у осіб з пухлинами органів сечовивідної системи, адже тільки 15% хворих отримали відповідне таргетне лікування, і врешті-решт тільки 6,3% відповідали критеріям успіху щодо показника ВБП (Massard C. et al., 2017). Перспективним є застосування геномних сигнатур, які включають індивідуальну біологію пухлини для стратифікації ризику метастазування НКК, однак цей метод поки що не використовується в клінічній практиці. Проте надалі ці геномні сигнатури можуть бути використані для виявлення пацієнтів з підвищеним ризиком метастазування у пацієнтів з НКК у майбутніх клінічних випробуваннях.
Окрім клінічної ефективності, існує ще один аргумент на користь ад’ювантної терапії — це бажання хворого повністю одужати від онкологічної хвороби. Результати анкетування KCCure Patient survey 2019 р. свідчать про те, що коли проводили опитування про найважливіший результат, який пацієнти хочуть отримати від свого лікування, то >60% хворих обрали шанс досягнення повної відповіді на терапію. Менш важливими факторами, які впливали на їх рішення щодо ад’ювантного лікування, були ризик розвитку ПЕ та вартість препарату, тому при ухваленні рішення щодо ад’ювантної терапії повинні розглядатися можливі ризики (фінансова токсичність, наявність ПЕ) та переваги такого лікування (підвищення ЗВ, БРВ та можливість повного одужання). Після завершення ад’ювантної терапії згідно з рекомендаціями NCCN 2024 р. рекомендовано спостерігати пацієнтів як хворих зі стадією T3, а саме проводити КТ 1 р/6 міс протягом 3 років та 1 р/1 рік впродовж 5 років.
Тобто зараз ми бачимо суттєву перевагу у виживаності при застосуванні інгібітора PD-1 в ад’ювантному режимі, що є величезним проривом для наших пацієнтів з НКК. На сьогодні очевидним є факт, що тільки пембролізумаб є єдиним препаратом, який чинить реальний позитивний та вагомий вплив на прогноз хвороби, якщо застосовувати його в якості ад’ювантної терапії НКК. Проте потрібна подальша оптимізація відбору хворих для проведення ад’ювантного лікування.
Так, у межах сателітного симпозіуму «Відправ рак у нокаут» Міжнародної науково-практичної конференції «СОУУ–2024. Досягнення і перспективи в лікуванні пухлин та захворювань сечостатевої системи» доповідачами зроблено акцент на епідеміології, діагностичних модальностях та значенні гістологічної будови новоутворення нирки для прогнозу перебігу онкопатології, а також на сучасних можливостях ад’ювантної терапії при НКК, що є проривом у її лікуванні.














Leave a comment