Роль внутрішньочеревної аерозольної хіміотерапії під тиском (PIPAC) у лікуванні перитонеального карциноматозу раку шлунка: систематичний огляд
Пепенін М.О., Кондрацький Ю.М., Городецький А.В., Добржанський О.Ю.
Резюме. Вступ. Загальна виживаність пацієнтів із вперше діагностованим перитонеальним карциноматозом раку шлунка (ПК РШ) становить 3–6 міс. Сучасні алгоритми лікування рекомендують системну терапію в комбінації з імуно- або таргетною терапією, однак такий підхід виявляється ефективним лише в 14–25% усіх випадків. Для хворих з ПК РШ розроблено та імплементовано методи внутрішньочеревної хіміотерапії, такі як гіпертермічна внутрішньочеревна хіміотерапія (Hyperthermic intraperitoneal chemotherapy — HIPEC) та нормотермічна внутрішньочеревна хіміотерапія (Normothermic intraperitoneal chemotherapy — NIPEC). Однак ці методи пов’язані з певними лімітувальними факторами, першим з яких є нерівномірний розподіл діючої речовини в черевній порожнині та її ускладнена експозиція у важкодоступних місцях. Внутрішньочеревну аерозольну хіміотерапію під тиском (Pressurized intraperitoneal aerosol chemotherapy — PIPAC) розроблено для усунення цих обмежень, тиск карбоперитонеуму та фізичні властивості аерозольної хіміотерапії сприяють більш рівномірному розподілу антинеопластичного агента в черевній порожнині та кращій пенетрації пухлинної тканини. Мета дослідження полягає в аналізі ефективності PIPAC як інноваційного методу лікування ПК РШ. Об’єктом дослідження є група пацієнтів з ПК РШ, які отримували лікування з використанням процедури PIPAC. Використані методи дослідження. Систематичний огляд медичних баз даних MEDLINE, Cochrane та Embase з метою збору та аналізу даних про ефективність та безпеку PIPAC. В основних результатах дослідження встановлено, що PIPAC забезпечує збільшення загальної виживаності, зменшення об’єму асциту та поліпшення якості життя пацієнтів. За допомогою цього методу встановлено потенціал для підвищення загальної виживаності та зниження частоти розвитку ускладнень порівняно з іншими методами внутрішньочеревної хіміотерапії. Повна патологічна відповідь, хоча і була рідкісним явищем, вказує на потенціал PIPAC як ефективного засобу лікування ПК. Висновки. PIPAC є ефективним та безпечним методом терапії для пацієнтів з ПК РШ. Рекомендується подальше дослідження PIPAC для визначення оптимальних схем внутрішньочеревної хіміотерапії та оцінки довготривалої ефективності.
Одержано 25.03.2024
Прийнято до друку 15.04.2024
DOI: 10.32471/clinicaloncology.2663-466X.54-2.32351
ВСТУП
РШ посідає 6-те місце у світі за поширеністю та залишається однією з головних причин смертності пацієнтів від онкологічних захворювань. Згідно з даними GLOBOCAN Cancer Network станом на 2020 р. захворюваність на РШ в Україні становить 6,1–8,5 хворих серед жінок та ≥16,4 серед чоловіків на 100 000 осіб [1]. Відповідно до даних Національного канцер-реєстру України, не дивлячись на зниження показника загальної захворюваності порівняно з 2019 р. (−18,7%), у 2020 р. виявлено 6072 нових випадки захворювання на РШ, з яких 44,8% усіх осіб мали IV стадію захворювання, а 52,8%, тобто 3206 пацієнтів, не прожили і року від моменту встановлення діагнозу, загальна кількість померлих становила 4580 осіб [2]. Така незатишна статистика зумовлена насамперед відсутністю симптоматики на ранніх стадіях хвороби, її агресивним перебігом, недостатньою обізнаністю населення, відсутністю державних скринінгових програм, реєстрації сучасних препаратів з доведеною ефективністю, безпекою для пацієнта та доказовою базою. Це є дуже значущою соціально-економічною проблемою, яка потребує пошуків шляхів розв’язання, так як віддалені результати лікування все ще залишаються вкрай незадовільними.
Для РШ простежується чітка кореляція між стадією захворювання і загальною виживаністю пацієнтів. Найгіршим прогностичним критерієм перебігу хвороби є віддалене метастазування, яке у 50% випадків трапляється у вигляді ПК. На сьогодні медіана виживаності пацієнтів з вперше діагностованим ПК РШ становить 3–6 міс [3–7]. Сучасними лікувальними протоколами передбачене призначення системної паліативної хіміотерапії пацієнтам у відповідному загальному стані в діапазоні 0–2 за шкалою Східної кооперативної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) з додаванням таргетної або імунної терапії в розвинених країнах, в яких відповідні препарати зареєстровані, однак такі схеми мають доволі обмежену ефективність і на лікування відповідає тільки 14–25% усіх випадків [8–10]. Крім того, кишкова непрохідність та асцит, спричинені ПК, значно погіршують якість життя пацієнтів [11]. Застосування системної терапії у зменшенні вираженості симптомів перитонеального карциноматозу не досягло значного успіху. За даними досліджень, основними причинами резистентності ПК до системної терапії є зміни екстрацелюлярної архітектури, асоційовані з мезотеліально-мезенхімальним переходом перитонеальних фібробластів, та знижена перитонеальна васкуляризація [12–14].
У дослідженнях з використанням перитонеального діалізу встановлено, що розмір та гідрофільна природа більшості неопластичних агентів перешкоджає їх трансперитонеальній абсорбції, тим самим підвищуючи концентрацію останніх у черевній порожнині порівняно з плазмою крові [15, 16]. На наступному етапі досліджень, направленому на інтраперитонеальне застосування антинеопластичних лікарських засобів, зафіксовано, що гіпертермія зумовлює цитостатичний ефект [17]. Це відкриття спричинило появу найбільш популярного методу лікування ПК — HIPEC. Найчастіше HIPEC проводиться в комбінації з циторедуктивною хірургією як метод терапії вторинного ПК або первинних злоякісних новоутворень очеревини [18, 19].
Лікарські засоби, у яких не виявлено значних синергічних ефектів з гіпертермічною дією, таких як паклітаксел, застосовують в інший спосіб — NIPEC. На відміну від HIPEC, NIPEC проводиться як у комбінації з циторедуктивною хірургією, так і в амбулаторних умовах у якості паліативної терапії для пацієнтів, що не є кандидатами для хірургічного лікування [20].
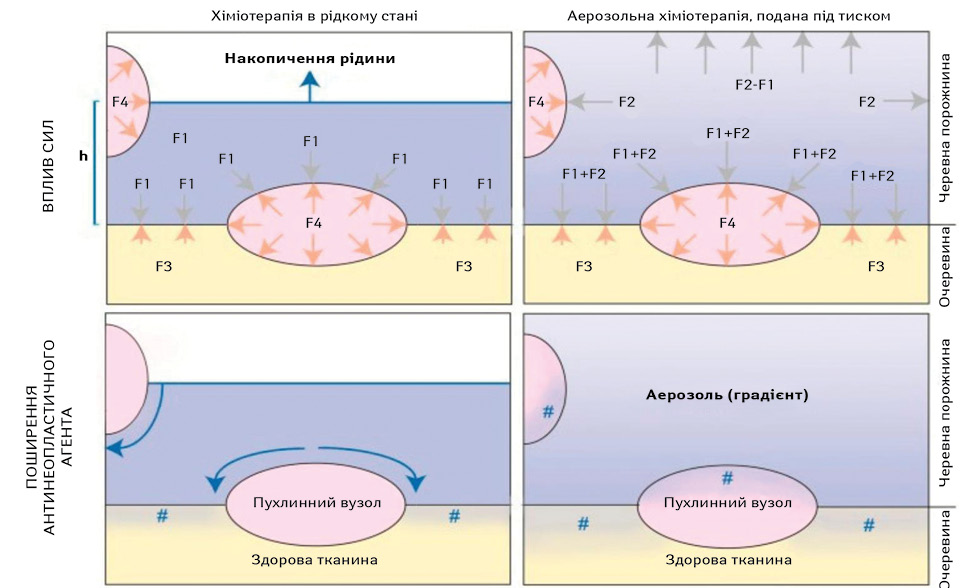
Однак концентрація антинеопластичного агента в черевній порожнині не являється єдиним критерієм ефективності внутрішньочеревної терапії. Основними лімітувальними факторами NIPEC та HIPEC є ускладнена експозиція діючої речовини у важкодоступних місцях, її нерівномірний розподіл та потреба в адекватній циторедукції для забезпечення трансперитонеальної проникності діючої речовини [10].
Адекватна циторедукція, тобто резекція всіх макроскопічних вторинних вогнищ (оцінка повноти циторедукції (Completeness of Cytoreduction — CC) на рівні 0), необхідна для забезпечення ефективної внутрішньочеревної дії антинеопластичного агента [21, 22]. PIPAC розроблено для усунення цих обмежень. У доклінічних дослідженнях зафіксовано, що аерозольні частки діючої речовини в PIPAC призводять до більш рівномірного розподілу препарату в черевній порожнині порівняно з HIPEC [23, 24].
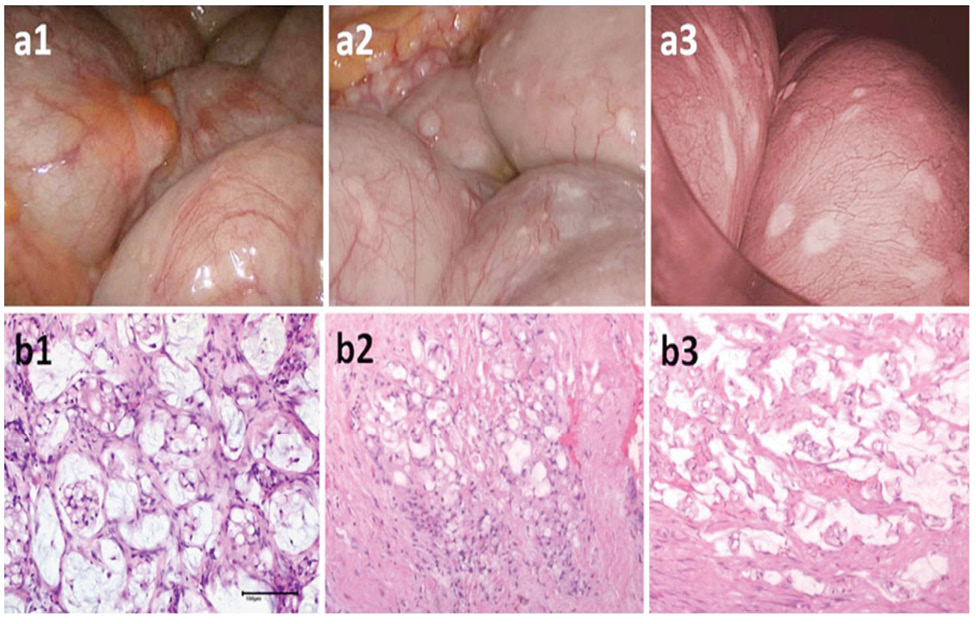
До додаткових переваг PIPAC належать тиск карбоперитонеуму, що забезпечує більшу проникність діючої речовини у вторинні вогнища та більш рівномірний розподіл антинеопластичного агента (рис. 1–2) [25, 26]. Процедура виконується малоінвазивним шляхом, що дозволяє скоротити тривалість перебування пацієнта в стаціонарі, зменшити вираженість болю, асоційованого з хірургічним доступом, та покращити якість життя, при цьому, як правило, хворий продовжує отримувати системну хіміотерапію [27, 28].
МЕТОДИ
Систематичний огляд проведено за допомогою пошуку в базах даних MEDLINE, Cochrane та Embase досліджень, опублікованих до 30 грудня 2023 р., ключові слова пошуку включали такі терміни: «PIPAC», «peritoneal carcinomatosis», «gastric cancer».
ОБГОВОРЕННЯ
Вибір препаратів
Першими препаратами, використаними для проведення PIPAC, були оксаліплатин та комбінація цисплатину і доксорубіцину. Ці хіміопрепарати найчастіше обирали для проведення HIPEC через їх відносно низьку кількість побічних явищ, синергізм з гіпертермією і відсутність специфічності до клітинного циклу пухлини [29].
Дослідження ескалації доз антинеопластичних агентів при PIPAC проведено для цисплатину (до 30 мг/м2), доксорубіцину (до 6 мг/м2) та оксаліплатину (до 135 мг/м2), однак більшість клінічних досліджень, що проводяться зараз, використовують більш стандартизовані дозування [30, 31].
Кількість та тяжкість перебігу побічних подій безпосередньо впливають на якість життя пацієнта та його здатність толерувати наступні курси поліхіміотерапії (ПХТ). У більшості досліджень, спрямованих на порівняння оксаліплатину з доксорубіцином у комбінації з цисплатином, звітували про підвищення больових відчуттів після процедури у групі оксаліплатину. За результатами проспективного моноцентрового дослідження PIPAC-OPC2 підвищена частота споживання опіоїдних анальгетиків відмічалася у групі оксаліплатину порівняно з доксорубіцином та цисплатином. У ретроспективному дослідженні, спрямованому на визначення ефективності PIPAC в лікуванні ПК колоректального раку, встановлено, що помірний та виражений біль з тяжким перебігом після PIPAC частіше виявляли в групі оксаліплатину, ніж цисплатину та доксорубіцину. Загрозливим побічним ефектом PIPAC, який фіксують лише під час застосування оксаліплатину, є гострий перитонеальний склероз, що призводить до механічної кишкової непрохідності [29, 32, 53].
Поточні дослідження І фази вивчають застосування NAB-паклітакселу, іринотекану та імунотерапевтичних лікарських засобів при PIPAC, хоча переважна більшість з них проводяться за межами Європи [33, 34].
У більшості клінічних досліджень, спрямованих на визначення ефективності PIPAC у лікуванні перитонеального карциноматозу РШ, усе ж використана схема доксорубіцин/цисплатин у зв’язку з відносно низьким відсотком побічних явищ та позитивними результатами попередніх досліджень (табл. 1).
| Номер клінічного дослідження | Локалізація первинного злоякісного новоутворення | Країна | Лікарські засоби, що використовуються при проведенні PIPAC | Схема системної терапії |
| NCT04913662 | Шлунок | Південна Корея | Паклітаксел | FOLFOX |
| NCT04329494 | Шлунок, яєчники, апендикс | США | Доксорубіцин/цисплатин | FOLFOX |
| NCT05644249 | Шлунок | Литва | Доксорубіцин/цисплатин | FOLFOX |
| NCT03304210 | Шлунок, підшлункова залоза, яєчники, грудна залоза | Бельгія | NAB-паклітаксел | Н/д |
| NCT05303714 | Шлунок | Італія | Доксорубіцин/цисплатин | FOLFOX |
| NCT05318794 | Шлунок | Англія | Доксорубіцин/цисплатин | Н/д |
Порівняння HIPEC та PIPAC
Спільні характеристики HIPEC і PIPAC включають потребу в операційній та загальну анестезію, хоча тривалість PIPAC коротша. PIPAC як етап операції займає лише 30 хв порівняно з 60–120 хв, потрібними для проведення HIPEC. Хоча внутрішньочеревний тиск, що досягається при проведенні PIPAC, є фактором, що покращує пенетрацію пухлинної тканини, одночасно він підвищує ризик пошкодження тканин. При дослідженні на тваринах, яким виконано накладання товстокишкового анастомозу, PIPAC порівняно з HIPEC мав вищу, хоч і не достовірну частоту неспроможностей анастомозу (37,5% проти 0%, p=0,20). Водночас у групі PIPAC відмічене більше споживання їжі і менша втрата маси тіла, що може свідчити про кращу якість життя [35].
Концентрація препарату для PIPAC вища, водночас дозування необхідне для проведення процедури значно нижче порівняно з HIPEC, що призводить до меншої абсорбції антинеопластичних агентів у кровотік і, як наслідок, нижчого відсотка побічних явищ [36]. Хоча техніку виконання лапароскопічної HIPEC у комбінації з циторедукцією опубліковано ще у 2018 р., HIPEC традиційно виконується відкритим шляхом, отже, має вищу тривалість перебування в лікарні та періоду, необхідного для повного відновлення [37]. Загальний рівень ускладнень після HIPEC + CRS (Cytoreductive surgery — циторедуктивна операція) сягає 55%, здебільшого визначається об’ємом CRS, при цьому інфекційні ускладнення становлять значну частину серед загального числа [38]. Тривалість госпіталізації після HIPEC коливається в широкому діапазоні й також асоційована з об’ємом CRS і ступенем ускладнень [39]. Зі свого боку, PIPAC зазвичай потребує перебування в стаціонарі від 1 до 3 діб та навіть може виконуватися в якості амбулаторної процедури, однак дані стосовно використання PIPAC у комбінації з CRS відсутні [32].
Ускладнення PIPAC
Відсоток ускладнень під час або після проведення PIPAC варіює від 0 до 62% та залежить від ретельності відбору пацієнтів та досвіду центру [31, 36, 40, 41]. Серед ускладнень, асоційованих з проведенням PIPAC, зазначено целюліт, фасциїт, кишкова непрохідність, плевральний випіт, флегмона передньої черевної стінки та перфорація стінки порожнистого органа, спричинена виконанням хірургічного доступу, проте ці ускладнення є загальнохірургічними і безпосередньо не пов’язані з процедурою PIPAC [36, 41–43]. Про унікальні тяжкі ускладнення, такі як перитонеальний склероз, повідомлялося рідко і лише після застосування оксаліплатину [31].
Важливо зазначити, що більшість пацієнтів, залучених у ранні дослідження PIPAC, мали поширене метастатичне ураження очеревини, що підвищувало загальний ризик ускладнень. Також слід пам’ятати про анестезіологічні ускладнення, пов’язані з підвищенням внутрішньочеревного тиску та розвитком можливих алергічних реакцій [27, 44]. Подібно до HIPEC, важливо пам’ятати про потенційні ускладнення, пов’язані з прийомом хіміопрепаратів. У доклінічних дослідженнях, проведених на тваринах після застосування високих доз цисплатину, відмічена тяжка форма тубулярного некрозу нирок.
Крім того, повідомлялося про нейтропенію, анемію, панкреатит, трансамініт, нудоту, втому та біль у животі як незначні ускладнення [30, 31, 45].
Предметом дискусії є місце PIPAC у лікуванні пацієнтів з онкопатологією та його комбінації із системною терапією. Більшість досліджень, присвячених PIPAC, проводилися у пацієнтів із прогресуванням метастатичного ураження очеревини на системній хіміотерапії, відповідно ці пацієнти не були визначені як кандидати для CRS/HIPEC.
Аналогічно дослідженням HIPEC виник інтерес використання PIPAC у якості профілактичного методу під час радикальних операцій у пацієнтів з підвищеним ризиком перитонеального рецидиву. В одному з таких досліджень, присвяченому РШ, не виявили підвищення частоти розвитку ускладнень у разі додавання профілактичного PIPAC під час гастректомії з лімфаденектомією D2 [45]. Ще одним з можливих методів є проведення PIPAC при неоад’ювантній терапії перед HIPEC + CRS. Дослідження такої методики охоплювало 406 пацієнтів, яким проводили PIPAC через ПК декількох типів злоякісних новоутворень, 21 пацієнта (5%) визнано кандидатом на проведення CRS/HIPEC у зв’язку з регресією вторинних вогнищ на тлі проведення PIPAC. У 20 з 21 пацієнтів досягнуто 0–1 бал відповідно до CC score [46].
Найвищий показник конверсії після 3 сеансів PIPAC поєднано із системною хіміотерапією на CRS/HIPEC становив 14%. У 146 пацієнтів у цьому дослідженні середній показник індексу ПК становив 16, а 7-місячна безрецидивна виживаність — 67% [47].
Незалежно від того, чи використовується PIPAC у якості неоад’ювантної, ад’ювантної або паліативної терапії, він є ефективним методом внутрішньочеревної терапії перитонеального карциноматозу різних первинних локалізацій.
РЕЗУЛЬТАТИ
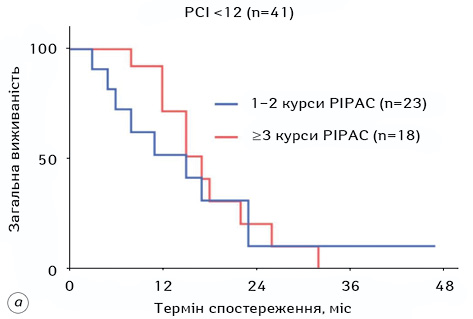
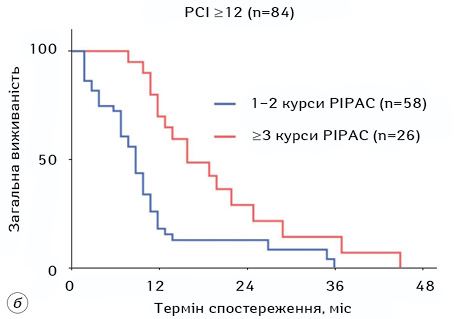
У більшості досліджень PIPAC, які охоплювали пацієнтів з РШ, застосовували комбінацію цисплатину в дозі 7,5 мг/м2 і доксорубіцину в дозі 1,5 мг/м2. Медіана кількості процедур PIPAC, які отримували пацієнти під час цих досліджень, становила від 1,5 до 3, а медіана PCI в непрофілактичних дослідженнях — від 10 до 20 (рис. 3, 4, табл. 2). Більшість досліджень дозволяли проводити постійну системну хіміотерапію, хоча схему визначено лише в одному дослідженні. Частота ускладнень після PIPAC становила від 0 до 37,5%, а смертність — від 0 до 8,3%. За наявними даними, PRGS (peritoneal regression grading score — оцінка перитонеальної регресії) і загальна виживаність пацієнтів, які пройшли щонайменше 2 курси лікування PIPAC, становили 40–83% і 15–16 міс відповідно. Повна патологічна відповідь була рідкісною, але її зафіксовано у 1 пацієнта в дослідженнях S. Rotolo та співавт. і F. Struller та співавт. [42, 47]. Також виявлено, що PCI не завжди корелює з PRGS [43]. У дослідженні F. Tidadini та співавт. додавання PIPAC збільшило загальну виживаність з моменту встановлення діагнозу ПК (12,8 міс vs 9,1; p=0,056) і сприяло зменшенню середньої кількості днів госпіталізації протягом 6 міс після встановлення діагнозу ПК (2 доби vs 11, p=0,04) без будь-якого значного збільшення частоти ускладнень (p=0,62) [48]. Злоякісний асцит є поширеною проблемою для пацієнтів з ПК РШ. За даними I. Gockel та співавт., стабілізацію або зменшення об’єму асциту встановлено у 79% осіб [49], за даними M. Alyami та співавт., повне зникнення асциту зафіксовано у 50% пацієнтів [50, 51].
| Перший автор, рік публікації | Кількість пацієнтів | Середня кількість процедур | Середній PCI | % PRGS
Grade 1/2 |
OS, міс | Наступна CRS | Середня тривалість госпіталізації, дні | Гострі ускладнення (CTCAE 3+,CD 3+), % |
| Nadiradze G., 2016 [51] | 24 | 2 | 16 | 50,0% | 15,4 | Н/д | Н/д | 37,5 |
| Rotolo S., 2020 [42] | 28 | 2 | 20 | Н/д | 12,3 | 3,5% | 2 | 4,0 |
| Alyami M., 2021 [50] | 42 | 2 | 17 | Н/д | 19,1 | 14,0% | 3 | 3,0 |
| Sindayigaya R., 2022 [52] | 131 | 2 | 15 | 73,0% | 10 | 7,0% | 5 | 5,0 |
| Tidadini F., 2022 [48] | 17 | 2 | 18 | Н/д | 12,8 | 11,8% | Н/д | 11,8 |
Наразі опубліковано лише 1 клінічне дослідження, присвячене профілактичному PIPAC після лапароскопічної гастректомії з лімфаденектомією D2 через пухлини підвищеного ризику (перснеподібноклітинна карцинома/T3+/N+/cyt+). Усі пацієнти, крім одного, отримали неоад’ювантну хіміотерапію, 15 з 21 хворого — ад’ювантну хіміотерапію. Один пацієнт мав позитивні результати цитологічного дослідження змивів з черевної порожнини на початку операції, але жоден з пацієнтів не мав позитивного результату цитологічного дослідження після проведення PIPAC. Ці та вищенаведені дані дозволяють припустити, що PIPAC може проводитися в якості методу конверсії позитивних перитонеальних змивів. Частота ускладнень не відрізнялася від середньої частоти ускладнень після лапароскопічної гастректомії з лімфаденектомією D2. 2 пацієнти (9,5%) мали гострий перебіг ускладнень, серед яких 1 — неспроможність стравохідно-тонкокишкового анастомозу і 1 — неспроможність кукси дванадцятипалої кишки [45]. Серед інших ускладнень траплялися: нейтропенія (4,7%), закреп (4,7%) і помірний біль (42,8%). Загалом, PIPAC поєднано з гастректомією або як самостійна процедура є безпечною і потенційно корисною в лікуванні РШ.
ВИСНОВКИ
ПК РШ — складна проблема, яка потребує персоналізованого та мультидисциплінарного підходу. PIPAC як методика лікування перитонеального карциноматозу потребує більш детального вивчення, але вже може застосовуватися у ретельно відібраних пацієнтів. Не дивлячись на поки що відсутні критерії чіткої селекції пацієнтів для цієї процедури, PIPAC у якості додаткового методу внутрішньочеревної хіміотерапії без підвищеного ризику розвитку хірургічних ускладнень залишається багатообіцяючим. Крім того, підвищена проникність пухлинної тканини під дією тиску дозволить розширити вибір хіміотерапевтичних препаратів, які можна застосовувати в PIPAC, що може відкрити можливість внутрішньочеревної хіміотерапії для ще більшої групи пацієнтів. Хоча повна відповідь на PIPAC поки що є рідкісним явищем, подовження виживаності з покращенням якості життя є метою, вартою подальших досліджень.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Ferlay, J., Ervik, M., Lam, F., Laversanne, M., Colombet, M., Mery, L., & Bray, F. (2024). Global Cancer Observatory: Cancer Today (version 1.1). Lyon, France: International Agency for Research on Cancer. Available from: gco.iarc.who.int/today.
2. Yarema, R., Оhorchak, М., Hyrya, P., Kovalchuk, Y., Safiyan, V., Karelin, I., … Fetsych, Т. (2020). Gastric cancer with peritoneal metastases: Efficiency of standard treatment methods. World Journal of Gastrointestinal Oncology, 12(5), 569–581. doi: 10.4251/wjgo.v12.i5.569.
3. Patel, T. H., & Cecchini, M. (2020). Targeted Therapies in Advanced Gastric Cancer. Current Treatment Options in Oncology, 21(9), 70. doi: 10.1007/s11864-020-00774-4. PMID: 32725377.
4. Tan, Z. (2019). Recent Advances in the Surgical Treatment of Advanced Gastric Cancer. Medical Science Monitor, 25, 3537–3541. doi: 10.12659/MSM.916475.
5. Rijken, A., Lurvink, R. J., Luyer, M. D. P., Nieuwenhuijzen, G. A. P., van Erning, F. N., van Sandick, J. W., & de Hingh, I. H. J. T. (2021). The Burden of Peritoneal Metastases from Gastric Cancer: A Systematic Review on the Incidence, Risk Factors and Survival. Journal of Clinical Medicine, 10(21), 4882. doi: 10.3390/jcm10214882.
6. Wang, Z., Chen, J. Q., Liu, J. L., & Tian, L. (2019). Issues on peritoneal metastasis of gastric cancer: an update. World Journal of Surgical Oncology, 17(1), 215. doi: 10.1186/s12957-019-1761-y.
7. Baba, H., Yamamoto, M., Endo, K., Ikeda, Y., Toh, Y., Kohnoe, S., & Okamura, T. (2003). Clinical efficacy of S-1 combined with cisplatin for advanced gastric cancer. Gastric Cancer, 6(1), 45–49. doi:10.1007/s10120-003-0222-y.
8. Ross, P., Nicolson, M., Cunningham, D., Valle, J., Seymour, M., Harper, P., … Norman, A. (2002). Prospective randomized trial comparing mitomycin, cisplatin, and protracted venous-infusion fluorouracil (PVI 5-FU) With epirubicin, cisplatin, and PVI 5-FU in advanced esophagogastric cancer. Journal of Clinical Oncology, 20(8), 1996–2004. doi: 10.1200/JCO.2002.08.105.
9. Preusser, P., Wilke, H., Achterrath, W., Fink, U., Lenaz, L., Heinicke, A., … Buente, H. (1989). Phase II study with the combination etoposide, doxorubicin, and cisplatin in advanced measurable gastric cancer. Journal of Clinical Oncology, 7(9), 1310–1317. doi: 10.1200/JCO.1989.7.9.1310. PMID: 2671287.
10. Lambert, L. A., & Wiseman, J. (2018). Palliative Management of Peritoneal Metastases. Annals of Surgery oncology, 25(8), 2165–2171. doi: 10.1245/s10434-018-6335-7.
11. Bootsma, S., Bijlsma, M. F., & Vermeulen, L. (2023). The molecular biology of peritoneal metastatic disease. EMBO Molecular Medicine, 15(3), e15914. doi: 10.15252/emmm.202215914.
12. Sandoval, P., Jiménez-Heffernan, J. A., Rynne-Vidal, Á., Pérez-Lozano, M. L., Gilsanz, Á., Ruiz-Carpio, V., … López-Cabrera, M. (2013). Carcinoma-associated fibroblasts derive from mesothelial cells via mesothelial-to-mesenchymal transition in peritoneal metastasis. Journal of Pathology, 231(4), 517–531. doi: 10.1002/path.4281.
13. Li, J., & Guo, T. (2022). Role of Peritoneal Mesothelial Cells in the Progression of Peritoneal Metastases. Cancers (Basel), 14(12), 2856. doi: 10.3390/cancers14122856.
14. Dedrick, R. L., Myers, C. E., Bungay, P. M., & DeVita, V. T. Jr. (1978). Pharmacokinetic rationale for peritoneal drug administration in the treatment of ovarian cancer. Cancer Treatment Reports, 62(1), 1–11.
15. Flessner, M. F. (1996). Small-solute transport across specific peritoneal tissue surfaces in the rat. Journal of the American Society of Nephrology, 7(2), 225–233. doi: 10.1681/ASN.V72225. PMID: 8785391.
16. Spratt, J. S., Adcock, R. A., Muskovin, M., Sherrill, W., & McKeown, J. (1980). Clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Research, 40(2), 256–260.
17. Harper, M. M., Kim, J., & Pandalai, P. K. (2022). Current Trends in Cytoreductive Surgery (CRS) and Hyperthermic Intraperitoneal Chemotherapy (HIPEC) for Peritoneal Disease from Appendiceal and Colorectal Malignancies. Journal of Clinical Medicine, 11(10), 2840. doi: 10.3390/jcm11102840.
18. Kusamura, S., Dominique, E., Baratti, D., Younan, R., & Deraco, M. (2008). Drugs, carrier solutions and temperature in hyperthermic intraperitoneal chemotherapy. Annals of Surgery oncology, 98(4), 247–252. doi: 10.1002/jso.21051.
19. Sugarbaker, P. H. (2017). Normothermic intraperitoneal chemotherapy long term (NIPEC-LT) in the management of peritoneal surface malignancy, an overview. Pleura and Peritoneum, 2(2), 85–93. doi: 10.1515/pp-2017-0012.
20. Sugarbaker, P. H. (2021). Intraperitoneal paclitaxel: pharmacology, clinical results and future prospects. Journal of Gastrointestinal Oncology, 12(1), S231–S239. doi: 10.21037/jgo-2020-03.
21. Jacquet, P., & Sugarbaker, P. H. (1996). Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. Cancer Treatment and Research, 82, 359–374. doi: 10.1007/978-1-4613-1247-5_23.
22. Solass, W., Herbette, A., Schwarz, T., Hetzel, A., Sun, J. S., Dutreix, M., & Reymond, M. A. (2012). Therapeutic approach of human peritoneal carcinomatosis with Dbait in combination with capnoperitoneum: proof of concept. Surgical Endoscopy, 26(3), 847–852. doi: 10.1007/s00464-011-1964-y.
23. Khosrawipour, V., Khosrawipour, T., Kern, A. J., Osma, A., Kabakci, B., Diaz-Carballo, D., … Fakhrian, K. (2016). Distribution pattern and penetration depth of doxorubicin after pressurized intraperitoneal aerosol chemotherapy (PIPAC) in a postmortem swine model. Journal of Cancer Research and Clinical Oncology, 142(11), 2275–2280. doi: 10.1007/s00432-016-2234-0.
24. Esquis, P., Consolo, D., Magnin, G., Pointaire, P., Moretto, P., Ynsa, M. D., … Chauffert, B. (2006). High intra-abdominal pressure enhances the penetration and antitumor effect of intraperitoneal cisplatin on experimental peritoneal carcinomatosis. Annals of Surgery, 244(1), 106–112. doi: 10.1097/01.sla.0000218089.61635.5f.
25. Facy, O., Al Samman, S., Magnin, G., Ghiringhelli, F., Ladoire, S., Chauffert, B., … Ortega-Deballon, P. (2012). High pressure enhances the effect of hyperthermia in intraperitoneal chemotherapy with oxaliplatin: an experimental study. Annals of Surgery, 256(6), 1084–1088. doi: 10.1097/SLA.0b013e3182582b38.
26. Shree, V., Lim, T. J., Lean, L. L., So, B. Y. J., & Kim, G. (2020). Anaesthesia considerations and techniques for Pressurised IntraPeritoneal Aerosol Chemotherapy (PIPAC). Pleura and Peritoneum, 5(4), 20190013. doi: 10.1515/pp-2019-0013.
27. Robella, M., Vaira, M., & De Simone, M. (2016). Safety and feasibility of pressurized intraperitoneal aerosol chemotherapy (PIPAC) associated with systemic chemotherapy: an innovative approach to treat peritoneal carcinomatosis. World Journal of Surgical Oncology, 14, 128. doi: 10.1186/s12957-016-0892-7.
28. Vaira, M., Robella, M., Borsano, A., & De Simone, M. (2016). Single-port access for Pressurized IntraPeritoneal Aerosol Chemotherapy (PIPAC): technique, feasibility and safety. Pleura and Peritoneum, 1(4), 217–222. doi: 10.1515/pp-2016-0021.
29. Nadiradze, G., Horvath, P., Sautkin, Y., Archid, R., Weinreich, F. J., Königsrainer, A., & Reymond, M. A. (2019). Overcoming Drug Resistance by Taking Advantage of Physical Principles: Pressurized Intraperitoneal Aerosol Chemotherapy (PIPAC). Cancers, 12(1), 34. doi: 10.3390/cancers12010034.
30. Kim, G., Tan, H. L., Sundar, R., Lieske, B., Chee, C. E., Ho, J., … So, J. B. Y. (2020). PIPAC-OX: A Phase I Study of Oxaliplatin-Based Pressurized Intraperitoneal Aerosol Chemotherapy in Patients with Peritoneal Metastases. Clinical Cancer Research, 27(7), 1875–1881. doi: 10.1158/1078-0432.CCR-20-2152.
31. Graversen, M., Detlefsen, S., Pfeiffer, P., Lundell, L., & Mortensen, M. B. (2018). Severe peritoneal sclerosis after repeated pressurized intraperitoneal aerosol chemotherapy with oxaliplatin (PIPAC OX): report of two cases and literature survey. Clinical & Experimental Metastasis, 35(3), 103–108. doi: 10.1007/s10585-018-9895-9.
32. Van De Sande, L., Graversen, M., Hubner, M., Pocard, M., Reymond, M., Vaira, M., … Ceelen, W. (2018). Intraperitoneal aerosolization of albumin-stabilized paclitaxel nanoparticles (Abraxane™) for peritoneal carcinomatosis — a phase I first-in-human study. Pleura and Peritoneum, 3(2), 20180112. doi: 10.1515/pp-2018-0112.
33. Lang, N., Diciola, A., Labidi-Galy, I., Ris, F., Di Marco, M., Mach, N., … Hubner, M. (2023). Nab-PIPAC: a phase IB study protocol of intraperitoneal cisplatin and nab-paclitaxel administered by pressurised intraperitoneal aerosol chemotherapy (PIPAC) in the treatment of advanced malignancies confined to the peritoneal cavity. BMJ Open, 13(1), e067691. doi: 10.1136/bmjopen-2022-067691.
34. Tavernier, C., Passot, G., Vassal, O., Allaouchiche, B., Decullier, E., Bakrin, N., … Kepenekian, V. (2020). Pressurized intraperitoneal aerosol chemotherapy (PIPAC) might increase the risk of anastomotic leakage compared to HIPEC: An experimental study. Surgical Endoscopy, 34(7), 2939–2946. doi: 10.1007/s00464-019-07076-3.
35. Giger-Pabst, U., Bucur, P., Roger, S., Falkenstein, T. A., Tabchouri, N., Le Pape, A., … Ouaissi, M. (2019). Comparison of Tissue and Blood Concentrations of Oxaliplatin Administrated by Different Modalities of Intraperitoneal Chemotherapy. Annals of Surgery oncology, 26, 4445–4451. doi: 10.1245/s10434-019-07695-z.
36. Arjona-Sánchez, Á., Rodríguez-Ortiz, L., Rufián-Peña, S., Sánchez-Hidalgo, J. M., & Briceño-Delgado, J. (2018). Laparoscopic approach in complete cytoreductive surgery and hyperthermic intraperitoneal chemotherapy by CO2 closed system in a low grade pseudomyxoma peritonei. Cirugía Española (Engl. Ed.), 96(10), 656–658. doi: 10.1016/j.ciresp.2018.03.013.
37. Gamboa, A. C., Lee, R. M., Turgeon, M. K., Zaidi, M. Y., Kimbrough, C. W., Grotz, T. E., … Staley, C. A. (2020). Implications of Postoperative Complications for Survival After Cytoreductive Surgery and HIPEC: A Multi-Institutional Analysis of the US HIPEC Collaborative. Annals of Surgery oncology, 27(13), 4980–4995. doi: 10.1245/s10434-020-08843-6.
38. Pillinger, N. L., Koh, C. E., Ansari, N., Munoz, P. A., McNamara, S. G., & Steffens, D. (2022). Preoperative cardiopulmonary exercise testing improves risk assessment of morbidity and length of stay following cytoreductive surgery with hyperthermic intraperitoneal chemotherapy. Anaesthesia and Intensive Care, 50(6), 447–456. doi: 10.1177/0310057X211064904.
39. Robella, M., Hubner, M., Sgarbura, O., Reymond, M., Khomiakov, V., di Giorgio, A., … Vaira, M. (2022). ISSPP PIPAC study group. Feasibility and safety of PIPAC combined with additional surgical procedures: PLUS study. European Journal of Surgical Oncology, 48(10), 2212–2217. doi: 10.1016/j.ejso.2022.05.001.
40. Alyami, M., Gagniere, J., Sgarbura, O., Cabelguenne, D., Villeneuve, L., Pezet, D., … Passot, G. (2017). Multicentric initial experience with the use of the pressurized intraperitoneal aerosol chemotherapy (PIPAC) in the management of unresectable peritoneal carcinomatosis. European Journal of Surgical Oncology, 43(11), 2178–2183. doi: 10.1016/j.ejso.2017.09.010.
41. Mehta, S., Kammar, P., Patel, A., Goswami, G., Shaikh, S., Sukumar,V., … Bhatt, A. (2022). Feasibility and Safety of Taxane-PIPAC in Patients with Peritoneal Malignancies-a Retrospective Bi-institutional Study. Indian Journal of Surgical Oncology, 14(1), 1–9. doi: 10.1007/s13193-022-01641-4.
42. Rotolo, S., Ferracci, F., Santullo, F., Lodoli, C., Inzani, F., Abatini, C., … Di Giorgio, A. (2020). Systemic chemotherapy and pressurized intraperitoneal aerosol chemotherapy (PIPAC): A case report of a multimodal treatment for peritoneal metastases of pancreatic origin. International Journal of Surgery Case Reports, 77S, S75–S78. doi: 10.1016/j.ijscr.2020.10.054.
43. Graversen, M., Rouvelas, I., Ainsworth, A. P., Bjarnesen, A. P., Detlefsen, S., Ellebaek, S. B., … Mortensen, M. B.(2023). Feasibility and Safety of Laparoscopic D2 Gastrectomy in Combination with Pressurized Intraperitoneal Aerosol Chemotherapy (PIPAC) in Patients with Gastric Cancer at High Risk of Recurrence-The PIPAC-OPC4 Study. Annals of Surgery oncology, 30(7), 4433–4441. doi: 10.1245/s10434-023-13278-w.
44. Robella, M., De Simone, M., Berchialla, P., Argenziano, M., Borsano, A., Ansari, S., … Vaira, M. (2021). A Phase I Dose Escalation Study of Oxaliplatin, Cisplatin and Doxorubicin Applied as PIPAC in Patients with Peritoneal Carcinomatosis. Cancers (Basel), 13(5), 1060. doi: 10.3390/cancers13051060.
45. Girshally, R., Demtröder, C., Albayrak, N., Zieren, J., Tempfer, C., & Reymond, M. A. (2016). Pressurized intraperitoneal aerosol chemotherapy (PIPAC) as a neoadjuvant therapy before cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. World Journal of Surgical Oncology, 14(1), 253. doi: 10.1186/s12957-016-1008-0.
46. Alyami, M., Mercier, F., Siebert, M., Bonnot, P. E., Laplace, N., Villeneuve, L., … Kepenekian, V. (2019). Unresectable peritoneal metastasis treated by pressurized intraperitoneal aerosol chemotherapy (PIPAC) leading to cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. European Journal of Surgical Oncology, 47(1), 128–133. doi: 10.1016/j.ejso.2019.06.028.
47. Struller, F., Horvath, P., Solass, W., Weinreich, F. J., Strumberg, D., Kokkalis, M. K., … Reymond, M. A. (2019). Pressurized intraperitoneal aerosol chemotherapy with low-dose cisplatin and doxorubicin (PIPAC C/D) in patients with gastric cancer and peritoneal metastasis: a phase II study. Therapeutic Advances in Medical Oncology, 11, 1758835919846402. doi: 10.1177/1758835919846402.
48. Tidadini, F., Abba, J., Quesada, J. L., Baudrant, M., Bonne, A., Foote, A., … Arvieux, C. (2022). Effect of Pressurized Intraperitoneal Aerosol Chemotherapy on the Survival Rate of Patients with Peritoneal Carcinomatosis of Gastric Origin. Journal of Gastrointestinal Cancer, 53, 971–979. doi: 10.1007/s12029-021-00698-8.
49. Gockel, I., Jansen-Winkeln, B., Haase, L., Rhode, P., Mehdorn, M., Niebisch, S., … Thieme, R. (2018). Pressurized Intraperitoneal Aerosol Chemotherapy (PIPAC) in Gastric Cancer Patients with Peritoneal Metastasis (PM): Results of a Single-Center Experience and Register Study. Journal of Gastrointestinal Cancer, 18(4), 379–391. doi: 10.5230/jgc.2018.18.e37.
50. Alyami, M., Bonnot, P. E., Mercier, F., Laplace, N., Villeneuve, L., Passot, G., … Glehen, O. (2021). Pressurized intraperitoneal aerosol chemotherapy (PIPAC) for unresectable peritoneal metastasis from gastric cancer. European Journal of Surgical Oncology, 47(1), 123–127. doi: 10.1016/j.ejso.2020.05.021.
51. Nadiradze, G., Giger-Pabst, U., Zieren, J., Strumberg, D., Solass, W., & Reymond, M. A. (2016). Pressurized Intraperitoneal Aerosol Chemotherapy (PIPAC) with Low-Dose Cisplatin and Doxorubicin in Gastric Peritoneal Metastasis. Journal of Gastrointestinal Surgery, 20(2), 367–373. doi: 10.1007/s11605-015-2995-9.
52. Sindayigaya, R., Dogan, C., Demtröder, C. R., Fischer, B., Karam, E., Buggisch, J. R., … Giger-Pabst, U. (2022). Clinical Outcome for Patients Managed with Low-Dose Cisplatin and Doxorubicin Delivered as Pressurized Intraperitoneal Aerosol Chemotherapy for Unresectable Peritoneal Metastases of Gastric Cancer. Annals of Surgery oncology, 29, 112–123. doi: 10.1245/s10434-021-10860-y.
53. Graversen, M., Detlefsen, S., Ainsworth, A. P., Fristrup, C. W., Knudsen, A. O., Pfeiffer, P., … Mortensen, M. B. (2023). Treatment of Peritoneal Metastasis with Pressurized Intraperitoneal Aerosol Chemotherapy: Results from the Prospective PIPAC-OPC2 Study. Annals of Surgery oncology, 30(5), 2634–2644. doi: 10.1245/s10434-022-13010-0.
Адреса для листування:
Пепенін Микита Олексійович
03022, Київ, вул. Юлії Здановської, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: pepenin95@gmail.com
Correspondence:
Mykyta Pepenin
33/43 Yulii Zdanovskoi Str., Kyiv
Nonprofit Organization National Cancer Institute
E-mail: pepenin95@gmail.com














Leave a comment