Плоскоклітинний рак легень розвивається з клітин альвеолярного епітелію
Резюме. Вступ. Рак легень (РЛ) посідає провідне місце за рівнем захворюваності та смертності у світі. Його діагностують у 60–70% усіх випадків на III–IV стадіях, коли вже неможливо провести повний курс лікування. У наведених даних встановлено потребу у вивченні проблеми РЛ. Одним з перших питань є визначення гістогенезу — від чого залежить рівень морфологічної діагностики й ефективність терапії. Вивченню гістогенезу залозистого РЛ присвячено багато робіт, водночас плоскоклітинний рак легень (ПРЛ) у цьому плані не висвітлений у медичній літературі. Мета — визначити макроскопічні та гістологічні особливості ПРЛ за операційними матеріалами. Матеріали і методи дослідження. Вивчені макроскопічні та гістологічні дані операційного матеріалу 15 хворих на ПРЛ, які обстежувалися і лікувалися в Державному некомерційному підприємстві (ДНП) «Національний інститут раку» у 2023 р. Препарати забарвлені гематоксиліном і еозином. Проведені імуногістохімічні дослідження з моноклональними антитілами Кі-67 та ядерним антигеном проліферуючих клітин (Proliferating Cell Nuclear Antigen — PCNA). Використано мікроскоп Olympus BX41. Матеріал верифікований гістологічним методом згідно з Міжнародною гістологічною класифікацією Всесвітньої організації охорони здоров’я (ВООЗ). Результати дослідження. Виявлений екзофітний ріст ПРЛ у бронхах у 2 (13%) хворих, у решти — перибронхіальний (87%). 1/3 частина всіх хворих на ПРЛ (5 осіб, або 33%) мала багатовузловий ріст. Зафіксовано, що пухлина виявлялася на відстані 0,5–3,5 см від найближчого бронха. У гістологічному дослідженні встановлений ріст ПРЛ від базальної мембрани до центру альвеол. Висновки. Вивчення гістологічної структури ПРЛ дозволило виявити у всіх випадках ріст новоутворення з альвеолярного епітелію, який починається від базальної мембрани і росте до її центру, в якому відмічається некроз як відома характерна ознака епітеліальних пухлин, які інтенсивно ростуть, і настає нестача кровопостачання. Наведений патоморфоз ПРЛ у всіх досліджених препаратах підтверджується множинними морфологічними ознаками ракової тканини, її клітин і є нашим пріоритетним феноменом, не представленим у науковій літературі.
Одержано 29.04.2024
Прийнято до друку 06.05.2024
DOI: 10.32471/clinicaloncology.2663-466X.54-2.32323
ВСТУП
РЛ — найбільш смертоносний злоякісний процес у світі, який посідає провідне місце за рівнем захворюваності та смертності [2, 5, 9, 25]. Відомо також, що діагностують РЛ у 60–70% усіх випадків на III–IV стадіях, коли не завжди можна використати адекватні методи лікування. Відмічається також підвищений рівень смертності у 60–75% усіх випадків протягом 1-го року після встановлення діагнозу [9, 21]. Cитуація, що склалася, викликає стурбованість усієї медичної спільноти, учених-пульмонологів і потребує поглибленого вивчення проблеми загалом і, зокрема, гістогенезу, від чого залежить точність морфологічної діагностики, а відтак і ефективність терапії РЛ [1, 3, 4, 27].
Вивченню питання гістогенезу присвячена велика кількість експериментальних досліджень закордонних авторів. G. Ferone та співавтори [17] проаналізували 60 статей, опублікованих у ХХІ ст., присвячених вивченню цього питання. У результаті автори не дійшли єдиного висновку. Кожний з них зафіксував 1 чи 2 джерела розвитку РЛ. Є декілька публікацій, присвячених гістогенезу РЛ на патологоанатомічному матеріалі людини [10, 12–14, 20, 21].
Зважаючи на те, що із сучасної Міжнародної гістологічної класифікації ВООЗ виключено назву «бронхіоло-альвеолярний РЛ» і замінено на «вистеляючий» (lepidic), тобто залишено структурно-формальну назву, як і для інших типів залозистого новоутворення, складається думка, що автори не згодні з генезом цього типу РЛ [26, 28]. З одного боку, таке упорядкування має загальний класифікаційний сенс, але при цьому втрачається гістогенетична складова назви цього типу РЛ. З другого боку, такий крок може прямо чи опосередковано свідчити про єдине джерело розвитку різних варіантів залозистого РЛ (ЗРЛ). У ланцюгу різних досліджень стосовно гістогенезу РЛ відома монографія I. Bertoncello [11], в якій автор стверджує, що ЗРЛ розвивається виключно з альвеолярного епітелію.
Що ж стосується ПРЛ, то подібні дані відсутні. Але W. Travis припустив, що ПРЛ може розвиватися з базального епітелію бронхів [26, 28], тобто гістогенез ПРЛ досконало ще не визначений і потребує різносторонніх досліджень. Одним з таких може бути наше вивчення морфологічних аспектів операційного матеріалу від хворих на ПРЛ.
Мета — визначити макроскопічні та гістологічні особливості ПРЛ за операційними матеріалами.
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Вивчені макроскопічні та гістологічні дані за операційними матеріалами 15 хворих на ПРЛ, які обстежувалися та лікувалися в ДНП «Національний інститут раку» у 2023 р. Матеріал отримували в порядку госпіталізації та під час планового оперативного лікування. Усі дані хворих зіставлені з клініко-рентгенологічними результатами обстеження, типом оперативного втручання, наявністю метастатичного ураження, вростання в плевру та іншими характеристиками. Метод забарвлення — гематоксиліном й еозином. Проведені імуногістохімічні дослідження з моноклональними антитілами Кі-67 та PCNA. Використано мікроскоп Olympus BX41. Операційний матеріал верифікований гістологічним методом згідно із сучасною ВООЗ Міжнародною гістологічною класифікацією пухлин легень [26].
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ
У дослідження залучені хворі віком від 48 до 77 років, 6 (40%) з них віком 60–70 років, а середній вік становив (64,5±0,5) років. Чоловіків було 14 (93%) і 1 (7%) жінка віком 62 роки, у якої виявлений пухлинний процес у легенях і метастаз в 5-му ребрі. У 10 (67%) хворих виявлений 1 пухлинний вузол, а 2 і більше вузлів зафіксовано у 5 (33%) пацієнтів. У 2 з них відмічається нечіткість периферичних контурів пухлини, що можна оцінити як дифузний ріст у паренхімі легень. Заслуговує на увагу поширеність ракового процесу у 1 хворого, в якого пухлинні вузли виявлені у 2 долях. Визначений метастатичний ріст ПРЛ у лімфатичні вузли, м’які тканини і ребро. У пацієнтів більш молодого віку в 48 і 49 років патологічний процес мав поширений характер. Цікаво відмітити, що екзофітне ураження в бронхах виявлено лише у 2 (13%) хворих, а у 13 (87%) — ракова пухлина була на різній відстані від найближчого бронха. Більш детальна характеристика отриманих даних представлена в таблиці.
| Клініко-морфологічні ознаки | |||||||||||||||||||
| Ураження легень | Тип операції | Наявність екзофіту | Відстань від пухлини до бронхів 0,5–3,5 см | Наявність багатовузлової пухлини | Вростання пухлини в плевру | Наявність метастазів | |||||||||||||
| Правої | Лівої | Лобектомія | Білобектомія | Пульмонектомія | |||||||||||||||
| n | % | n | % | n | % | n | % | n | % | n | % | n | % | n | % | n | % | n | % |
| 9 | 60 | 6 | 40 | 12 | 80 | 2 | 13 | 1 | 7 | 2 | 13 | 9 | 60 | 5 | 33 | 6 | 40 | 8 | 54 |
Гістологічне дослідження операційного матеріалу всіх 15 хворих на ПРЛ дозволило виявити ріст пухлини в альвеолах та розвиток некротичних мас у їх центрі. Чітко прослідковувалися міжальвеолярні перетинки, не рідко із судинами (рис. 1). Напрямок росту ПРЛ в альвеолах від базальної мембрани до центру підтверджується низкою морфологічних ознак. Шар клітин, які ростуть від базальної мембрани, забарвлюється більш інтенсивно, ядра в них гіперхромні.
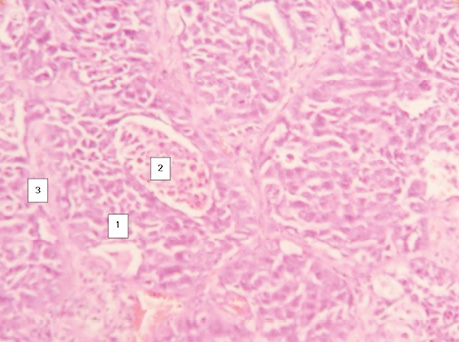
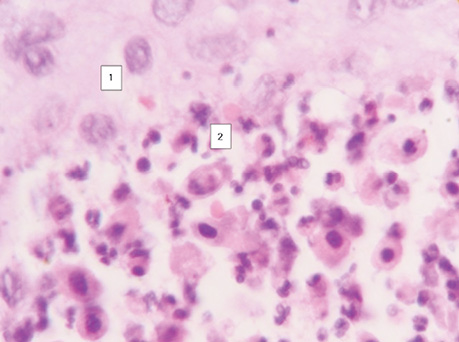
Наступні ряди клітин над ними більш диференційовані і виглядають світлішими, а ряди клітин, що знаходяться над некротичними масами в центрі альвеол, набувають ознак лізису, й окремі клітини відпадають від солідного пласта пухлини, що прослідковується на мікрофотографіях. На окремих гістологічних зрізах можна зафіксувати частину клітини ще в солідному пласті, а друга її частина уже знаходиться серед некротичних мас (рис. 2). Крім того, за результатами проведених нами реакцій з моноклональними антитілами Кі-67 (рис. 3). і PCNA (рис. 4) встановлено, що ряд базальних клітин більш інтенсивно відреагував порівняно з клітинами над ними. Реакція свідчить про більш виражений активний проліферативний стан клітин у базальному ряду. Водночас шар ракових клітин, що прилягає до центру альвеоли, незначно реагує з моноклональними антитілами та для них характерні ознаки некротичних змін у зв’язку з активним ростом пухлини і нестачею кровопостачання [12].
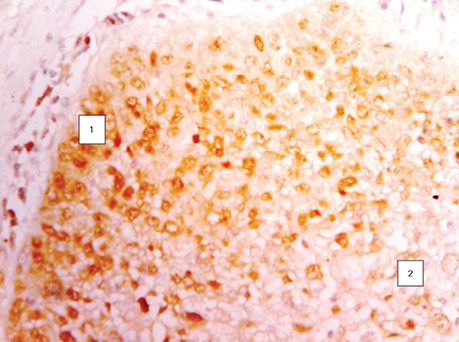
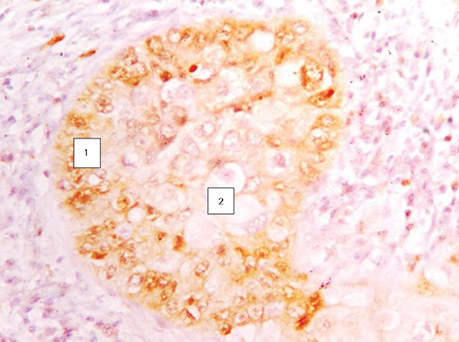
ОТРИМАНІ ДАНІ ТА ЇХ ОБГОВОРЕННЯ
У результатах макроскопічних досліджень операційного матеріалу встановлено, що лише у 2 (13%) хворих зафіксований екзофітний ріст пухлини в бронхах, у 9 (60%) — пухлинні вузли знаходилися на різній відстані — від 0,5 до 3,5 см від найближчого бронха, що не може підтвердити розвиток ПРЛ з циліндричного епітелію центральних бронхів. У спеціальних гістологічних дослідженнях виявлено, що циліндричний епітелій належить до зрілого типу, з якого не може брати початок ракова пухлина [12]. Виявлення декількох пухлинних вузлів у легенях чи в долі легені свідчить про мультифокальний ріст ПРЛ, тобто існують множинні джерела розвитку цього типу пухлини.
Низка вчених визначили місце переходу клітин базального епітелію бронха в альвеолярний, яке є найбільш вразливим до біологічних чи хімічних реагентів. Саме в цій локалізації виявляються епітеліальні клітини з найбільш вираженими реактивними і проліферативними змінами [18, 19, 22]. Епітеліальні клітини в такому місці мають ознаки «Status resistence minimum». Згадані автори створили показову схему, на якій яскраво прослідковуються перехід і зміни базального епітелію бронха в альвеолярний, тобто в цьому місці можуть розвиватися різні патологічні процеси і, зокрема, РЛ. Інші дослідники констатували наявність таких переходів упродовж усього бронхіального дерева, що може пояснити мультифокальний ріст РЛ [23]. Аналогічно таке вразливе місце є в людському організмі у жінок. Місце стику циліндричного епітелію цервікального каналу в плоский епітелій ектоцервіксу, де розвиваються передракові стани і рак шийки матки. На принципі отримання діагностичного матеріалу з цього вразливого місця побудований скринінг раку шийки матки у жінок усіх країн світу.
Поряд із цим декілька вчених, використовуючи різні методи дослідження і, зокрема, метод електронної мікроскопії, установили, що стовбуровою клітиною (СК) легень, а відтак і СК РЛ є альвеолоцит ІІ типу (АТІІ) [6–8, 10, 15, 16, 19, 29]. Результати наших досліджень співпадають з даними вищезгаданих авторів.
Відомо, що структурні аспекти органа часто передбачають схильність до певних захворювань. Проведені спеціальні дослідження дозволили авторам різних країн світу установити, що від бронхів різного калібру відходять бронхіоло-альвеолярні (термінальні) структури, тобто будова легень у периферичних і центральних відділах подібна, що має безпосереднє значення в розвитку РЛ [14, 24]. Важливо нагадати, що в легенях людини нараховується 300–400 млн альвеол. Цей факт має вирішальне значення при розвитку РЛ з альвеолярного епітелію і може пояснити безсимптомний початок і пізню діагностику.
Про місце початку розвитку патологічних процесів у легенях відомо з публікації L.S. Bolgova [12]. На основі морфологічних і функціональних досліджень стверджується, що всі патологічні процеси в легенях беруть початок з термінальних бронхіол. Цей факт ухвалений в анатомічній номенклатурі і має безпосереднє відношення до наших пошукових розробок.
Виконані нами дослідження розкривають не визначену до цього часу характеристику росту і поширення ПРЛ достовірними морфологічними даними і узгоджуються з результатами фундаментальних досліджень авторів різних напрямків вивчення проблеми РЛ.
ВИСНОВКИ
1. Сучасне вивчення морфологічних особливостей росту і поширення ПРЛ за макроскопічними, гістологічними та імуногістохімічними ознаками операційного матеріалу дозволяють зробити підсумок про те, що цей тип РЛ характеризується переважно перибронхіальним у 87% і лише в 13% усіх випадків — ендобронхіальним ростом, поширеністю паренхімою легень у 33% та мультифокальним ураженням легень.
2. В усіх гістологічних препаратах 15 обстежених хворих виявлений чіткий ріст ПРЛ з альвеолярних клітин, що починається від базальної мембрани і росте в напрямку до її центру, в якому часто відмічається некроз як відома характерна ознака епітеліальних пухлин.
3. Уперше в науковій літературі світу публікуються виявлені нами особливості гістологічної структури і росту ПРЛ з клітин альвеолярного епітелію, локалізованих в альвеолах, яких в організмі людини нараховується 300–400 млн, що пояснює безсимптомний початок розвитку РЛ при ураженні лише їх частини та послідовний ріст пухлини до фатального клінічного перебігу і пізньої діагностики, коли вже неможливо провести комплексне ефективне лікування, чим і пояснюється висока смертність від РЛ.
4. Результати наших досліджень можуть сприяти новому обґрунтованому підходу до морфологічної та рентгенологічної діагностики та оцінити можливість локального безпосереднього введення лікарських циторедуктивних препаратів, а також створенню сучасних програм профілактичного напрямку РЛ.
CПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Болгова, Л. С. (1999). О гистогенезе рака легкого. Онкология, 4, 262–265.
2. Болгова, Л. С., & Туганова Т. Н. (2013). Рак легкого: вопросы гистогенеза и цитологической диагностики. Київ: KIM.
3. Болгова, Л. С., Aлeксeeнкo, O. I., Tугaнoвa, T. Н., Зотиков, Л. A., & Кротевич, М. С. (2008). Цитологические, цитогенетические и ультраструктурные исследования при изучении гистогенеза железистого рака легкого. Oнкология, 10(3), 334–338.
4. Болгова, Л. С., Tуганова, T. Н., Aлексеенко, O. I., Кротевич, М. С., & Шестакова, Т. С. (2010). Патологоанатомическое изучение характера роста и распространение рака легкого для уточнения гистогенеза. Онкология, 12(1), 112–126.
5. Верьовкіна, Н. О. (2018). Останні досягнення імунотерапії в лікуванні онкологічних пацієнтів: застосування імунотерапії при недрібноклітинному раку легені. Клінічна онкологія, 4(32), 228–231.
6. Загорулько, А. К., & Аскари, Т. А. (2002). Атлас ультраструктурной морфологии респираторного отдела легких. Симферополь: «AZ — PRESS» —«СОНАТ».
7. Туганова, Т. Н., & Болгова, Л. С. (2011). Сравнительные данные цитогенетических показателей альвеолярного эпителия и опухолевых клеток при плоскоклеточном раке легкого. Клиническая онкология, 3(3), 102–106.
8. Туганова, Т. Н., Болгова, Л. С., & Ярощук, Т. М. (2011). Исследования ядрышковых организаторов хромосом и эпителия паренхимы легкого для уточнения гистогенеза железистого рака. Онкология, 13(1), 17–21.
9. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2023). Рак в Україні, 2021–2022. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. (Vol. 24). Кропивницький: Поліум.
10. Beers, M. Y., & Moodley, Y. (2017). When Is an Alveolar Type 2 Cell an Alveolar Type Cell? А Conundrum for Lung Stem Cell Biology and Regenerative Medicine. American Journal of respiratory cell and molecular biology, 57, 118–127. doi.org/10.1165/rcmb.2016-0426PS.
11. Bertoncello, I. (2015). Stem Cells in the Lung. Devlopment, Repair and Regeneration. Springer.
12. Bolgova, L. S., Tuganova, T. N., Alekseenko, O. I., & Ponomarenko, A. A. (2022). On the origin of lung cancer development. Experimental oncology, 44(1), 17–22. doi.org/10.32471/exp-oncology.2312-8852.vol-44-no-1.17227.
13. Bolgova, L. S., Tuganova, T. N., Alekseenko, O. I., Litvinets, O. M., Suprun, G. A., & Ponomarenko, A. A. (2020). Histogenesis of central lung cancer: cytological investigation. Experimental oncology, 42(4), 310–313. doi.org/10.32471/exp-oncology.2312-8852.vol-42-no-4.15232.
14. Bolgova, L., Shypko, A., Tuganova, T., Alekseenko, O., Smolanka, I., Ponomarenko, A., & Bilko, N. (2023). New data on histogenesis and histological structure of lung cancer. Experimental oncology, 45(1), 62–69. doi.org/10.15407/exp.- oncology.2023.01.062.
15. Desai, T. J., Brownfield, D. G., & Krasnow, M. A. (2014). Alveolar progenitor and Stem cells in lung development, renewal and cancer. Nature, 507(7491), 190–194.
16. Eramo, A., Lotti, F., & Sette, G. (2008). Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death & Differentiation, 15(3), 504–514.
17. Ferone, G., Lee, M. C., Sage, J., & Berns, A. (2020). Cells of origin of lung cancers: lessons from mouse studies. Genes & Development, 34(15–16), 1017–1032. doi: 10.1101/gad.338228.120.
18. Frank, D. B., Penkala, I. J., Zepp, J. A., Sivakumar, A., Linares-Saldana, R., Zacharias, W. J., … Morrisey, E. E. (2019). Early lineage specification definesalveolar Epithelial ontogeny in the murine lung. Proceedings of the National Academy of Sciences of the United States of America, 116(10), 4362–4371. doi.org/10.1073/pnas.1813952116.
19. Hanna, J. M., & Onaitis, M. W. (2013). Cell of origin of lung cancer. Journal of Carcinogenesis and Mutagenesis, 12, 6. doi: 10.4103/1477-3163.109033.
20. Have-Opbroek, A. A., Benfield, J. R., van Krieken, J. H., & Dijkman, J. H. (1997). The alveolar type II cell in the genesis of human adenocarcinomas and squamous cell carcinomas. Histopathology, 12, 319–336.
21. Heng, W. S., Gosens, R., & Kruyt, F. (2019). Lung cancer stem cells: origin, features, maintenance mechanisms and therapeutic targeting. Biochemical Pharmacology, 160, 121–133. doi.org/10.1016/j.bcp.2018.12.010.
22. Hogan, B. L., Barkauskas, C. E., Chapman, H. A., Epstein, J. A., Jain, R., Hsia, C. C., … Morrisey, E. E. (2014). Repair and Regeneration of the Respiratory System: Complexity, Plasticity, and Mechanisms of Lung Stem Cell Function. Cell Stem Cell, 15(2), 123–138. doi.org/10.1016/j.stem.2014.07.012.
23. Navarro, S., & Driscoll, B. (2017). Regeneration of the Aging Lung: A Mini-Review. Gerontology, 63(3), 270–280. doi.org/10.1159/00045108.
24. Netter, F. (2019). Atlas of human anatomy. Amsterdam: Elsevier.
25. Sung, H., Ferlay, J., Siegel, R. L., Laversanne, M., Soerjomataram, I., Jemal, A., & Bray, F. (2021). Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. Cancer Journal for Clinicians, 71(3), 209–249. doi.org/10.3322/caac.21660.
26. Thoracic Tumours: WHO Classification of Tumours. (2021). (5th ed. V.5). Lyon: International Agency for Researh on cancer. publications.iarc.fr/ Book-And-Report-Series/Who-Classification-Of-Tumours/Thoracic-Tumours-2021.
27. Toyokawa, G., Yamada, Y., Tagawa, T., Kozuma, Y., Matsubara, T., Haratake, N., … Maehara, Y. (2018). Significance of spread through air spaces in resected pathological Stage I lung adenocarcinoma. Annals of Thoracic Surgery, 105, 1655–1663. doi: 10.1016/j.athoracsur.2018.01.037.
28. Travis, W., Nicholson, S., & Hirsch, F. R. (2004). Pathology and genetics of Tumours of the Lung, Pleura, Thymus and Heart. IARC Press.
29. Weibel, E. R. (1970). Morphometry of human lungs. NY: Springer.
Адреса для листування:
Болгова Лідія Севастянівна
03022, Київ, вул. Юлії Здановської, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: bolgova2006@ukr.net
Correspondence:
Lidiya Bolgova
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: bolgova2006@ukr.net














Leave a comment