Сорафеніб у лікуванні йодонегативного диференційованого раку щитоподібної залози
Солодянникова О.І.1, Кметюк Я.В.2, Столярова О.Ю.1, Даниленко В.В.1, Сукач Г.Г.1
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Всеукраїнський центр радіохірургії при лікарні «Феофанія» Державного управління справами, Київ, Україна
Резюме. Мета роботи — розробити спосіб лікування йодонегативних метастазів диференційованого раку щитоподібної залози (ДРЩЗ). Матеріали і методи дослідження. Проліковано 20 хворих з йодонегативними метастазами ДРЩЗ, з яких у 10 ефективність лікування оцінювали за допомогою сцинтиграфії всього тіла (СВТ) з 99mTc-MIBI. У 10 пацієнтів безпосередні результати терапії інгібіторами тирозинкінази оцінювали за допомогою позитронно-емісійної томографії (ПЕТ) з 18F-ФДГ. 8 осіб залучили у групу, в якій відмічалося ураження кісток і лікування здійснювалося за допомогою радіонуклідної та дистанційної променевої терапії. Середній вік пацієнтів коливався від 43 до 76 років, медіана — 57,8+3,9 року, з них жінок — 24, чоловіків — 14. Патогістологічно папілярний рак діагностовано у 31 особи, фолікулярний — у 5 осіб, папілярно-фолікулярний — у 2 хворих. Дослідження проводилося з використанням наступних технічних засобів — 2-детекторної гамма-камери фірми «Mediso» (Угорщина) та однофотонного емісійного комп’ютерного томографа (ОФЕКТ) «E. CAM 180» фірми «Siemens» (Німеччина). ПЕТ/комп’ютерну томографію (КТ) проводили на комбінованому томографі «Biograph-64-TruePoint-Siemens» (Німеччина) згідно з рекомендаціями Європейської асоціації ядерної медицини (European Association of Nuclear Medicine — EANM). У групі порівняння охоплено 20 пацієнтів з йодопозитивними метастазами ДРЩЗ. Результати. До початку терапії 10 хворим на ДРЩЗ проведено СВТ з 99mTc-MIBI і повторне дослідження через 3 міс з метою оцінки ефективності лікування. Після проведення діагностичного обстеження пацієнтам призначено таргетну терапію препаратом Нексавар® згідно з протоколом лікування. Унаслідок терапії досягнуто регресії вогнища в легенях у межах 70%. Подальший моніторинг ефективності протипухлинного лікування проводився за допомогою СВТ з 99mTc-MIBI. 10 пацієнтів, яким до лікування було проведене первинне діагностичне дослідження за допомогою ПЕТ/КТ — 18F-ФДГ, також проліковані за допомогою таргетної терапії препаратом Нексавар®. Завдяки діагностичному скануванню з 18F-ФДГ після проведеної терапії виявили зниження функціональної активності вогнища в зоні шиї, однак зменшення розміру вогнища не зафіксовано. Висновки. Лікування йодонегативних метастазів ДРЩЗ за допомогою інгібіторів тирозинкінази супроводжувалося зменшенням кількості метастатичних вогнищ та зниженням рівня їх функціональної активності. У проведених дослідженнях доведено можливість використання методик з нейодними радіофармпрепаратами (РФП) (99mTc-MIBI) для оцінки ефективності лікування йодонегативних метастазів ДРЩЗ. ПЕТ/КТ з 18F-ФДГ є високо інформативною методикою для оцінки впливу інгібіторів тирозинкінази на функціональну активність метастатичних вогнищ за даними метаболічного сканування при лікуванні йодонегативних метастазів ДРЩЗ. За відсутності позитивної динаміки після 3–4 курсів показано застосування дистанційної променевої терапії із сумарною осередковою дозою (СОД) 30–50 Гр, яка дозволяє зменшити об’єм метастатичних осередків та знизити їх метаболічну активність. Соціальне та економічне значення одержаних результатів унаслідок виконання дослідження дозволили покращити показники загальної та безрецидивної виживаності у працездатної частини хворих на ДРЩЗ, здешевити спостереження пацієнтів з йодонегативними формами ДРЩЗ.
Одержано 15.04.2024
Прийнято до друку 22.04.2024
DOI: 10.32471/clinicaloncology.2663-466X.54-2.32250
ВСТУП
Важливість проблеми визначається тим, що останніми роками зросла кількість (4–20%) радіойодорезистентних (РР) метастазів ДРЩЗ, клітини яких не можуть накопичувати радіойод, а радіойодотерапія (РЙТ) як метод лікування стає для таких хворих неефективною [1]. Терапія цієї категорії пацієнтів проводиться згідно з протоколами Європейського консенсусу щодо ведення хворих на диференційовану карциному щитоподібної залози (European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium, 2010), РЙТ є обов’язковим етапом комплексного лікування ДРЩЗ.
Останніми роками в Україні зареєстровані та почали застосовувати в лікуванні рефрактерних форм ДРЩЗ інгібітори тирозинкінази (сорафеніб, сунітиніб), проте лише в поодиноких дослідженнях вивчали цитологічні аспекти в прогнозуванні РР папілярного раку щитоподібної залози [2], не виявляли поєднаність кількісних показників радіонуклідних метаболічних зображень (СВТ з нейодними РФП та ПЕТ/КТ з 18F-ФДГ) та цитологічних особливостей тиреоцитів. Важливим є і те, що науково-клінічні аспекти терапії РР папілярного раку щитоподібної залози та розробки адекватних способів оцінки ефективності лікування в українській онкології та радіології практично не досліджувалися.
РР осередків ДРЩЗ тією чи іншою мірою розвивається первинно або в процесі лікування у 5–15% хворих [3]. Розвиток РР суттєво погіршує прогноз, знижуючи загальну 10-річну виживаність до 10%. Виживаність хворих на РР ДРЩЗ із віддаленими метастазами становить 2,5–3,5 року.
Щодо лікування йодонегативних форм ДРЩЗ, досліджуються можливості хіміотерапії. У джерелах медичної літератури наводяться результати застосування комбінації доксорубіцин + цисплатин, однак відмічається її підвищена токсичність [1]. Представлені перші результати клінічних досліджень із застосування молекулярно-таргетних препаратів, деякі з них уже застосовуються в схемах лікування рефрактерних форм ДРЩЗ [4–6].
Згідно з результатами багатоцентрових клінічних досліджень інгібітори протеїнкіназ суттєво знижують ризик прогресування онкопатології, що становить 41% порівняно з плацебо. Медіана виживаності без прогресування (ВБП) дорівнює 10,8 міс у групі сорафенібу (Нексавар®) порівняно з 5,8 міс у групі плацебо. Максимальне зменшення цільової ділянки ураження досягається у 73% хворих у групі застосування сорафенібу порівняно з 27% у групі плацебо. Контроль над захворюванням встановлюється у 54% пацієнтів завдяки стабілізації процесу на тлі нормалізації показників тироглобуліну.
Слід також зазначити, що на основі даних доказової медицини (рівень 1А) препарат Нексавар® (сорафеніб) включений до схеми лікування метастатичного прогресуючого ДРЩЗ, рефрактерного до терапії радіоактивним йодом, у 2014 р. відповідно до Американських рекомендацій Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN).
Так, проблема лікування та його ефективності при йодонегативних формах ДРЩЗ в Україні вивчена недостатньо, тому метою нашого дослідження стало вивчення впливу таргетних препаратів на йодонегативні метастази ДРЩЗ та використання радіонуклідних методів оцінки його ефективності.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
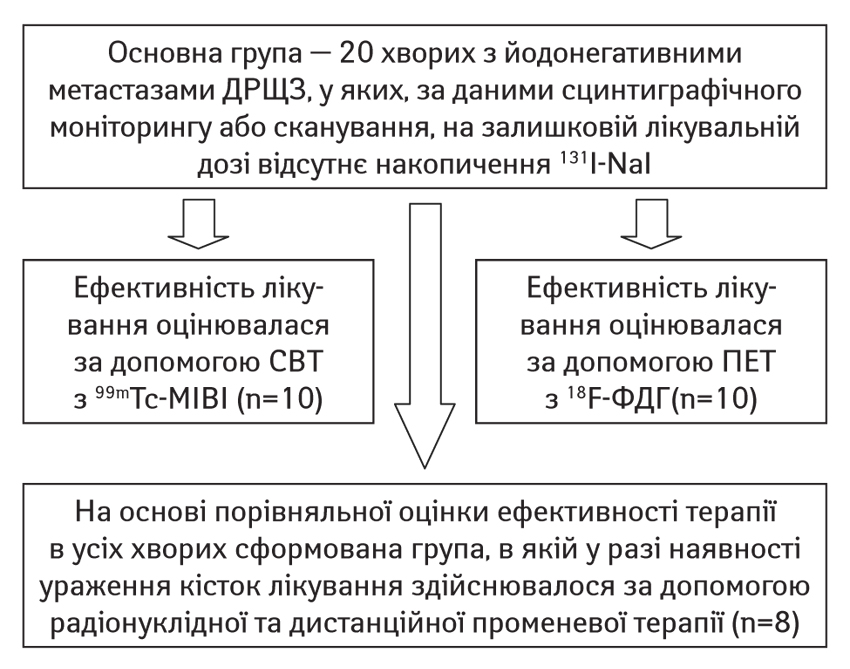
Нами проліковано 20 хворих з йодонегативними метастазами ДРЩЗ. Йодонегативний характер рецидивів та метастазів визначався за допомогою СВТ з нейодними РФП — 99mTc-MIBI, ПЕТ з 18F-ФДГ. 8 пацієнтів залучено в групу, в якій відмічалося ураження кісток і лікування здійснювали за допомогою радіонуклідної та дистанційної променевої терапії. Середній вік пацієнтів коливався від 43 до 76 років, медіана — 57,8±3,9 року. З них жінок — 11, чоловіків — 9. Патогістологічно папілярний рак діагностовано у 17 осіб, фолікулярний — у 3 пацієнтів.
Лікування та спостереження хворих проводили за наступною схемою (рис. 1).
Методика лікування сорафенібом. Застосування препарату сорафенібу (Нексавар®) в якості пероральної таргетної монотерапії у пацієнтів з ДРЩЗ, рефрактерним до RIA-терапії, проводиться в дозі 800 мг на добу (2 табл. по 200 мг два рази на добу), що сприяє досягненню позитивного результату лікування з передбачуваним та керованим профілем побічних явищ. Механізм дії препарату Нексавар® базується на тому, що він є інгібітором низки ферментів із групи кіназ, що знижує проліферацію пухлинних клітин in vitro. Доведено, що сорафеніб інгібує численні внутрішньоклітинні кінази (c-CRAF, BRAF та мутовану BRAF) та кінази клітинної поверхні (KIT, FLT-3, RET, VEGFR-1, VEGFR-2, VEGFR-3, PDGFR-β).
Основними критеріями оцінки ефективності препарату були результати сцинтиграфічних досліджень з нейодними РФП та динаміка показників онкомаркера — тироглобуліну.
Оцінювання ефективності лікування сорафенібом у першій групі проводили з 99mTc-MIBI в індикаторній дозі 450–500 МБк. Препарат вводився внутрішньовенно. Дослідження проводили на гамма-камері з використанням низькоенергетичного паралельного коліматора високого розрішення при налаштуванні на фотопік 140 кеВ і шириною вікна дискримінації 10%. Запис діагностичного зображення здійснювався через 40–60 хв після внутрішньовенного введення 450–500 МБк з 99mТс-MIBI з наступними параметрами:
- розмір матриці 128×128;
- швидкість просування столу залежно від маси тіла пацієнта;
- становила від 6 до 10 см/хв;
- включена функція розпізнавання контуру тіла.
У разі потреби здійснювалася планарна прицільна сцинтиграфія з 99mТс-MIBI з розміром матриці 128×128 і набором не менше 250 000 імпульсів на кадр.
Отримані дані оброблялися за допомогою комп’ютерного забезпечення «Syngo» (фірма «Siemens Healthcare»). Комп’ютерна обробка включала стандартні операції контрастування зображень, побудову «зон інтересу», кривих «активність — час», визначення коефіцієнтів відносного накопичення РФП «осередок/фон». Побудова кривих «активність — час» дозволяла виявити оптимальні інтервали для сумації кадрів, а проведення статичної сцинтиграфії в декількох проєкціях або ОФЕКТ — підвищити точність топографічної діагностики.
Коефіцієнт відносного накопичення РФП у метастатичних осередках визначався за формулою:
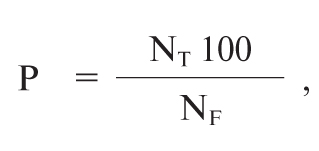
де Р — коефіцієнт відносного накопичення РФП у метастатичних осередках, %;
NT — кількість імпульсів на 1 піксель у «зоні інтересу», побудованої на осередку метастазу;
NF — кількість імпульсів на 1 піксель у «зоні інтересу», побудованої на симетричній ділянці нормальної тканини.
Усі радіонуклідні дослідження виконувалися на 2-детекторній гамма-камері фірми «Mediso» (Угорщина) та ОФЕКТ E. CAM 180 фірми «Siemens» (Німеччина).
У 3-й групі порівняння ефективність лікування сорафенібом оцінювалася за допомогою ПЕТ/КТ-обстеження.
Перед дослідженням проводиться контроль рівня глюкози в плазмі крові та лише після цього — встановлення допустимих значень <11 ммоль/л або <200 мг/дл, щоб дослідження ПЕТ з 18F-ФДГ могло бути виконаним. Якщо рівень глюкози в плазмі крові становить >11 ммоль/л, дослідження має бути перенесене. Аналіз крові на рівень глюкози повинен бути виконаний за допомогою каліброваного і затвердженого методу, оскільки використовується в якості поправки при визначенні рівня накопичення РФП. Для клінічних досліджень рекомендовані верхні показники рівня глюкози в діапазоні від 7 до 8,3 ммоль/л.
Дозування РФП здійснюється стандартним методом, виходячи з маси тіла пацієнта. Введення препарату проводилося внутрішньовенно з подальшим промиванням місця ін’єкції 10 мл фізіологічного розчину.
Під час ін’єкції 18F-ФДГ і подальшої фази поглинання РФП пацієнт повинен бути в положенні сидячи або лежачи у спокійному стані, щоб мінімізувати накопичення 18F-ФДГ у м’язах. З метою мінімізації накопичення 18F-ФДГ в «бурій жировій тканині» увесь час перебування пацієнта повинно бути в теплому приміщенні.
Серед пролікованих не було хворих з цукровим діабетом (ЦД), що потребували особливого протоколу дослідження.
Значення активності 18F-ФДГ визначаються типом сканування та розраховуються згідно з показниками маси тіла. Так, в разі 2D-сканування — 5 МБк/кг маси тіла, у випадку 3D-сканування — 2,5 МБк/кг маси тіла. У середньому при масі тіла 75–80 кг і введеній активності 180 МБк ефективна доза опромінення при ПЕТ-дослідженні становить близько 6–11 мЗв. Складова від 18F-ФДГ дорівнює близько 3–4 мЗв, решта належить до КТ.
Рекомендований інтервал між часом введення 18F-ФДГ та початком сканування становить 60 хв. Зміни часового інтервалу повинні чітко фіксуватися, так як від цього залежить вимірювання значень накопичення РФП.
Стандартизоване значення накопичення 18F-ФДГ (SUV) використовувалося як додаток до візуальної оцінки і розраховувалося за формулою:
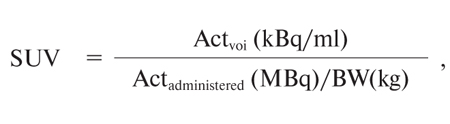
де Actvoi — активність, виміряна в «об’ємі інтересу»;
Actadministered — введена активність з поправкою на фізичний розпад 18F-ФДГ;
BW — маса тіла.
При виконанні ПЕТ/КТ враховувалося, що між попереднім діагностичним обстеженням чи курсом лікування має бути певний інтервал — не менше 21 доби.
Статистична обробка отриманих даних виконувалася за допомогою пакетів програм «Axum v 5.0», «Statistica v 5.0».
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
В основну групу спостереження залучено 20 хворих з йодонегативним раком щитоподібної залози. Перед проведенням лікування таргетним препаратом пацієнтам проводили СВТ з 99mTc-MIBI для підтвердження наявності йодонегативних вогнищ, оскільки на скануванні діагностичному або постлікувальному з 131I-NaI накопичення РФП не відмічено.
В основній групі у 12 пацієнтів зафіксовано метастази в легені, які виявлено за допомогою КТ. На СВТ при використанні максимальної діагностичної дози (200 МБк) накопичення РФП не встановлено. У 4 пацієнтів розвинулися метастази в середостіння, а ще у 4 — в лімфатичні вузли шиї (надключичні справа та підключичні зліва).
В окрему групу охоплено 8 пацієнтів, у яких відмічалося ураження кісток, у 5 з них лікування здійснювалося за допомогою радіонуклідної та дистанційної променевої терапії. Середній вік хворих коливався в діапазоні від 43 до 76 років, медіана — 57,8+3,9 року, з них жінок — 11, чоловіків — 9. Патогістологічно папілярний рак діагностовано у 17 осіб, фолікулярний — у 3 хворих.
До початку терапії 10 хворим з ДРЩЗ проведено СВТ з 99mTc-MIBI і повторне дослідження через 3 міс з метою оцінки ефективності лікування.
Наводимо клінічний приклад СВТ з 99mTc-MIBI у пацієнта з ДРЩЗ та йодорефрактерністю за результатами останніх постлікувальних сканувань (рис. 2).
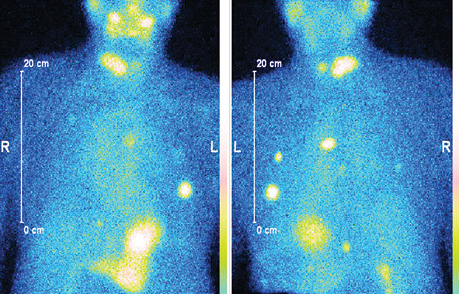
На сцинтиграфічному планарному зображенні з 99mTc-MIBI в передній та задній проєкціях візуалізуються множинні вогнища ураження легень при первинному диференційному йодонегативному раку щитоподібної залози.
Після проведення діагностичного обстеження пацієнту призначено таргетну терапію препаратом Нексавар® згідно з протоколом лікування. Досягнуто регресії вогнища в легенях у межах 70% (рис. 3). Подальший моніторинг ефективності протипухлинного лікування проводився за допомогою СВТ з 99mTc-MIBI.
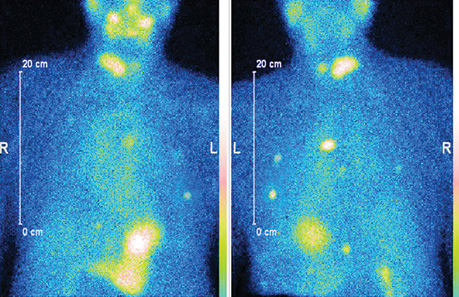
Як візуалізовано на рис. 3, після таргетної терапії на сцинтиграфічному зображенні відмічається зменшення функціональної активності метастатичних вогнищ.
10 пацієнтів, яким до лікування проведено дослідження ПЕТ/КТ з18F-ФДГ, також були проліковані за допомогою таргетної терапії препаратом Нексавар®.
В якості ілюстрації наводимо клінічні випадки проведення ПЕТ/КТ з 18F-ФДГ у пацієнтів з йодонегативними вогнищами ДРЩЗ з метою діагностики та постлікувального моніторингу.
Хворий А., папілярний рак щитоподібної залози, 4 курси РЙТ, відсутність накопичення 131I-NaI на постлікувальному скані після 3-го курсу. За даними ультразвукового та КТ-обстежень — підозра на можливі вогнища в зоні шиї та легень. Хворому назначено ПЕТ/КТ з 18F-ФДГ (рис. 4–5).
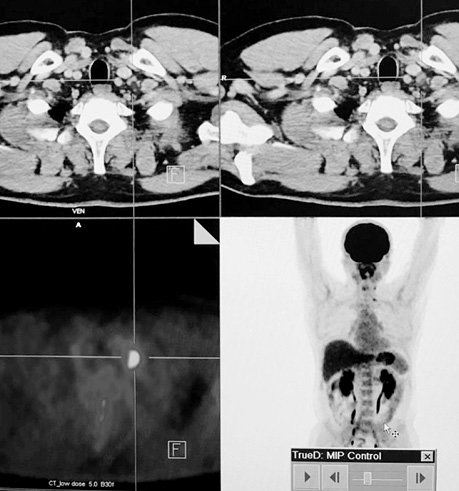
За даними ПЕТ/КТ з 18F-ФДГ, у цього пацієнта підтверджена наявність вогнища гіперфіксації РФП в зоні шиї, водночас не виявлено ознак пролонгації процесу в легенях. Вірогідно, ідентифіковані вогнища, за даними КТ, відповідають фіброзним змінам після перенесених запальних процесів.
Після проведення діагностичного обстеження пацієнту призначено таргетну терапію препаратом Нексавар® згідно з протоколом лікування.
Діагностичне сканування з 18F-ФДГ виявило зниження функціональної активності вогнища в зоні шиї (SUV — від 6,9 до 4,2). Зменшення розміру вогнища не зафіксовано (рис. 6).
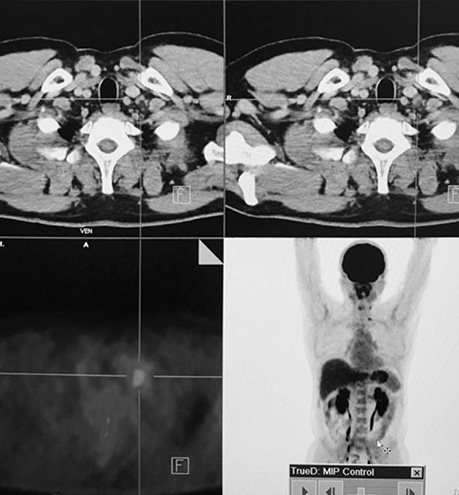
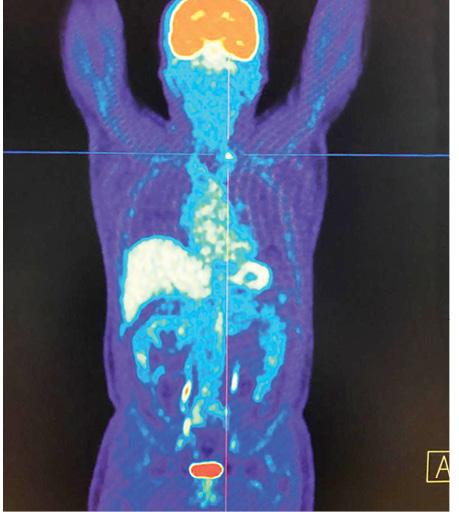
У пацієнта Б. з фолікулярною формою ДРЩЗ на постлікувальному скані після 5-го курсу РЙТ встановлено відсутність накопичення 131I-NaI. При цьому, за даними КТ та підвищеними значеннями тиреоглобуліну, можна було передбачити вірогідність метастазування. Хворому рекомендовано виконання ПЕТ/КТ з 18F-ФДГ (рис. 7).
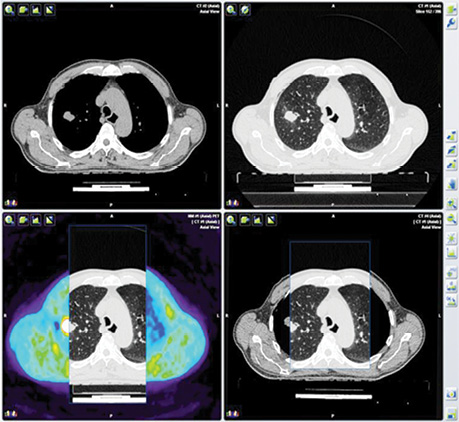
На КТ-зображенні відмічається чітке вогнище в лівій легені, яке співпадає при накладанні метаболічного ПЕТ-скану. Інші дрібні вогнища відповідають фіброзним та кальцинатним утворенням.
Отже, на етапі одержання структурного зображення вже було отримано інформацію про наявність метастатичного вогнища в легені, яка була підтверджена за допомогою 3D-трансформації (рис. 8).
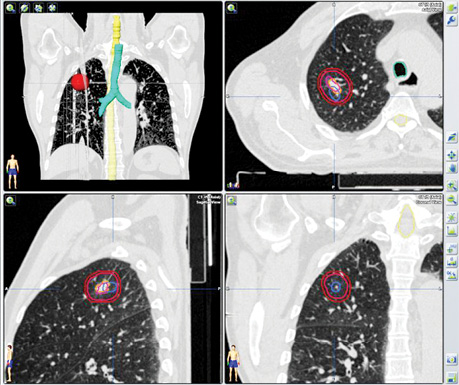
Наступним етапом була таргетна терапія йодонегативного метастатичного вогнища в легені. Для оцінки результативності лікування проведено ПЕТ/КТ з 18F-ФДГ. За даними метаболічного сканування достовірних змін як щодо розмірів вогнища, так і ступеня його функціональної активності не виявлено.
У 8 пацієнтів після проведення таргетної терапії залишалися вогнища в кістках, які продовжували накопичувати нейодний РФП при діагностичному скануванні. Цим хворим рекомендовано дистанційну променеву терапію, під час якої пацієнти одержали сумарну вогнищеву дозу 30 Гр, по 3 Гр за 10 фракцій. Ефект лікування проявився під час проведення 4–5 фракції опромінення.
Через 3 міс після дистанційної променевої терапії на остеосцинтиграфії з нейодним РФП 99mTc-MIBI відмічалося значне зниження відсотка накопичення препарату. У 5 хворих відсоток зменшення накопичення РФП становив >45%. Разом з цим у 6 хворих больовий синдром був відсутнім, у 2 — помірно зниженим.
Отже, проведення досліджень з одержанням метаболічних зображень у пацієнтів з йодонегативною формою ДРЩЗ до та після проведення таргетної та дистанційної променевої терапії дозволило оцінити її ефективність як за розмірами метастатичного вогнища, так і рівнем його функціональної активності.
ВИСНОВКИ
1. Лікування йодонегативних метастазів ДРЩЗ за допомогою інгібіторів тирозинкінази супроводжувалося зменшенням кількості метастатичних вогнищ та зниженням рівня їх функціональної активності.
2. У результатах проведеного дослідження підтверджено можливість використання методик з нейодними РФП (99mTc-MIBI) для оцінки ефективності лікування йодонегативних метастазів ДРЩЗ.
3. ПЕТ/КТ з 18F-ФДГ є високо інформативною методикою для оцінки впливу інгібіторів тирозинкінази на функціональну активність метастатичних вогнищ за даними метаболічного сканування при лікуванні йодонегативних метастазів ДРЩЗ.
ПЕРЕЛІК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Schlumberger, M., Tahara, M., Wirth, L. J., Robinson, B., Brose, M. S., Elisei, R., … Sherman, S. I. (2015). Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. New England Journal of Medicine, 372(7), 621–630. doi: 10.1056/NEJMoa1406470.
2. Зелінська, Г. В., Кулиніченко, Г. М., & Устименко, Г. Я. (2016). Субклональна структура популяції тироцитів радіойодрефрактерних та радіойодчутливих метастазів папілярного раку щитоподібної залози. Український радіологічний журнал, 3, 15–18.
3. Durante, C., Haddy, N., Baudin, E., Leboulleux, S., Hartl, D., Travagli, J. P., … Schlumberger, M. (2006). Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy. Journal of Clinical Endocrinology & Metabolism, 91(8), 2892–2899. doi: 10.1210/jc.2005-2838.
4. Czepczyriski, R., Gryczyriska, M., & Ruchala, M. (2016). 99mTc-EDDA/HYNIC-TOC in the diagnosis of differentiated thyroid carcinoma refractory to radioiodine treatment. Nuclear Medicine Review, 19(2), 67–73. doi: 10.5603/NMR.2016.0015.
5. Bannas, P., Derlin, T., Growth, M., Apostolova, I., Adam, G., Mester, J., & Klutmann, S. (2012). Can (18)F-FDG PET/CT be generally recommended in patients with differentiated thyroid carcinoma and elevated thyroglobulin levels but negative 131I whole-body scan? Annals of Nuclear Medicine, 26(1), 77–85. doi: 10.1007/s12149-011-0545-4.
6. Schlumberger, M., Brose, M., Elisei, R., Leboulleux, S., Luster, M., Pitoia, F., & Pacini, F. (2014). Definition and management of radioactive iodine-refractory differentiated thyroid cancer. Lancet Diabetes & Endocrinology, 2(5), 356–358. doi: 10.1016/S2213-8587(13)70215-8.
Адреса для листування:
Солодянникова Оксана Іванівна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: oik2000@ukr.net
Correspondence:
Oksana Solodyannikova
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: oik2000@ukr.net














Leave a comment